Похожие презентации:
Биологическая химия-биохимия полости рта
1.
СЗГМУ им. И. И. МЕЧНИКОВАКАФЕДРА КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ,
БИОЛОГИЧЕСКОЙ И ОБЩЕЙ ХИМИИ им. В.В. СОКОЛОВСКОГО
БИОЛОГИЧЕСКАЯ ХИМИЯ-БИОХИМИЯ ПОЛОСТИ РТА
Раздел XI
ЛЕКЦИЯ
БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Доцент Антонова Ж.В.
2024/2025
2.
План лекции1. Соединительные ткани, определение. 1.1. Типы СТ.
2. Клеточный состав СТ.
3. Межклеточный матрикс соединительной ткани. Основные компоненты.
4. Коллагеновые белки. 4.1. Строение фибриллярного КЛГ.
5. Синтез КЛГ. 5.1. Внутриклеточный этап синтеза. 5.2. Внеклеточный этап синтеза.
6. Регуляция синтеза КЛГ.
7. Полиморфизм КЛГ. 8. Нарушения синтеза коллагеновых белков. 9. Катаболизм КЛГ.
10. Строение эластина. 10.1. Сшивки в молекуле эластина. 11. Катаболизм эластина.
12. Гликозаминогликаны (ГАГ). 12.1. Гиалуронова кислота. 12.2.Хондроитинсульфаты.
12.3. Гепарин. 12.4. Кератансульфат. Дерматансульфат. 12.5. Катаболизм ГАГ.
13. Протеогликаны (строение, биологическая роль). 13.1.Большие ПГ. 13.2. Малые
ПГ.
14. Неколлагеновые специализированные белки межклеточного матрикса. 14.1.
Адгезивные белки. 14.2. Антиадгезивные белки.
2
15. Список литературы.
3.
Список сокращенийКЛГ – коллаген
ВКМ – внеклкточный матрикс
ГП – гликопротеины
ЭФР –эпидермальный фактор роста;
ТФР –тромбоцитарный фактор роста
β-ТФР -трансформирующий фактор роста
КСФ-колониестимулирующий фактор роста
ФНО – фактор некроза опухоли
ЛПЛ – липопротеинлипаза внепеченочных тканей
ПГ – протеогликаны
ГАГ – глюкозамногликаны
АК - аминокислоты
3
4.
1.Соединительные ткани (СТ)Это ткани, основу которых составляет большое количество
межклеточного вещества (МКВ), в котором на значительном
расстоянии рассредоточены клетки различного типа,
участвующие в формировании межклеточного матрикса (МКМ,
ВНК).
Общие свойства СТ:
• мезенхималтное происхождение (за исключением эмали зуба),
• структурное сходство
• опорная функция (наряду с другими функциями)
Для разных видов СТ характерен свой МКМ.
4
5.
1.1. Типы соединительтной тканиСобственно СТ
• Плотная (волокнистая) оформленная - образует сухожилия, связки (в том числе периодонтальной),
фасциях;
• Плотная (волокнистая) неоформленная - формирует футляры для мышц, нервов, капсулы органов;
образует склеру глаза, надкостницу, надхрящницу, волокнистый слой суставных капсул, клапаны
сердца, перикард, твердую мозговую оболочку, сетчатый слой дермы.
• Рыхлая неоформленная – в пульпе зуба, образует строму (интерстиций) различных органов,
собственную пластинку и подслизистую основу слизистых оболочек и др.
СТ со специфическими свойствами
Ретикулярная –составляет основу органов кроветворения и иммунной системы
Пигментная
Жировая (белая и бурая)
Слизистая
Скелетная СТ
• Минерализованные ткани: костная ткань (кости) и ее разновидность - зубные минерализованные
ткани дентина, цемента. Также к минерализованным тканям относится эмаль зуба
(эктодермальное происхождение);
• Неминерализованные – хрящевая ткань
5
6.
2. Клеточный состав соединительных тканейСтруктурные клетки (бластные, резидентные) обеспечивают
построение МКМ и его обновление.
• Например: фибробласты, хондробласты, остеобласты, одонтобласты,
цементобласты.
Клетки иммунной защиты – обеспечивают специфический
иммунитет в СТ. Эту роль выполняют в основном лимфоциты
Клетки неспецифической защиты – макрофаги, моноциты и в
меньшей степени нейтрофилы.
• Макрофаги и моноциты в определенных условиях формируют
кластные клетки, которые
узнают и поглощают микроорганизмы
трансформируют поврежденные клетки, измененные макромолекулы,
минеральные кристаллы.
6
7.
Кооперативное действие клеток обеспечивает постоянство состава МКМ, котороескладывается из процессов разрушения и восстановления.
Межклеточное сообщение разных клеток реализуется через прямой контакт и/или
посредством химических молекул цитокинов (интерлейкины, интерфероны, факторы
роста и др.)
Цитокины – небольшие пептиды или ГП с молек. массой от 5-30 кДа, которые
представлены
• Интерлейкинами (ИЛ)
• Интерферонами (ИФР)
• Факторами роста (ЭФР, ТФР, КСФ, ФНО)
Цитокины- сигнальные молекулы, высокоэффективного действия, воздействуют
паракринно или аутокринно; рецептор чаще всего- тирозиновая протеинкиназа.
Цитокины управляют развитием и гомеостазом иммунной системы; контролируют
рост и дифференцировку клеток крови (гемопоэз);участвуют в реакциях
неспецифической защиты; регулируют рост, дифференцировку, продолжительность
жизни клеток; управляют апоптозом
7
8.
3. Межклеточный матрикс соединительной тканиМКМ - трехмерная упорядоченная структура,
сформированная комплексом органических и неорганических
компонентов, заполняющая пространство между клетками.
Основные компоненты МКМ
▪ структурные белки коллаген и эластин
▪ гликозамингликаны
• протеогликаны и гликопротеины
▪ специфические неколлагеновые белки
4
9.
4. Коллагеновые белкиКоллагены (КЛГ) – семейство родственных фибриллярных белков,
секретируемых клетками соединительных тканей
(90% cоставляют коллагены I, II, III, IV типов).
В разных тканях преобладают разные типы коллагенов.
КЛГ – полиморфный белок, включающий 19 различных типов.
За счет сочетаний α-цепей (α1, α2, α3) формируются разные типы КЛГ.
КЛГ- основные структурные компоненты МКМ СТ, которые
• участвуют в процессах минерализации (I тип);
• стимулируют образование клеточных оболочек;
• обеспечивают прочность ткани (защитная функция);
• снижают скорость развития опухолей;
• отвечают за крепость связок и сухожилий;
• удерживает влагу в клетках
5
10.
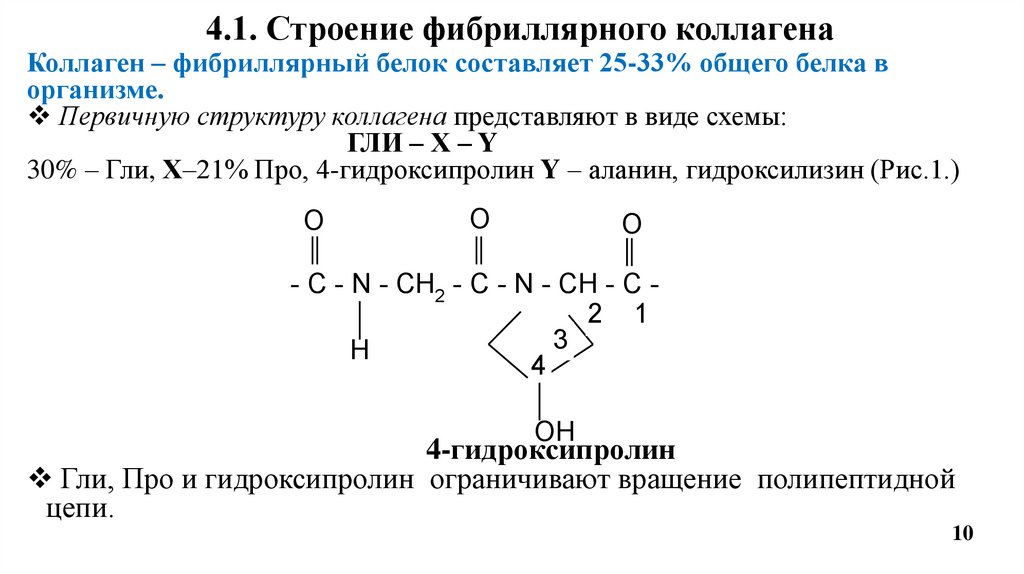
4.1. Строение фибриллярного коллагенаКоллаген – фибриллярный белок составляет 25-33% общего белка в
организме.
Первичную структуру коллагена представляют в виде схемы:
ГЛИ – Х – Y
30% – Гли, Х–21% Про, 4-гидроксипролин Y – аланин, гидроксилизин (Рис.1.)
O
O
O
- C - N - CH2 - C - N - CH - C 2 1
3
H
4
OH
4-гидроксипролин
Гли, Про и гидроксипролин ограничивают вращение полипептидной
цепи.
10
11.
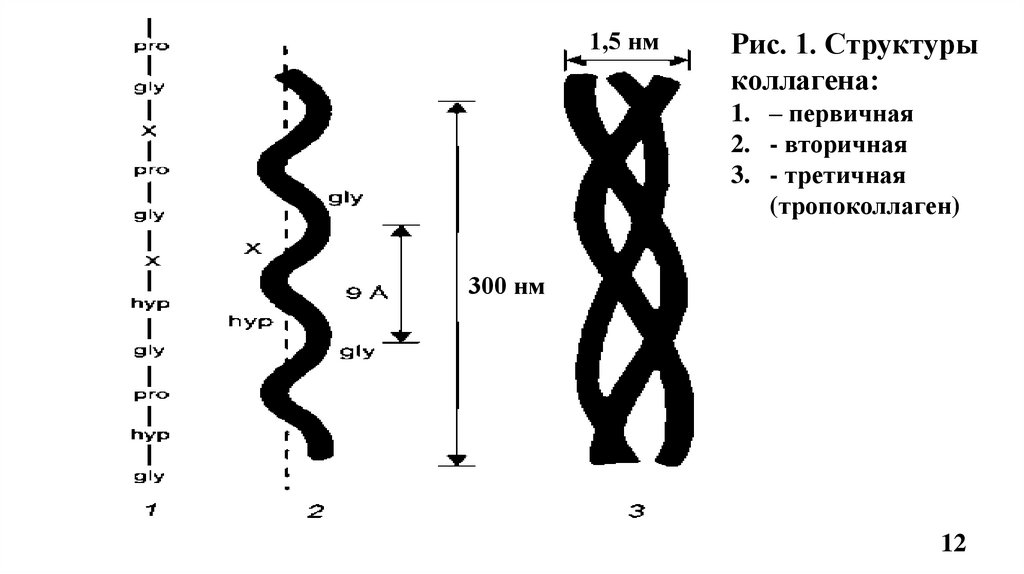
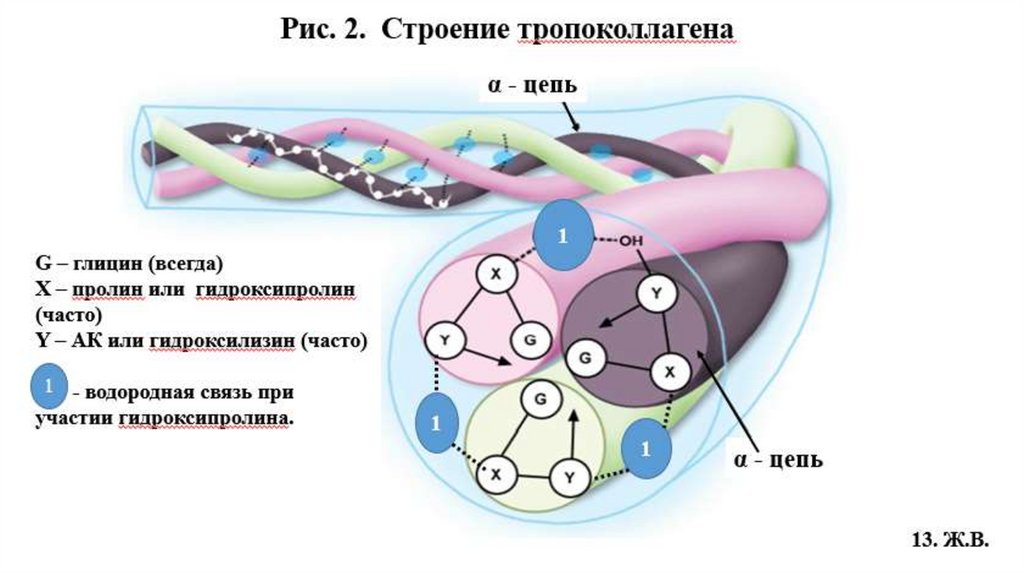
4.1. Строение фибриллярного коллагенаВторичная структура коллагена –вытянутая, левозакрученная -спираль (по 1000 АК
каждая), на один шаг спирали приходится 3 аминокислотных остатка (Рис.1, 2).
Третичная структура – это три α-цепи в виде плотных, вытянутых левозакрученных
спиралей сплетаются вокруг общей оси в правозакрученную суперспираль, образуя
тропоколлаген, структурную единицу коллагенового волокна (Рис.1, 2)
• Толщина молекулы тропоколлагена 1,5 нм и длина 300 нм (Рис.1)
• Молекула тропоколлагена стабилизируется водородными связями, образованными за счет
остатков гидроксипролина между -цепями (спиралями) (Рис.2)
• Маленький радикал Гли располагается внутри, м/у 3-мя цепями, в центре тройной
спирали по её оси, что необходимо для формирования фибриллярной структуры
тропоколлагена и включения его в коллагеновое волокно. Радикалы других АК
направлены наружу тройной спирали тропоколлагена (Рис.2).
Сочетание одинаковых или различных - цепей определяет различие типов коллагена.
Например: КЛГ I типа [ 1(I)]2 2, II типа [ 1(II)]3
11
12.
1,5 нмРис. 1. Структуры
коллагена:
1. – первичная
2. - вторичная
3. - третичная
(тропоколлаген)
300 нм
12
13.
14.
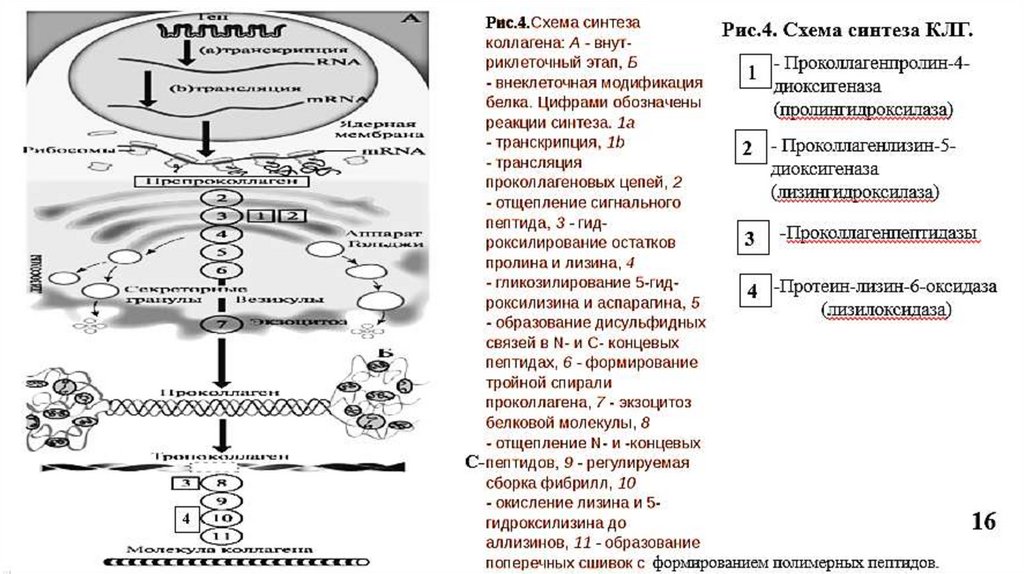
5. Синтез коллагена5.1. Внутриклеточный этап синтеза
происходит почти во всех бластных клетках
На рибосомах, связанных с мембраной ЭПР, синтезируются препроколлагеновые цепи, на N-конце у которых –гидрофобный сигнальный пептид, необходимый для
перемещения белковой цепи в просвет ЭПР.
В ЭПР - отщепление сигнального пептида специфической протеиназой.
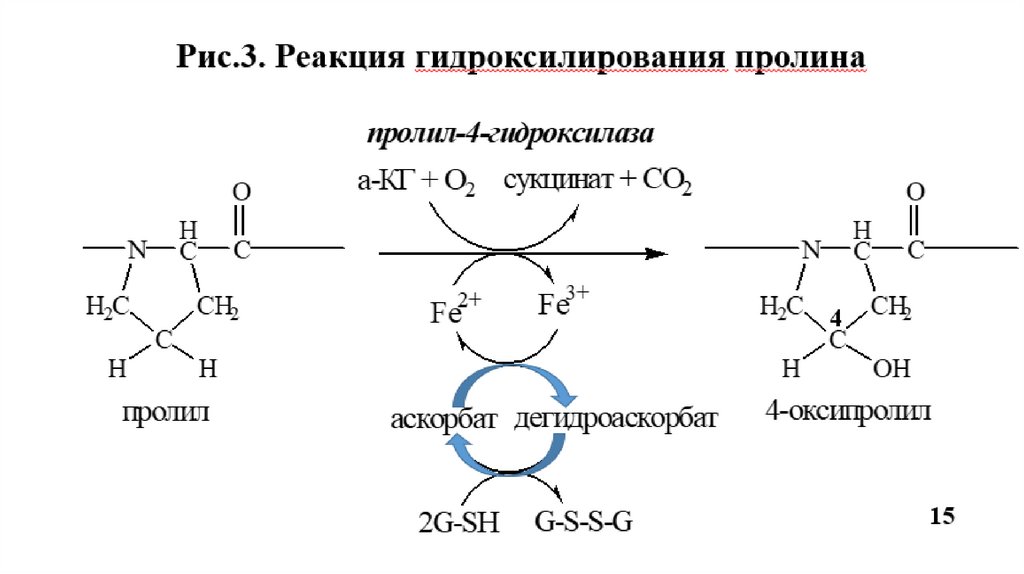
Гидроксилирование пролина (Рис.3) и лизина
Пролин
пролил-4-гидроксилаза (Fe2+, вит. С)
4-гидроксипролин
Лизин
лизил-5-гидроксилаза (Fe2+, вит. С)
5-гидроксилизин
Гидроксилаза пролина и лизина (Рис.4, ферменты 1 и 2) в активном центре содержат
Fe2+, а вит. С необходим для сохранения атома железа в восстановленной форме
14
(ферроформе) (Рис.3).
15.
16.
17.
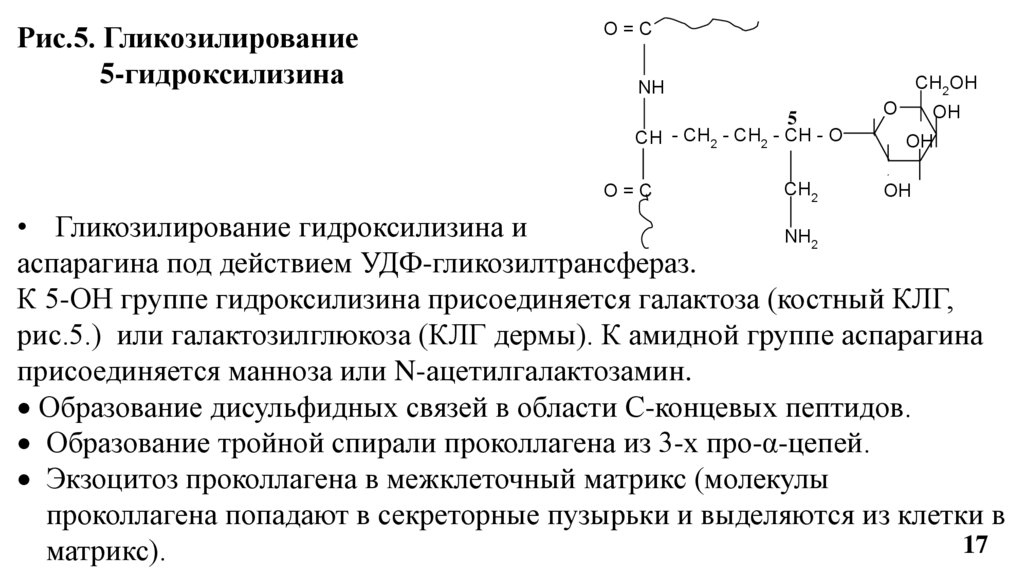
Рис.5. Гликозилирование5-гидроксилизина
O=C
CH2OH
NH
5
CH - CH2 - CH2 - CH - O
O=C
CH2
O
OH
OH
OH
• Гликозилирование гидроксилизина и
NH2
аспарагина под действием УДФ-гликозилтрансфераз.
К 5-ОН группе гидроксилизина присоединяется галактоза (костный КЛГ,
рис.5.) или галактозилглюкоза (КЛГ дермы). К амидной группе аспарагина
присоединяется манноза или N-ацетилгалактозамин.
Образование дисульфидных связей в области С-концевых пептидов.
Образование тройной спирали проколлагена из 3-х про-α-цепей.
Экзоцитоз проколлагена в межклеточный матрикс (молекулы
проколлагена попадают в секреторные пузырьки и выделяются из клетки в
17
матрикс).
18.
5.2.Внеклеточный этап синтезаМодификация проколлагена
Отщепление N и C –концевых пропептидов специфическими
проколлагенпептидазами с образованием тропоколлагена.
Самосборка коллагеновых фибрилл: молекулы тропоколлагена
располагаются ступенчато, параллельными рядами (по принципу
«голова к хвосту»), которые сдвинуты на ¼ относительно друг друга.
Промежутки между тропоколлагенами выполняют роль центров
минерализации, где откладываются кристаллы фосфата кальция
Из 5 рядов тропоколлагена образуется коллагеновая микрофибрилла.
Из 9-12 микрофибрилл формируется коллагеновая фибрилла.
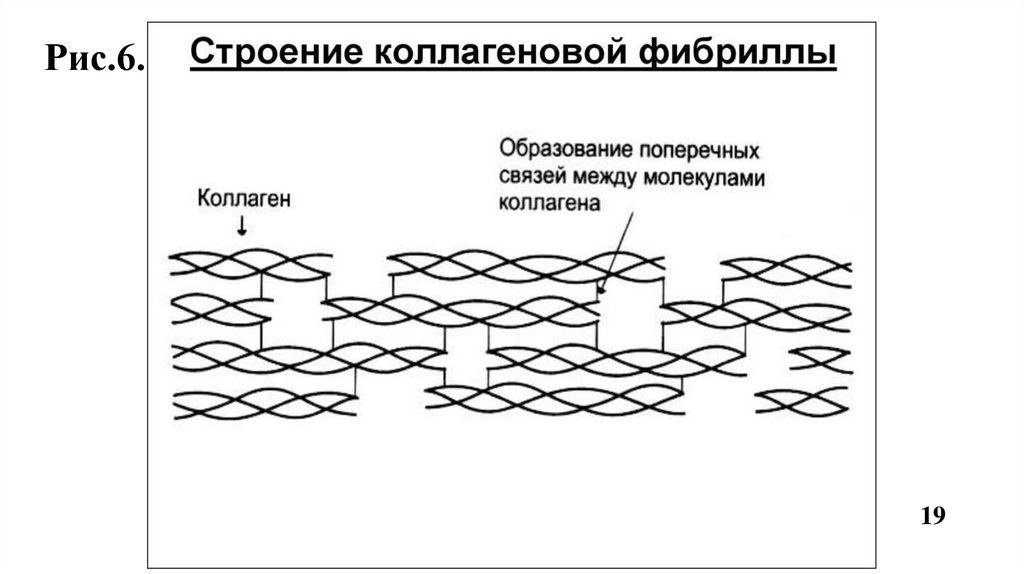
Фибриллы стабилизируются за счет ковалентных сшивок и
обладают высокой прочностью (Рис.6, 7,8).
18
19.
Рис.6.19
20.
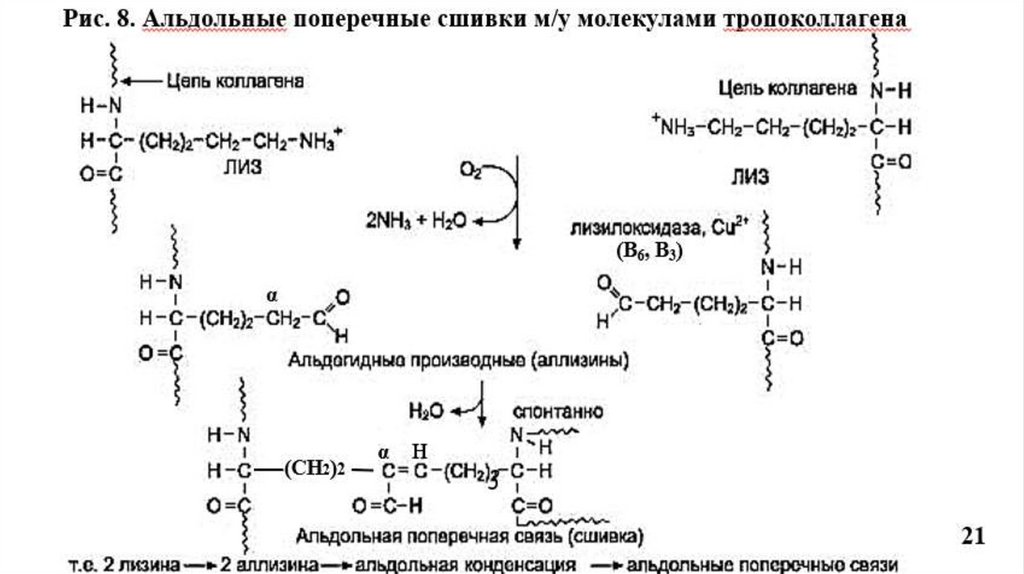
Прочность и стабилизация фибрилл обеспечивается поперечными сшивкамимежду остатками лизина в тропоколлагене.
Происходит окислительное дезаминирование лизина и гидроксилизина под
действием фермента лизилоксидазы (Cu+2- содержащей) при участии вит. В6, В3;
Образуются ковалентные альдольные поперечные сшивки между молекулами
тропоколлагена, что характерно для КЛГ костной ткани и дентина (Рис.8).
Альдиминные сшивки характерны для КЛГ сухожилий (Рис.7).
• Пространственная организация фибрилл завершается при участии фибронектина,
протеогликанов.
Рис. 7. Альдиминные сшивки
2Н
(CH2)n
NH
(CH2)n
Лизиннорлейин
20
21.
22.
6. Регуляция синтеза коллагенаВит. С стимулирует синтез коллагена, протеогликанов, пролиферацию
фибробластов
Глюкокортикоиды тормозят синтез коллагена
• путем снижения уровня м-РНК проколлагена
• ингибированием активности ферментов пролилгидроксилазы и
лизилгидроксилазы
Синтез коллагена кожи зависит от уровня эстрогенов. У женщин во
время менопаузы понижается содержание коллагена в дерме.
22
23.
7. Полиморфизм КЛГ.Группы коллагенов
фибриллообразующие
сетевидные
образующие микрофибриллы
ассоциированные с фибриллами
заякоренные фибриллы
Большинство коллагенов, присутствующих в тканях полости рта
относится к фибриллообразующим.
Это коллагены I типа: дентин, цемент, пульпа зуба, костная ткань,
периодонтальные волокна.
Коллаген II типа: цемент зуба, хрящевая ткань (1% гидроксилизина, 10%
углеводов).
Коллаген III типа: присутствует в стенках кровеносных сосудов, большое
количество гидроксипролина.
23
24.
Сетевидные типы коллагена – это коллаген IV, VIII, X типов.У них сохраняются N и C- концевые глобулярные домены, которые взаимодействуют
между собой и образуют связи «конец в конец». В результате формируется трехмерная
структура подобно сетке. Коллаген IV типа [ 1(IV)]2 2(IV) содержится в дентине
зуба, пульпе, переодонтальных волокнах, слизистой оболочке, костной и хрящевой
ткани.
Коллагены, образующие микрофибриллы – это коллаген VI типа:
короткоцепочечный белок, - цепи содержат глобулярные домены в N и C-концах.
Две молекулы коллагена соединяются антипараллельно, образуя димеры , а затем
тетрамеры. Вне клетки тетрамеры формируют микрофибриллы. Аминокислотная
последовательность арг-гли-асп (R-G-D) обеспечивают клеточную адгезию вместе
с белками интегринами.
Коллаген, ассоциированный с фибриллами, - это коллагены IX, XII, XIV
типов: содержатся в цементе зуба, хрящевой ткани, слизистой оболочке. -Цепи
коллагена состоят из 3 фибриллярных и 4 –глобулярных доменов, не формируют
24
фибриллы.
25.
8. Нарушения синтеза коллагеновых белковВ тканях полости рта клинически проявляются изменениями со стороны
зубочелюстной системы. Причины: недостаток витаминов и минералов,
генетические энзимопатии, аутоиммунные состояния.
• Недостаток вит. С и ведет к нарушению гидроксилирования пролина и лизина,
нарушению формирования коллагена. Это приводит к развитию множественного
кариеса, страдают периодонтальные связки, возникает кровоточивость десен,
подвижность и выпадение зубов, снижение иммунитета, кровоизлияния на коже и во
внутренних органах.
• Недостаток ионов Cu2+ или наследственные дефекты ферментов лизилоксидазы и
лизилгидроксилазы приводят к нарушению образования поперечных сшивок между
микрофибриллами коллагена. Ухудшаются механические свойства связок периодонта,
состояние тканей периодонта, возникают дефекты в развитии скелета.
• Сахарный диабет, при котором нарушается поступление глюкозы в клетку и
гликозилирование проколлагеновых -цепей. Развивается тяжелая форма пародонтита
плохо поддающаяся лечению. У детей, родившихся от матерей с СД, выявляется
системная гипоплазия твердых тканей зуба.
25
26.
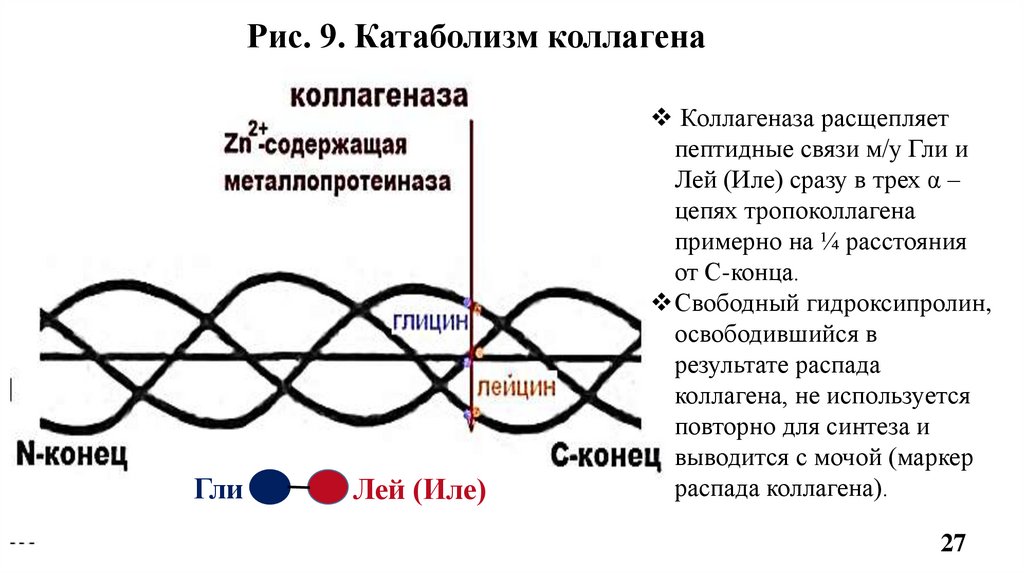
9. Катаболизм коллагенаОсуществляется Zn-зависимыми ферментами –
• матриксными металлопротеиназами -1, -8, -13 (ММР-1,-8,-13, или
коллагеназами);
• а также ММП -2 и -9 (желатиназами).
Коллагеназы расщепляют пептидные связи в тройной суперспирали,
образованные Гли-Лей или Гли-Иле в С-концевой области коллагена
(Рис.9), а уже потом желатиназы гидролизуют отдельные -цепи.
Избыточная активность матриксных металлопротеиназ приводит к
деструкции межклеточного матрикса при пульпите, пародонтите,
снижается эластичность сосудов, развивается сердечно-сосудистая
патология.
Примеч.: Коллагеназа используется в медицинской практике для лечения
ожоговой болезни, гнойных заболеваний.
26
27.
Рис. 9. Катаболизм коллагенаГли
Лей (Иле)
Коллагеназа расщепляет
пептидные связи м/у Гли и
Лей (Иле) сразу в трех α –
цепях тропоколлагена
примерно на ¼ расстояния
от С-конца.
Свободный гидроксипролин,
освободившийся в
результате распада
коллагена, не используется
повторно для синтеза и
выводится с мочой (маркер
распада коллагена).
27
28.
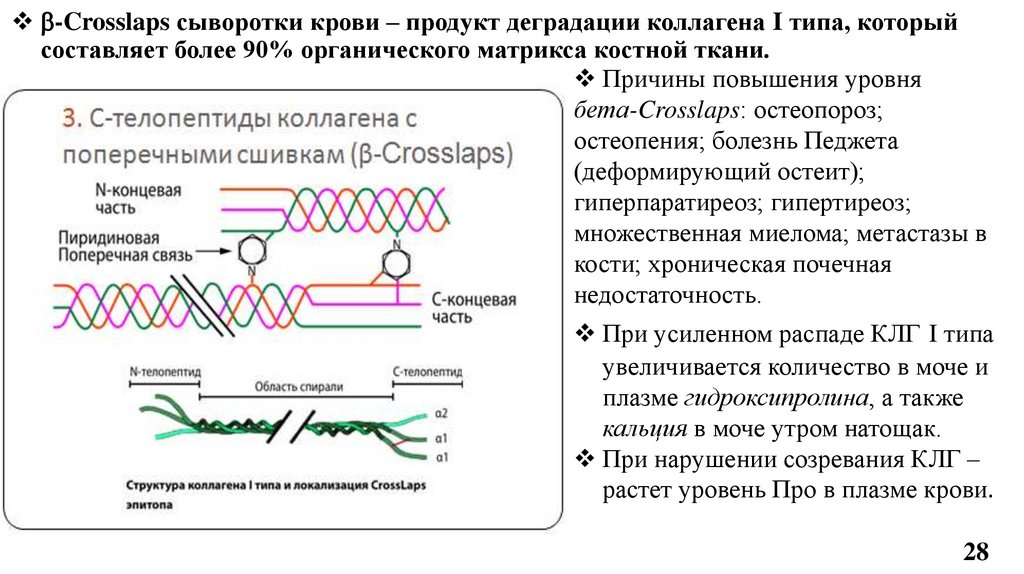
-Crosslaps сыворотки крови – продукт деградации коллагена I типа, которыйсоставляет более 90% органического матрикса костной ткани.
Причины повышения уровня
бета-Crosslaps: остеопороз;
остеопения; болезнь Педжета
(деформирующий остеит);
гиперпаратиреоз; гипертиреоз;
множественная миелома; метастазы в
кости; хроническая почечная
недостаточность.
При усиленном распаде КЛГ I типа
увеличивается количество в моче и
плазме гидроксипролина, а также
кальция в моче утром натощак.
При нарушении созревания КЛГ –
растет уровень Про в плазме крови.
28
29.
10. Строение эластинаЭластин – гликопротеин, структурный белок кровеносных сосудов,
легких, кожи, тканей периодонта, корня языка, в подслизистом слое губ,
щек, т.е. тканей, обладающих эластичностью.
М.м. 70 кДа, преобладают гидрофобные аминокислоты с небольшим
радикалом 27% -гли, 19%-ала, 10%-вал, 4,7%-лей, про и др.
Синтез эластина начинается в фибробластах, хондробластах и гладкомышечных клетках с образованием тропоэластина.
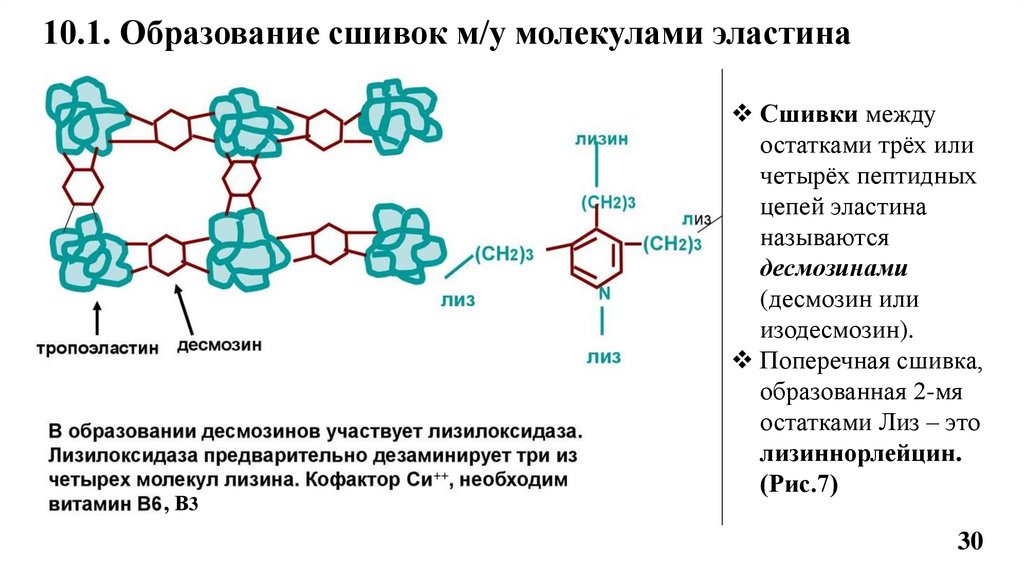
Окисление лизина под действием Cu-содержащей лизилоксидазы и
образование межмолекулярных лизиновых сшивок и десмозина.
Десмозин образуется из 3-х молекул аллизина, к-е конденсируются с 4-й
АК- лизином.
29
Структурным компонентом эластина является десмозин.
30.
10.1. Образование сшивок м/у молекулами эластина, В3
Сшивки между
остатками трёх или
четырёх пептидных
цепей эластина
называются
десмозинами
(десмозин или
изодесмозин).
Поперечная сшивка,
образованная 2-мя
остатками Лиз – это
лизиннорлейцин.
(Рис.7)
30
31.
11. Катаболизм эластинаОсуществляется под действием эластазы (эндопептидаза) полиморфно-ядерных
лейкоцитов (ПЯЛ). Эластаза может гидролизовать во ВКМ не только эластин, но и
другие белки (ПГ, коллаген и др.) Активность эластазы ингибирует 1- антитрипсин,
который синтезируется в печени и находится в крови. В тканях 1- антитрипсин
синтезируется макрофагами.
Изменения структуры эластина при патологии
Нарушение всасывания и дефицит Сu2+, наследственный дефект лизилоксидазы
ведет к нарушению образования десмозина. При этом утрачиваются пластичные
свойства эластина, что клинически проявляется в серьезной патологии сердца,
сосудов, легких (аневризма, эмфизема легких, варикозная болезнь, дефекты
сердечных клапанов).
В тканях десны эластаза неактивна. При воспалении повышается количество ПЯЛ.
Они становятся источником эластазы, активность которой возрастает, а содержание
1- антитрипсина (ингибитора) остается неизменным, что приводит к деструкции
31
эластичных волокон при гингивите и пародонтите.
32.
12. ГликозаминогликаныСтроение - линейные гетерополисахариды, содержат повторяющиеся
дисахаридные фрагменты.
Примеры: гиалуроновая кислота, хондроитинсульфат, дерматансульфат,
кератансульфат, гепарансульфат и др.
Наличие СОО- - групп и SO32- - cульфатных групп в
гликозаминогликанах придает им большой отрицательный заряд и
способность связывать Н2О для выполнения рессорной функции и
формирования тургора различных тканей.
За счет полианионных свойств все гликозаминогликаны связывают
катионы Са2+, Na+, K+ и принимают участие в минеральном обмене.
32
33.
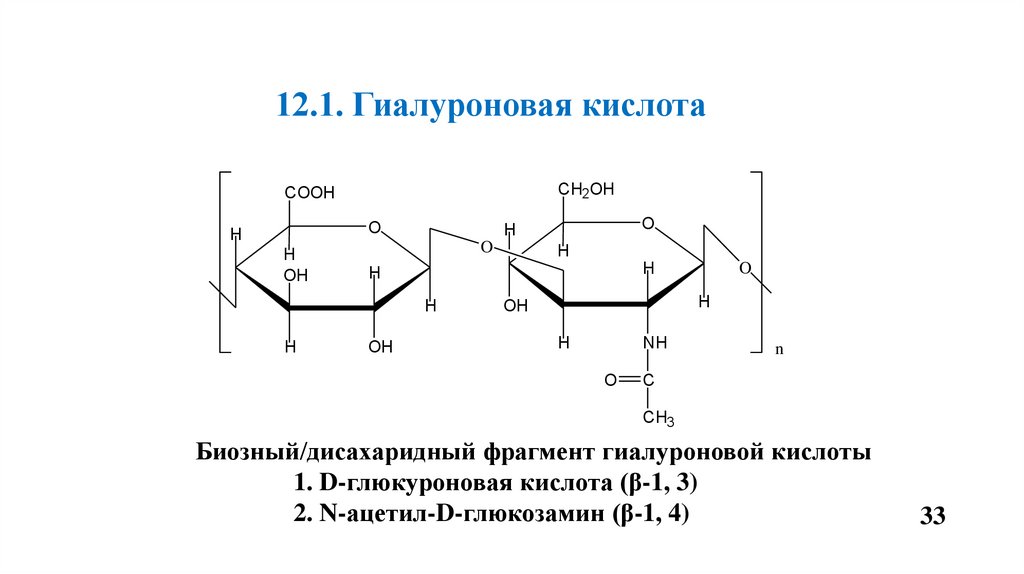
12.1. Гиалуроновая кислотаCH2OH
COOH
O
H
H
OH
O
H
OH
O
H
H
H
H
O
H
H
OH
H
NH
O
n
C
CH3
Биозный/дисахаридный фрагмент гиалуроновой кислоты
1. D-глюкуроновая кислота (β-1, 3)
2. N-ацетил-D-глюкозамин (β-1, 4)
33
34.
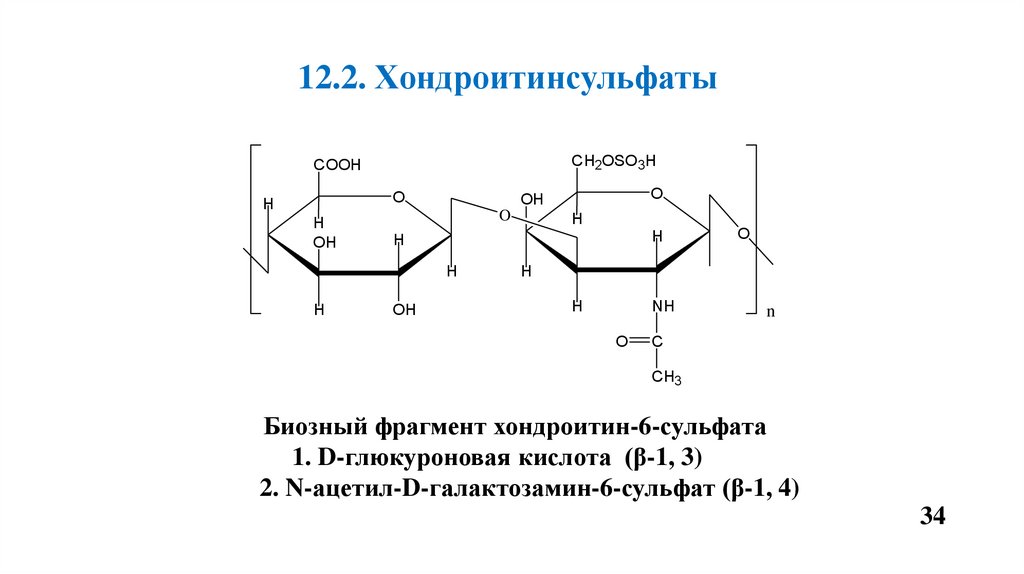
12.2. ХондроитинсульфатыCH2OSO3H
COOH
O
H
H
OH
O
H
H
H
H
H
O
OH
OH
O
H
H
NH
O
n
C
CH3
Биозный фрагмент хондроитин-6-сульфата
1. D-глюкуроновая кислота (β-1, 3)
2. N-ацетил-D-галактозамин-6-сульфат (β-1, 4)
34
35.
Гиалуроновая кислота (ГлК) – самый крупный гликозаминогликан.• Состоит из глюкуроновой кислоты и N-ацетилглюкозамина.
• ГлК много в пульпе зуба, она связывает большое количество воды.
• В больших количествах гиалуроновая кислота синтезируется во
время заживления ран и обеспечивает барьерную функцию.
Хондроитин-4(6)-сульфат
• Состоит из глюкуроновой кислоты и N-ацетил -D галактозамин 4(6)-сульфата.
• Находится во всех тканях полости рта, преимущественно в костной и
хрящевой ткани, цементе, дентине обеспечивает фиксацию
минеральных компонентов.
35
36.
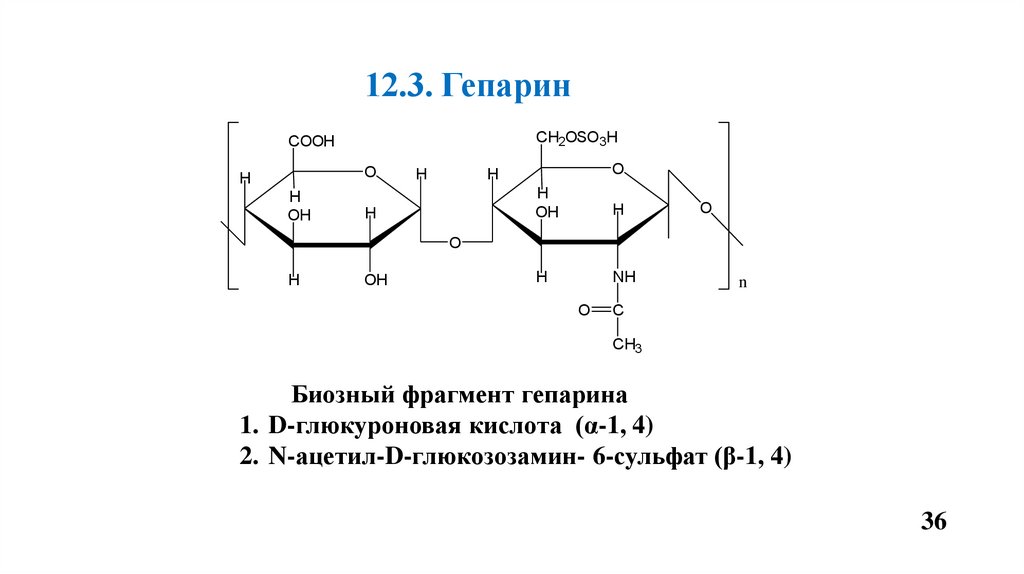
12.3. ГепаринCH2OSO3H
COOH
O
H
H
OH
H
O
H
H
H
OH
H
H
NH
O
O
H
OH
O
n
C
CH3
Биозный фрагмент гепарина
1. D-глюкуроновая кислота (α-1, 4)
2. N-ацетил-D-глюкозозамин- 6-сульфат (β-1, 4)
36
37.
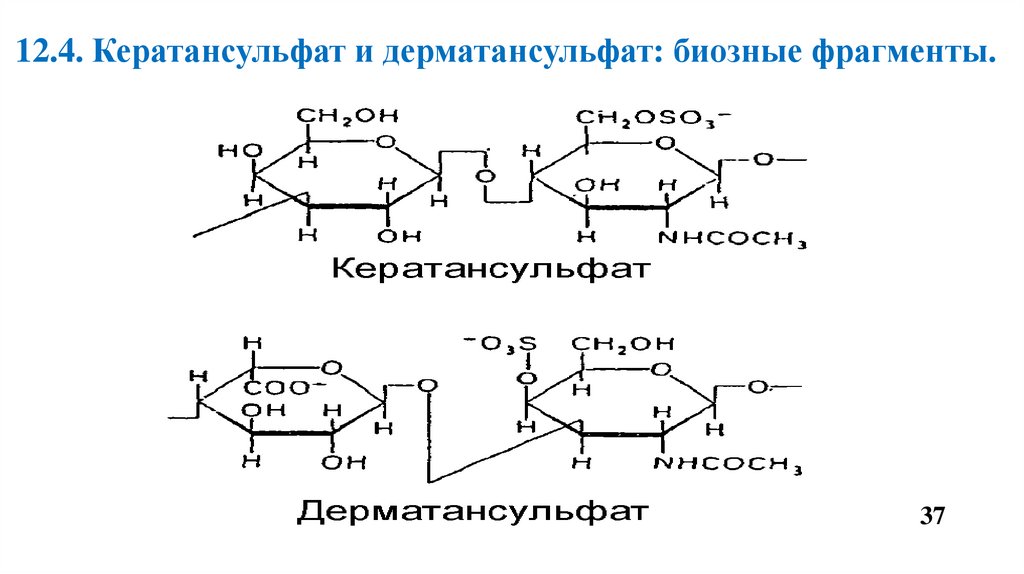
12.4. Кератансульфат и дерматансульфат: биозные фрагменты.37
38.
Гепарин- антикоагулянт прямого действия.• Синтезируется и накапливается в секреторных гранулах «тучных» клеток.
• Активирует ЛПЛ внепеченочных тканей.
• Гепарансульфат входит в состав протеогликанов (ПГ) базальных мембран, является
обязательным компонентом клеточной поверхности.
Дерматансульфат состоит из идуроновой кислоты и N-ацетил -D галактозамин 4-сульфата.
• Входит в состав малых ПГ – бигликана и декорина.
• Присутствует в больших количествах в коже, хрящах, сухожилиях, межпозвоночных
дисках, кровеносных сосудах, клапанах сердца.
• Участвует в стабилизации коллагеновых волокон.
Кератансульфат состоит из галактозы и N-ацетил -D глюкозамин -6-сульфата.
• Содержится в тканях полости рта, в хрящевой ткани и пульпе зуба.
• В роговице глаза обеспечивает прозрачность роговицы.
• Кератансульфаты входят в состав большого ПГ – агрекана и некоторых малых ПГ
хрящевого матрикса.
38
39.
12.5. Катаболизм гликозаминогликановПроисходит в клетках СТ под действием лизосомальных ферментов –
экзо-и эндогликозидаз (β-глюкуронидазы, гиалуронидазы, βгалактозидазы, β-идуронидазы) и сульфатазы.
Наследственные дефекты этих ферментов приводят к заболеваниям мукополисахаридозам.
• Болезнь характеризуется накоплением гликозаминогликанов в тканях.
• Происходит деформация скелета, увеличение органов, задержка
роста, искривление зубов, помутнением роговицы, нарушение
умственного развития, поражением ССС и др.
• Заболевание не поддается лечению.
При воспалении тканей пародонта бактериальные гиалуронидазы
расщепляют гиалуроновую кислоту, таким образом микроорганизмы
39
разрушают гликозаминогликаны межклеточного матрикса.
40.
13. ПротеогликаныСтроение
Высокомолекулярные соединения, состоящие из белкового компонента
(корового белка) и ковалентно присоединенных к нему через N-или Огликозидные связи сульфатированных гликозаминогликанов (ГАГ).
Содержание белка - 5% , а ГАГ- 95%.
Биологическая роль
Создают структурный каркас клеток, поддерживают форму тканей.
Играют роль рецепторов при сборке межклеточного матрикса.
Облегчают прикрепление клеток и регулируют их рост.
Связывают катионы и основную часть воды, поддерживая тургор тканей.
Присоединяют и хранят факторы роста.
Выполняют роль «молекулярного сита», задерживая бактерии и вирусы.
40
41.
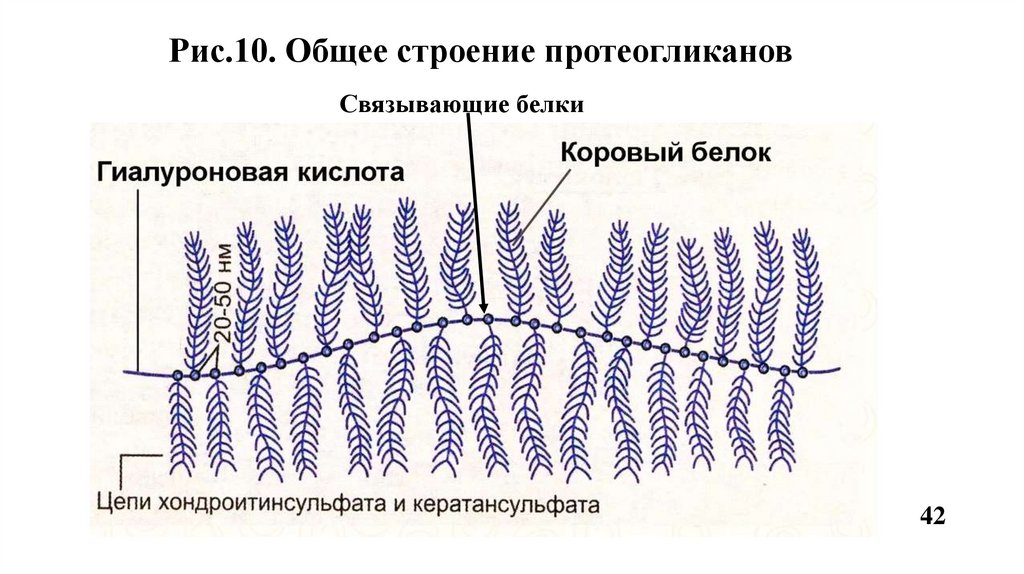
13.1. Большие протеогликаныСодержат более 100 цепей гликозаминогликанов например, агрекан,
версикан и др.(Рис.10, 11).
Версикан присутствует в цементе, костной ткани, пульпе зуба, слизистой
оболочке, периодонтальных связках, коже, кровеносных сосудах, хрящах.
Стержневой белок версикана состоит из аминокислотных
последовательностей Глу-Гли-Фен. Содержит хондроитинсульфаты,
гиалуроновую кислоту м.м. около 1000кДа. Роль: выполняет структурную
функцию; участвует в формировании матрикса за счет связывания с
коллагенами; заполненяет пространства между фибриллярными белками.
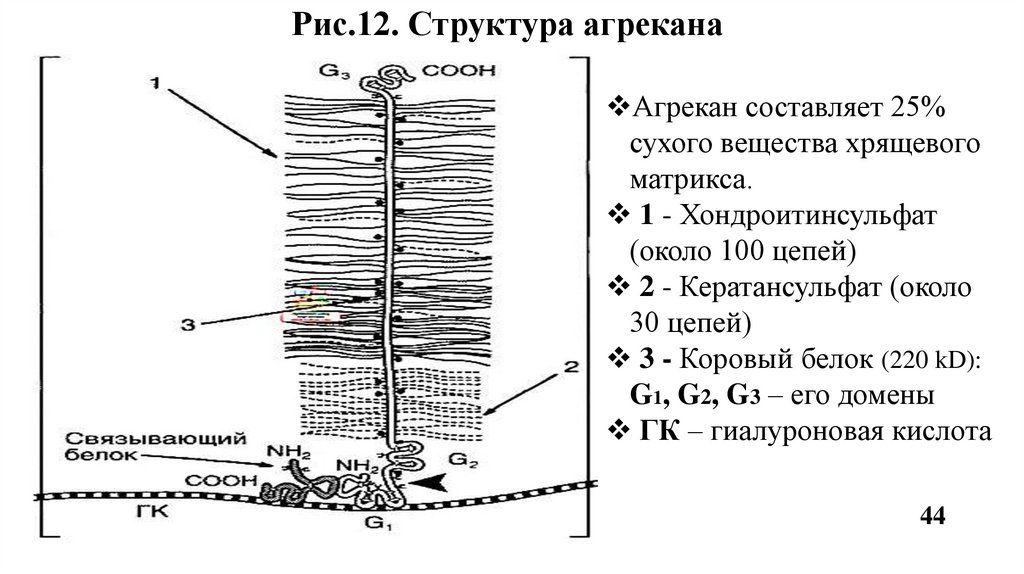
Агрекан - основной протеогликан хрящевой ткани. К одному коровому белку
присоединяются до 100 цепей хондроитинсульфатов и до 30 цепей
кератансульфатов. По форме агрекан напоминает бутылочный «ёршик»
(Рис.12). Агрекан связывается в агрегаты с гиалуроновой кислотой. Роль:
опорная функция, а также обеспечивает упругость хряща.
41
42.
Рис.10. Общее строение протеогликановСвязывающие белки
42
43.
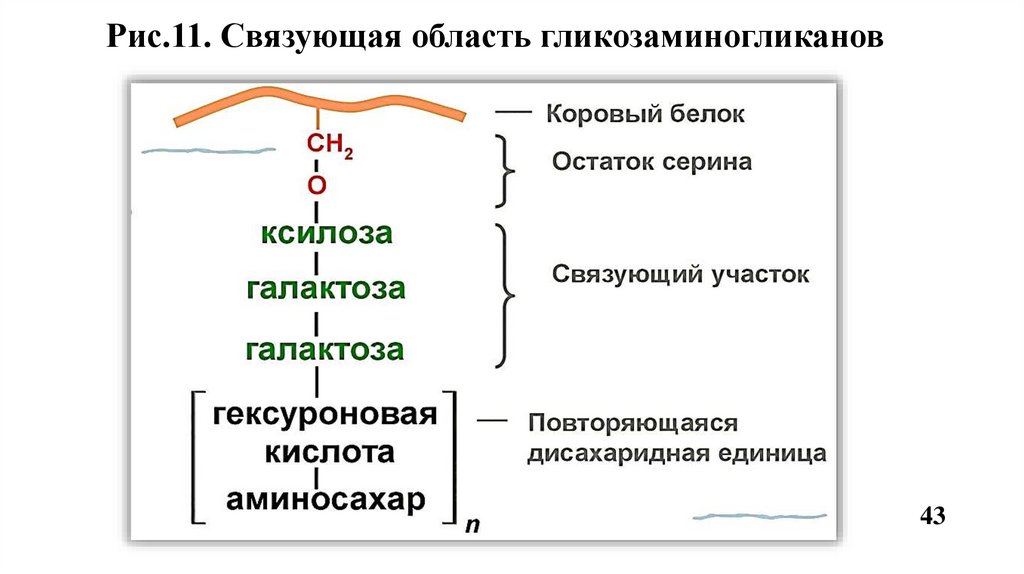
Рис.11. Связующая область гликозаминогликанов43
44.
Рис.12. Структура агреканаАгрекан составляет 25%
сухого вещества хрящевого
матрикса.
1 - Хондроитинсульфат
(около 100 цепей)
2 - Кератансульфат (около
30 цепей)
3 - Коровый белок (220 kD):
G1, G2, G3 – его домены
ГК – гиалуроновая кислота
44
45.
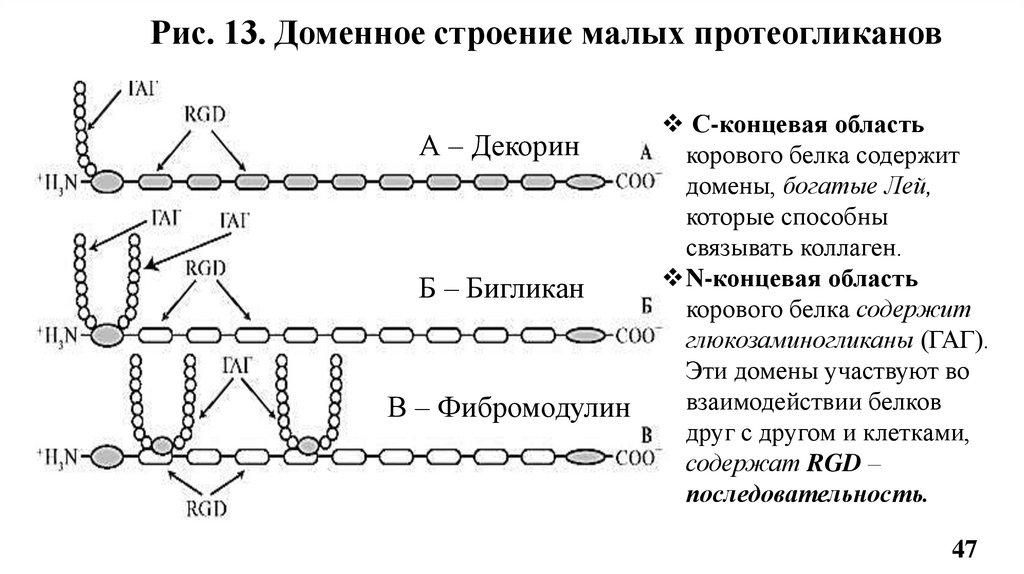
13.2. Малые протеогликаны (ПГ)Имеют небольшой коровый белок, к которому присоединены 1 или 2
цепи гликозаминогликанов.
Различают следующие группы малых протеогликанов:
• ПГ, Богатые лейцином (бигликан, декорин, фибромодулин,
остеоадерин, люмикан)
• ПГ, ассоциированные с клетками (синдекан, серглицин)
• ПГ базальных мембран (содержат гепарансульфат, напр., перлекан)
Фибромодулин м.м. 40 кДа, их небольшой коровый белок содержит
домены, богатые Лей, которые связываются с фибриллами коллагена II
типа, регулируя их диаметр;
Содержит 1-2 цепи кератансульфата и последовательности RGD (Рис.13).
Фибромодулин содержат: цемент корня зуба, дентин, периодонтальные
связки, костная ткань, пульпа зуба, слизистая оболочка.
45
46.
Остеоадерин м.м.~50кДа, их коровые белки, богаты Лей;содержит 4 сульфатированных остатка тирозина и цепи кератансульфата в
N-концевой области;
в С-концевой области много «-» заряженных АК.
Участвует в процессах минерализации.
Содержится в дентине, предентитне, костной ткани.
Бигликан и декорин м.м. 270 кДа,130 кДа, их коровые белки, богатые
Лей (Рис.13.).
Бигликан содержат 2 цепи дерматансульфата, а декарин - 1цепь
Участвуют в межклеточных взаимодействиях и связываются с эластином,
фибронектином, ламинином, β-ТФР.
Декорин участвует в связывании с коллагенами I и II типов, регулируя их
диаметр; ингибирует фибринолиз.
46
47.
Рис. 13. Доменное строение малых протеогликановА – Декорин
Б – Бигликан
В – Фибромодулин
С-концевая область
корового белка содержит
домены, богатые Лей,
которые способны
связывать коллаген.
N-концевая область
корового белка содержит
глюкозаминогликаны (ГАГ).
Эти домены участвуют во
взаимодействии белков
друг с другом и клетками,
содержат RGD –
последовательность.
47
48.
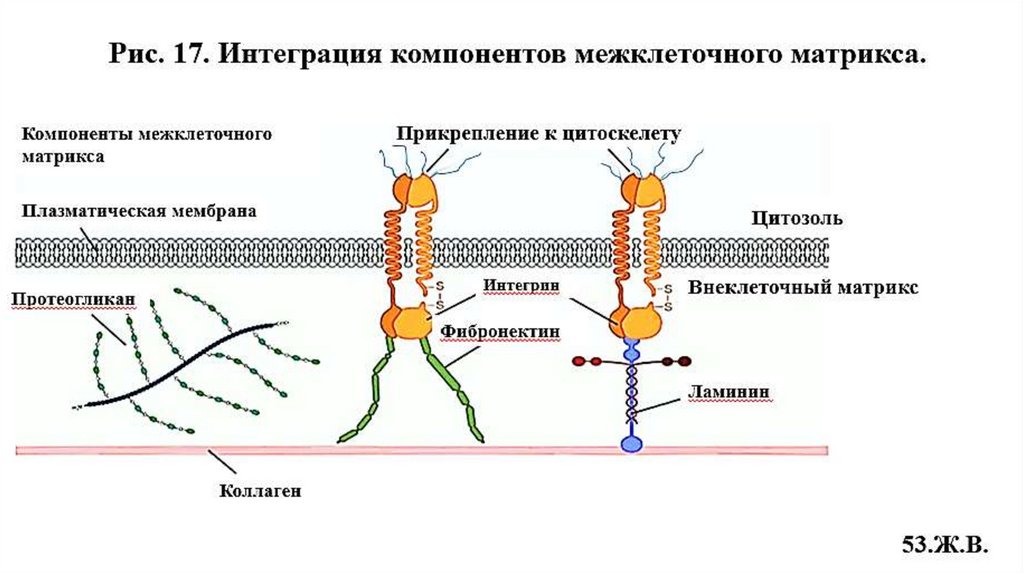
14. Неколлагеновые специализированные белкимежклеточного матрикса
14.1. Адгезивные белки
14.2. Антиадгезивные белки
• Фибронектин (Рис.14)
• Интегрин (Рис.15)
• Ламинин (Рис.16) и др.
• Остеонектин
• Тенасцин
• Тромбоспондин и др.
48
49.
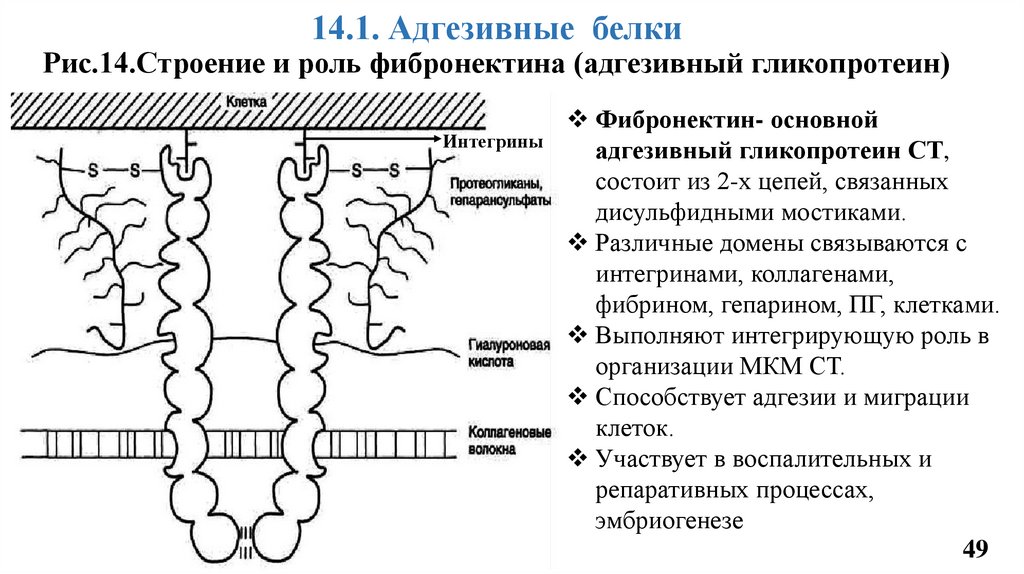
14.1. Адгезивные белкиРис.14.Строение и роль фибронектина (адгезивный гликопротеин)
Интегрины
Фибронектин- основной
адгезивный гликопротеин СТ,
состоит из 2-х цепей, связанных
дисульфидными мостиками.
Различные домены связываются с
интегринами, коллагенами,
фибрином, гепарином, ПГ, клетками.
Выполняют интегрирующую роль в
организации МКМ СТ.
Способствует адгезии и миграции
клеток.
Участвует в воспалительных и
репаративных процессах,
эмбриогенезе
49
50.
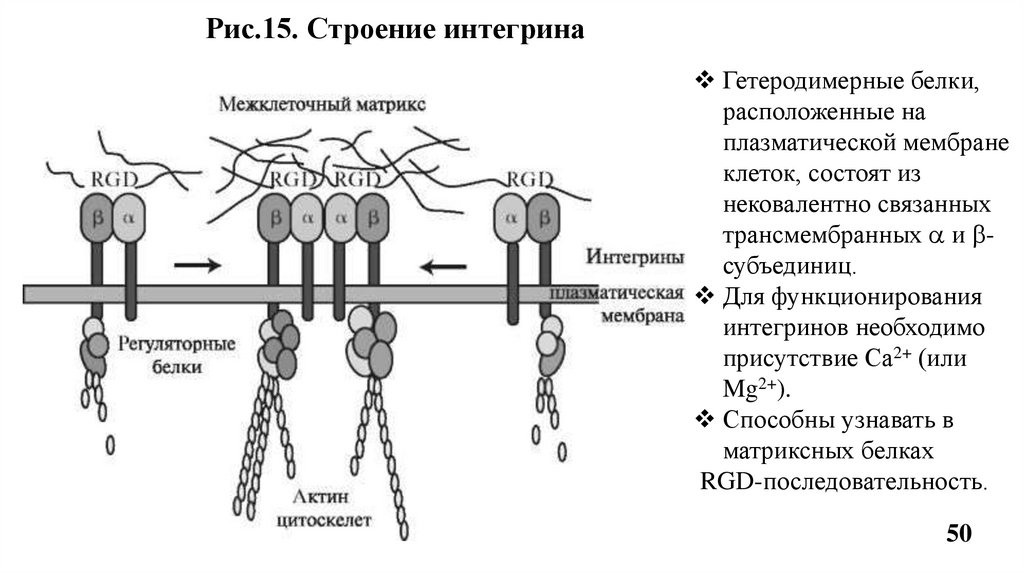
Рис.15. Строение интегринаГетеродимерные белки,
расположенные на
плазматической мембране
клеток, состоят из
нековалентно связанных
трансмембранных и субъединиц.
Для функционирования
интегринов необходимо
присутствие Са2+ (или
Mg2+).
Способны узнавать в
матриксных белках
RGD-последовательность.
50
51.
Благодраря трансмембранной ориентации (каждая цепь интегринапересекает мембрану один раз) интегрины передают сигналы от
межклеточного матрикса к цитоскелету и обратно, что
обеспечивает двухсторонюю передачу сигнала.
Цепи интегрина имеют большие внеклеточные домены, которые
обеспечивают адгезию клеток к клеткам и компонентам
межклеточного матрикса - коллагену, остеонектину, ламинину и др.
Взаимодействие интенгринов с белками межклеточного матрикса
в некоторых случаях препятствует апоптозу. Утрата или избыток
некоторых интегринов сопряжены с высокой степенью
злокачественности опухоли.
51
52.
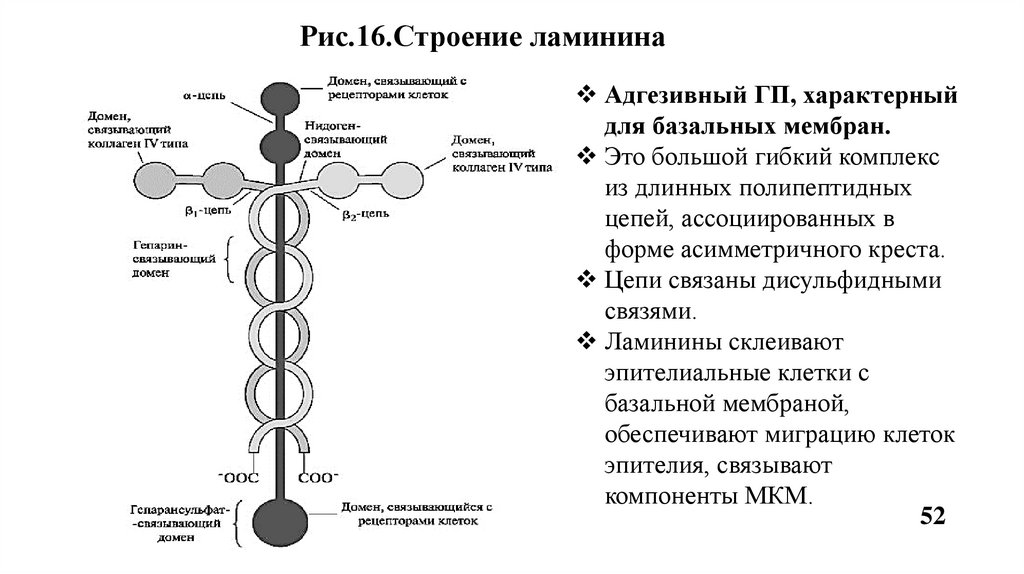
Рис.16.Строение ламининаАдгезивный ГП, характерный
для базальных мембран.
Это большой гибкий комплекс
из длинных полипептидных
цепей, ассоциированных в
форме асимметричного креста.
Цепи связаны дисульфидными
связями.
Ламинины склеивают
эпителиальные клетки с
базальной мембраной,
обеспечивают миграцию клеток
эпителия, связывают
компоненты МКМ.
52
53.
54.
14.2. Антиадгезивные белкиОстеонектин, тенасцин, тромбоспондин - гликопротеины обладают
антиадгезивными свойствами, играют роль в морфогенезе и эмбриогенезе, развитии
клеточного ответа на повреждение. Их концентрация повышается в матриксе при
некоторых опухолевых заболеваниях.
Тенасцин и тромбоспондин формируют комплексы с ПГ, поэтому изменяются
адгезивные свойства ПГ. Тромбоспондин проявляет антиадгезивные свойства в
клетках эндотелия и фибробластов. Он связывается с ТФР и β-ТФР и ослабевает
связывание матриксных молекул между собой.
• Остеонектин состоит из 4 доменов, к 2-м могут присоединяться ионы Са2+.
Остеониктин может ингибировать рост эндотелиальных клеток.
• Тромбоспондин и тенасцин - обладают как антиадгезивными, так и адгезивными
свойствами. Они взаимодействуют со многими лигандами межклеточного матрикса:
коллагеном, фибронектином, ПГ, Са2+и др.
• Количество тенасцина увеличивается в заживающих ранах.
54
55.
15. Список литературыОсновная литература
1. Биохимия. Под редакцией чл.-корр. РАН, проф. Северина Е.С., М., изд. ГЭОТАРМедиа, (В изданиях разных лет отличаются страницы, поэтому указаны разделы и главы):
Раздел 15 «Биохимия межклеточного матрикса», гл.I «Коллаген», гл.II «Эластин»,
гл.III «Гликозаминогликаны», гл.IV «Специализированные белки МКМ», гл. V «Структурная
организация МКМ»
2. Биологическая химия. Биохимия полости рта. Т.П. Вавилова., А.Е. Медведев.
Учебник. М., "ГЭОТАР-Медиа", 2014. Стр. 449-470.
3. Биохимия тканей и жидкостей полости рта. Вавилова Т.П. Учебное пособие.- 2-е изд;
испр. и доп. –М.: ГЭОТАР- Медиа, 2012. – 208 с.: ил. Стр.10-50.
4. Сборник тестовых заданий по разделам биологической химии и биохимии полости рта.
Уч.-методич. Пособие для студ. стом. фак. Под ред. проф. В.А. Дадали, доц. Ж.В. Антоновой,
доц. Р.Н. Павловой. Стр.140-150: «Биохимия соединительной ткани».
Дополнительная литература
3. Биохимия полости рта. Данилова Л.А., Чайка Н.А. Учебное пособие. СПб: СпецЛит
2012 – 62 с.: ил. Стр.7-19. // Или: изд. 2016 г. стр.8-24;
55
56.
Благодарю за внимание!56

































 Биология
Биология








