Похожие презентации:
Основы термодинамики
1. Основы термодинамики
2. Содержание
• Внутренняя энергия• Работа в термодинамике
• Первый закон термодинамики
_________
Термодинамика – теория тепловых
процессов, в которой не учитывается
молекулярное строение тел.
3. Внутренняя энергия
• Определение:Внутренняя энергия тела – это сумма
кинетической энергии хаотического
теплового движения частиц (атомов и
молекул) тела и потенциальной энергии
их взаимодействия
• Обозначение:
U
• Единицы измерения:
[Дж]
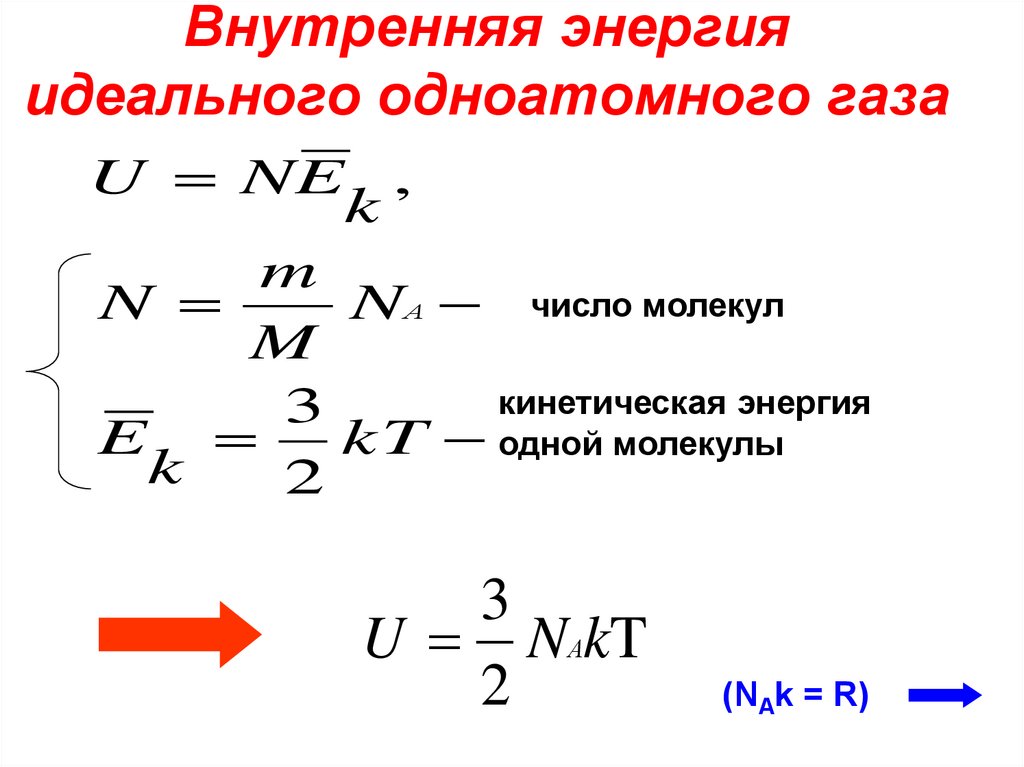
4. Внутренняя энергия идеального одноатомного газа
U NE ,k
m
N
NА число молекул
M
кинетическая энергия
3
E
kT одной молекулы
k
2
3
U NАkT
2
(NAk = R)
5. Внутренняя энергия идеального одноатомного газа
3mU
RT
2M
6. В общем виде:
i mi
U
RT pV
2M
2
где i – число степеней свободы молекул газа
(i = 3 для одноатомного газа и i = 5 для
двухатомного газа)
7.
Так какm
pV
RT
M
- уравнение Клапейрона –
Менделеева,
то внутренняя энергия:
3
U pV
2
5
U pV
2
- для одноатомного газа
- для двухатомного газа.
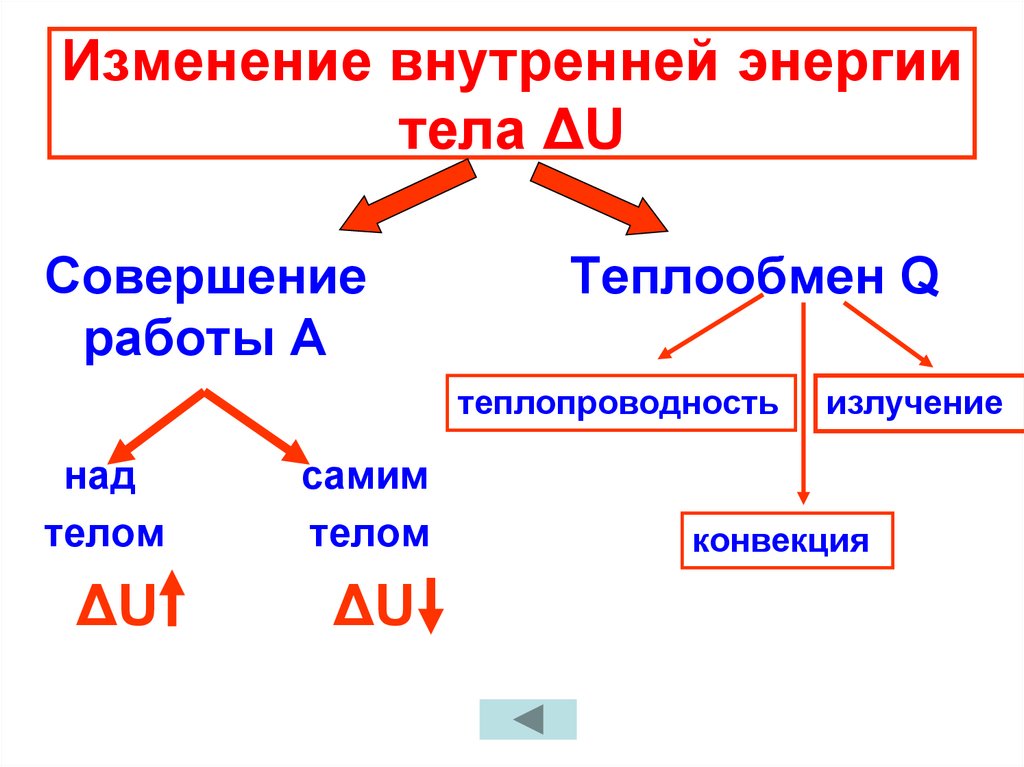
8. Изменение внутренней энергии тела ΔU
Совершениеработы А
Теплообмен Q
теплопроводность
над
телом
самим
телом
ΔU
ΔU
излучение
конвекция
9. Работа в термодинамике
• Работа газа:A p(V2 V1 ) p V
• Работа внешних сил:
A A
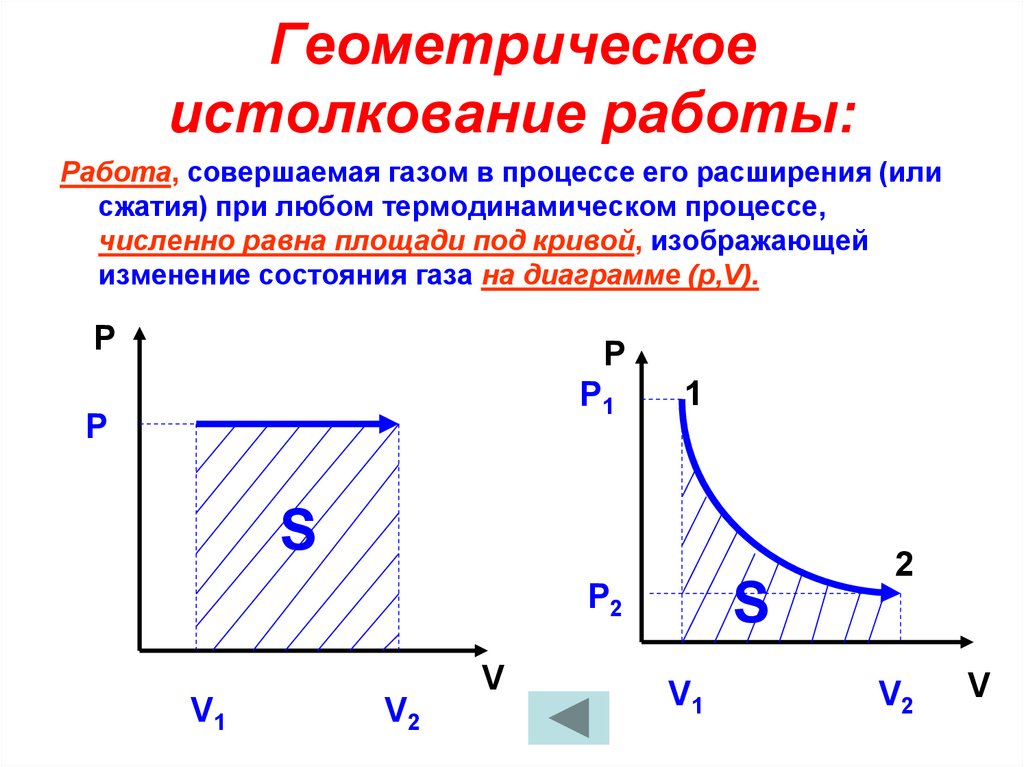
10. Геометрическое истолкование работы:
Работа, совершаемая газом в процессе его расширения (илисжатия) при любом термодинамическом процессе,
численно равна площади под кривой, изображающей
изменение состояния газа на диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
11.
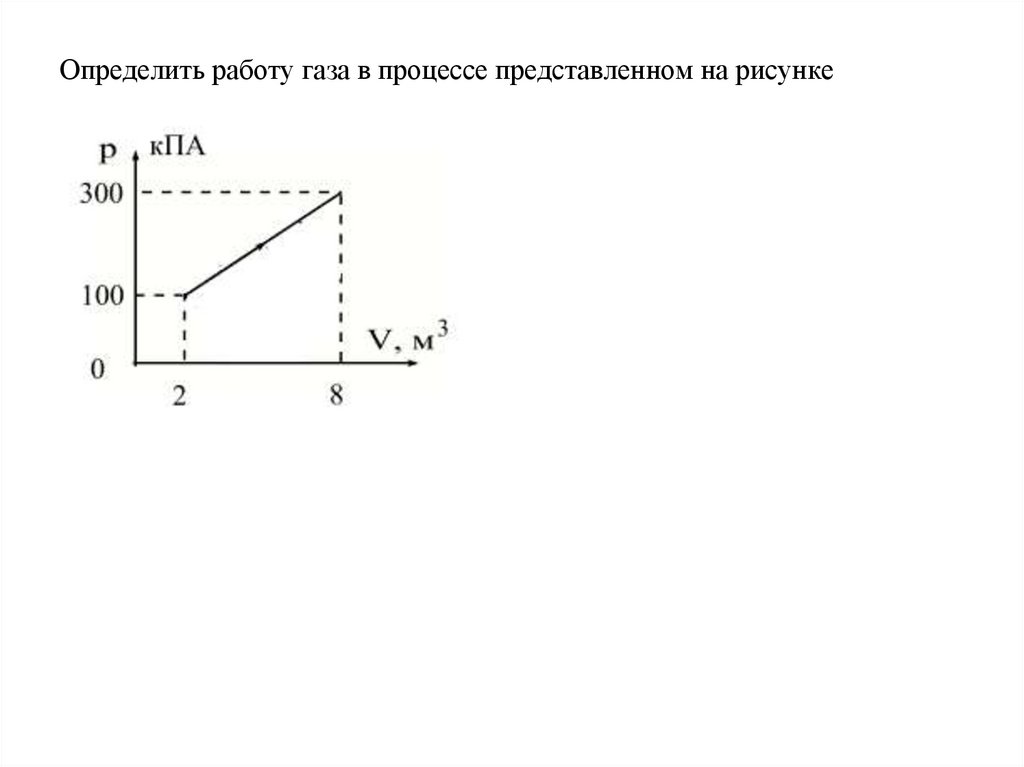
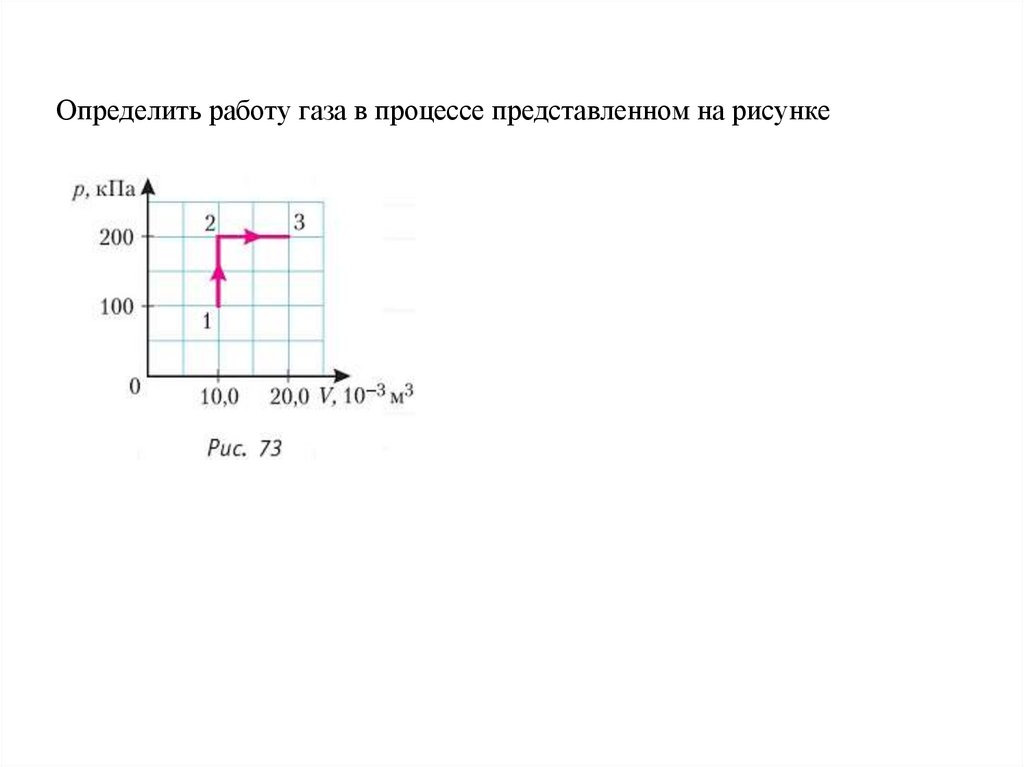
Определить работу газа в процессе представленном на рисунке12.
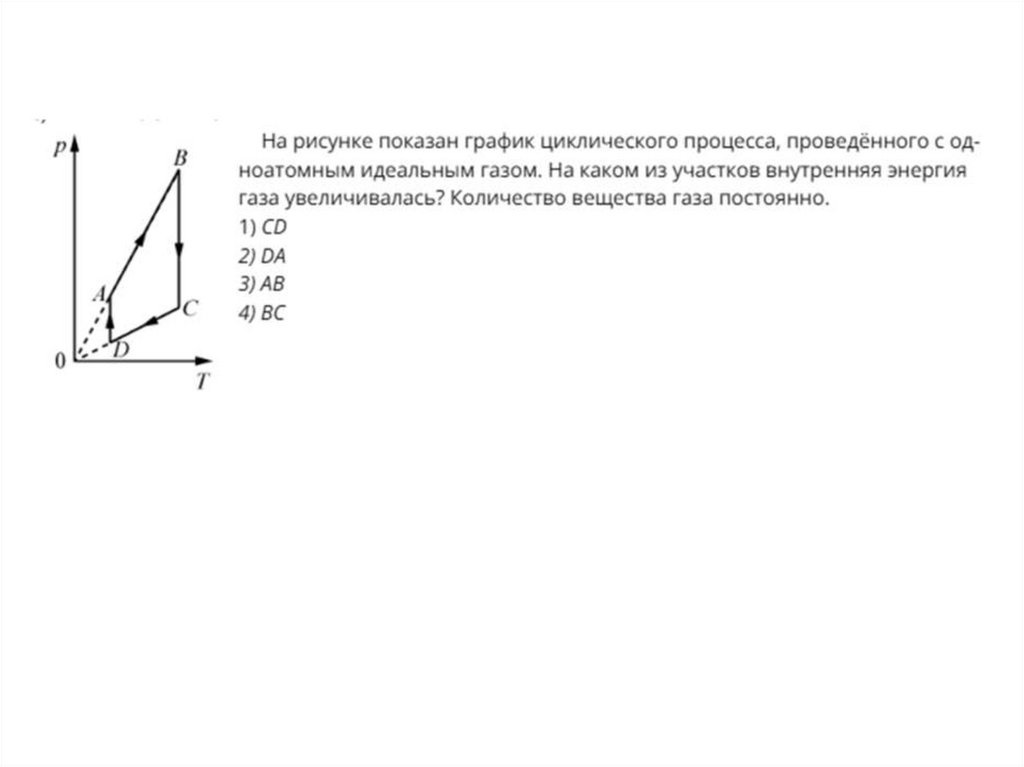
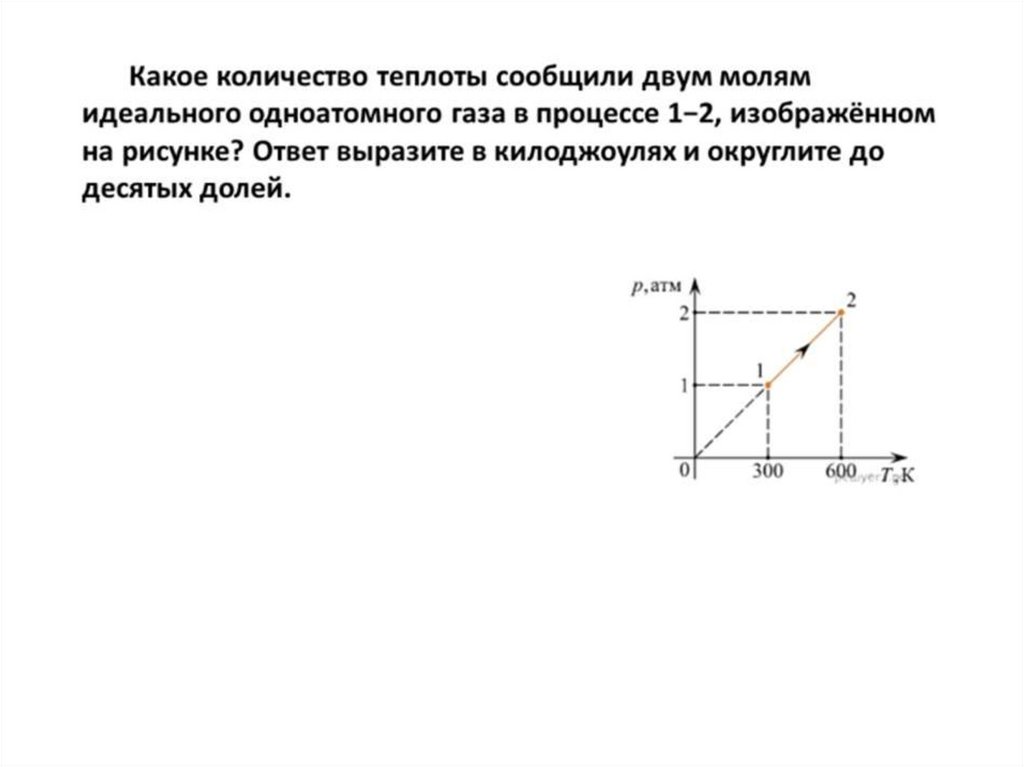
Определить работу газа в процессе представленном на рисунке13. Первый закон термодинамики
Количество теплоты, переданное системе, идёт наизменение её внутренней энергии и на совершение
системой работы над внешними телами
i
Q U A
14. Применение первого закона термодинамики к различным процессам
ПроцессИзохорный
Постоянный Первый закон
параметр
термодинамики
V = const
ΔU = Q
Изотермический Т = const
Q=A
Изобарный
Р = const
Q = ΔU + A
Адиабатный
Q=0
ΔU = -A










 Физика
Физика








