Похожие презентации:
Спирты. Номенклатура спиртов
1. спирты
СПИРТЫ2.
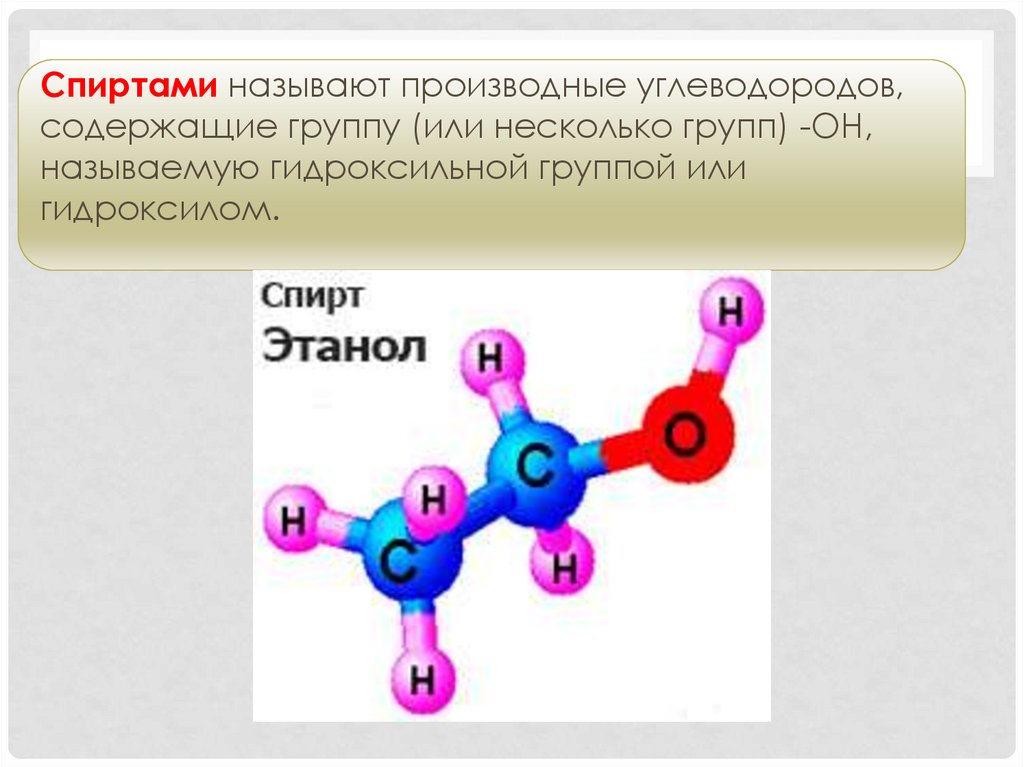
Спиртами называют производные углеводородов,содержащие группу (или несколько групп) -ОН,
называемую гидроксильной группой или
гидроксилом.
3.
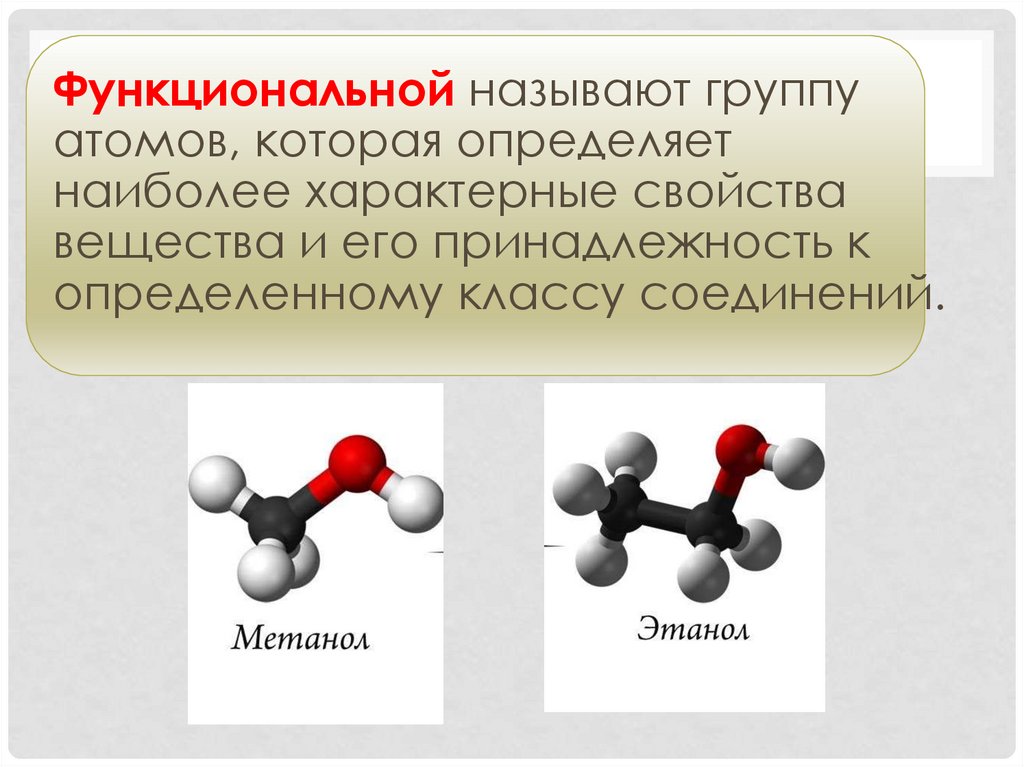
Функциональной называют группуатомов, которая определяет
наиболее характерные свойства
вещества и его принадлежность к
определенному классу соединений.
4.
Предельными одноатомнымиспиртами или, алканолами
называют органические
соединения, в молекулах которых
алкильный радикал (R) связан с
гидроксильной группой.
Состав их соответствует формуле
R – ОН или СnH2n+1OH
5.
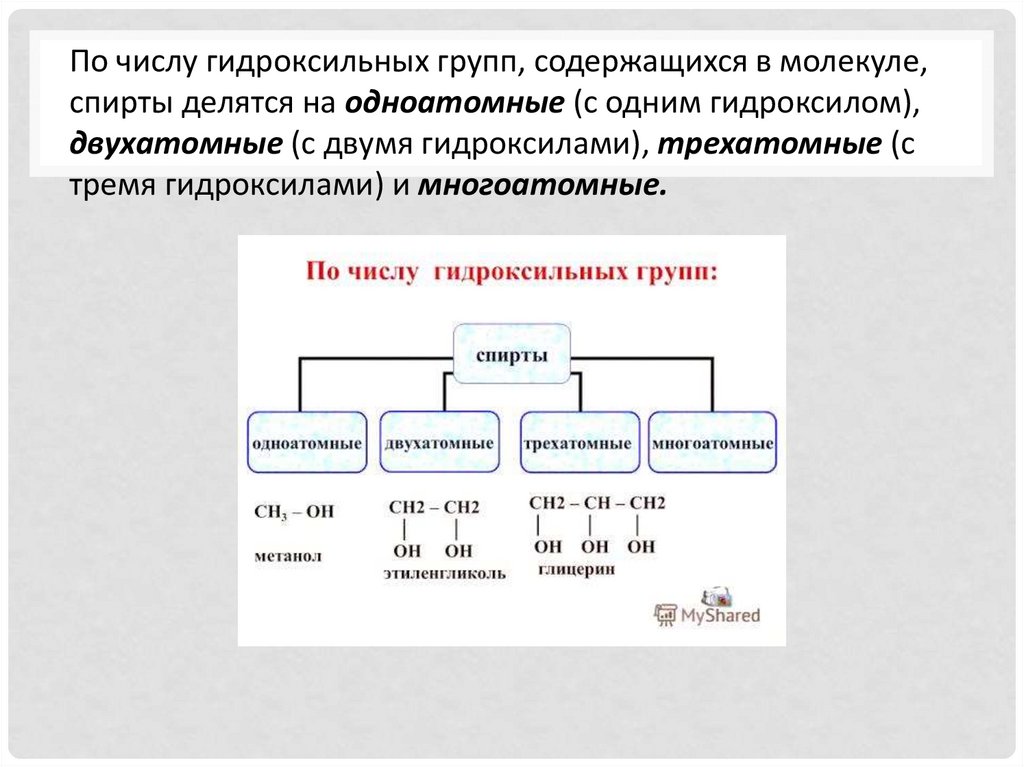
По числу гидроксильных групп, содержащихся в молекуле,спирты делятся на одноатомные (с одним гидроксилом),
двухатомные (с двумя гидроксилами), трехатомные (с
тремя гидроксилами) и многоатомные.
6. Номенклатура спиртов
НОМЕНКЛАТУРА СПИРТОВСистематические названия даются по названию
углеводорода с добавлением суффикса -ол и цифры,
указывающей положение гидроксигруппы (если это
необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца
цепи.
7. Изомерия спиртов
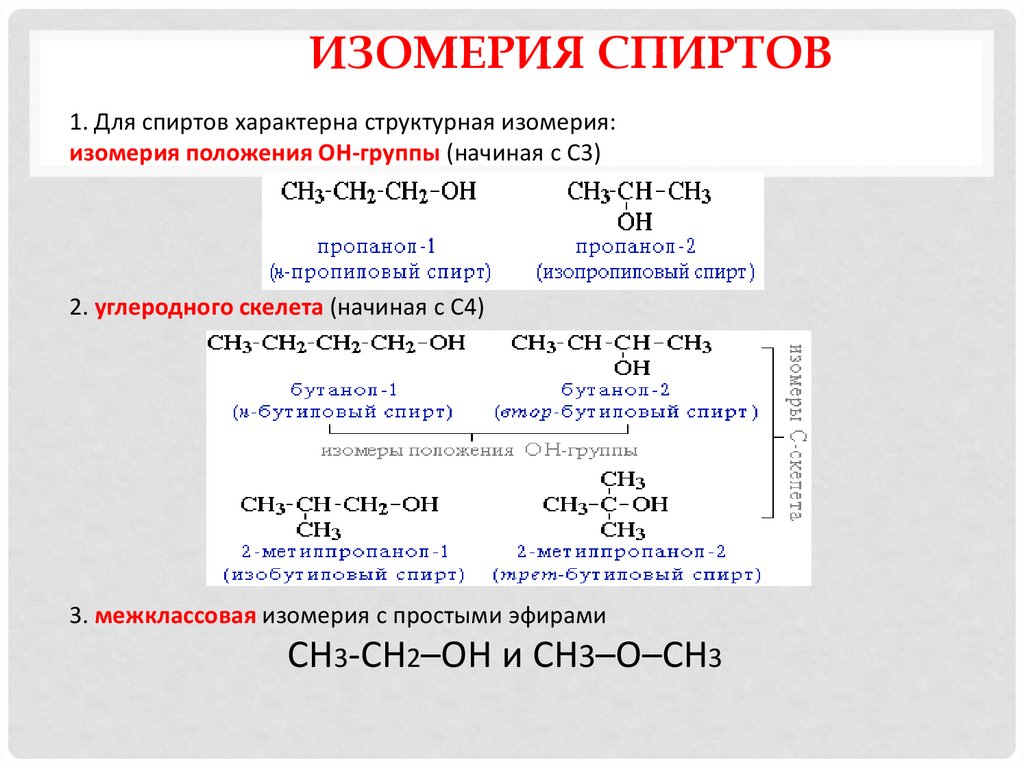
ИЗОМЕРИЯ СПИРТОВ1. Для спиртов характерна структурная изомерия:
изомерия положения ОН-группы (начиная с С3)
2. углеродного скелета (начиная с С4)
3. межклассовая изомерия с простыми эфирами
СН3-CH2–OH и CH3–O–CH3
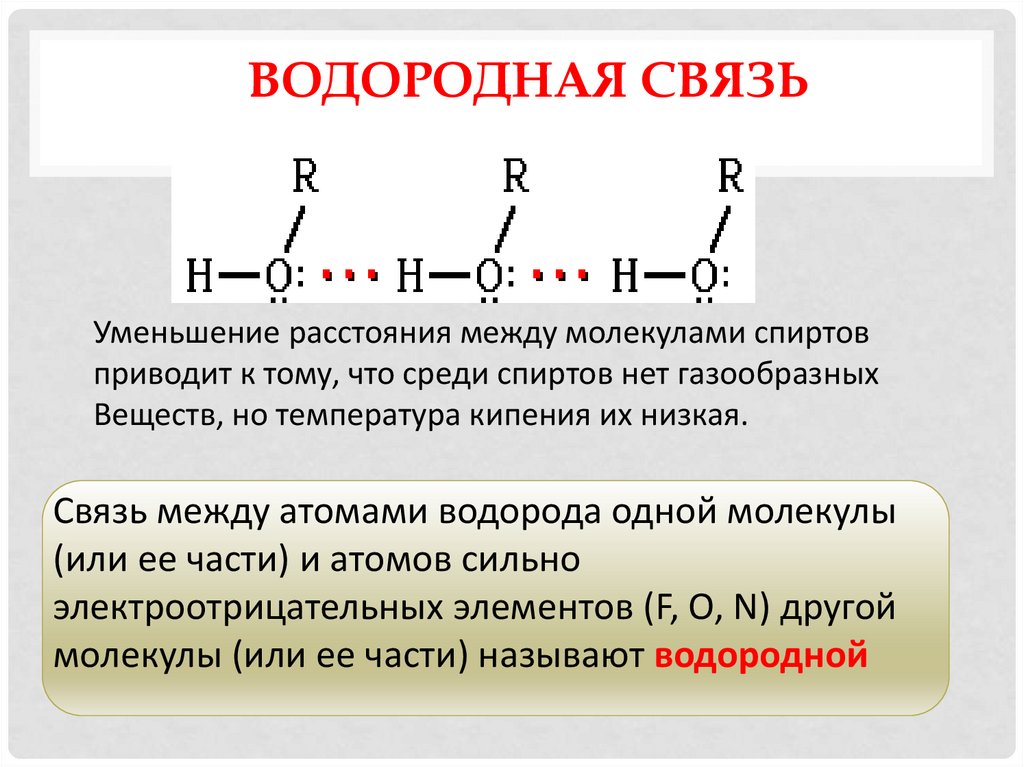
8. Водородная связь
ВОДОРОДНАЯ СВЯЗЬУменьшение расстояния между молекулами спиртов
приводит к тому, что среди спиртов нет газообразных
Веществ, но температура кипения их низкая.
Связь между атомами водорода одной молекулы
(или ее части) и атомов сильно
электроотрицательных элементов (F, O, N) другой
молекулы (или ее части) называют водородной
9. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВА10. Получение спиртов
ПОЛУЧЕНИЕ СПИРТОВ1. Гидролиз галогеналканов
2. Гидратация алкенов
3. Гидрирование альдегидов и кетонов
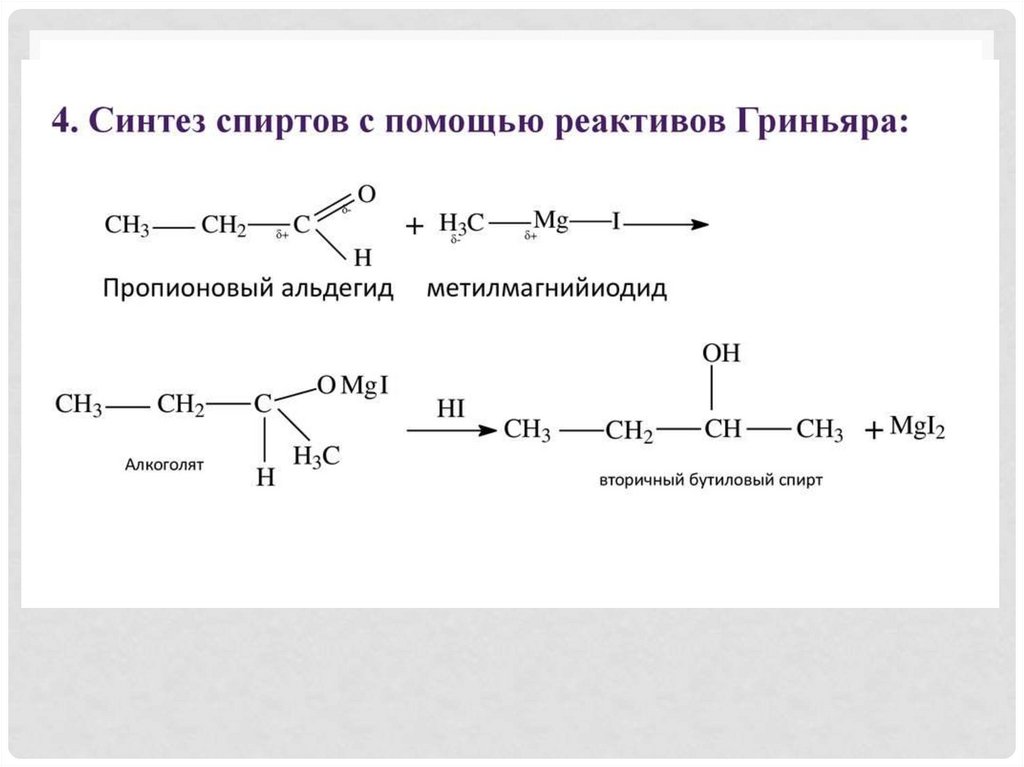
4. Реактив Гриньяра
5. Гидролиз сложных эфиров
6. Расщепление простых эфиров
7. Окисление метана
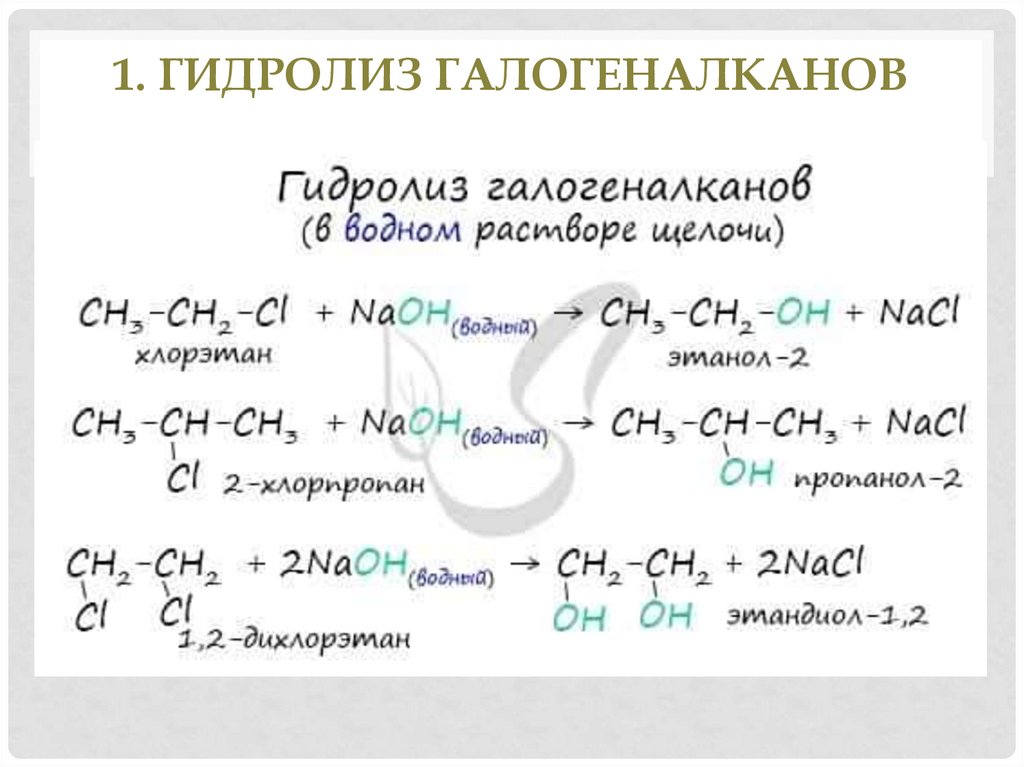
11. 1. Гидролиз галогеналканов
1. ГИДРОЛИЗ ГАЛОГЕНАЛКАНОВ12. 2. Гидратация алкенов
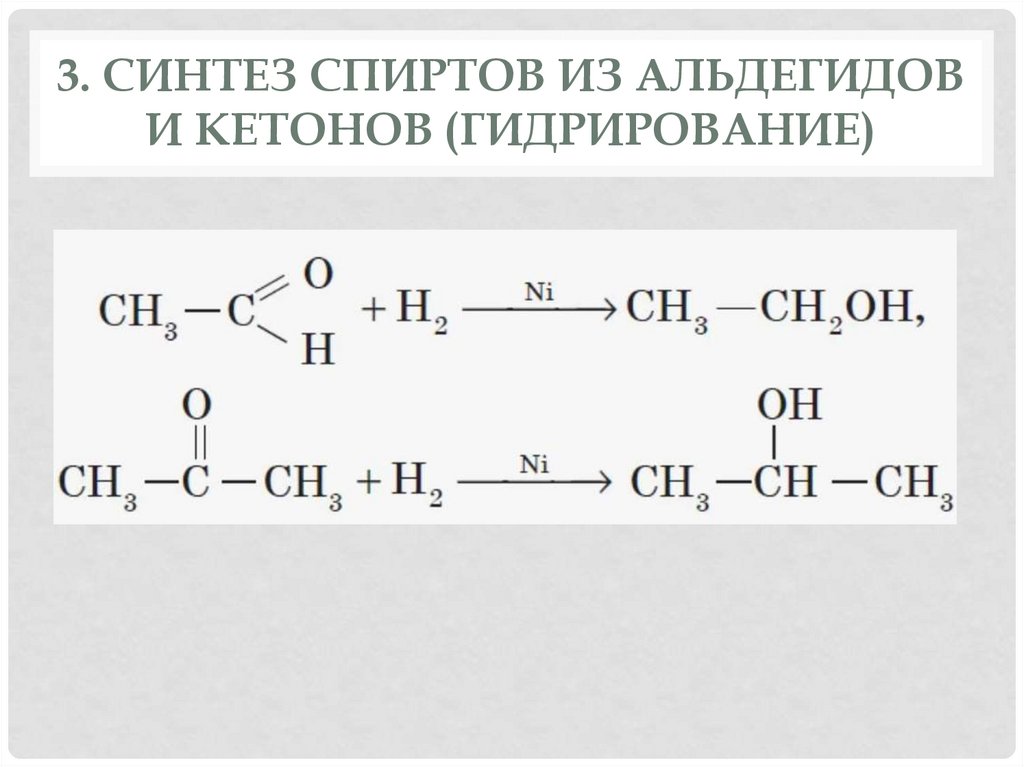
2. ГИДРАТАЦИЯ АЛКЕНОВ13. 3. Синтез спиртов из альдегидов и кетонов (Гидрирование)
3. СИНТЕЗ СПИРТОВ ИЗ АЛЬДЕГИДОВИ КЕТОНОВ (ГИДРИРОВАНИЕ)
14.
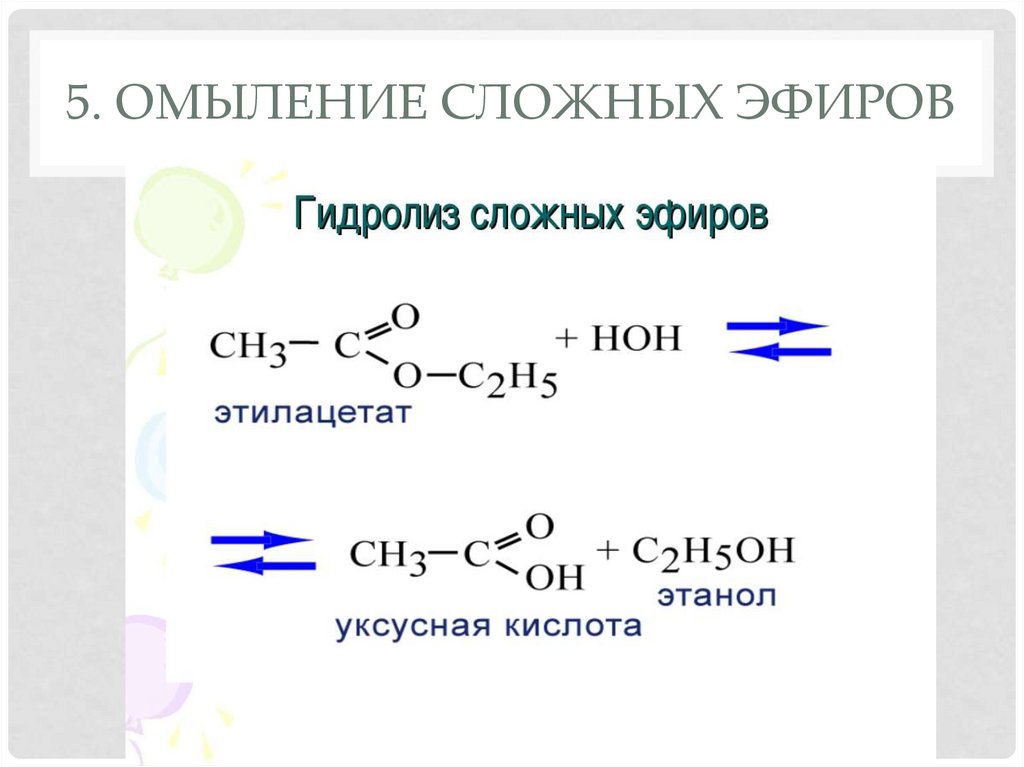
15. 5. Омыление сложных эфиров
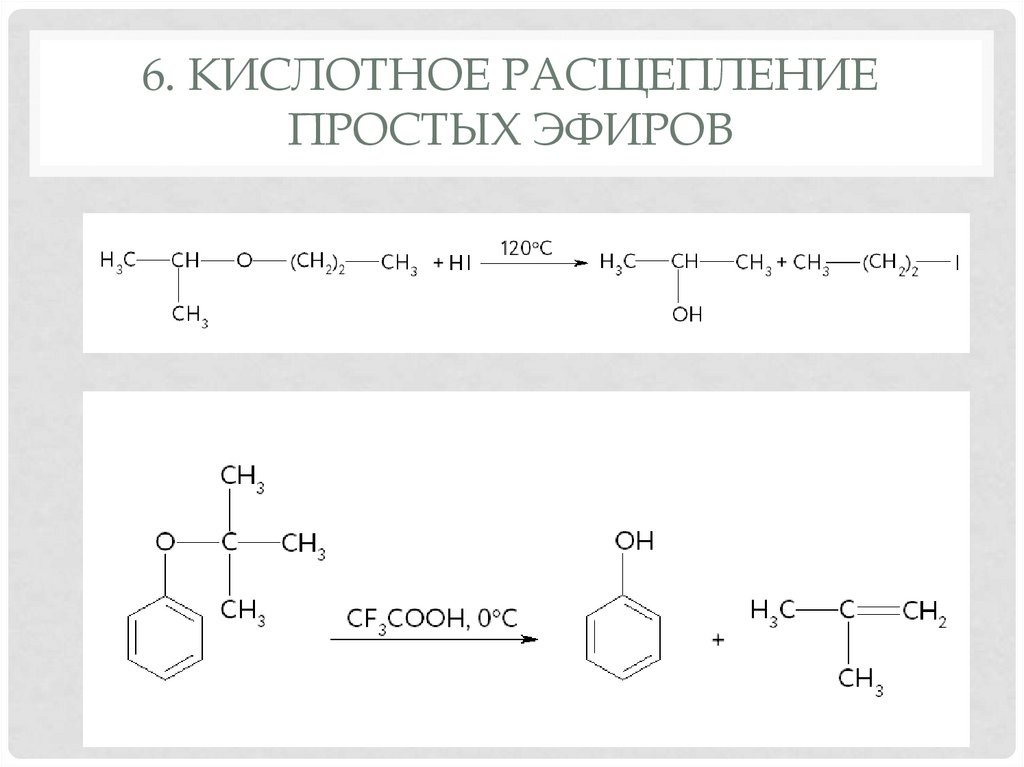
5. ОМЫЛЕНИЕ СЛОЖНЫХ ЭФИРОВ16. 6. Кислотное расщепление простых эфиров
6. КИСЛОТНОЕ РАСЩЕПЛЕНИЕПРОСТЫХ ЭФИРОВ
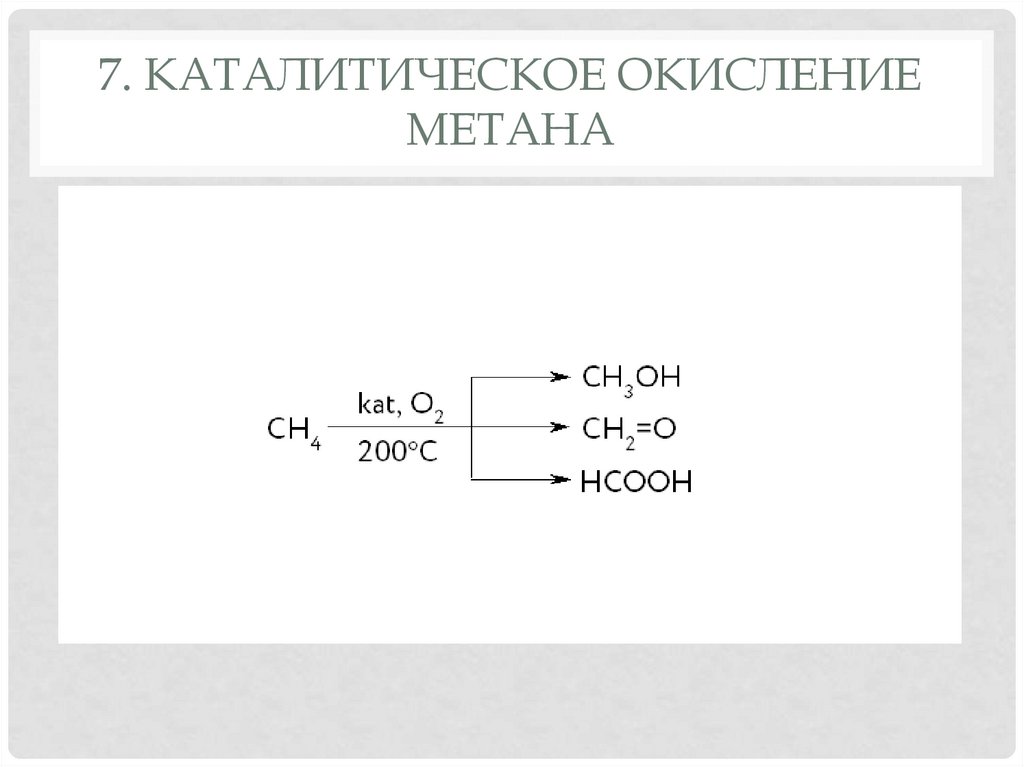
17. 7. Каталитическое окисление метана
7. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕМЕТАНА
18. Химические свойства спиртов
ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ1. + галогенводороды
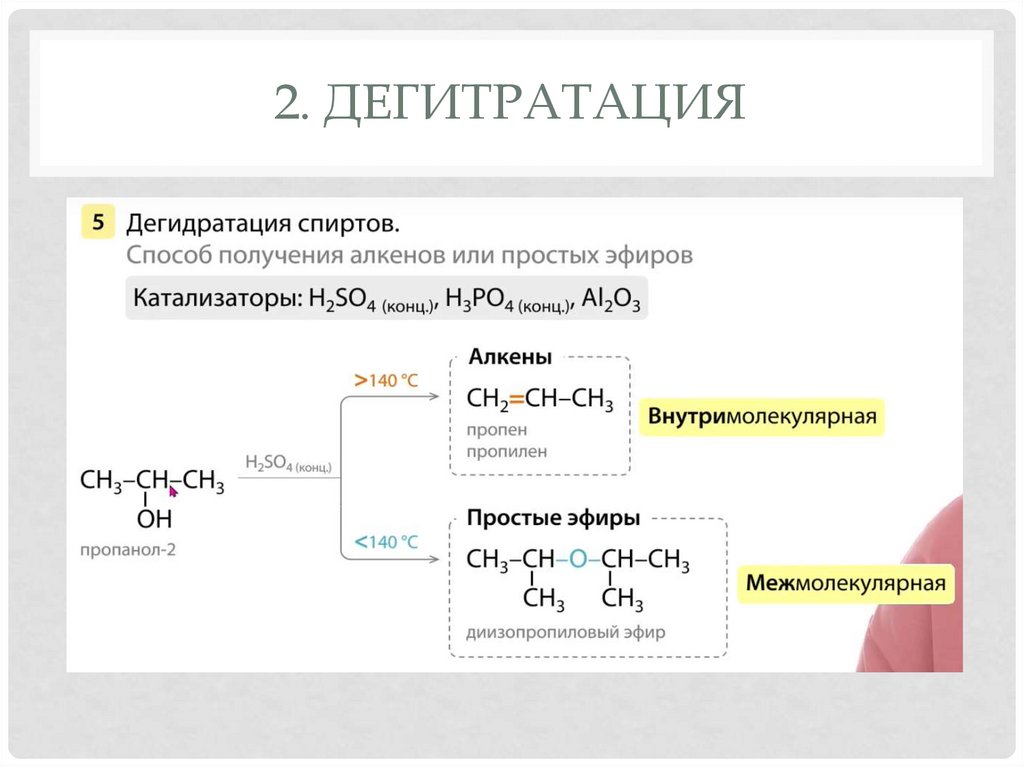
2. - вода (дегидратация) внутри/межмол.
3. + О2 (горение)
4. + щел/щелюзем Ме (замещение)
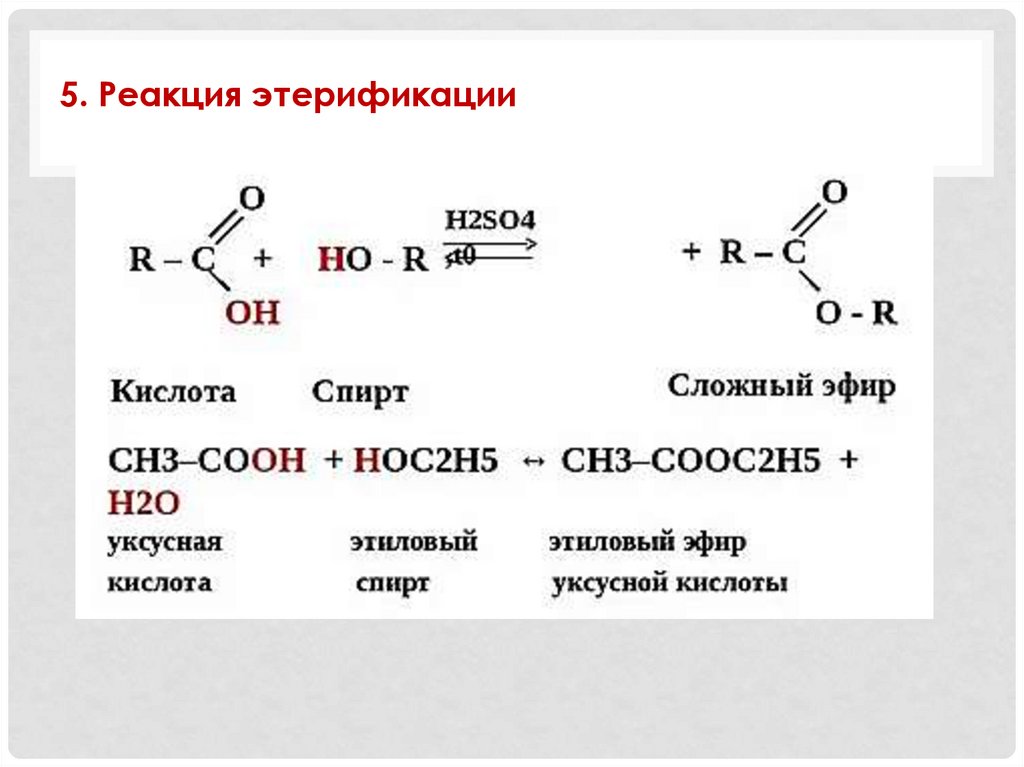
5. + карбоновые кислоты (этерификация)
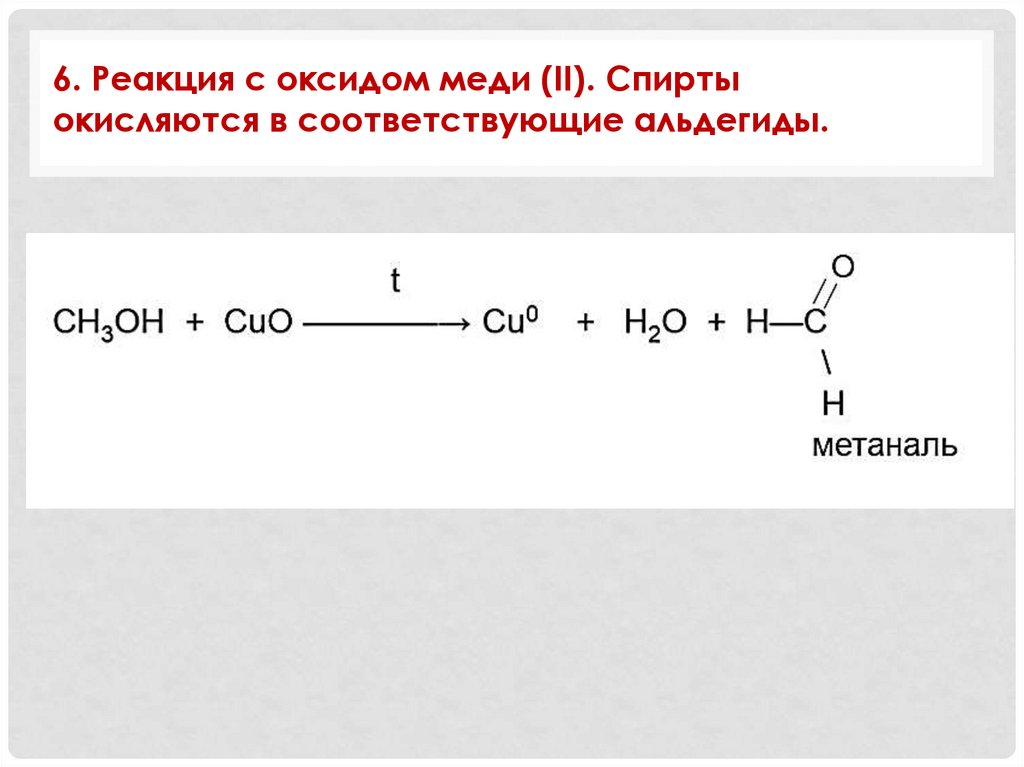
6. +СuО
7. Замещение на галоген
8. -Н2
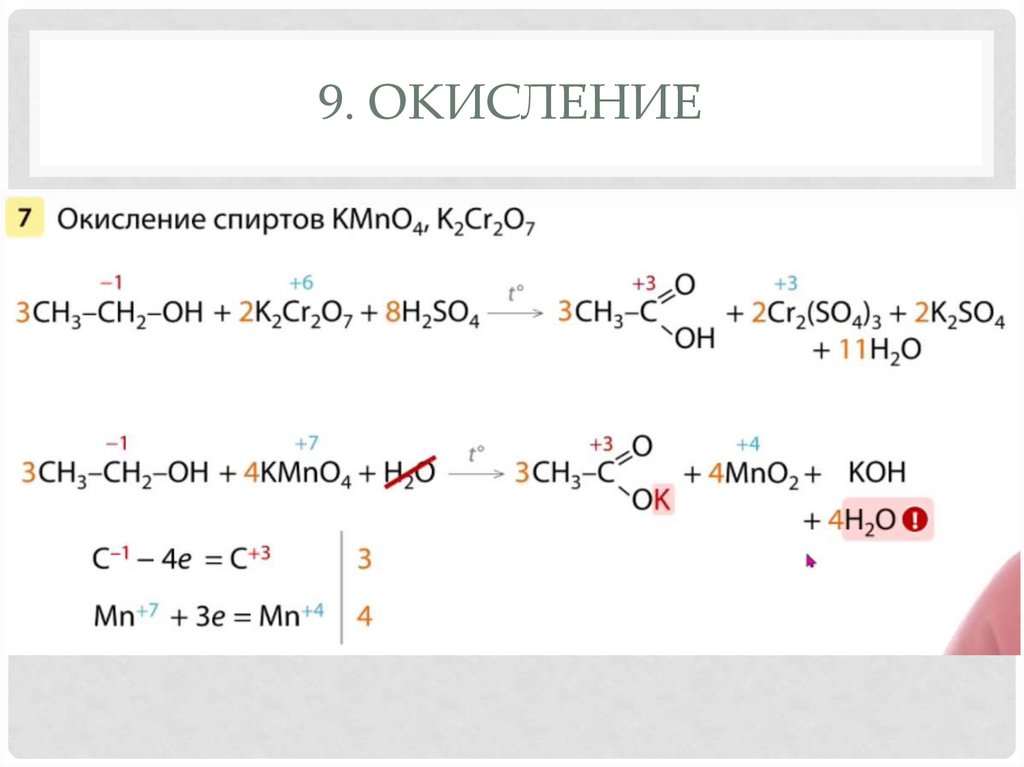
9. Окисление
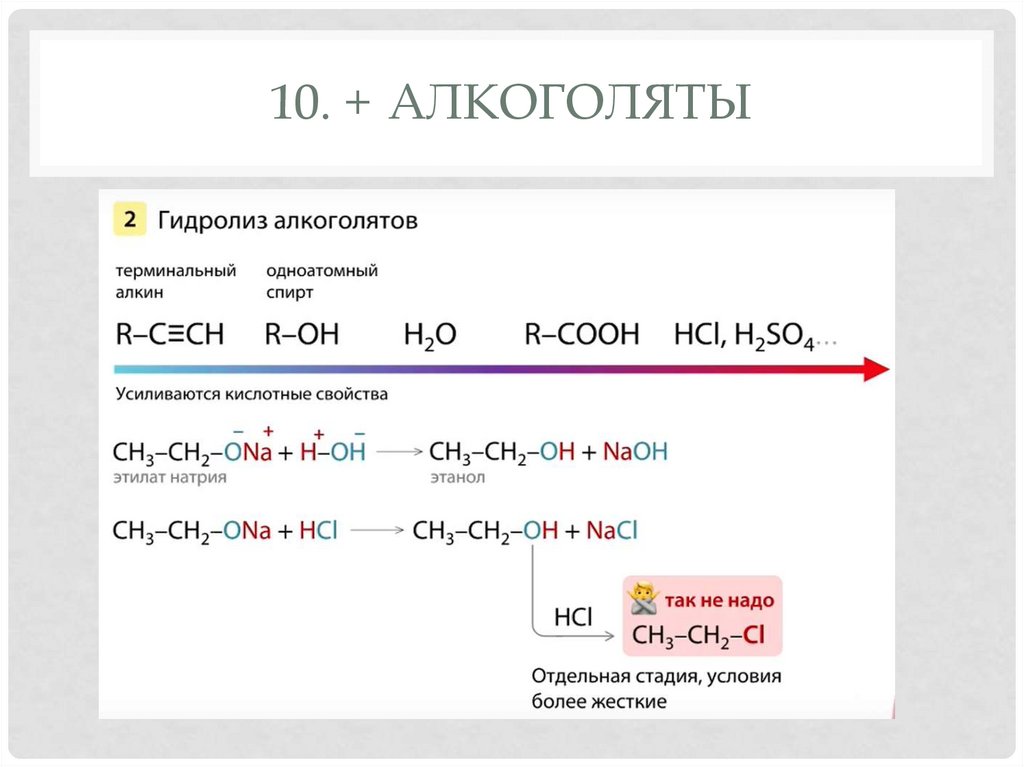
10. + алкоголяты
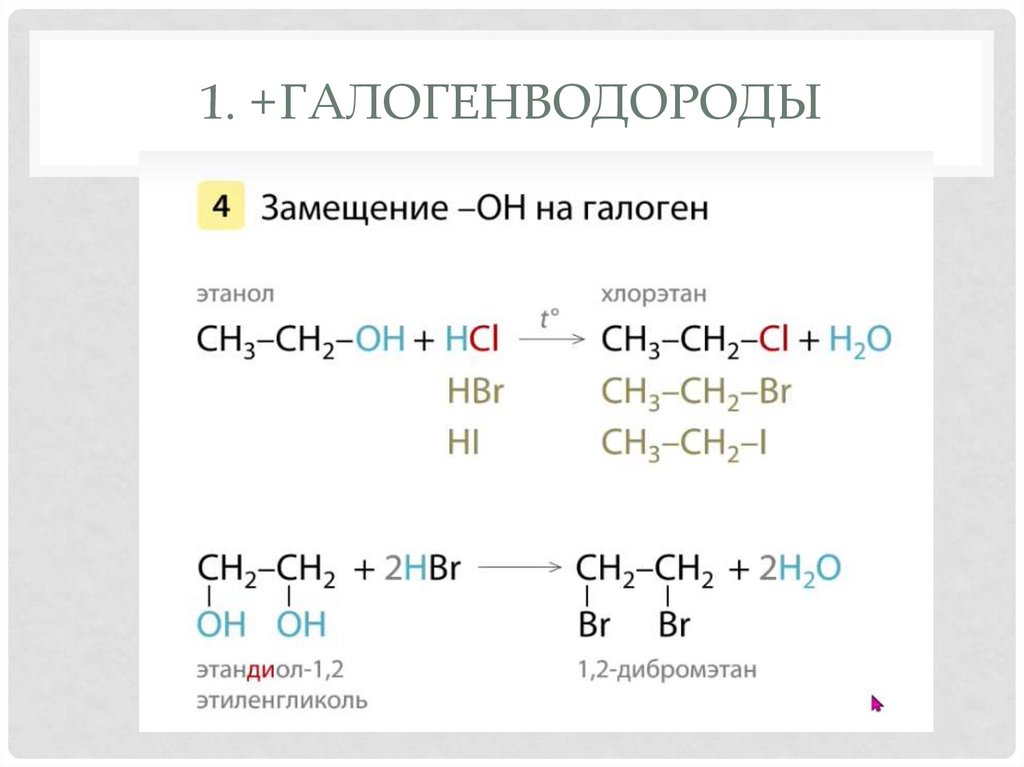
19. 1. +галогенводороды
1. +ГАЛОГЕНВОДОРОДЫ20. 2. Дегитратация
2. ДЕГИТРАТАЦИЯ21. 2. Дегитратация
2. ДЕГИТРАТАЦИЯ22. 2. Дегитратация
2. ДЕГИТРАТАЦИЯ23. 3. Горение
3. ГОРЕНИЕ24.
4. Спирты взаимодействуют со щелочными ищелочно-земельными металлами
25.
5. Реакция этерификации26.
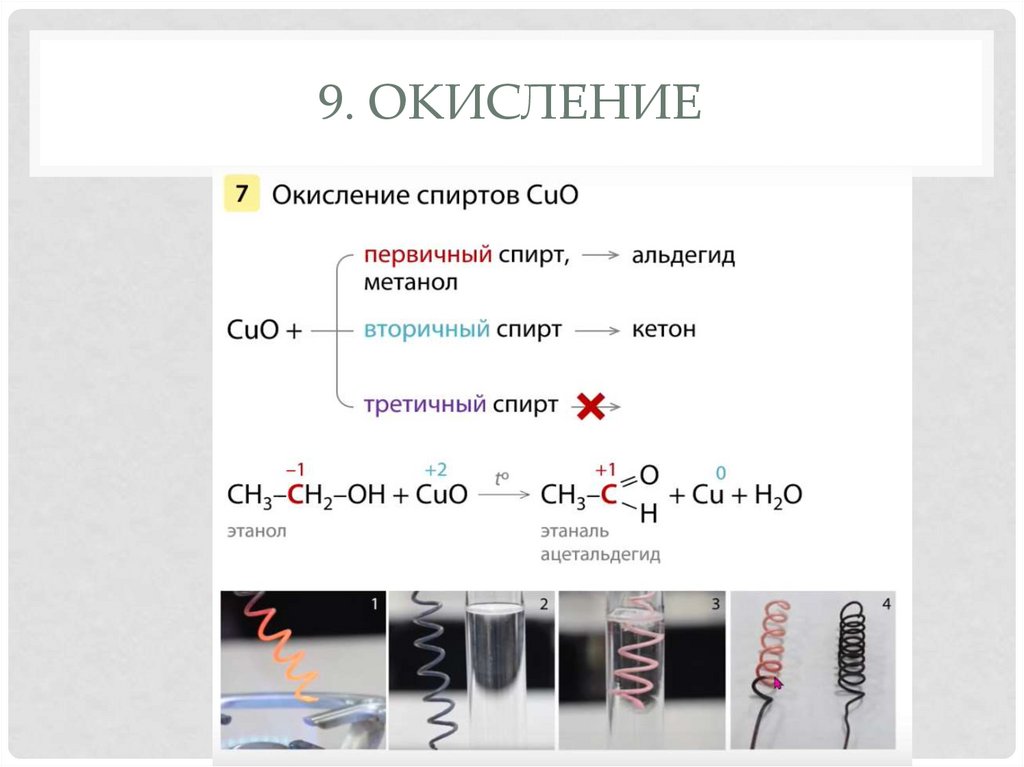
6. Реакция с оксидом меди (II). Спиртыокисляются в соответствующие альдегиды.
27. 7. Замещение -ОН на галоген
7. ЗАМЕЩЕНИЕ -ОН НА ГАЛОГЕН28. 8. Дегидрирование
8. ДЕГИДРИРОВАНИЕ29. 9. Окисление
9. ОКИСЛЕНИЕ30. 9. Окисление
9. ОКИСЛЕНИЕ• Первичные спирты в мягких условиях окисляются последовательно
до альдегидов и затем — до кислот:
В щелочной среде:
Третичные:
31. 9. Окисление
9. ОКИСЛЕНИЕ32. 9. Окисление
9. ОКИСЛЕНИЕ33. 9. Окисление
9. ОКИСЛЕНИЕ34. 9. Окисление
9. ОКИСЛЕНИЕ35. 10. + алкоголяты
10. + АЛКОГОЛЯТЫ36. 10. Алкоголяты
10. АЛКОГОЛЯТЫ37. ПРЕДСТАВИТЕЛИ
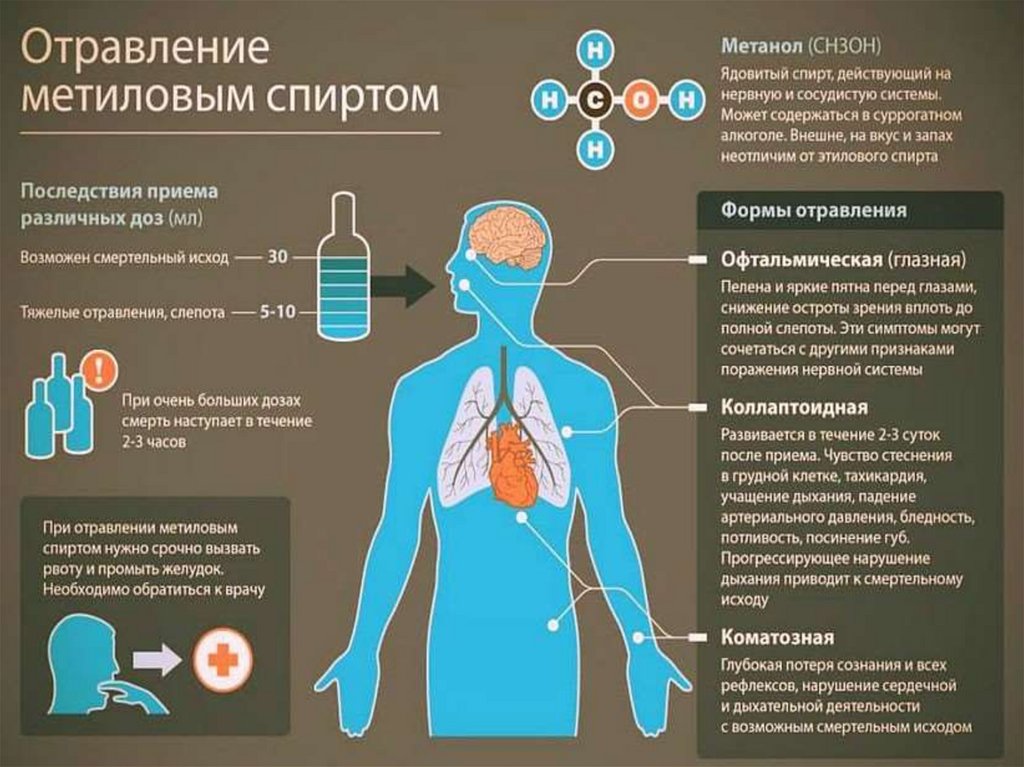
МЕТАНОЛ (древесный спирт)СН3ОН – жидкость (tкип = 64,5;
tпл =- 98; ρ = 0,793 г/см3), с
запахом алкоголя, хорошо
растворяется в воде. Ядовит –
вызывает слепоту, смерть
наступает от паралича верхних
дыхательных путей.
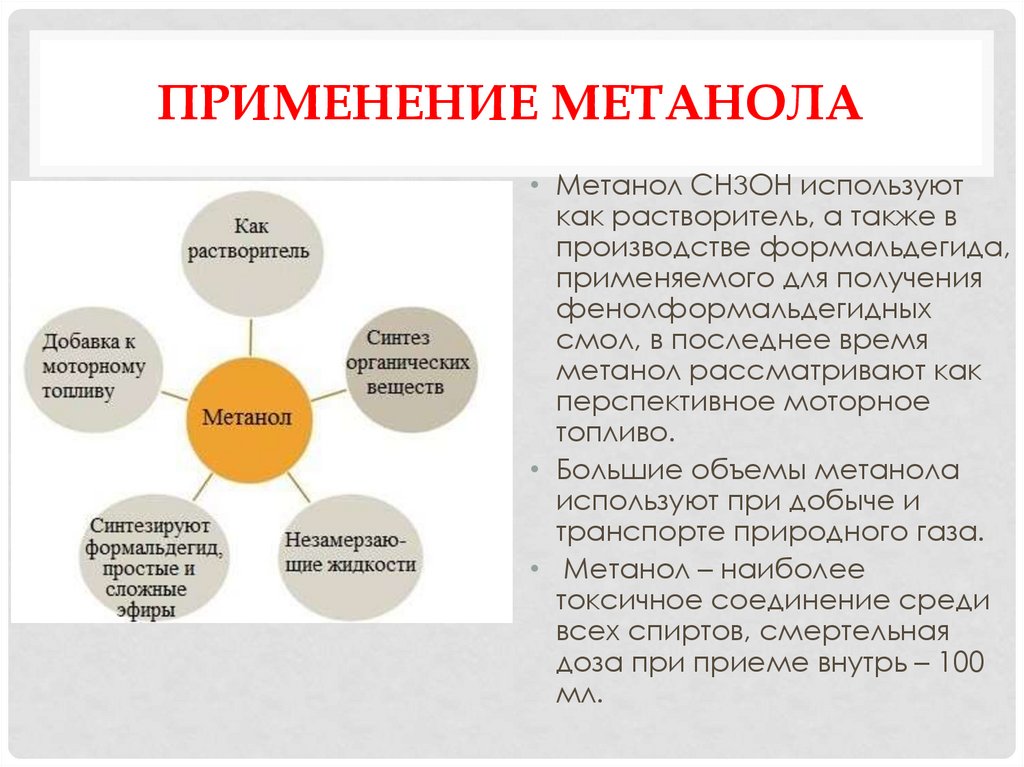
38. ПРИМЕНЕНИЕ МЕТАНОЛА
• Метанол СН3ОН используюткак растворитель, а также в
производстве формальдегида,
применяемого для получения
фенолформальдегидных
смол, в последнее время
метанол рассматривают как
перспективное моторное
топливо.
• Большие объемы метанола
используют при добыче и
транспорте природного газа.
• Метанол – наиболее
токсичное соединение среди
всех спиртов, смертельная
доза при приеме внутрь – 100
мл.
39.
40.
ЭТАНОЛ (винный спирт)С2Н5ОН – бесцветная
жидкость, с запахом
спирта, хорошо
смешивается с водой,
ядовитое наркотическое
вещество.
41. ПРИМЕНЕНИЕ ЭТАНОЛА
Этанол С2Н5ОН – исходное соединение для полученияацетальдегида, уксусной кислоты, а также для производства
сложных эфиров карбоновых кислот, используемых в
качестве растворителей.
Кроме того, этанол – основной компонент всех спиртных
напитков, его широко применяют и в медицине как
дезинфицирующее средство.
42. ПОЛУЧЕНИЕ ЭТАНОЛА
• спиртовое брожение глюкозы:C6H12O6 → 2C2H5OH + 2CO2↑
глюкоза → спирт этанол
получение спирта из алкена:
CH2= CH2 + H2O → C2H5OH
этилен
этанол
гидратация алкена → спирт

























 Химия
Химия








