Похожие презентации:
Окисление и восстановление
1.
____01.2024 г1
2. ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ Д/З §34, 37 учить конспект, составить схемы образования химических связей между: 1)Na и S, 2)K и N,
3)Ca и Br2
3.
составить схемы образования химических связей между: 1)Na и S, 2)K и N, 3)Ca и Br4.
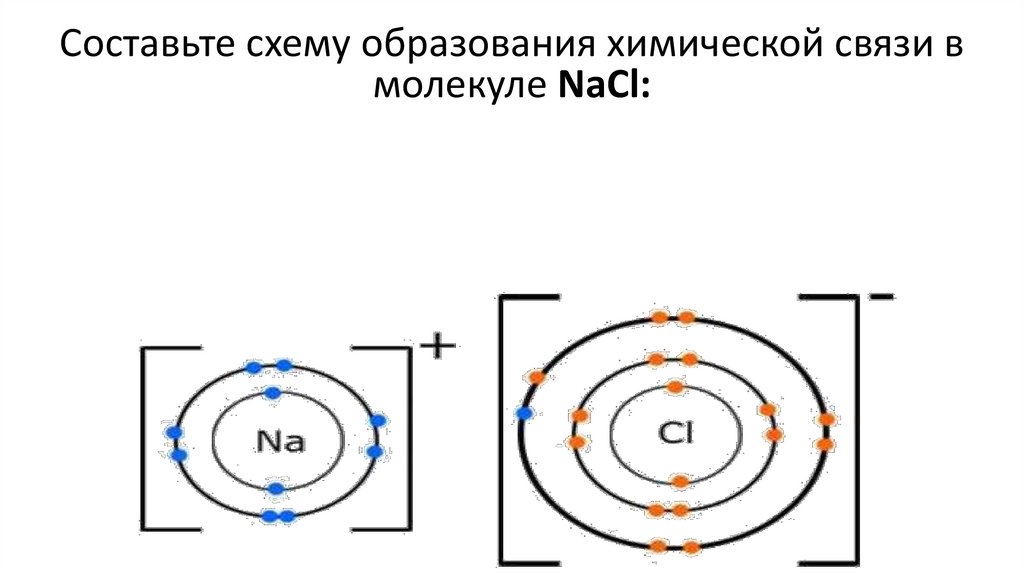
Составьте схему образования химической связи вмолекуле NaCl:
5.
ОКИСЛЕНИЕ И ВОССТАНОВЛЕНИЕ0
+
Na - 1e → Na ОКИСЛЕНИЕ
ВОС-ЛЬ
Cl
0
+ 1e
ОК-ЛЬ
0
Na + Cl
e
-
0
→
→
Сl
ВОССТАНОВЛЕНИЕ
+
Na + Сl
ОКИСЛЕНИЕ – процесс отдачи атомом электронов
ВОССТАНОВЛЕНИЕ – процесс присоединения электронов атомом
-
6.
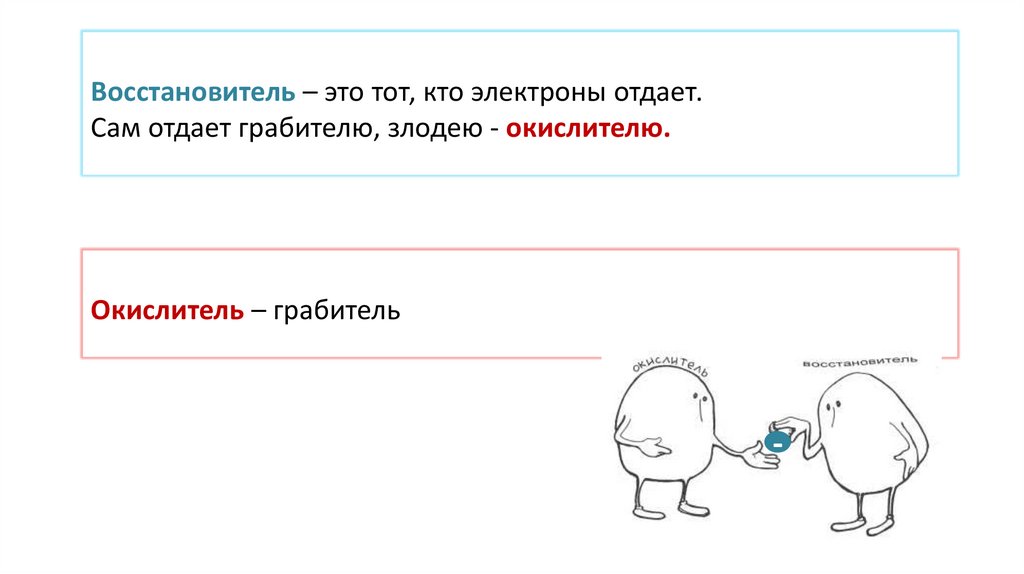
Восстановитель – это тот, кто электроны отдает.Сам отдает грабителю, злодею - окислителю.
Окислитель – грабитель
-
7. СТЕПЕНЬ ОКИСЛЕНИЯ
Учитель химии: Наумова А.А.8.
9.
10.
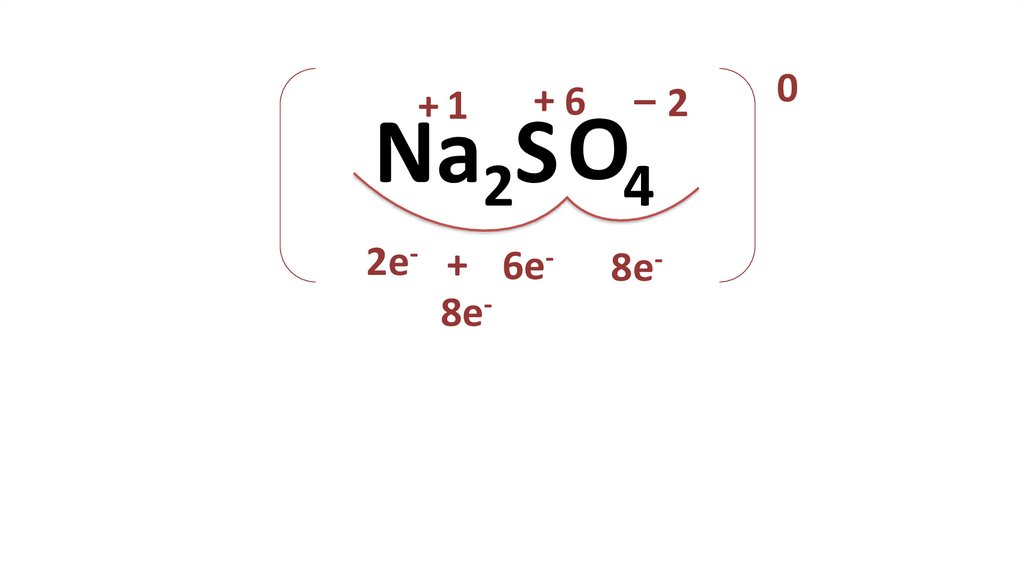
+1+6
–2
Na2S O4
2e- + 6e8e-
8e-
0
11.
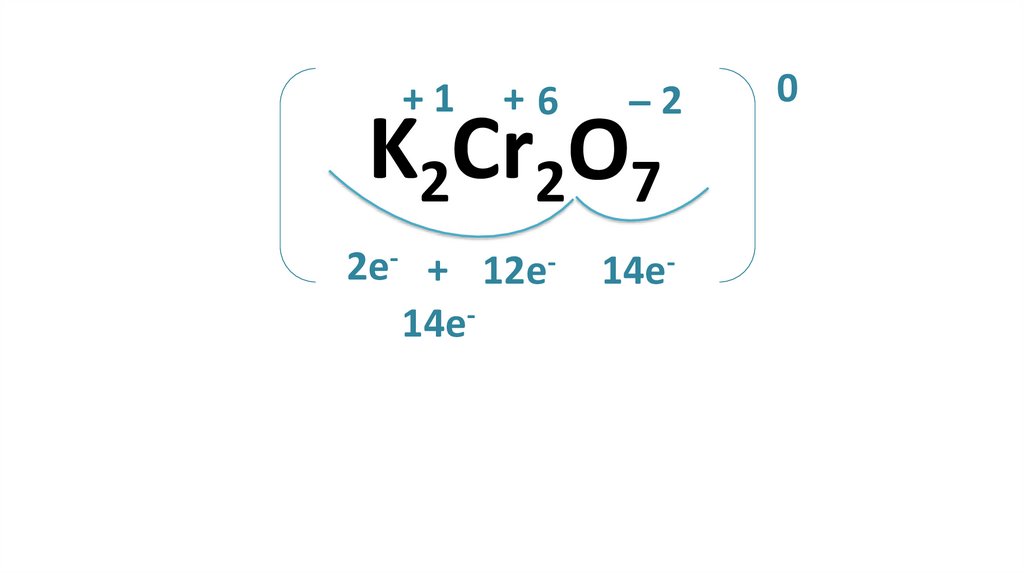
+1+6
–2
2e- + 12e14e-
14e-
K2Cr2O7
0
12.
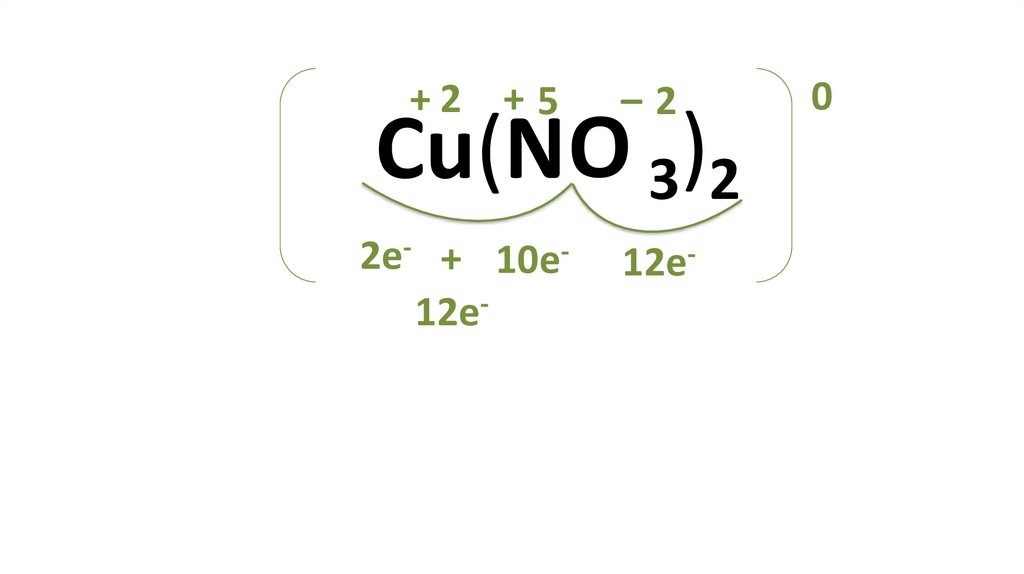
+2 + 5–2
2e- + 10e12e-
12e-
Cu(NO 3)2
0
13.
Na2SO4K2Cr2O7
Cu(NO3)2
Степень окисления (С.О.) – это тот условный заряд,
который приобрели бы атомы в соединении в результате
отдачи или принятия соответствующего числа электронов
14.
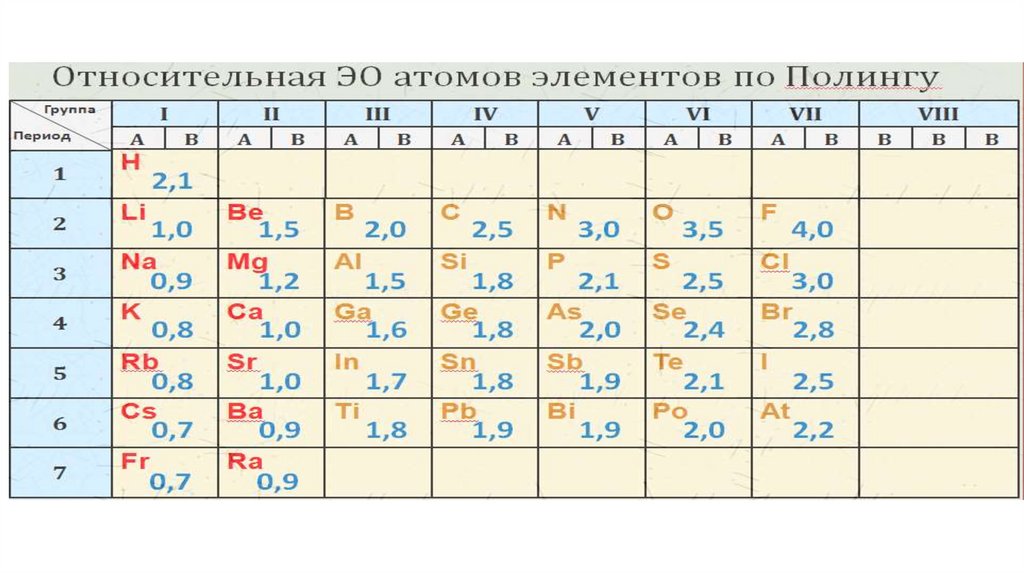
ПРАВИЛА:1) с.о. [O] = (-2) (искл. OF2 и H2O2)
2) с.o. [H] в соединениях с неметаллами (+1),
металлами (-1)
3) с.о. металлов совпадает с валентностью
4) с.о. галогенов (VIIА) в бинарных соединениях = (-1)
5) с.о. в его простом веществе = (0)
6) сумма величин с.о., умноженных на кол-во атомов в
соединении = (0)
15.
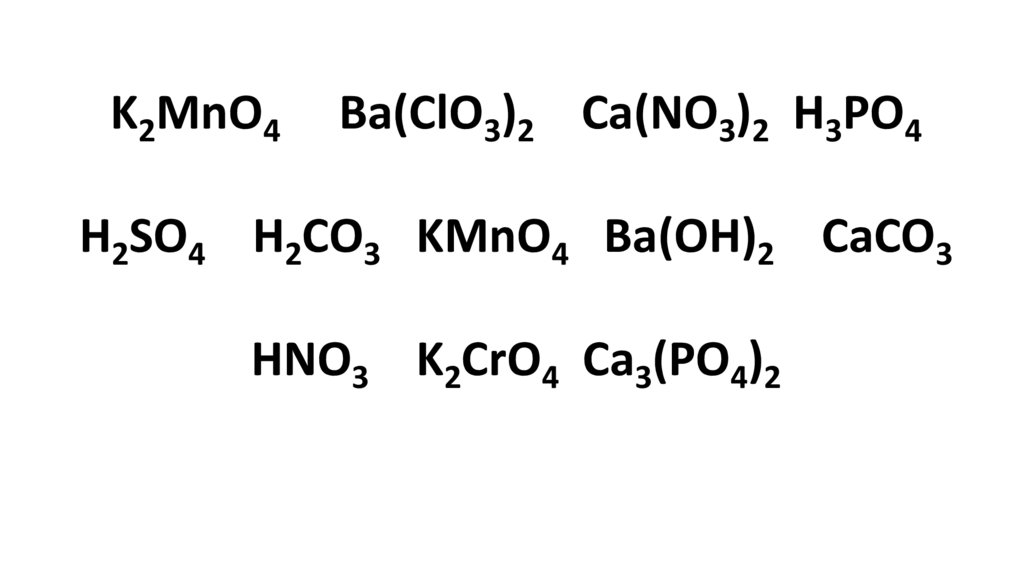
K2MnO4Ba(ClO3)2 Ca(NO3)2 H3PO4
H2SO4 H2CO3 KMnO4 Ba(OH)2 CaCO3
HNO3 K2CrO4 Ca3(PO4)2
16.
Домашнее задание§38 упр. 4,5,6
учить конспект
17.
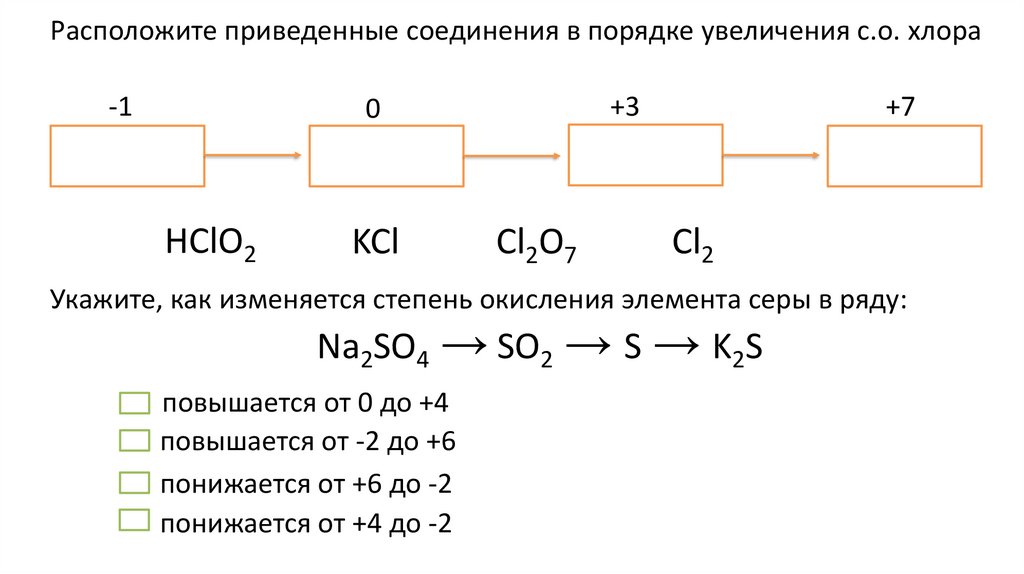
Расположите приведенные соединения в порядке увеличения с.о. хлора-1
+3
0
HClO2
KCl
Cl2O7
+7
Cl2
Укажите, как изменяется степень окисления элемента серы в ряду:
Na2SO4 → SO2 → S → K2S
повышается от 0 до +4
повышается от -2 до +6
понижается от +6 до -2
понижается от +4 до -2
18.
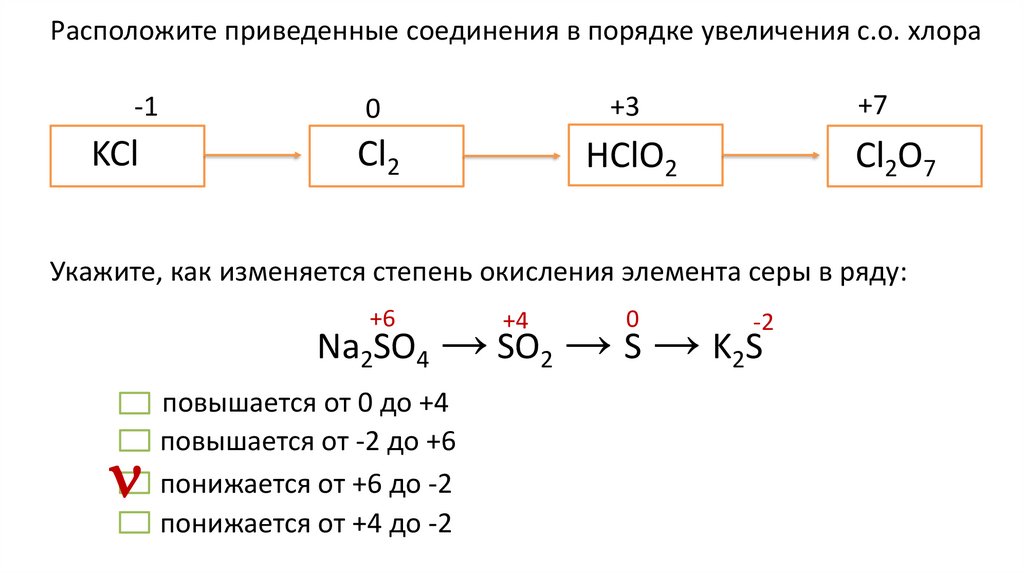
Расположите приведенные соединения в порядке увеличения с.о. хлора-1
0
+3
KCl
Cl2
HClO2
+7
Cl2O7
Укажите, как изменяется степень окисления элемента серы в ряду:
+6
+4
0
-2
Na2SO4 → SO2 → S → K2S
n
повышается от 0 до +4
повышается от -2 до +6
понижается от +6 до -2
понижается от +4 до -2








 Химия
Химия