Похожие презентации:
Степень окисления. Окисление и восстановление
1.
2.
10.11Степень окисления.
Окисление и восстановление.
Цели урока:
Определять степени окисления атомов в
бинарных соединениях. Определять понятие
«степень окисления». Рассчитывать
максимальную и минимальную степени
окисления атомов по положению химических
элементов в периодической таблице, по
молекулярной формуле бинарного соединения
3.
1) У каких элементов степень окисленияравна 0?
2) У какого элемента степень окисления
равна 0 и -1?
3)Назови три вещества со степенью
окисления 0
4.
Работа у доскиОпределите степени окисления
элементов в следующих веществах:
Na2O, KCl, Mg3P2, СaO, K2S, BaBr2,
MnO2, CO, NaOH, Li2SO4
5.
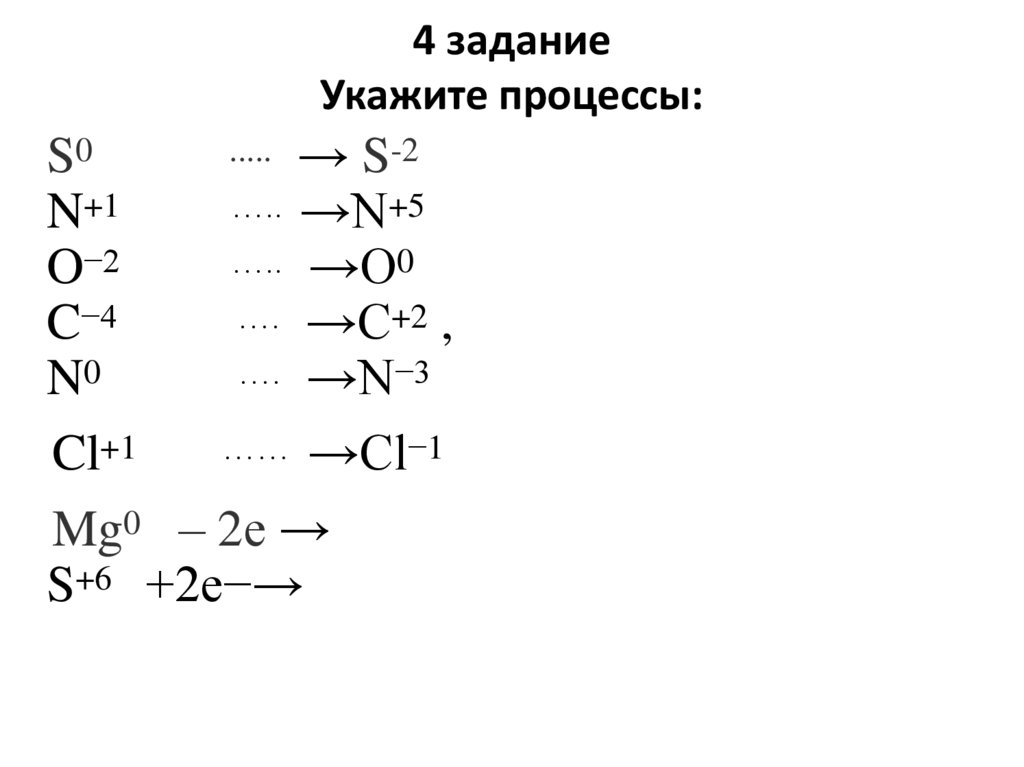
4 заданиеУкажите процессы:
..... → S-2
S0
….. →N+5
N+1
….. →O0
O−2
…. →C+2 ,
C−4
…. →N−3
N0
…… →Cl−1
Cl+1
Mg0 – 2е →
S+6 +2e−→
6.
Алгоритм составления формулы в соединениях:1. На первом месте пишется элемент с меньшей электроотрицательностью, на
втором с большей электроотрицательностью.
2. Элемент, написанный на первом месте имеет положительный заряд «+», а на
втором с отрицательным зарядом «-».
3. Указать для каждого элемента степень окисления.
4. Найти общее кратное значение степеней окисления.
5. Разделить наименьшее общее кратное на значение степеней окисления и
полученные индексы приписать внизу справа после символа соответствующего
элемента.
7.
Составьте формулы:Оксидов калия, углерода , железа,
серы
8.
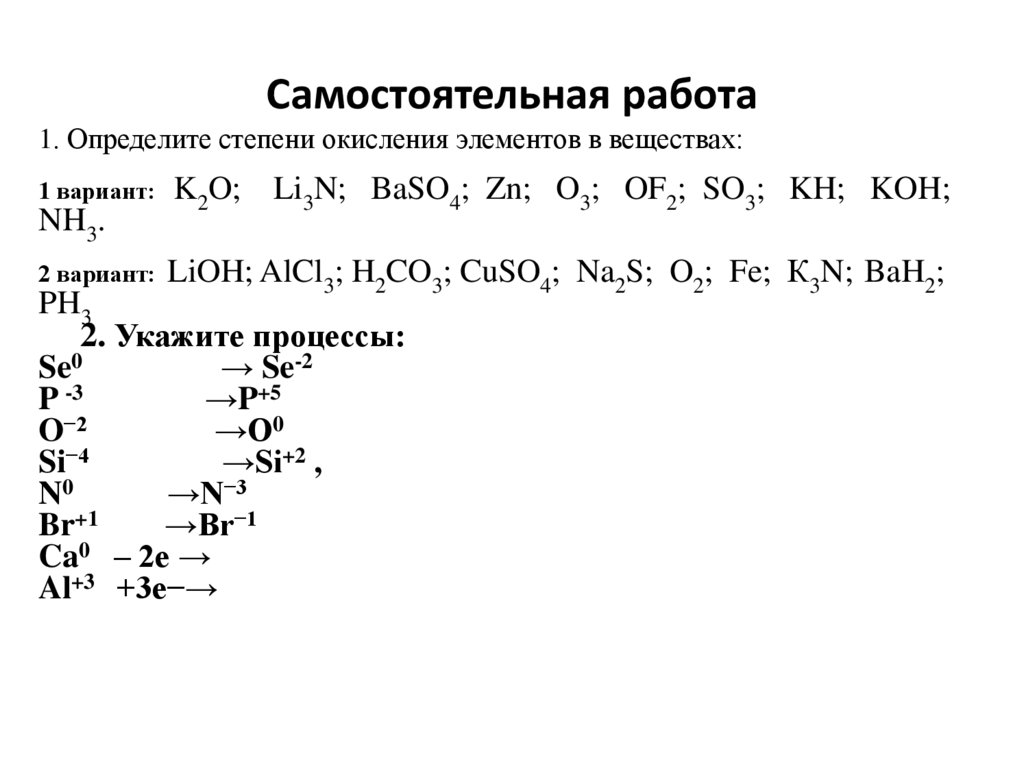
Самостоятельная работа1. Определите степени окисления элементов в веществах:
1 вариант:
NH3.
K2O; Li3N; BaSO4; Zn; O3; OF2; SO3; KH; KOH;
2 вариант: LiOH; AlCl3; H2CO3; CuSO4; Na2S; O2; Fe; К3N; BaH2;
PH3
2. Укажите процессы:
Se0
→ Se-2
P -3
→P+5
O−2
→O0
Si−4
→Si+2 ,
N0
→N−3
Br+1
→Br−1
Ca0 – 2е →
Al+3 +3e−→
9.
10.
Домашнее задание:Параграф 19, упр. 2,3 на стр. 75







 Химия
Химия








