Похожие презентации:
Химическая эволюция РНК-мир
1. Химическая эволюция
РНК-мир2. Как устроен курс?
Постепенное усложнение:1.
2.
3.
4.
5.
6.
Химическая эволюция
Вирусы
Клетка
Бактерии
Эукариоты
…
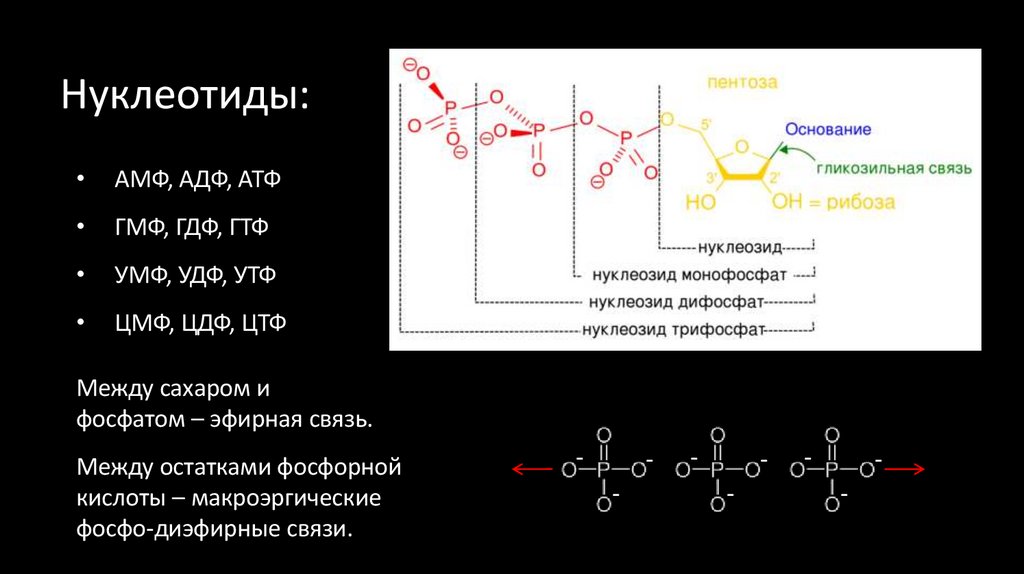
3. Нуклеотиды:
АМФ, АДФ, АТФ
ГМФ, ГДФ, ГТФ
УМФ, УДФ, УТФ
ЦМФ, ЦДФ, ЦТФ
Между сахаром и
фосфатом – эфирная связь.
Между остатками фосфорной
кислоты – макроэргические
фосфо-диэфирные связи.
-
-
-
-
-
-
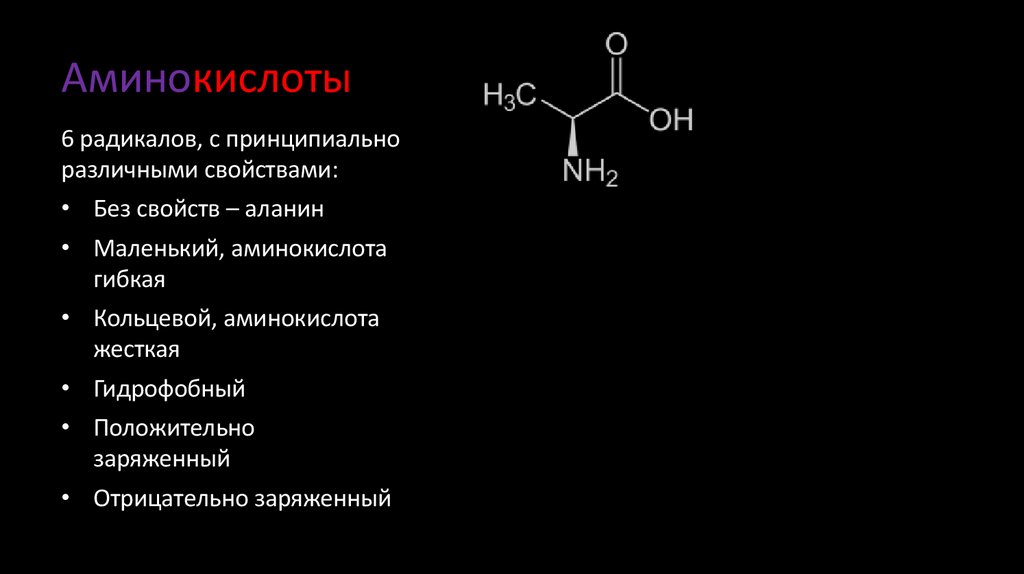
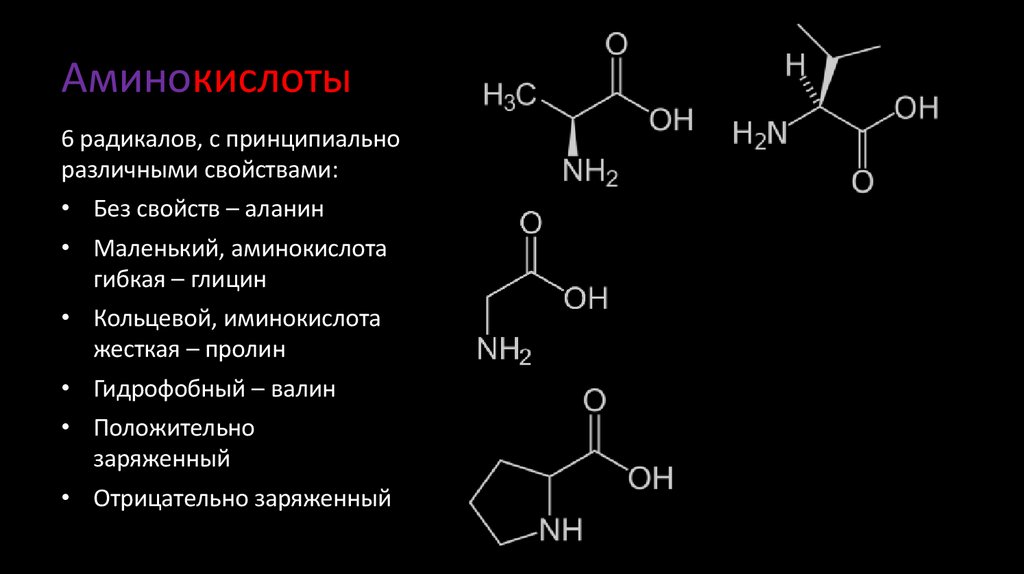
4. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, аминокислота
жесткая – пролин
• Гидрофобный – валин
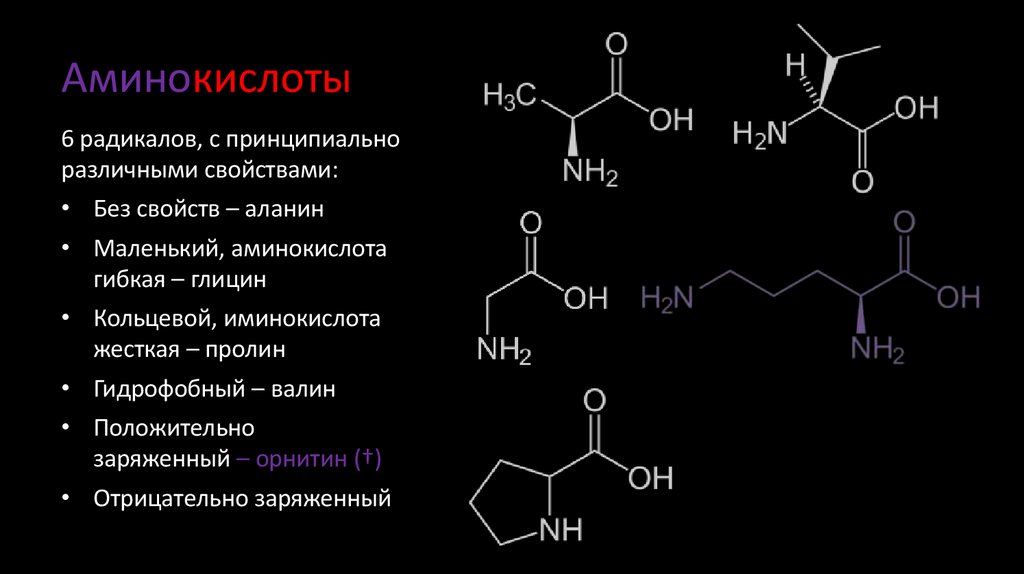
• Положительно
заряженный – орнитин (†)
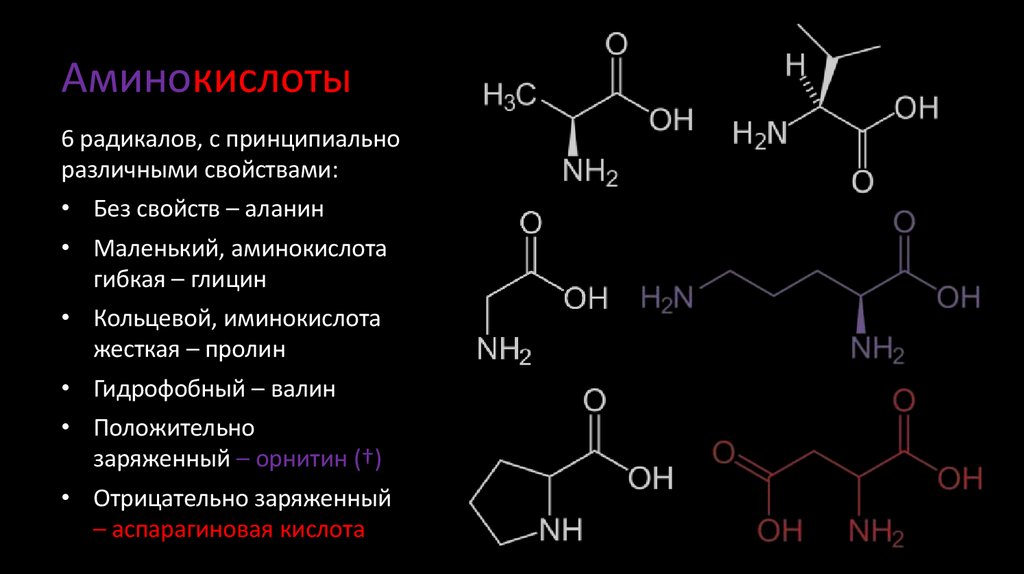
• Отрицательно заряженный
– аспарагиновая кислота
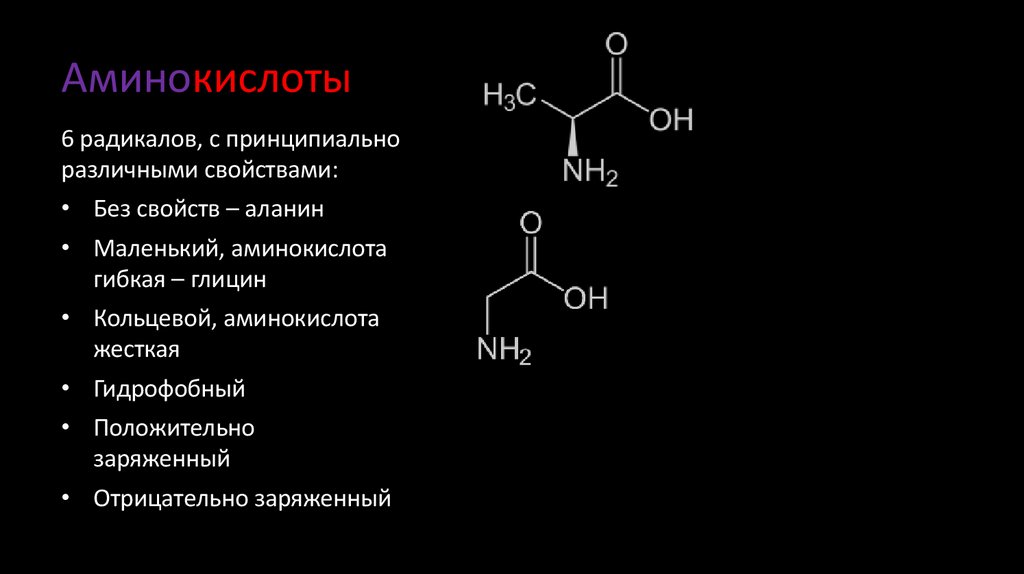
5. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, аминокислота
жесткая – пролин
• Гидрофобный – валин
• Положительно
заряженный – орнитин (†)
• Отрицательно заряженный
– аспарагиновая кислота
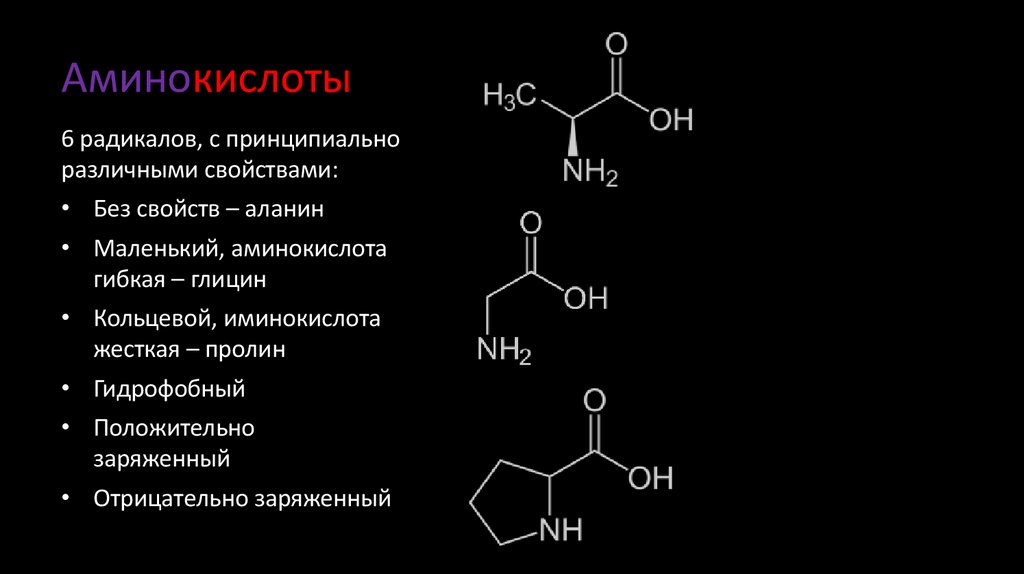
6. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, иминокислота
жесткая – пролин
• Гидрофобный – валин
• Положительно
заряженный – орнитин (†)
• Отрицательно заряженный
– аспарагиновая кислота
7. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, иминокислота
жесткая – пролин
• Гидрофобный – валин
• Положительно
заряженный – орнитин (†)
• Отрицательно заряженный
– аспарагиновая кислота
8. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, иминокислота
жесткая – пролин
• Гидрофобный – валин
• Положительно
заряженный – орнитин (†)
• Отрицательно заряженный
– аспарагиновая кислота
9. Аминокислоты
6 радикалов, с принципиальноразличными свойствами:
• Без свойств – аланин
• Маленький, аминокислота
гибкая – глицин
• Кольцевой, иминокислота
жесткая – пролин
• Гидрофобный – валин
• Положительно
заряженный – орнитин (†)
• Отрицательно заряженный
– аспарагиновая кислота
10.
11. Зона Златовласки
• Зона, в которойтемпературные условия,
позволяющие воде
существовать в жидкой
фазе
=>
• Возможно существование
жизни, похожей на
земную
12. Геологическое строение
• KREEPбазальты!
Тектоническое движение
+
Давно
Давно
Магнитное поле
+
±
-
13. Атмосфера и климат
Атмосфера зависит от:Количества расплавленных ранее
минералов на поверхности.
“Сдуваемости” газа с
поверхности.
Массы планеты в самом начале
её формирования
От процессов, происходящих на
планете и в её недрах
Парникового эффект
Падение Тейи привело к
выходу диокиси
углерода и воды в
атмосферу, что привело
к стабилизации
Имеет крайне плотную
атмосферу из
углекислого газа из-за
постоянных
извержений вулканов
Атмосфера Марса из-за
прекращения тектоники
и потери магнитного
поля подверглась
“сдуванию”
14. Теории возникновения жизни
АбиогенезТеория “первичного бульона”
Теория “майонеза”
Теория “пиццы”
Панспермия
Теория “переселения жизни”
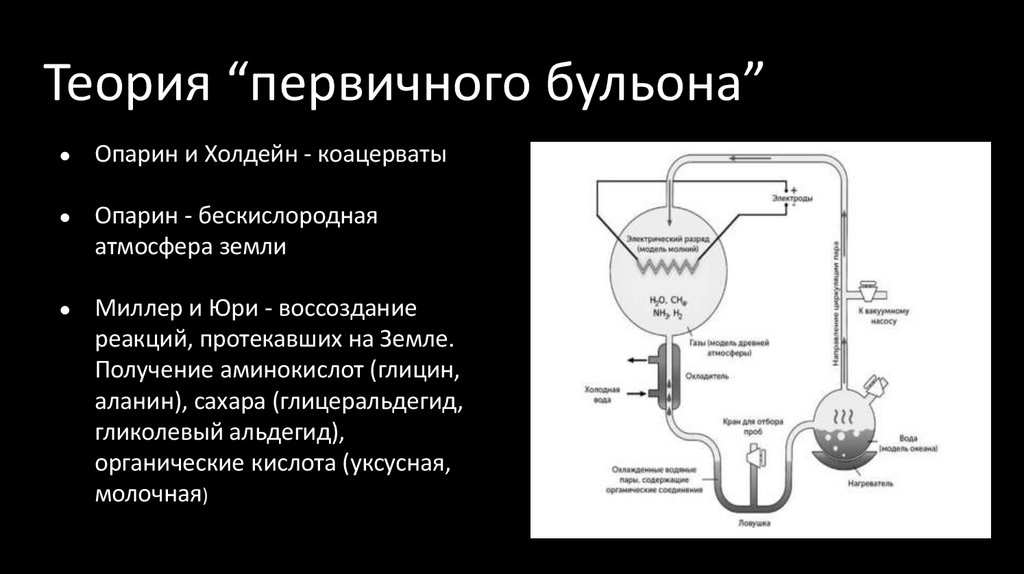
15. Теория “первичного бульона”
Опарин и Холдейн - коацерваты
Опарин - бескислородная
атмосфера земли
Миллер и Юри - воссоздание
реакций, протекавших на Земле.
Получение аминокислот (глицин,
аланин), сахара (глицеральдегид,
гликолевый альдегид),
органические кислота (уксусная,
молочная)
16. Проблемы теории “первичного бульона”
Хиральная чистота
Трудность в образовании полимеров
из-за смещения равновесия
(гидролиз)
“Неупрощаемая сложность”
Для построения ДНК и РНК требуется
фосфор, но он только в
нерастворимых KREEP- базальтах
УФ - разрушитель молекул.
Аналитическим методом было
выявлено, что атмосфера Земли была
богата диокисью углерода (а не
метаном и азотом, как у Миллера атмосфера Миллера схожа только со
спутниками ледяных гигантов и
некоторых метеоритов, в некоторых
из них находят аминокислоты). Для
восстановления углерода требуется
сильный восстановитель, которого
пока не обнаружили.
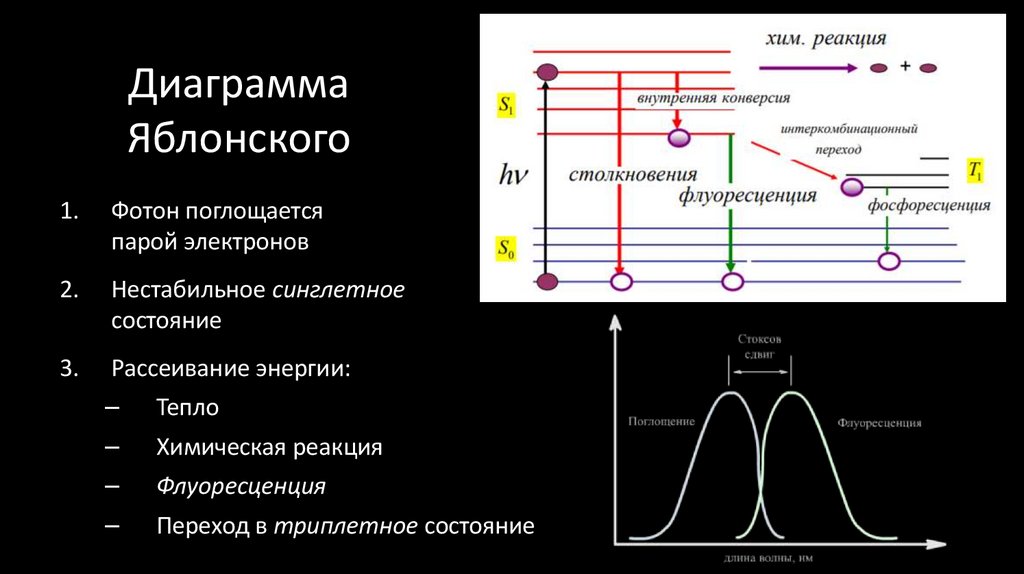
17. Диаграмма Яблонского
1.Фотон поглощается
парой электронов
2.
Нестабильное синглетное
состояние
3.
Рассеивание энергии:
–
Тепло
–
Химическая реакция
–
Флуоресценция
–
Переход в триплетное состояние
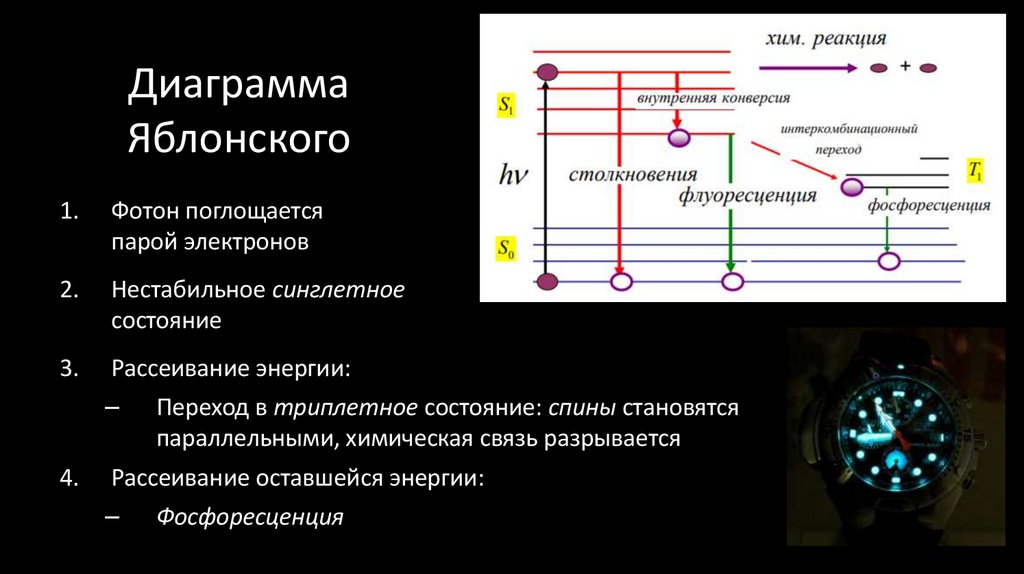
18. Диаграмма Яблонского
1.Фотон поглощается
парой электронов
2.
Нестабильное синглетное
состояние
3.
Рассеивание энергии:
–
4.
Переход в триплетное состояние: спины становятся
параллельными, химическая связь разрывается
Рассеивание оставшейся энергии:
–
Фосфоресценция
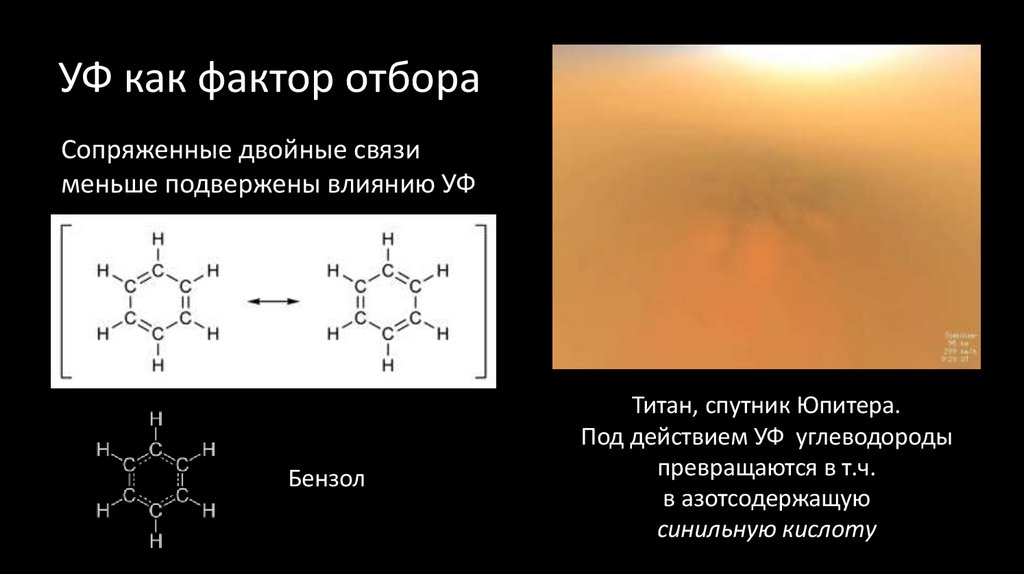
19. УФ как фактор отбора
Сопряженные двойные связименьше подвержены влиянию УФ
Бензол
Титан, спутник Юпитера.
Под действием УФ углеводороды
превращаются в т.ч.
в азотсодержащую
синильную кислоту
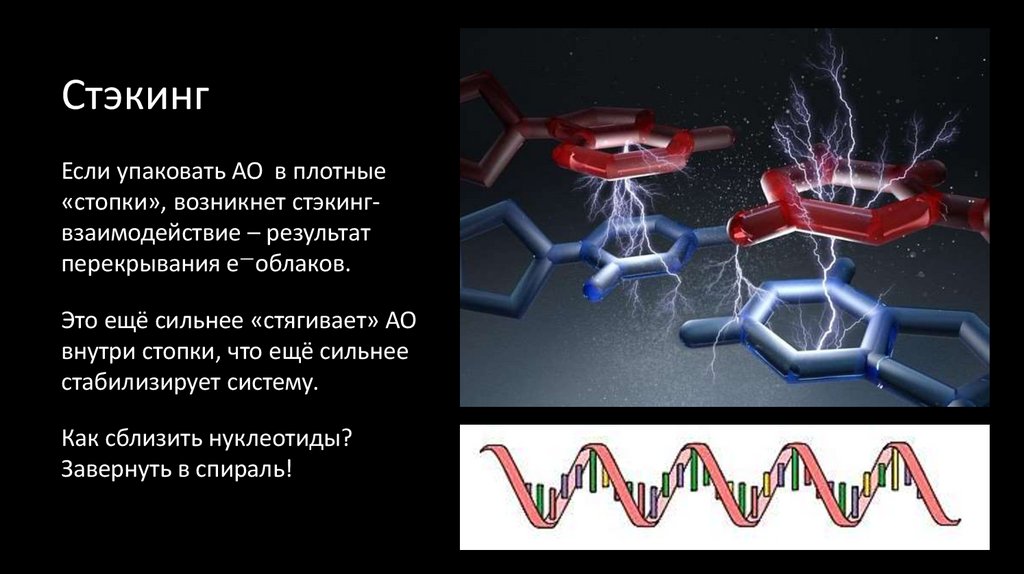
20. Стэкинг
Если упаковать АО в плотные«стопки», возникнет стэкингвзаимодействие – результат
перекрывания е—облаков.
Это ещё сильнее «стягивает» АО
внутри стопки, что ещё сильнее
стабилизирует систему.
Как сблизить нуклеотиды?
Завернуть в спираль!
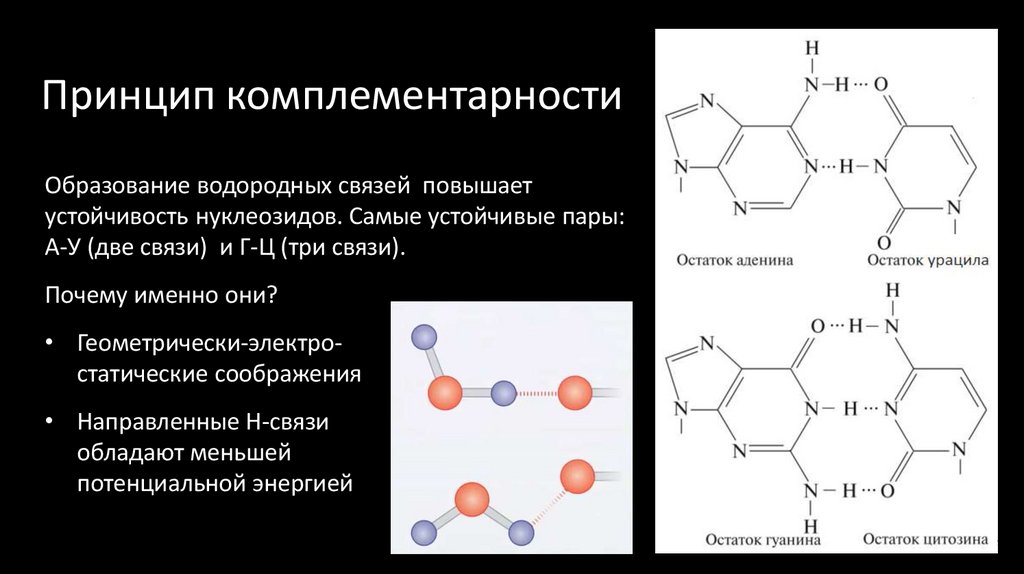
21. Принцип комплементарности
Образование водородных связей повышаетустойчивость нуклеозидов. Самые устойчивые пары:
А-У (две связи) и Г-Ц (три связи).
Почему именно они?
• Геометрически-электростатические соображения
• Направленные Н-связи
обладают меньшей
потенциальной энергией
22. Теории железносерного и цинкового мира
Локализация - чёрные
курильщики
Восстановитель CO2 атомарный водород
Сульфид цинка защищает от УФ
Вулканы и источники
23. Но! Одно большое НО!
Азотистые основания в
предыдущих теориях
получаются с
минимальным
выходом и при таких
условиях невозможен
оказался синтез
нуклеотидов. Поэтому
для них были найдены
альтернативные пути
синтеза под началом
процесса - фотолиза.
Циановые дожди.
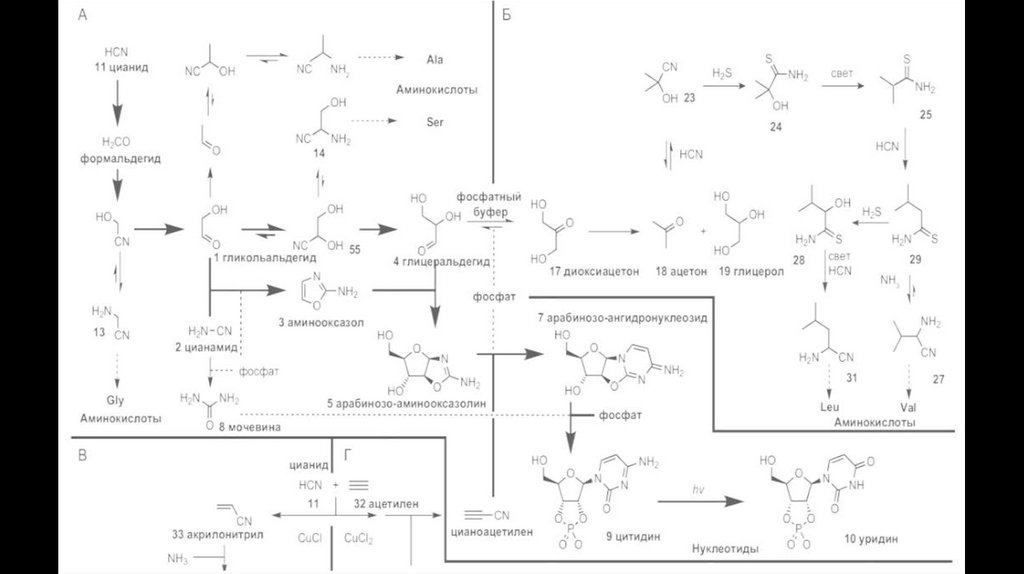
24. Решение!
В теории “первичной пиццы”решается проблема водной среды и
излишнего УФ, благодаря глине.
В теории “первичного майонеза”
решается вопрос защиты
химических процессов, благодаря
локализации внутри протоклеток жировых пузырьков.
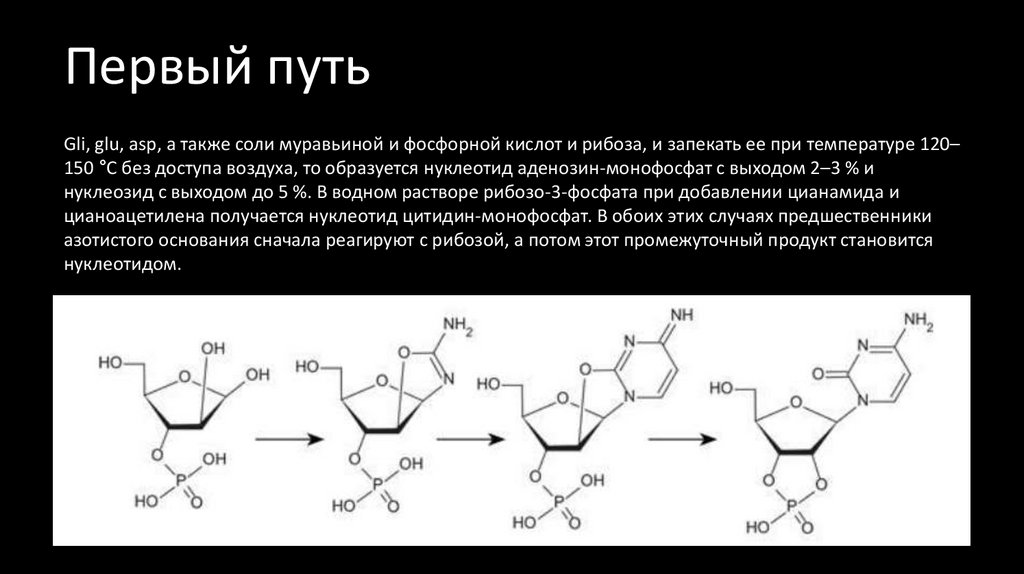
25. Первый путь
Gli, glu, asp, а также соли муравьиной и фосфорной кислот и рибоза, и запекать ее при температуре 120–150 °C без доступа воздуха, то образуется нуклеотид аденозин-монофосфат с выходом 2–3 % и
нуклеозид с выходом до 5 %. В водном растворе рибозо-3-фосфата при добавлении цианамида и
цианоацетилена получается нуклеотид цитидин-монофосфат. В обоих этих случаях предшественники
азотистого основания сначала реагируют с рибозой, а потом этот промежуточный продукт становится
нуклеотидом.
26. Второй путь
Второй путь начинается с побочных продуктов синтеза азотистых оснований из формамида. Наряду саденином, гуанином, цитозином и урацилом при этом получаются их формильные производные, имеющие
альдегидную (CHO) группу на одном из атомов азота в кольце, чаще всего именно на том, который образует
связь с сахаром в нуклеотидах. Эта группа может служить затравкой для построения сахара, если такое
вещество (например, 9- формил-аденин) попадет в условия реакции Бутлерова – щелочную среду с
формальдегидом
Альдольно-кротоновая конденсация (реакция Бутлерова)
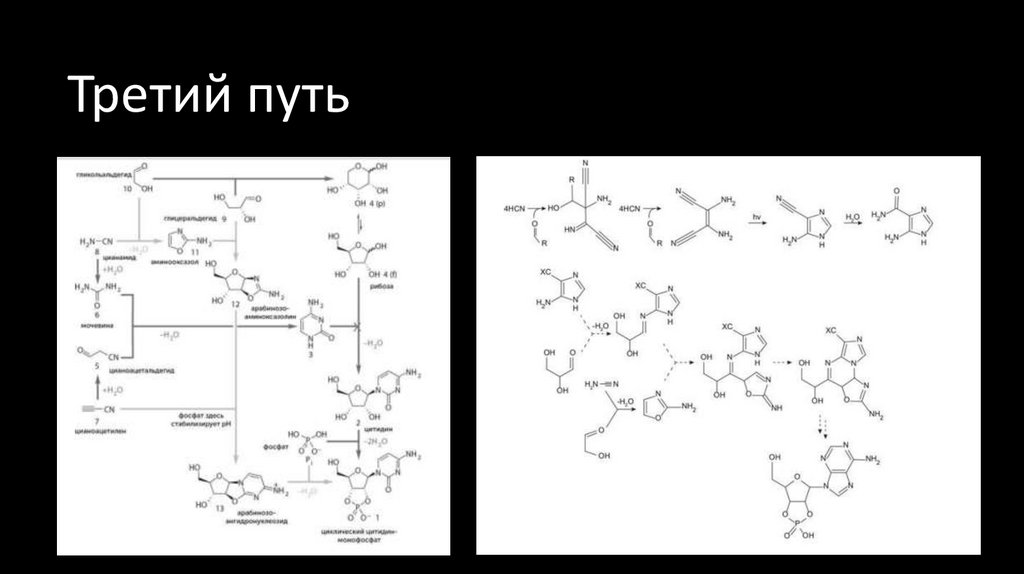
27. Третий путь
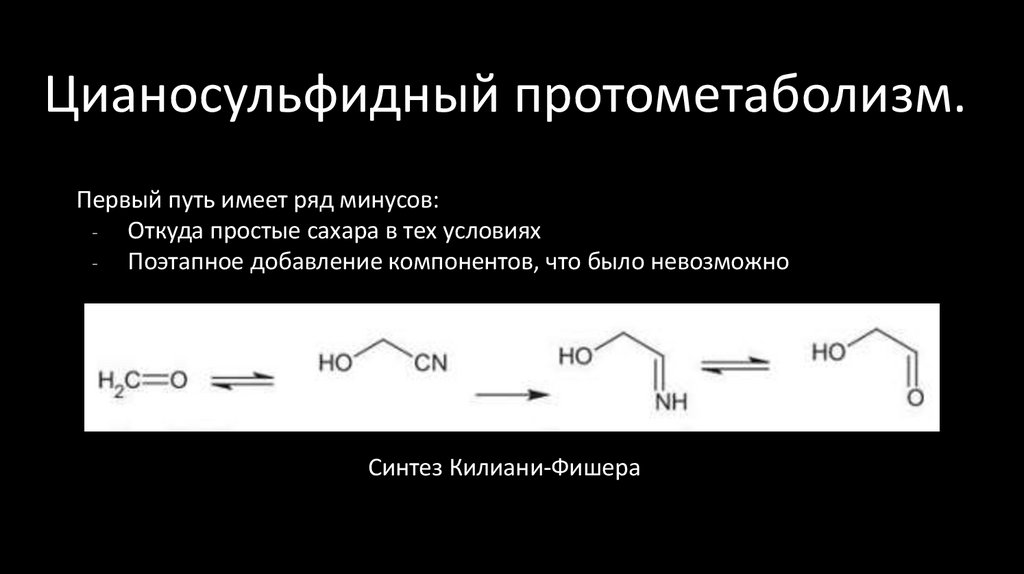
28. Цианосульфидный протометаболизм.
Первый путь имеет ряд минусов:- Откуда простые сахара в тех условиях
- Поэтапное добавление компонентов, что было невозможно
Синтез Килиани-Фишера
29.
30.
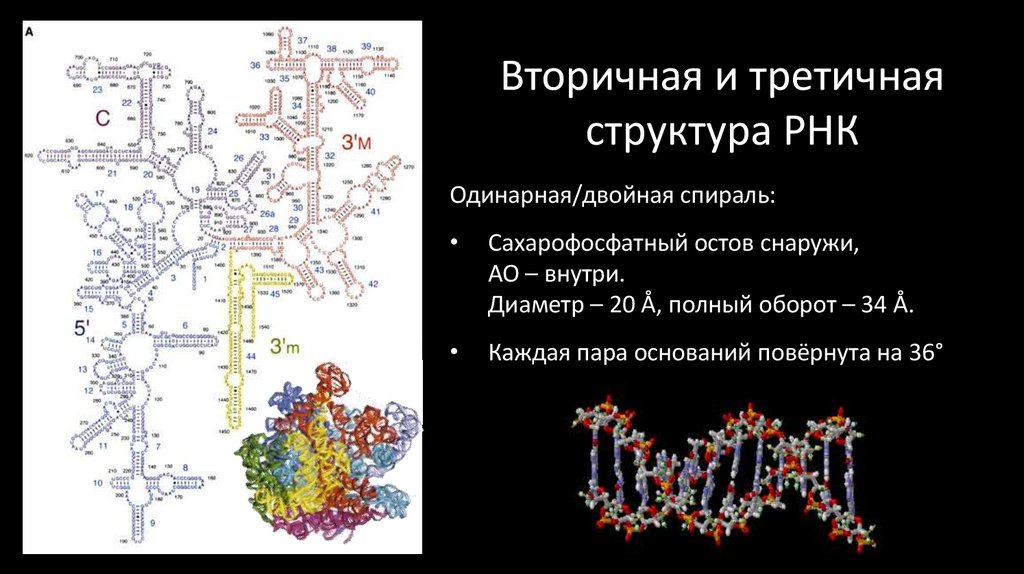
31. Вторичная и третичная структура РНК
Одинарная/двойная спираль:Сахарофосфатный остов снаружи,
АО – внутри.
Диаметр – 20 Å, полный оборот – 34 Å.
Каждая пара оснований повёрнута на 36°
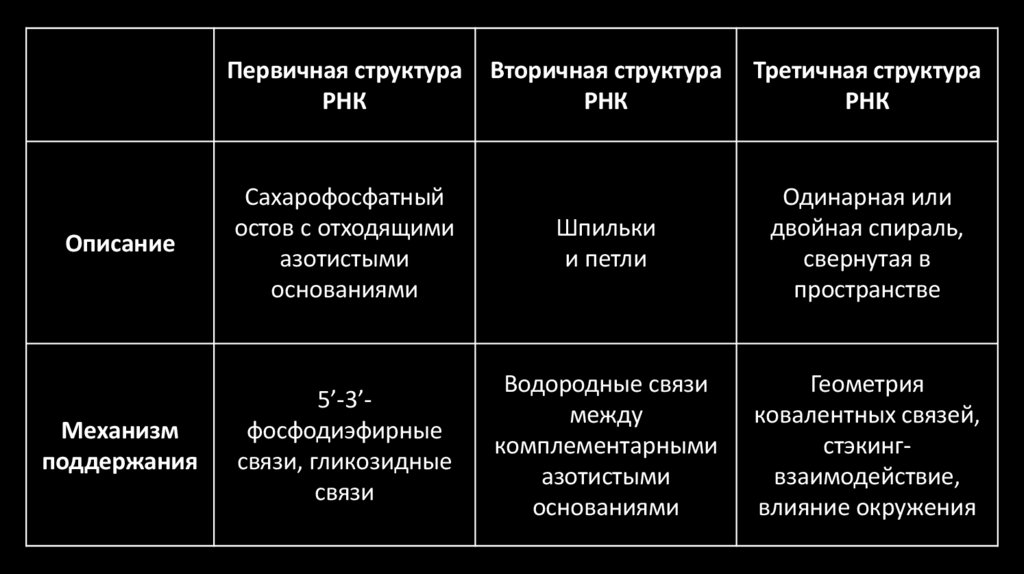
32.
Первичная структураРНК
Вторичная структура
РНК
Третичная структура
РНК
Описание
Сахарофосфатный
остов с отходящими
азотистыми
основаниями
Шпильки
и петли
Одинарная или
двойная спираль,
свернутая в
пространстве
Механизм
поддержания
5’-3’фосфодиэфирные
связи, гликозидные
связи
Водородные связи
между
комплементарными
азотистыми
основаниями
Геометрия
ковалентных связей,
стэкингвзаимодействие,
влияние окружения
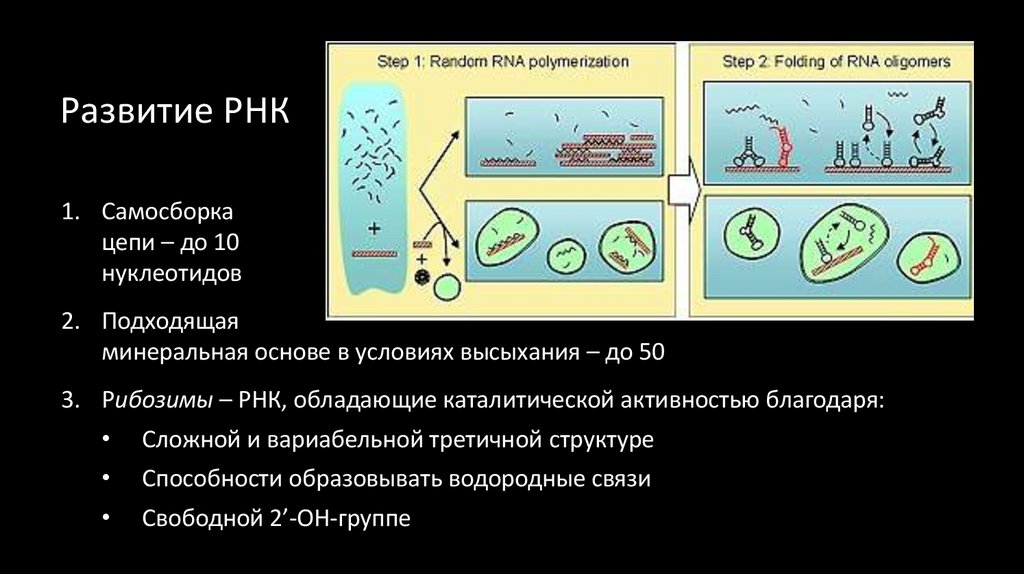
33. Развитие РНК
1. Самосборкацепи – до 10
нуклеотидов
2. Подходящая
минеральная основе в условиях высыхания – до 50
3. Рибозимы – РНК, обладающие каталитической активностью благодаря:
Сложной и вариабельной третичной структуре
Способности образовывать водородные связи
Свободной 2’-ОН-группе
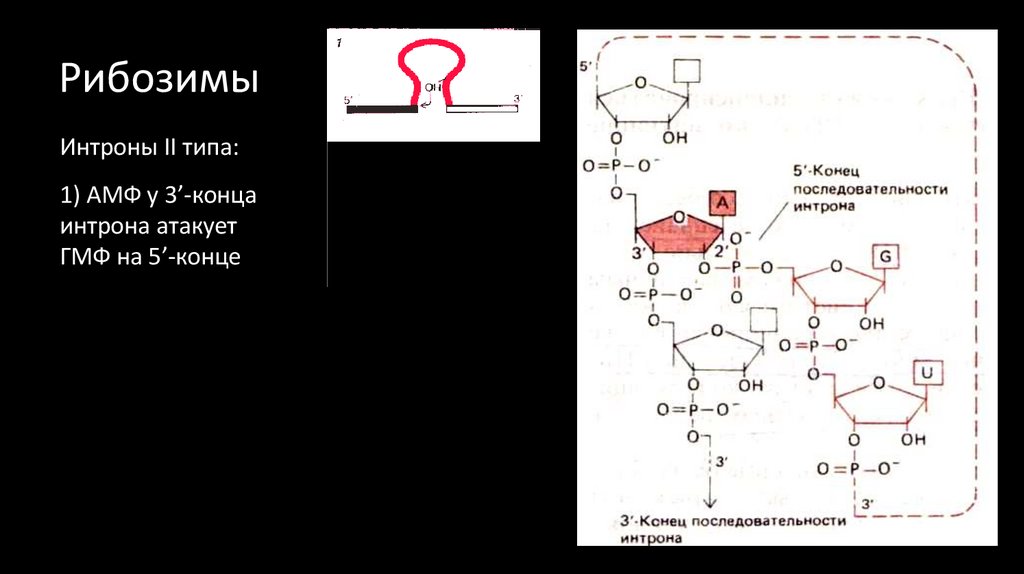
34. Рибозимы
АГ
Интроны II типа:
1) АМФ у 3’-конца
интрона атакует
ГМФ на 5’-конце
2) ОН-группа,
оказавшаяся на 3’конце экзона
атакует 3’-конец
интрона
3) Интрон
отделяется в
структуре «лассо»
ГА
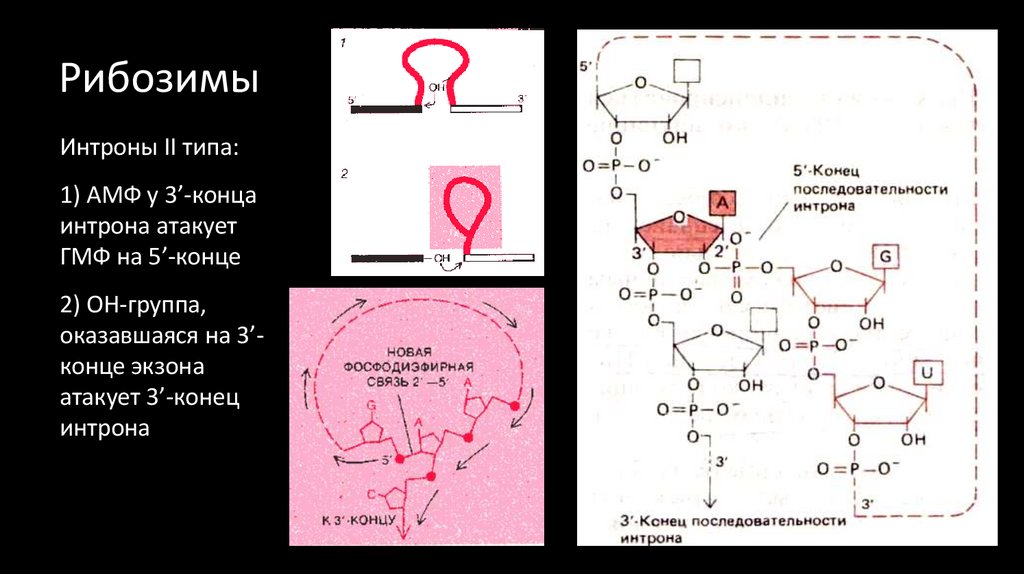
35. Рибозимы
АГ
Интроны II типа:
1) АМФ у 3’-конца
интрона атакует
ГМФ на 5’-конце
2) ОН-группа,
оказавшаяся на 3’конце экзона
атакует 3’-конец
интрона
3) Интрон
отделяется в
структуре «лассо»
ГА
36. Рибозимы
АГ
Интроны II типа:
1) АМФ у 3’-конца
интрона атакует
ГМФ на 5’-конце
ГА
2) ОН-группа,
оказавшаяся на 3’конце экзона
атакует 3’-конец
интрона
3) Интрон
отделяется в
структуре «лассо»
ГА
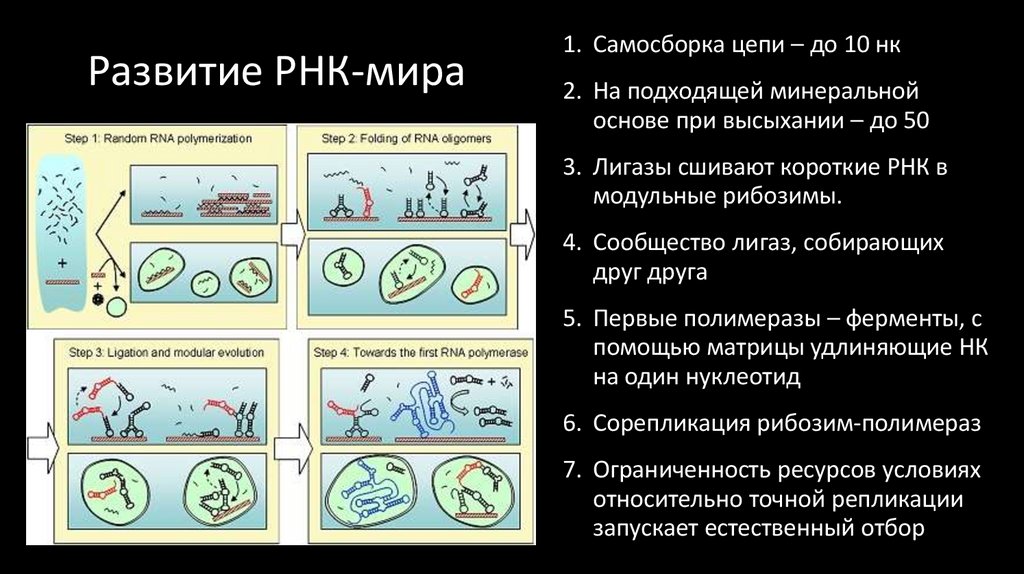
37. Развитие РНК-мира
1. Самосборка цепи – до 10 нк2. На подходящей минеральной
основе при высыхании – до 50
3. Лигазы сшивают короткие РНК в
модульные рибозимы.
4. Сообщество лигаз, собирающих
друг друга
5. Первые полимеразы – ферменты, с
помощью матрицы удлиняющие НК
на один нуклеотид
6. Сорепликация рибозим-полимераз
7. Ограниченность ресурсов условиях
относительно точной репликации
запускает естественный отбор
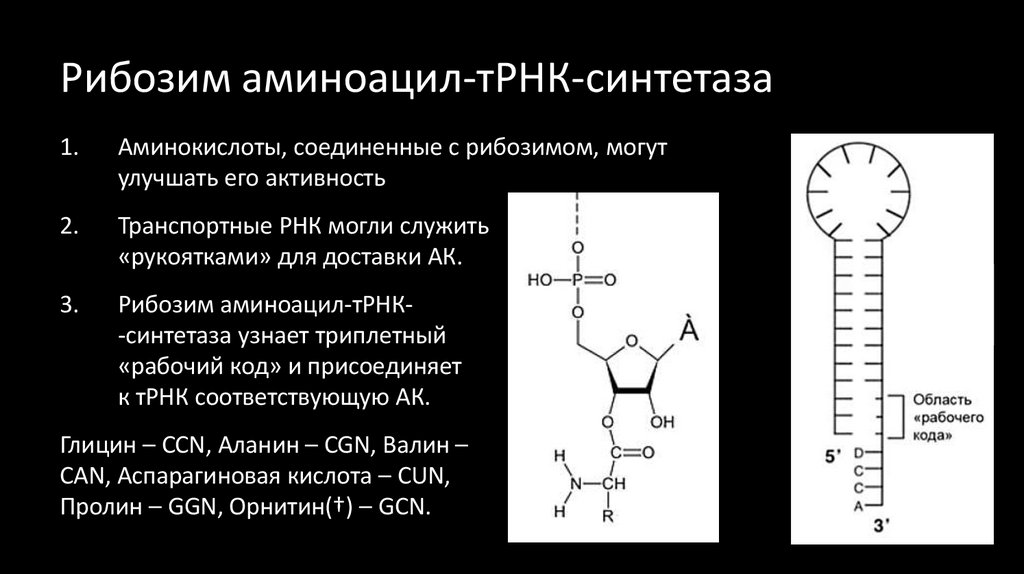
38. Рибозим аминоацил-тРНК-синтетаза
1.Аминокислоты, соединенные с рибозимом, могут
улучшать его активность
2.
Транспортные РНК могли служить
«рукоятками» для доставки АК.
3.
Рибозим аминоацил-тРНК-синтетаза узнает триплетный
«рабочий код» и присоединяет
к тРНК соответствующую АК.
Глицин – ССN, Аланин – CGN, Валин –
CAN, Аспарагиновая кислота – CUN,
Пролин – GGN, Орнитин(†) – GCN.
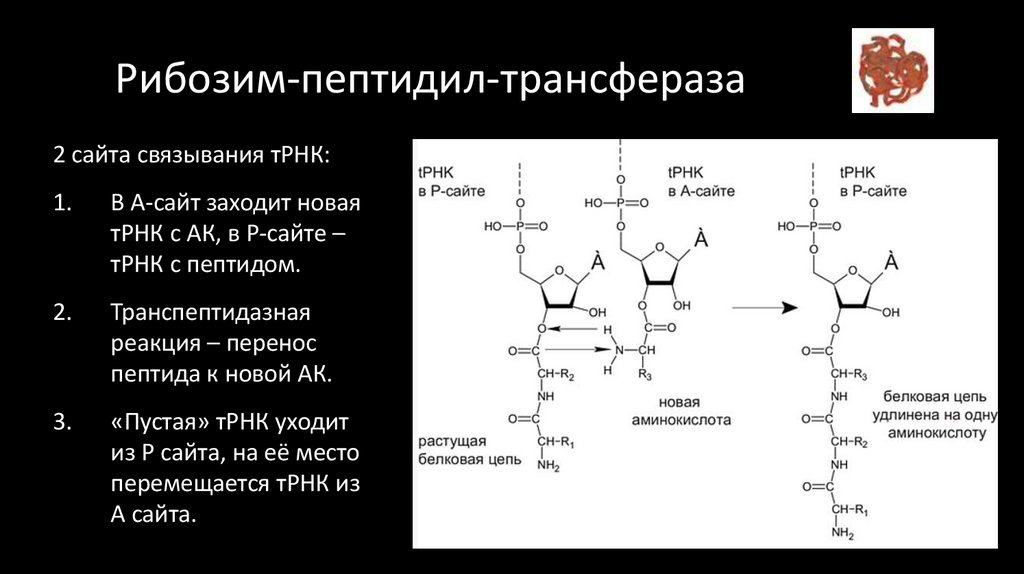
39. Рибозим-пептидил-трансфераза
2 сайта связывания тРНК:1.
В А-сайт заходит новая
тРНК с АК, в P-сайте –
тРНК с пептидом.
2.
Транспептидазная
реакция – перенос
пептида к новой АК.
3.
«Пустая» тРНК уходит
из P сайта, на её место
перемещается тРНК из
А сайта.
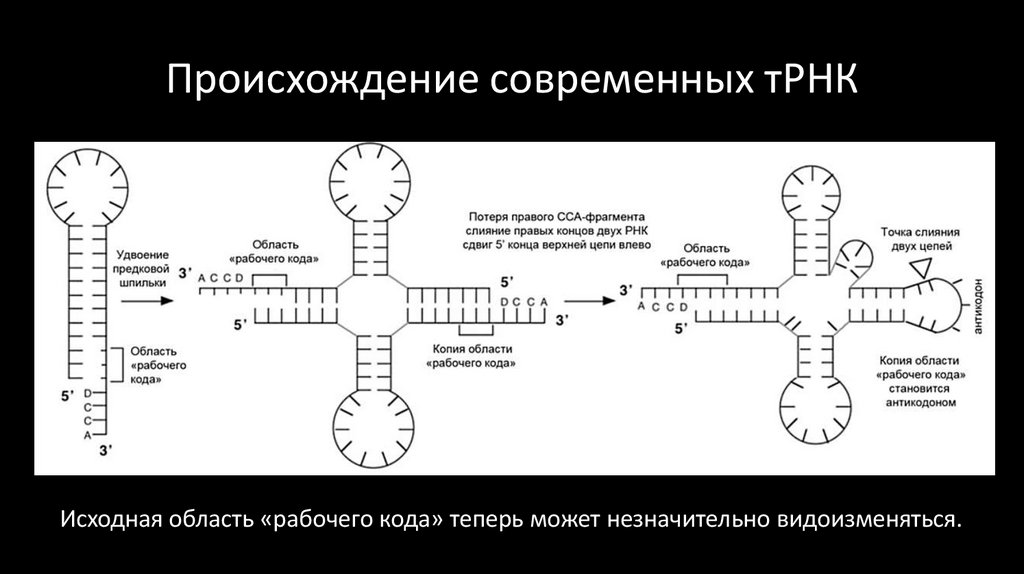
40. Происхождение современных тРНК
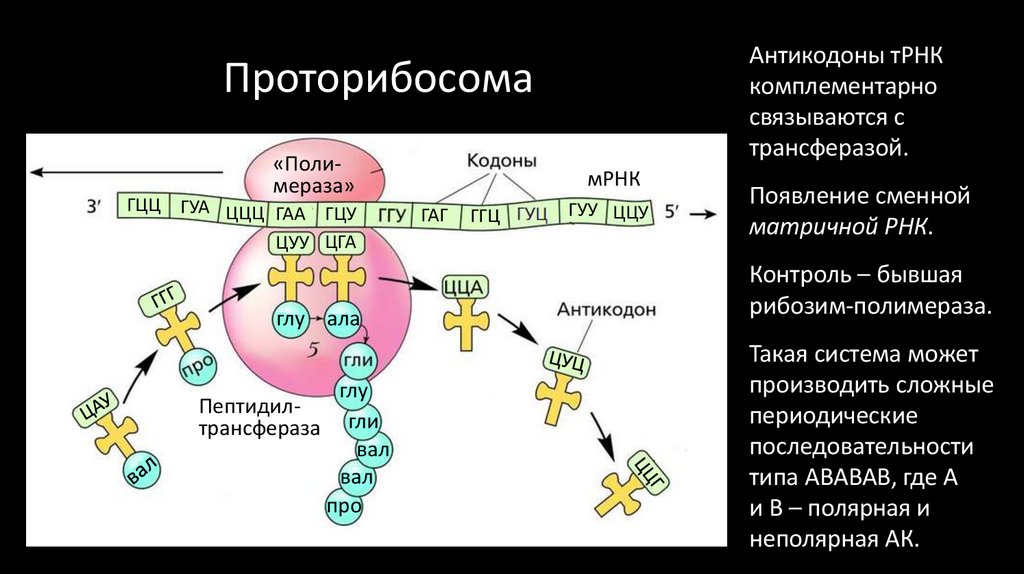
Исходная область «рабочего кода» теперь может незначительно видоизменяться.41. Проторибосома
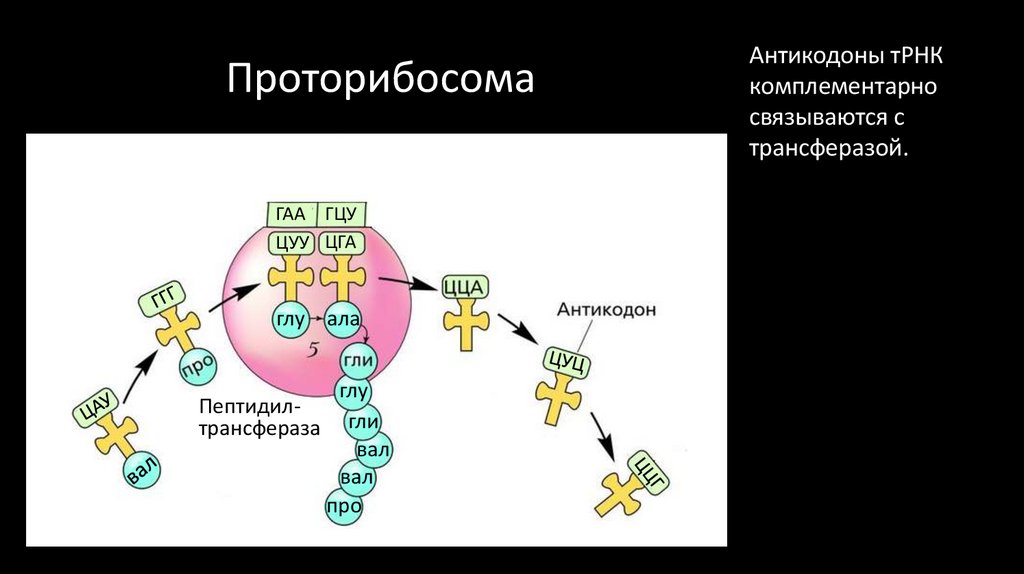
ГАА ГЦУЦУУ ЦГА
глу ала
Пептидилтрансфераза
глу
гли
вал
вал
про
Антикодоны тРНК
комплементарно
связываются с
трансферазой.
42. Проторибосома
Антикодоны тРНКкомплементарно
связываются с
трансферазой.
Появление сменной
матричной РНК.
43. Проторибосома
Антикодоны тРНКкомплементарно
связываются с
трансферазой.
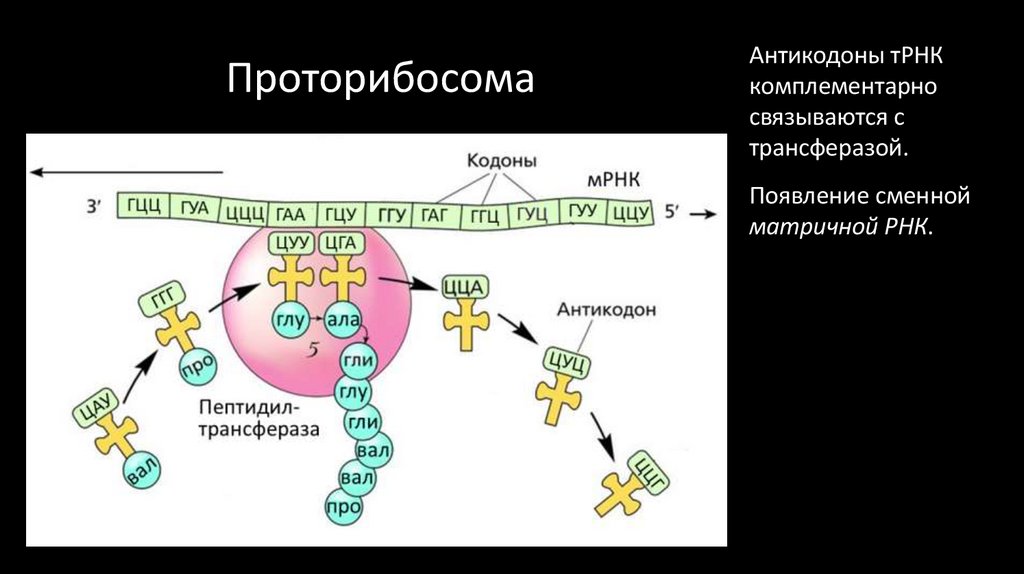
Проторибосома
«Полимераза»
ГЦЦ ГУА ЦЦЦ ГАА ГЦУ
ЦУУ ЦГА
глу ала
Пептидилтрансфераза
глу
гли
вал
вал
про
мРНК
ГАГ
ГГЦ
ГУУ ЦЦУ
Появление сменной
матричной РНК.
Контроль – бывшая
рибозим-полимераза.
Такая система может
производить сложные
периодические
последовательности
типа АВАВАВ, где А
и В – полярная и
неполярная АК.
44. Вторичная структура белка: β-слои
Образованы чередованием полярныхи неполярных АК. В изгибах – пролин.
Держится за счёт водородных связей
между амино- и карбоксильными
группами соседних слоев.
Примеры использования таких белков:
Белки с положительным зарядом
стабилизируют укладки рибозимов,
в том числе пептидилтрансферазы
Каталитические центры древних
ферментов
45. Новые АК!
Что уже есть?Универсальная, гибкая, жесткая,
гидрофобная, заряженная положительно и отрицательно.
Что пригодилось бы ещё? Повесим это на аланин.
Гидрофильная незаряженная: серин (ОН-группа)
и гистидин (ароматическое кольцо с азотами).
Серосодержащая – для образования серных
мостиков в третичной структуре: цистеин.
Итог: резкое расширение каталитических возможностей,
появление многих основных классов белковых ферментов.
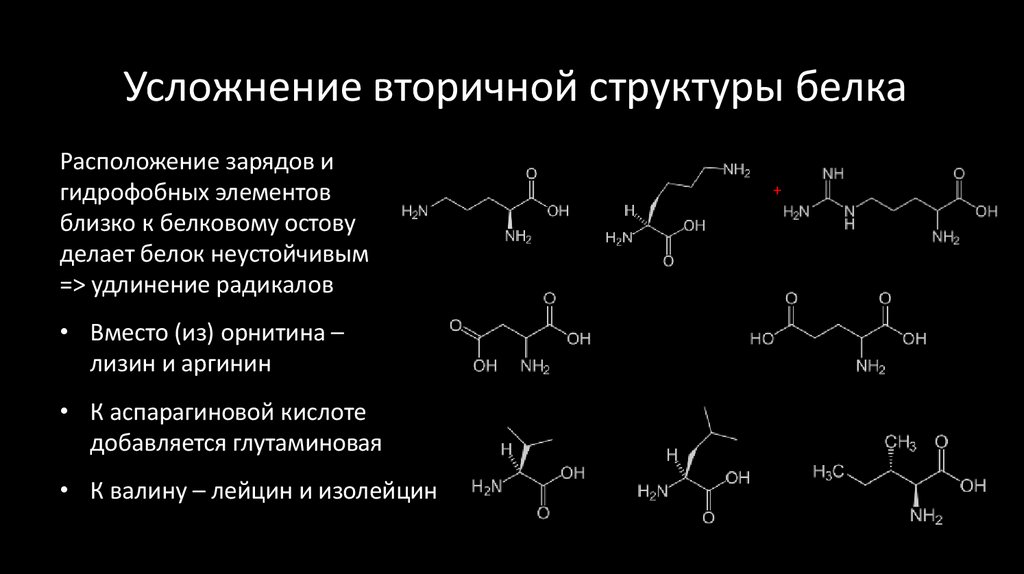
46. Усложнение вторичной структуры белка
Расположение зарядов игидрофобных элементов
близко к белковому остову
делает белок неустойчивым
=> удлинение радикалов
• Вместо (из) орнитина –
лизин и аргинин
• К аспарагиновой кислоте
добавляется глутаминовая
• К валину – лейцин и изолейцин
+
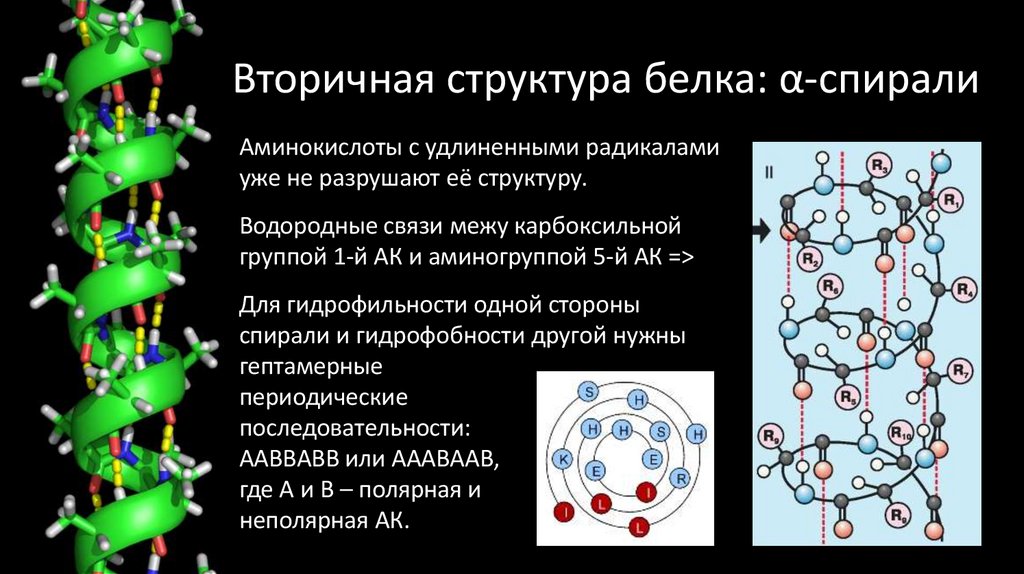
47. Вторичная структура белка: α-спирали
Аминокислоты с удлиненными радикаламиуже не разрушают её структуру.
Водородные связи межу карбоксильной
группой 1-й АК и аминогруппой 5-й АК =>
Для гидрофильности одной стороны
спирали и гидрофобности другой нужны
гептамерные
периодические
последовательности:
ААВВАВВ или АААВААВ,
где А и В – полярная и
неполярная АК.
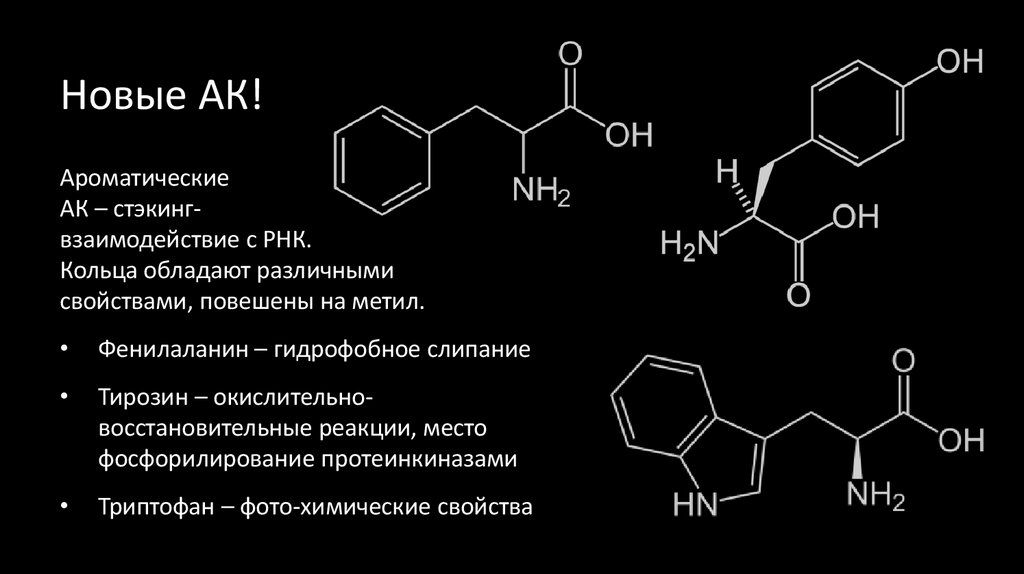
48. Новые АК!
АроматическиеАК – стэкингвзаимодействие с РНК.
Кольца обладают различными
свойствами, повешены на метил.
Фенилаланин – гидрофобное слипание
Тирозин – окислительновосстановительные реакции, место
фосфорилирование протеинкиназами
Триптофан – фото-химические свойства
49. Современные ферменты: рибозимы и белки
ФерментИз РНК
Из белка
Рибосома
+
+
Сплайсосома
+
+
Лигаза
-
+
Полимераза
-
+
Аминоацил-тРНК-синтетаза
-
+
Большинство ферментов
-
+
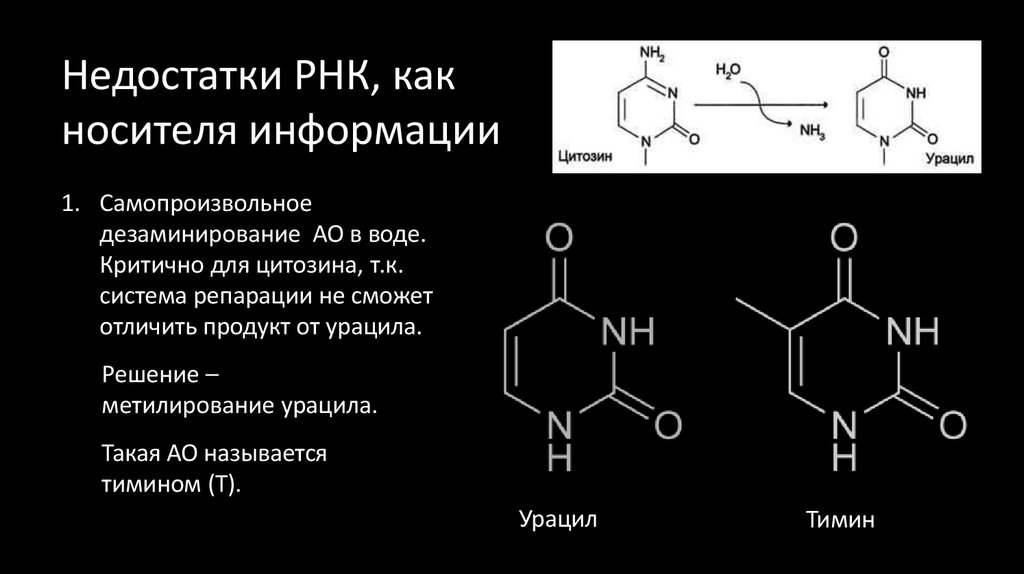
50. Недостатки РНК, как носителя информации
1. Самопроизвольноедезаминирование АО в воде.
Критично для цитозина, т.к.
система репарации не сможет
отличить продукт от урацила.
Решение –
метилирование урацила.
Такая АО называется
тимином (Т).
Урацил
Тимин
51. Недостатки РНК, как носителя информации
2. Способностьк катализу
снижает
срок жизни.
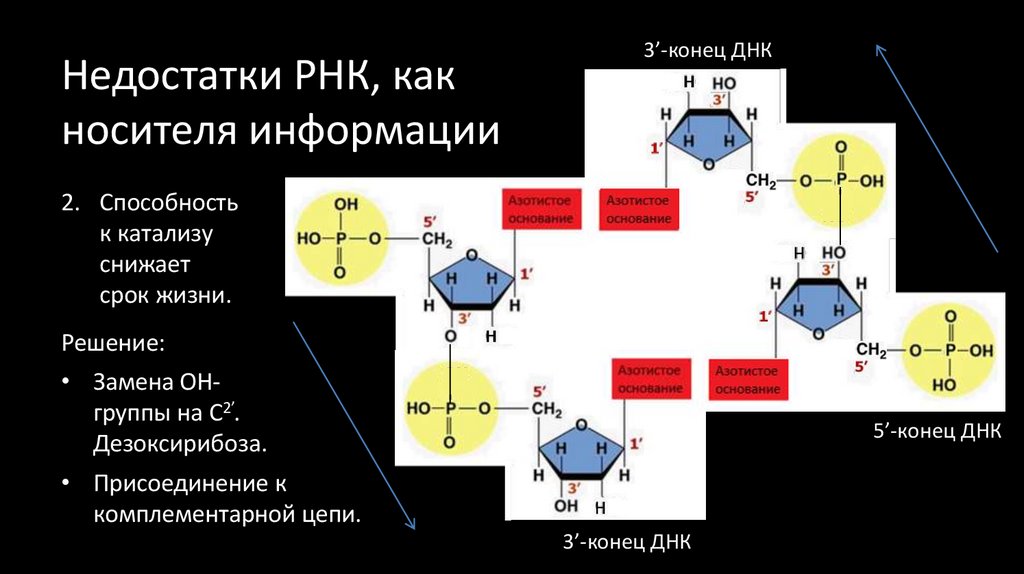
52. Недостатки РНК, как носителя информации
3’-конец ДНК2. Способность
к катализу
снижает
срок жизни.
Решение:
• Замена ОНгруппы на С2’.
Дезоксирибоза.
5’-конец ДНК
• Присоединение к
комплементарной цепи.
3’-конец ДНК
53. Сложность: ДНК лучше РНК, но промежуточный этап – хуже
Решение: эволюционныеэксперименты в вирусах.
Эволюция жизни:
1. Мир РНК: рибозимы в
порах в минеральных
осадках
2. Кооперация независимых
генетических элементов;
вирусоподобные частицы
3. «Гонка вооружений» между
вирусами и их доклеточными хозяевами. Возникновение ДНК, как дающей
преимущество в заражении (в ущерб точности копирования)
54. Гонка вооружений
1) Изобретение вирусамиДНК (использование
дезоксирибозы)
2) Изобретение клетками
урацил-ДНК-гликозилаз
(разновидность нуклеаз)
3) Вирусы заменяют
урацил на тимин:
Для этого вирусам
необходимы белки, вырезающие и встраивающие отдельные нуклеотиды.
Горизонтальный перенос генов –> ДНК-геном и система репарации.
55. LUCA
Более 1000 семейств генов:Все рРНК, половина рибосомных белков
Почти все аминоацил-тРНК-синтетазы
ДНК-зависимая-РНК-полимераза, ДНК-лигаза
Гомолог RecA – предок хеликаз
РНК-связывающие белки – предки SSB-белков
Белок-трансфераза – предок T3SS
Ферменты множества метаболических путей,
дублирующих друг друга и не встречающихся
вместе в одном организме
Скользящий зажим, погрузчик скользящего зажима,
гемы, хиноны, cyt b, дегидрогеназы, гидрогеназы,
ферменты окисления серы, хлорофиллы…
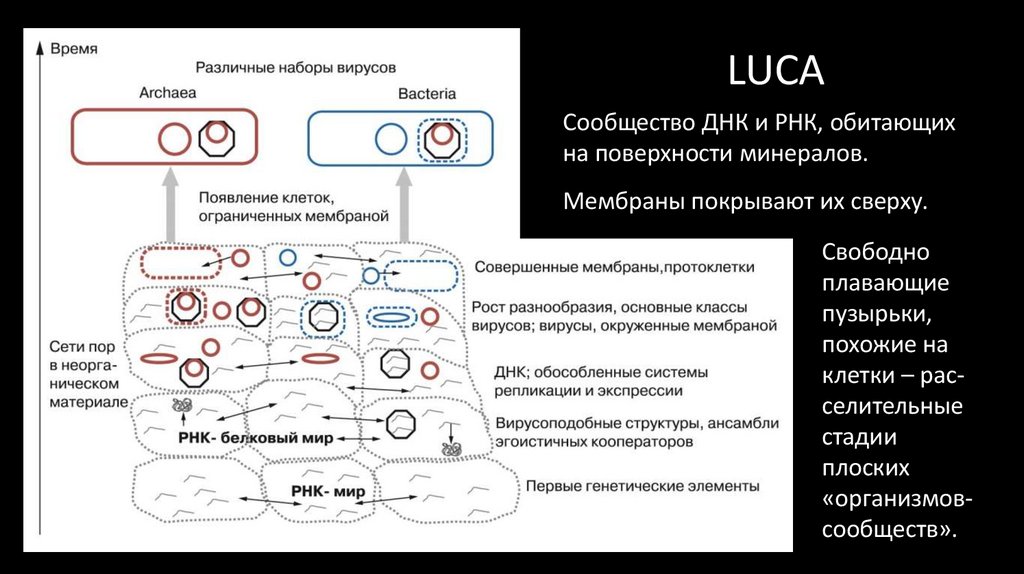
56. LUCA
Сообщество ДНК и РНК, обитающихна поверхности минералов.
Мембраны покрывают их сверху.
Свободно
плавающие
пузырьки,
похожие на
клетки – расселительные
стадии
плоских
«организмовсообществ».




















 Химия
Химия








