Похожие презентации:
Угольная кислота и её соли
1.
Угольная кислота и еёсоли
.
2.
Угольная кислота• Химическая формула - H2CO3
• Структурная формула – все связи ковалентные
полярные
• Кислота слабая, существует только в водном растворе,
очень непрочная, разлагается на углекислый газ и воду:
• CO2 + H2O ↔ H2CO3
• В ионных уравнениях записываем
• H2CO3 ↔ H2O + CO2
3.
Угольная кислота• Двухосновная, образует соли:
• -средние – карбонаты (ионы CO32-)
• - кислые – гидрокарбонаты (ионы НCO3-)
4.
Физические свойства Н2СО3Угольная кислота Н2СО3
слабая, очень неустойчивая
даже в водных растворах. В
насыщенном водном
растворе практически весь
углекислый газ содержится в
виде молекул СО2,
окруженных молекулами
воды.
5.
Соли угольной кислотыкарбонаты
гидрокарбонаты
• твёрдые
кристаллические
вещества.
• твёрдые
кристаллические
вещества.
• большинство из них в
воде не
растворяются
• растворяются в воде
• Диссоциация: с
образованием
карбонат-анионов
• Диссоциация: с
образованием
катиона водорода,
карбонат-аниона.
6.
2 ряда солей Н2СО3Средние
(Нормальные)
• Карбонаты
Na2CO3
CaCO3
Кислые
• Гидрокарб
онаты
NaHCO3
Ca(HCO3)2
Трехвалентные металлы (Fe, Al, Cr) карбонатов
вообще не образуют – в соответствующих
клетках таблицы растворимости стоят
прочерки
7.
Взаимопревращениякарбонатов и гидрокарбонатов
= Ca(HCO3)2
-
8.
Соли угольной кислоты, ихрастворимость
Химическая формула
Название
Na2CO3
Сода
кальцинированная
Сода питьевая
Поташ
Мел, мрамор,
известняк
Доломит
NaHCO3
K2CO3
CaCO3
MgCO3
Растворимость
9.
10.
Химические свойствакарбонатов и гидрокарбонатов
• 1) Качественная реакция на CO32- карбонат – ион "вскипание" при действии
сильной кислоты:
• Мел СаCO3 + 2HCl = СaCl2 + H2O + CO2↑
Питьевая сода NaНCO3 + HCl = NaCl + H2O + CO2↑
2) Вступают в реакции обмена с другими растворимыми солями
• Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
3) Карбонаты и гидрокарбонаты могут превращаться друг в друга
• Са(ОН)2 + СО2 = CaCO3↓ + Н2О
• СаСО3 + СО2 + Н2О = Са(НСО3)2
• 4) Разложение гидрокарбонатов и карбонатов при нагревании
• NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
• CaCO3 t˚C → CaO + CO2↑
11.
Получение Н2СО3• Угольная кислота образуется при
растворении в воде диоксида
углерода СО2
• Содержание угольной кислоты в
растворе увеличивается при
понижении температуры раствора
и увеличении давления
углекислого газа.
СО2 + Н2О = Н2СО3
12.
Получение Н2СО3• Также угольная кислота образуется при
взаимодействии её солей (карбонатов и
гидрокарбонатов) с более сильной
кислотой. При этом бо́льшая часть
образовавшейся угольной кислоты, как
правило, разлагается на воду и диоксид
углерода
Na CO + 2HCl = 2NaCl +
CO + H O
2
3
2
2
13.
Практическое значение солейН2СО3
• СаСО3 карбонат кальция
• Мел
• Мрамор (Плотный
кристаллический
известняк)
• Известняк
• Кальцит(известковый
шпат)
14.
Применение СаСО3 карбонатакальция
• Замачивание и стирка белья
• Очистка нефти
• Производство стекла
• В текстильной промышленности
• В мыловаренной промышленности
15.
Практическое значение солейН2СО3
• NaHCO3
гидрокарбонат
натрия
• Питьевая сода
• Пищевая сода
• Двууглекислый
натрий
16.
Применение NaHCO3гидрокарбоната натрия
• В огнетушителях
• В хлебопечении
• При изготовлении шипучих
напитков
17.
Практическое значение солейН2СО3
• Na2CO3
карбонат
натрия
• Стиральная
сода
• Кальцинирова
нная сода
• Нормальный
карбонат
18.
Практическое значение солей Н2СО3• Na2CO3
10H2O
кристаллогид
рат карбоната
натрия
• Кристалличес
кая сода
• Натрит
19.
Практическое значение солей Н2СО3•К2СО3
карбонат
калия
• Поташ
• Углекислый
калий
• Белая «зола»
от костра
20.
Сталактиты исталагмиты
• сталактитами называют кальцитовые
натёчно-капельные образования,
имеющие форму сосульки с
внутренним питающим каналом
• сталагмиты - натечные минеральные
образования (большей частью
известковые), растущие в виде
конусов, столбов со дна пещер и
других подземных карстовых
полостей навстречу сталактитам и
нередко сливающиеся с ними.
21.
Здесь, среди миллионов кристаллов кальцита и арагонита человеку сложно понять,какие силы природы смогли создать это каменное чудо.
взаимопревращения в природе
Пещера «Эмине-Баир-Хосар» в Крыму!
22.
Пещера «Эмине-Баир-Хосар» в Крыму23.
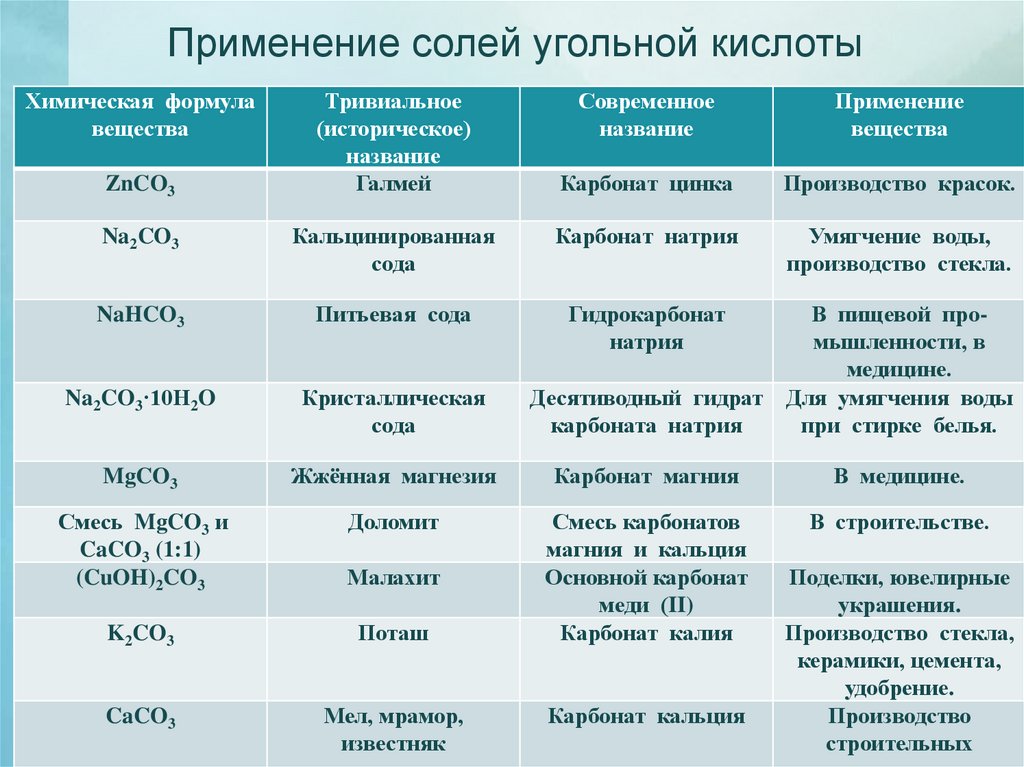
Применение солей угольной кислотыХимическая формула
вещества
ZnCO3
Тривиальное
(историческое)
название
Галмей
Современное
название
Применение
вещества
Карбонат цинка
Производство красок.
Умягчение воды,
производство стекла.
Na2CO3
Кальцинированная
сода
Карбонат натрия
NaHCO3
Питьевая сода
Гидрокарбонат
натрия
Na2CO3·10H2O
Кристаллическая
сода
MgCO3
Жжённая магнезия
Карбонат магния
В медицине.
Смесь MgCO3 и
CaCO3 (1:1)
(CuOH)2CO3
Доломит
В строительстве.
Малахит
K2CO3
Поташ
Смесь карбонатов
магния и кальция
Основной карбонат
меди (II)
Карбонат калия
CaCO3
Мел, мрамор,
известняк
В пищевой промышленности, в
медицине.
Десятиводный гидрат Для умягчения воды
карбоната натрия
при стирке белья.
Карбонат кальция
Поделки, ювелирные
украшения.
Производство стекла,
керамики, цемента,
удобрение.
Производство
строительных
24.
• Знаете ли вы, что…..?• 24 апреля 1833 года в США
была запатентована
газированная содовая вода.
Впервые газированный
напиток был получен в 1767
году гениальным
английским химиком
Джозефом Пристли. Он
открыл одно из свойств
диоксида углерода, с
помощью которого и стало
возможным производство
газированной воды.
25.
Состав газированной воды• Газированную воду в бутылках
обогащают СО2, который очищает
воду от микробов. Углекислый газ
также способствует увеличению
сроков хранения воды и играет роль
консерванта. Наличие в напитке или
воде двуокиси углерода как
консерванта отмечается на этикетке
кодом Е290.
• При соединении углекислого газа с
водой образуется угольная кислота.
























 Химия
Химия








