Похожие презентации:
Угольная кислота и ее соли. 9 класс
1. Угольная кислота и её соли
МОУ «СОШ № 43 города Чебоксары»Угольная кислота
и её соли
36
9 класс Химия
Учитель: Трофимова Жанна Васильевна
2. Угольная кислота
3.
Периодическая система химических элементов Д.И.МенделееваГруппы элементов
I
1
1
2
2
3
3
II
III
IV
V
1
12
4
5
5
7
8
6
9
7
10
VII
VIII
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА
0
+6
2 е,- 4 е-
2
Углерод – основа всего
живого на Земле.
3
Степень окисления в
соединениях +4, +2, - 4.
4
В природе встречается как
в свободном виде (алмаз,
графит), так и в связанном
состоянии ( углекислый
газ, карбонаты, уголь,
нефть и т.д.)
4
6
VI
4.
Электронное строение12
0
2p2
+6
2 s2
2
4
1 s2
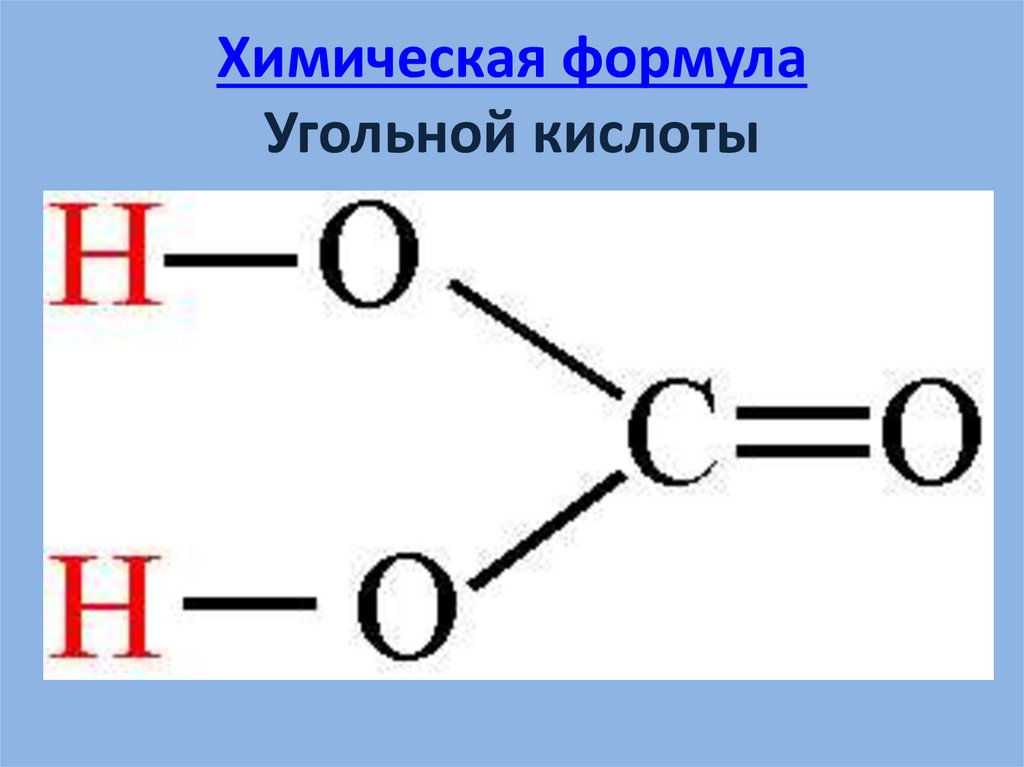
5. Химическая формула Угольной кислоты
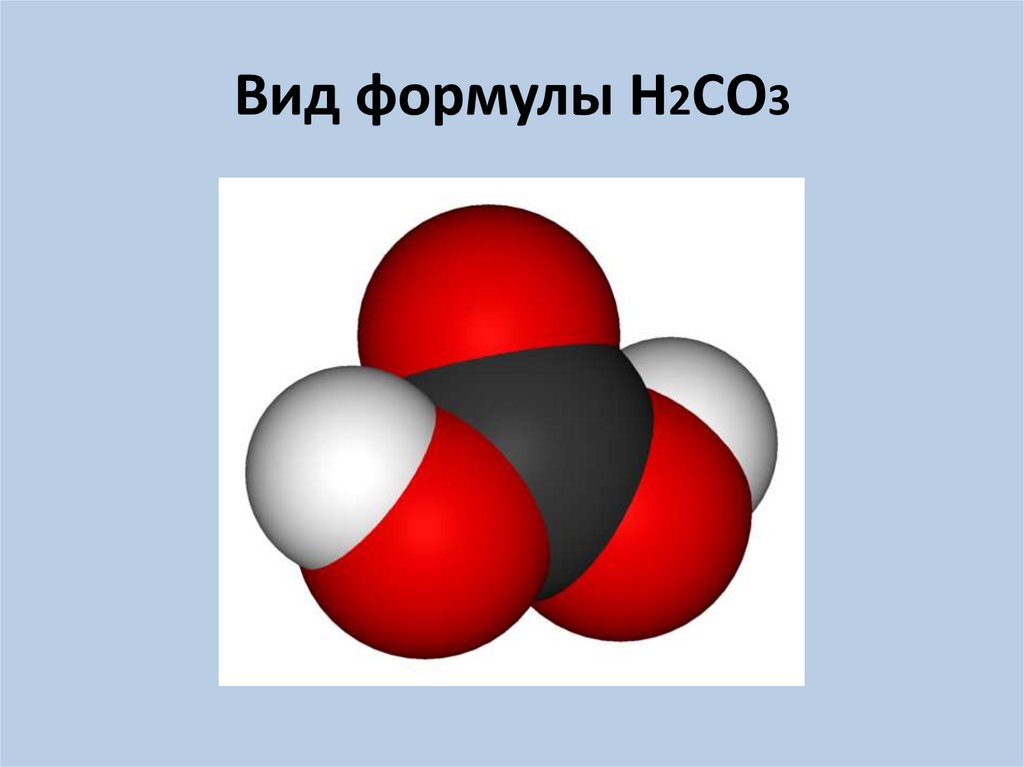
6. Вид формулы Н2СО3
7. Физические свойства Н2СО3
Угольная кислота Н2СО3 слабая, оченьнеустойчивая даже в водных
растворах. В насыщенном водном
растворе практически весь
углекислый газ содержится в виде
молекул СО2, окруженных
молекулами воды.
8. Получение Н2СО3
• Угольная кислота образуется прирастворении в воде диоксида углерода
СО2
• Содержание угольной кислоты в
растворе увеличивается при понижении
температуры раствора и увеличении
давления углекислого газа.
СО2 + Н2О = Н2СО3
9. Получение Н2СО3
• Также угольная кислота образуется привзаимодействии её солей (карбонатов и
гидрокарбонатов) с более сильной
кислотой. При этом бо́льшая часть
образовавшейся угольной кислоты, как
правило, разлагается на воду и диоксид
углерода
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
10.
11. 2 ряда солей Н2СО3
Средние (Нормальные)• Карбонаты
Na2CO3
CaCO3
Кислые
• Гидрокарбонаты
NaHCO3
Ca(HCO3)2
Трехвалентные металлы (Fe, Al, Cr) карбонатов
вообще не образуют – в соответствующих клетках
таблицы растворимости стоят прочерки
12. Практическое значение солей Н2СО3
• СаСО3 карбонат кальция• Мел
• Мрамор (Плотный
кристаллический
известняк)
• Известняк
• Кальцит(известковый
шпат)
13. Применение СаСО3 карбоната кальция
Замачивание и стирка белья
Очистка нефти
Производство стекла
В текстильной промышленности
В мыловаренной промышленности
14. Практическое значение солей Н2СО3
• NaHCO3гидрокарбонат натрия
• Питьевая сода
• Пищевая сода
• Двууглекислый натрий
15. Применение NaHCO3 гидрокарбоната натрия
• В огнетушителях• В хлебопечении
• При изготовлении шипучих напитков
16. Практическое значение солей Н2СО3
• Na2CO3 карбонатнатрия
• Стиральная сода
• Кальцинированная
сода
• Нормальный
карбонат
17. Практическое значение солей Н2СО3
• Na2CO3 10H2Oкристаллогидрат
карбоната
натрия
• Кристаллическая
сода
• Натрит
18. Практическое значение солей Н2СО3
• К2СО3 карбонаткалия
• Поташ
• Углекислый
калий
• Белая «зола» от
костра
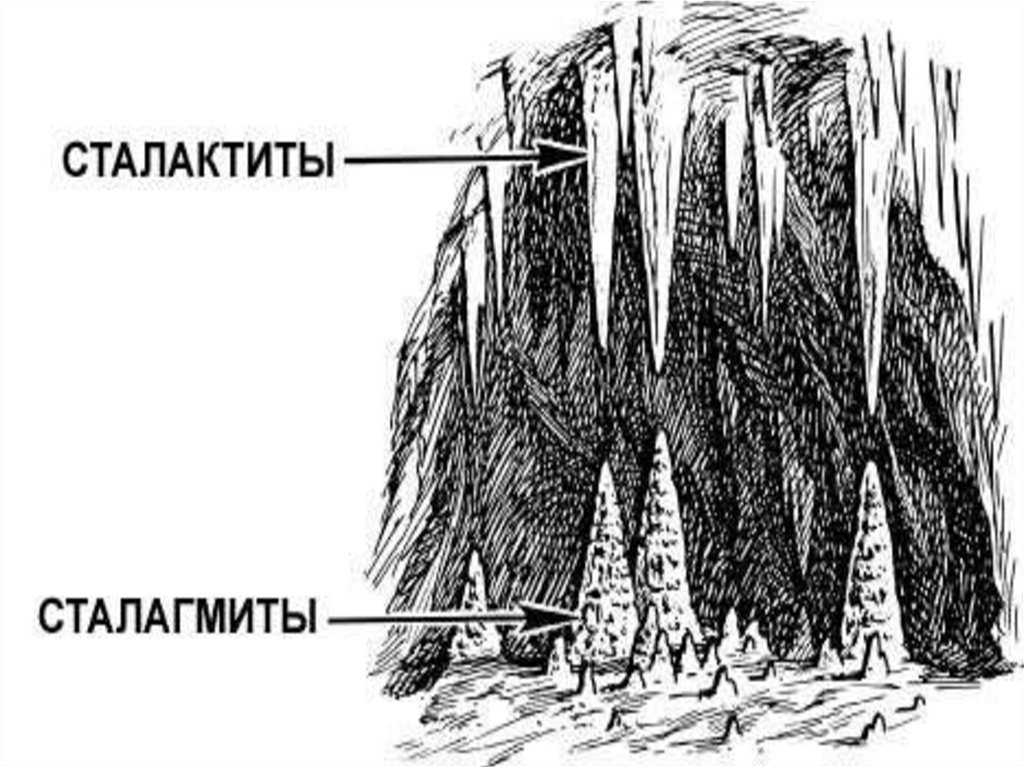
19. Сталактиты и сталагмиты
• сталактитами называют кальцитовые натёчнокапельные образования, имеющие формусосульки с внутренним питающим каналом
• сталагмиты - натечные минеральные
образования (большей частью известковые),
растущие в виде конусов, столбов со дна пещер
и других подземных карстовых полостей
навстречу сталактитам и нередко сливающиеся с
ними.
20.
21. Механизм образования
Вода, проникающая в пещеру, растворяетизвестняк в химической реакции:
2+
CaCO3 + H2O + CO2 <=> Ca + 2 HCO3
При определённых условиях (разница в
парциальном давлении углекислого газа в
растворе и воздухе) реакция идёт в обратную
сторону, и происходит отложение карбоната
кальция — растут сталактиты. Происходит это
весьма медленно, характерное время —
десятки, сотни лет. Длина сталактитов в
отдельных случаях достигает нескольких метров.



























 Химия
Химия








