Похожие презентации:
Коррозия металлов
1.
Презентационный проект по химии на темуКоррозия металлов
2. Содержание
Введение (Слайд 3)● Процесс коррозии (Слайд 4)
● Классификация коррозии металлов (Слайд 5)
● Химическая коррозия (Слайд 6)
● Химическая коррозия (Слайд 7)
● Электрохимическая коррозия (Слайд 8)
● Электрохимическая коррозия (Слайд 9)
● Способы борьбы с коррозией (Слайд 10)
● Способы борьбы с коррозией (Слайд 11)
● Заключение (Слайд 12)
● Источники (Слайд 13)
3. Введение
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое илихимическое взаимодействие между металлом
(сплавом) и средой, приводящее к ухудшению
функциональных свойств металла (сплава),
среды или включающей их технической системы.
Слово коррозия происходит от латинского
«corrodo» – «грызу» (позднелатинское «corrosio»
означает «разъедание»).
4. Процесс коррозии Среда, в которой металл подвергается коррозии , называется коррозионной или агрессивной средой. В случае с
металлами,говоря об их коррозии, имеют в виду нежелательный процесс
взаимодей-ствия
металла
со
средой.
Рисунок 1 «Коррозия металлов»
Окислительновосстановительные реакции
в данном случае проходят
через переход электронов
на окислитель. В процессе
коррозии
такого
типа
кислород
воздуха
взаимодействует
с
поверхностью железа. При
этом образуется оксидная
пленка, которая называется
ржавчиной:
3Fe
+
2O2
=
Fe3O4
(FeO•Fe2O3)
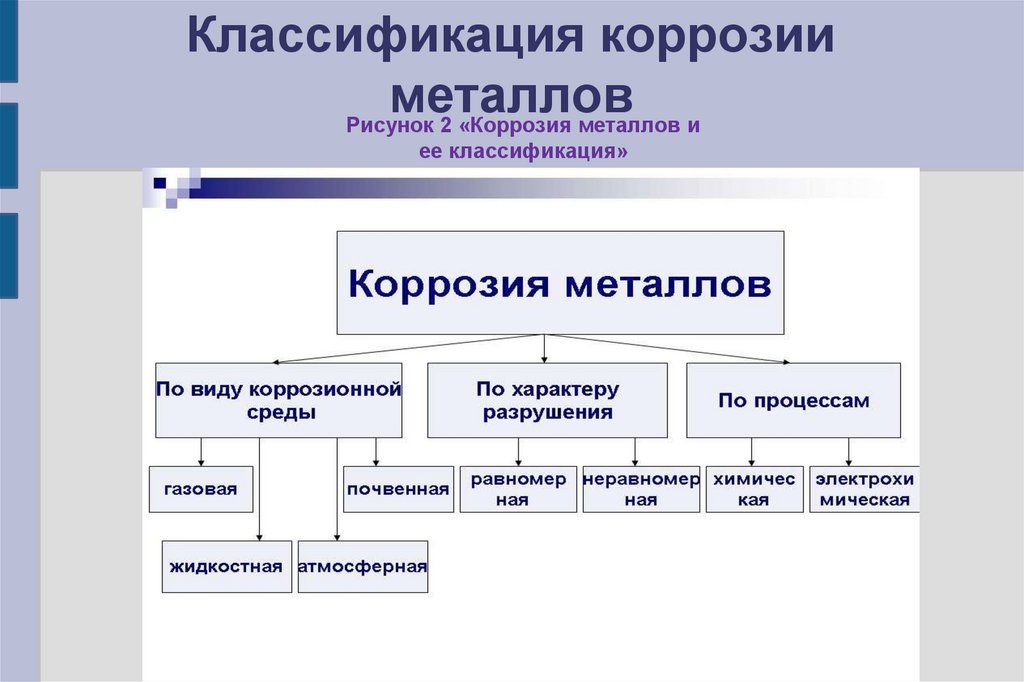
5. Классификация коррозии металлов
Рисунок 2 «Коррозия металлов иее классификация»
6. Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической
связи, атомы металла и атомы,входящие в состав окислителей, образуют химическую связь.
Газовая
- разрушает металл в среде
окислительного
газа
при
воздействии температуры
(кислород,
диоксид
серы,
сероводород, пары воды,
галогены)
- может привести к полному
разрушению металла (если
металл активный), а в других
случаях может образоваться
защитная пленка ( алюминий,
хром, цирконий)
2Fe + 3Cl2=2FeCl3
4Fe + 3O2=2Fe2O3
Уравнение
реакции
окисления металлов
кислородом (пример
газовой
коррозии)
можно записать в
общем виде:
Рисунок 3 «Окисление металлов
кислородом»
7. Химическая коррозия
Жидкостнаяможет
протекать
в
неэлектролитах таких как ,
нефть,керосин,смазочные
масла,органические вещества
- может легко приобрести
электрохимический характер
при
наличии
небольшого
количества влаги
-
Cu+S=CuS
2Ag+S=Ag2S
2Al+6CCl4=3C2Cl6+3AlCl3
Рисунок 4 «Жидкостная коррозия»
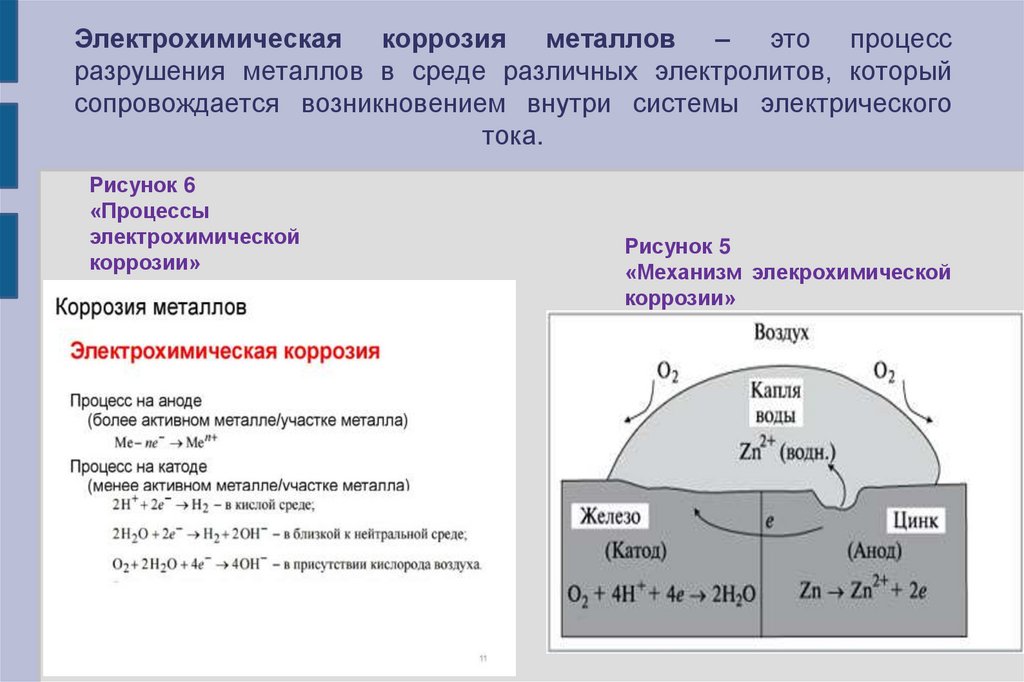
8. Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается
возникновением внутри системы электрическоготока.
Рисунок 6
«Процессы
электрохимической
коррозии»
Рисунок 5
«Механизм элекрохимической
коррозии»
9. Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды
электрохимической коррозии:- в растворах электролитов
в
растворах
кислот,
оснований,
солей,
в
природной воде
- атмосферная
в атмосферных условиях и в
среде любого влажного газа
(самый
распространенный
вид коррозии)
- почвенная
в зависимости от состава
почв, а также ее аэрации,
коррозия может протекать
более или менее интенсивно
(Кислые
почвы
наиболее
агрессивны, а песчаные –
- биокоррозия
возникает
в
результате
жизнедеятельности бактерий
и
других
организмов,
вырабатывающих такие газы
как
CO2,
H2S
и
др.,
способствующие
коррозии
металла.
- электрокоррозия
происходит под действием
блуждающих
токов
на
подземных сооружениях, в
результате
работ
электрических
железных
дорог, трамвайных линий и
10. Способы борьбы с коррозией
Покраска
металлических
изделий масляными и другими
красками
Покрытие
минеральным
маслом (смазывание)
Покрытие более коррозионностойкими
металлами
(хромирование,
цинкование,
никелирование)
Легирование металлов
Кислотоупорные
и
нержавеющие стали, в состав
которых входят никель, хром,
титан,
повышающие
антикоррозионные
свойства
Рисунок 5 «Цинкование металла»
11. Способы борьбы с коррозией
Применение веществ,
которые, находясь в
коррозионной среде в
достаточной
концентрации, сильно
замедляют либо вообще
прекращают
коррозионное
разрушение металла
(Ингибиторы коррозии)
Рисунок 6 «Результат действия
ингибитора коррозии»»
12. Заключение
Коррозия вызывается химической реакциейметалла с веществами окружающей среды,
протекающей на границе металла и среды.
● Химическая
коррозия протекает без участия
тока , с помощью окислительного газа .
● Электрохимическая
коррозия протекает с
участием
электролитов
,
образуя
гальванический (коррозионный элемент).
13. Источники
1)Учебник по химии. 9 класс . О.С. ГабриелянДрофа 2008 (Коррозия металлов;Химическая и электрохимическая
коррозия;Борьба с коррозией)
2)http://www.krugosvet.ru/enc/nauka_i_tehnika/himiya/KORROZIYA_ME
TALLOV.html
(Определения)
3)http://www.obrabotka.ru/articles/obshhie_svedeniya_o_korrozii_metall
a.html
(Процесс коррозии)
4)http://zadachi-po-khimii.ru/obshaya-himiya/korroziya-metallov.html
(Химическая и электрохимическая коррозия;Вывод)
5)http://www.teploskat.ru/metalli/obrabotka10.php
(Способы борьбы с коррозией)
6)http://www.okorrozii.com/ingibitor-korrozii.html
(Ингибиторы коррозии)











 Химия
Химия








