Похожие презентации:
Ферменты и их свойства
1.
Тема 2.Ферменты и
их свойства
1
2.
Это специфические белки, образующ. во всех клеткахи выполняют роль биологических катализаторов
Методы получения и очистки ферментов
1. Ткани измельчают: а) в ступке
б)гомогенезатором
в) автолизом
2. Фистульный метод
3. Их выделяют растворителями:
а) холодной водой
б) физ. р-ром, буферным р-ром
в) глицерином, спиртом, ацетоном
4. Очистка ферментов:
а) диализом
б) электрофорезом
в) избирательной адсорбцией
г) «высаливанием»
2
3.
Методы обнаруж. и колич. опред. ферментовПо их каталитической активности:
а) по исчезновению субстрата (амилаза)
б) по появлению продуктов реакции (липаза)
За международную единицу активности (Е)
принимают такое к-во ферм., кот. катализирует
превращение (синтез или распад) 1 микромоля
субстрата за 1 мин. при стандартных условиях
(рН, Т)
3
4.
Хим. строение ферментовВсе они белки со всеми их свойствами
Однокомпонентные - это простые белки (амилаза)
Двухкомпонентные - сложные белки
(лактатдегидрогеназа)
Холофермент
апофермент + кофермент, где
холофермент - сложный белок
апофермент - термолабильная часть фермента, а
кофермент - низкомолекулярная термостабильная
небелковая часть фермента, кот. легко от него
отделяется при нагревании или диализе (НАД, ФАД)
Если кофермент состоит только из металла или -SН
группы называется кофактор.
4
5.
Профермент - неактивная форма фермента котораяпревращается в активную
+НCl
пепсиноген
пепсин + полипептид
Мультиферментные системы - одновременно
несколько ферментов катализируют цепь реакций (
дыхательная цепь).
Активный центр (АЦ) ферм - группа атомов в
молекуле ферм., кот. вступает во временное соед. с
субстратом и при ее разрушении ферм. теряет
активность (SН - группа, Fе)
5
6.
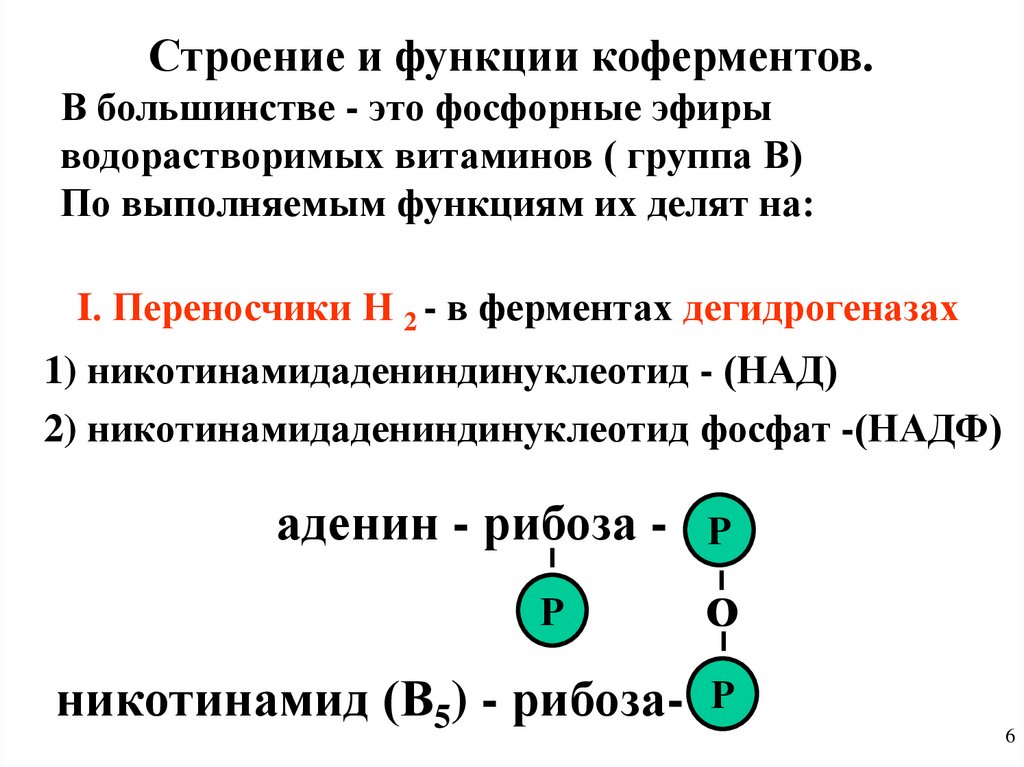
Строение и функции коферментов.В большинстве - это фосфорные эфиры
водорастворимых витаминов ( группа В)
По выполняемым функциям их делят на:
I. Переносчики Н 2 - в ферментах дегидрогеназах
1) никотинамидадениндинуклеотид - (НАД)
2) никотинамидадениндинуклеотид фосфат -(НАДФ)
аденин - рибоза Р
Р
О
никотинамид (В5) - рибоза- Р
6
7.
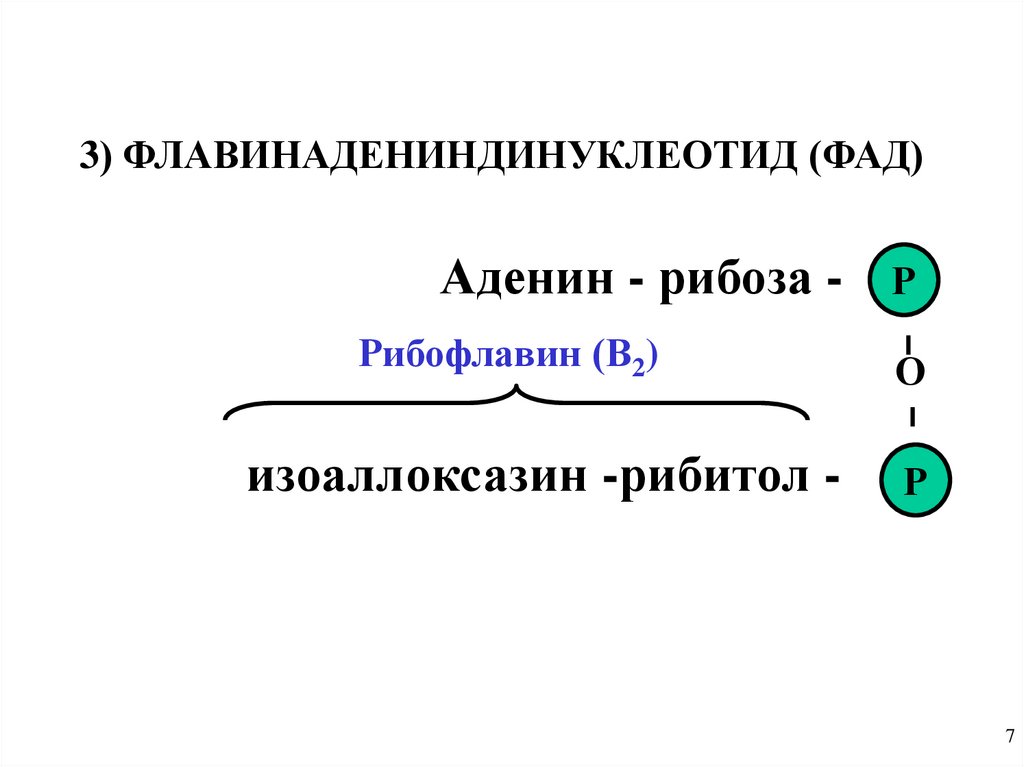
3) ФЛАВИНАДЕНИНДИНУКЛЕОТИД (ФАД)Аденин - рибоза Рибофлавин (В2)
изоаллоксазин -рибитол -
Р
О
Р
7
8.
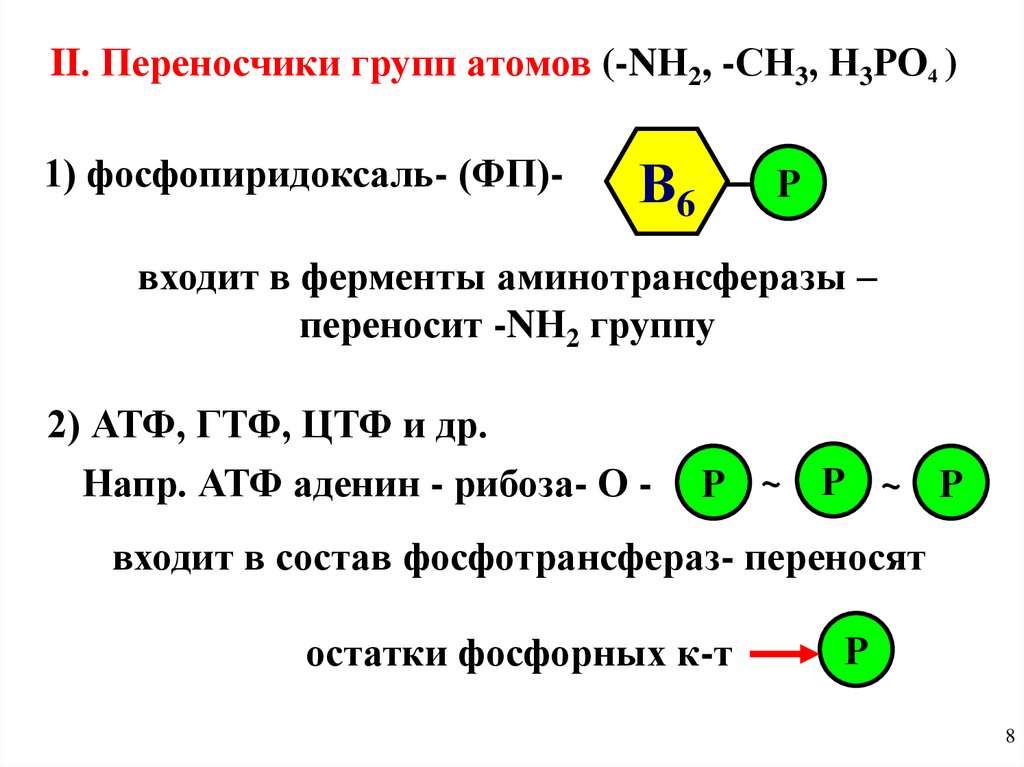
II. Переносчики групп атомов (-NН2, -СН3, Н3РО4 )1) фосфопиридоксаль- (ФП)-
В6
Р
входит в ферменты аминотрансферазы –
переносит -NН2 группу
2) АТФ, ГТФ, ЦТФ и др.
Напр. АТФ аденин - рибоза- О -
Р ~ Р ~ Р
входит в состав фосфотрансфераз- переносят
остатки фосфорных к-т
Р
8
9.
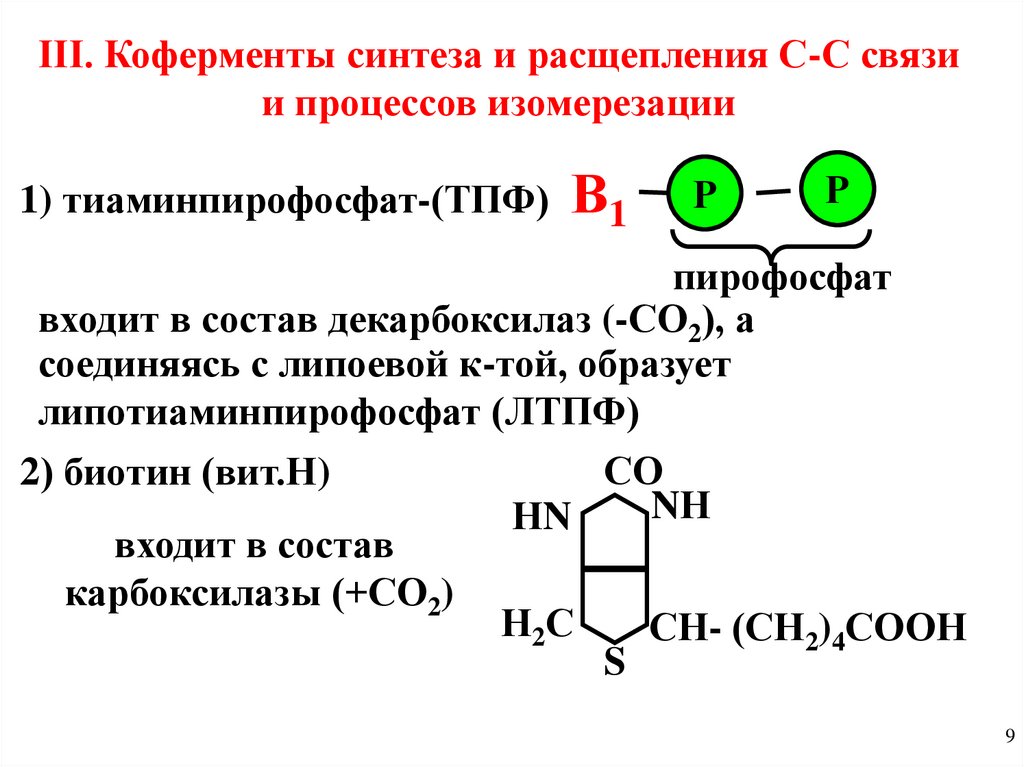
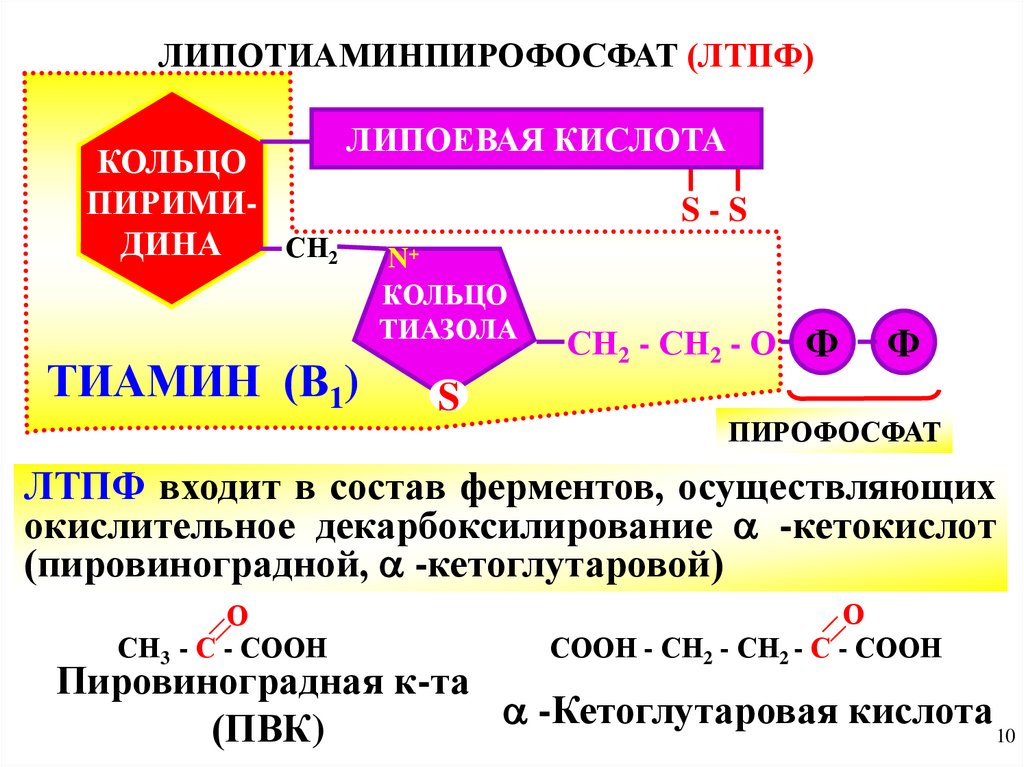
III. Коферменты синтеза и расщепления С-С связии процессов изомерезации
1) тиаминпирофосфат-(ТПФ) В1
Р
Р
пирофосфат
входит в состав декарбоксилаз (-СО2), а
соединяясь с липоевой к-той, образует
липотиаминпирофосфат (ЛТПФ)
СО
2) биотин (вит.Н)
NН
НN
входит в состав
карбоксилазы (+СО2)
Н2С
СН- (СН2)4СООН
S
9
10.
ЛИПОТИАМИНПИРОФОСФАТ (ЛТПФ)КОЛЬЦО
ПИРИМИДИНА
СН2
ЛИПОЕВАЯ КИСЛОТА
ТИАМИН (В1)
S-S
N+
КОЛЬЦО
ТИАЗОЛА
S
СН2 - СН2 - О Ф
Ф
ПИРОФОСФАТ
ЛТПФ входит в состав ферментов, осуществляющих
окислительное декарбоксилирование -кетокислот
(пировиноградной, -кетоглутаровой)
О
СН3 - С - СООН
О
СООН - СН2 - СН2 - С - СООН
Пировиноградная к-та
-Кетоглутаровая
кислота
(ПВК)
10
11.
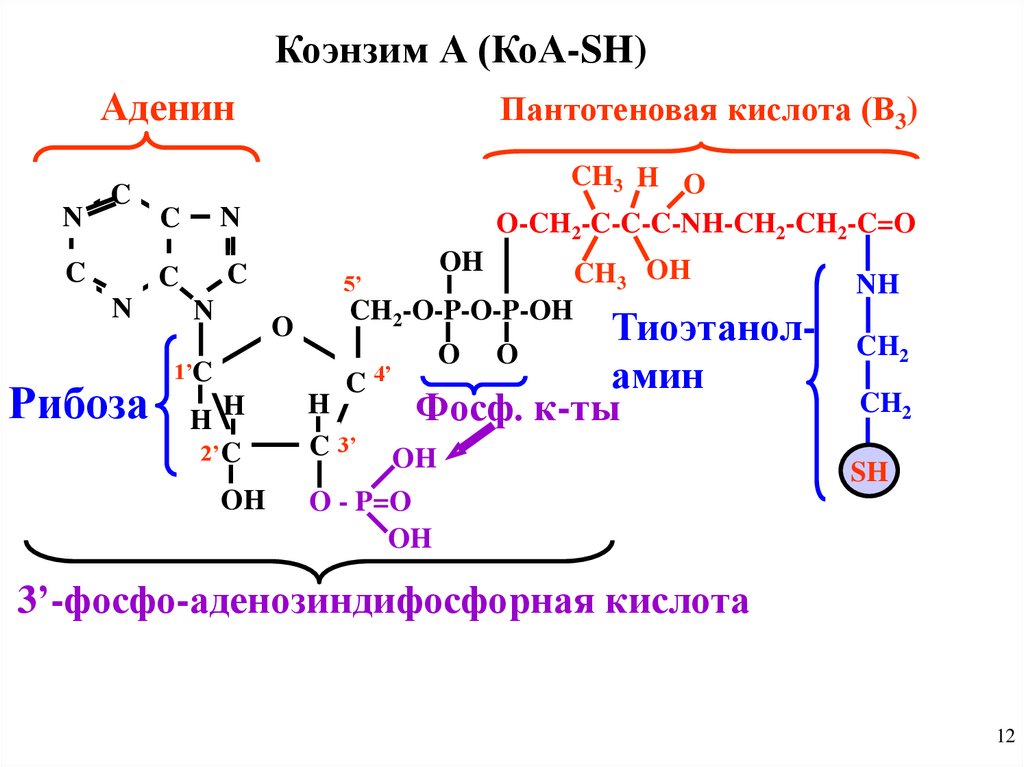
3) Коэнзим ацетилирования (Коэнзим А, КоА-SН)состоит из:
Р
аденин - рибоза Р
Тиоэтаноламин
Пантотеновая
к-та
О
Р
1) 3-фосфоаденозин
дифосфорная к-ты
2) пантотеновая к-ты
3) тиоэтаноламина (SН)
Активирует жирные кислоты,
входит в состав ацилтрансфераз
(переносят остатки уксусной и др к-т).
11
12.
Коэнзим А (КоА-SH)N
Аденин
Пантотеновая кислота (В3)
C
CH3 H O
O-CH2-C-C-C-NH-CH2-CH2-C=O
C
N
Рибоза
C
N
C
C
N
5’
O
1’C
HH
2’C
OH
OH
CH3 OH
CH2-O-P-O-P-OH
ТиоэтанолO O
C
амин
C 4’
H
Фосф. к-ты
NH
CH2
CH2
C 3’
OH
O - P=O
OH
SH
3’-фосфо-аденозиндифосфорная кислота
12
13.
Коэнзим АЯвл.
коферментом
ферментов
ацетилирования.
Напр.,
активирует
уксусную к-ту, вовлекая её в процессы:
ЦТК, биосинтеза жирных к-т, стеролов и
др. в-в.
Участвует
в
окислительном
декарбоксилировании ПВК и
-кетоглутаровой кислот.
Участвует в -окислении жирных кислот.
13
14.
IY. Железопорфириновые комплексысодержат гем и входят в состав ферментовгеминовой природы (каталаза, пероксидаза,
цитохромы и др.).
14
15.
Основные ( общие ) свойства ферментов:1. Термолабильность - зависимость активности от Т0
Оптимальная- 37-420С. При ее повышении их
активность вначале повышается, затем снижается и
выше 700С идет тепловая денатурация (разрушение)
фермента.
При ее снижении их активность снижается и ниже
600С обратимо прекращается. С повышением Т0 их
активность восстанавливается!
15
16.
2. Специфичность субстратная - это избирательноедействие фермента на определенный субстрат.
а) групповая - фермент катализирует реакцию с
группой субстратов ( липаза)
б) индивидуальная - катализирует реакции с
одним субстратом (амилаза, уреаза)
в) структурная ( стереохимическая) - катализирует
реакции с одним стереоизомером (оксидаза -Lам/к-т)
3. Влияние рН - максимальная активность ферм.
проявляется при определенном рН ( Напр. пепсин
рН - 1-2, трипсин рН - 8-9, амилаза рН -6-7)
16
17.
4. Активаторы и ингибиторы ферментовАктиваторы- в-ва повышающие активность ферментов или
превращающие профермент в фермент
Напр: NaCl для амилазы или НCl для пепсиногена
Ингибиторы - в-ва снижающие активность или
прекращающие активность ферментов (парализаторы).
К парализаторам относятся соли тяжелых металлов, сильные
к-ты и щелочи.
Существует 3 вида ингибирования (торможения)
Конкурентное ингибирование - это явления когда
ингибитор взаимодействуя с активным центром фермента,
препятствует образованию фермент-субстратного комплекса.
Напр: малоновая кислота тормозит окисление янтарной к-ты.17
18.
Неконкурентное ингибирование - при этом ингибиторвзаймодейтсвует уже с фермент-субстратным комплексом,
тормозя окончание реакции.
Напр: гепарин снижает активность тромбина,
препятствуя свертыванию крови
Аллостерическое ингибирование (торможение) - при
этом ингибитор присоединяется не к активному центру
фермента, а в другом месте (Allos - другой), изменяя его
третичную структуру.
Напр.: так действуют гормоны.
18
19.
Механизм действия ферментов1. Теория снижения энергии активации. Хим. реакция
начинается при наличии химически активных молекул.
Энергия активации - количество энергии в Дж, кот.
необходима для перевода всех молекул 1 моля в-ва, в хим.
активное состояние. Напр: для гидролиза сахарозы серной ктой нужно 134,4 кДж/моль, а с ферм. сахаразой 40,4 кДж/моль
2. Теория промежуточных соединений
Установлено, что фермент(Е)
вступает во временное
соединение с субстратом (S) с образованием ферментсубстратного комплекса (ЕS), который переходит в
нестабильное состояние (SЕ) и распадается с образованием
продуктов реакции по схеме:
Е+S
ЕS
Адсорбционная
SР
теория.
Е+Р
Реагирующие
в-ва
адсорбируются на ферменте и с повышением их
концентрации увеличивается скорость реакции.
19
3.
20.
Международная классификация ферментовКлассы ферментов:
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (синтетазы)
20
21.
Классыподразделяются
на:
подклассы,
подподкласы
и
порядковый номер в подподклассе.
Шифр фермента - четырехзначный код, в
котором первая цифра - класс, втораяподкласс, третья- подподкласс, четвертая порядковый номер в подподклассе.
Например:
1.1.1.1. - алкогольдегидрогеназа
3.1.1.3. - липаза
21
22.
Номенклатура - это различные названия ферментов:1. Рациональная ( рабочая) - к латинскому корню
названия субстрата добавляется окончание «аза» (липаза).
2. Систематическая - включает 3 части:
а) рациональное название главного субстрата;
б) кофермент;
в) характер катализируемой реакции.
Напр: лактат: НАД - оксидоредуктаза
22
23.
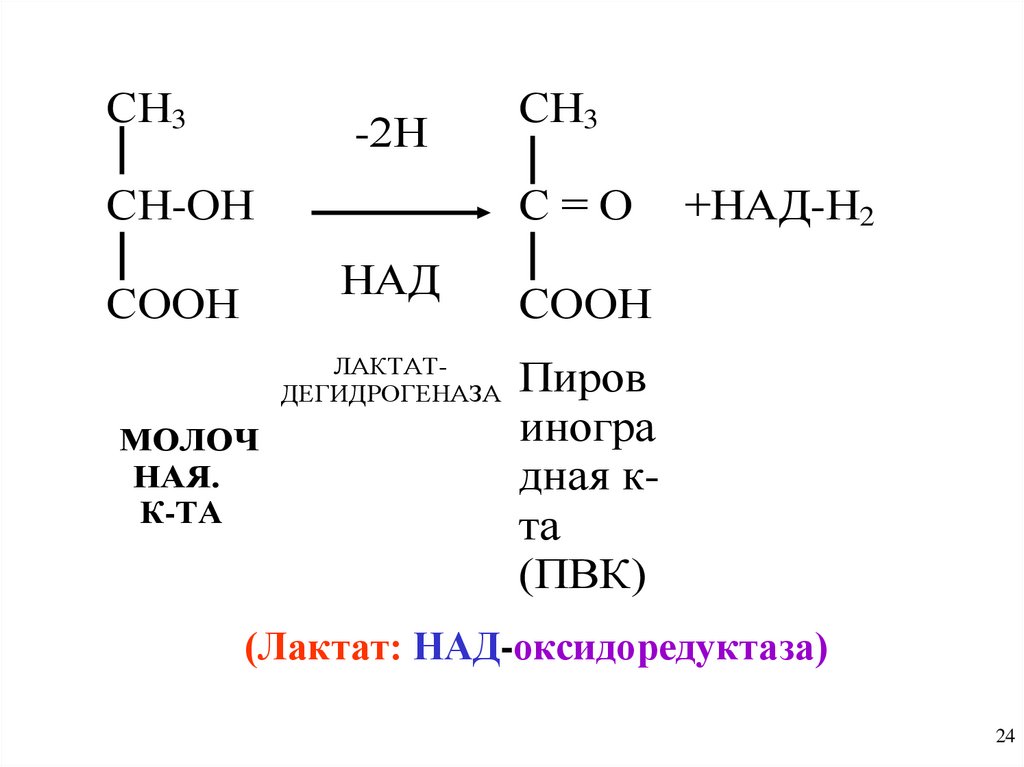
Характеристика отдельных классовферментов
1. Класс ОКСИДОРЕДУКТАЗЫ - катализируют
окислительно-восстановительные реакции (ОВР)
Имеется 17 подклассов
а) Анаэробные дегидрогеназы - переносят Н2
от субстрата на другое соединение ( не на О2)
Напр. лактатдегидрогеназа
23
24.
СН3-2Н
СН-ОН
С=О
НАД
СООН
ЛАКТАТДЕГИДРОГЕНАЗА
МОЛОЧ
НАЯ.
К-ТА
СН3
+НАД-Н2
СООН
Пиров
иногра
дная кта
(ПВК)
(Лактат: НАД-оксидоредуктаза)
24
25.
б) аэробные дегидрогеназы (оксидазы) - переносят Н2 отсубстрата на О2
СН3
СН-NН2
-2Н
СН3
С = NН +ФАД-Н2 +О2 ФАД+Н2О2
СООН
ФАД СООН
АЛА
Оксидаза ИМИНОК-ТА
L-аминок-т
25
26.
в) ферменты содержащие гем (геминовые природы),участвуют в переносе электронов.
Это цитохромы а, в, с, цитохромоксидаза,
каталаза и пероксидаза.
2Н2О2
каталаза
2Н2О + О2
Н2О2
пероксидаза
Н2О + О
26
27.
2. Класс ТРАНСФЕРАЗЫ - катализируют реакциипереноса групп ( -NH2 , -СН3 , -H3PO4, )
и наз. аминотрансферазы, метилтрансферазы
фосфотрансферазы.
27
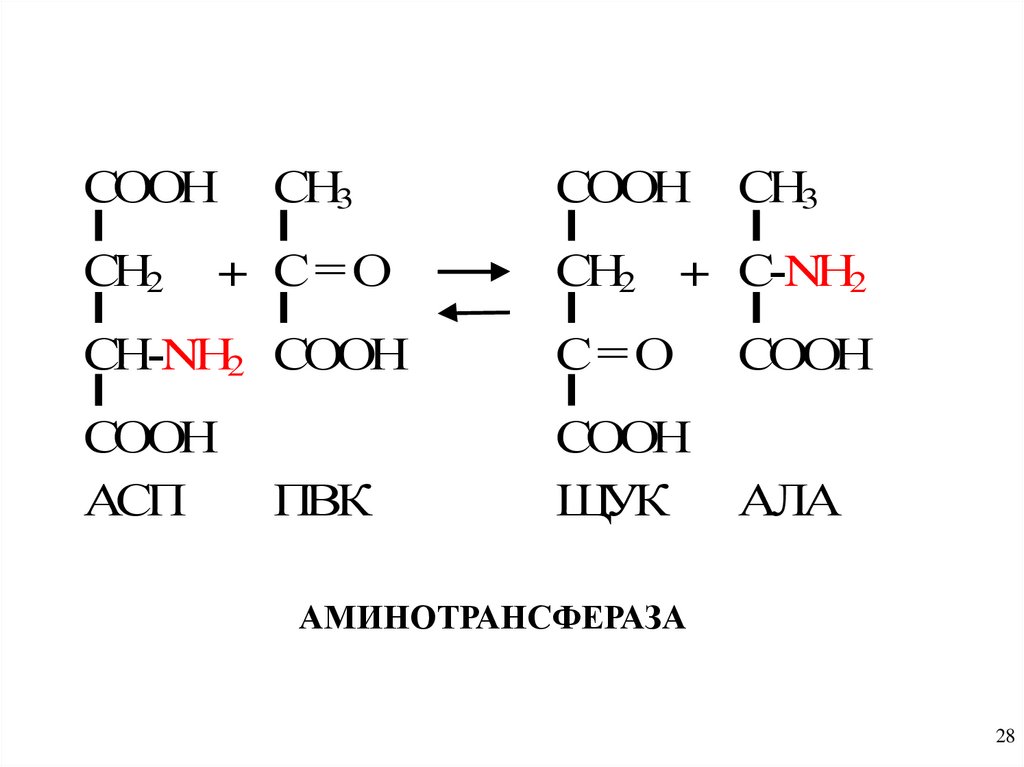
28.
СООНСН2
СН3
+ С= О
СООН
СН3
СН2 + С-NН2
СН-NН2 СООН
С= О
СООН
СООН
АСП
СООН
ЩУК
АЛА
ПВК
АМИНОТРАНСФЕРАЗА
28
29.
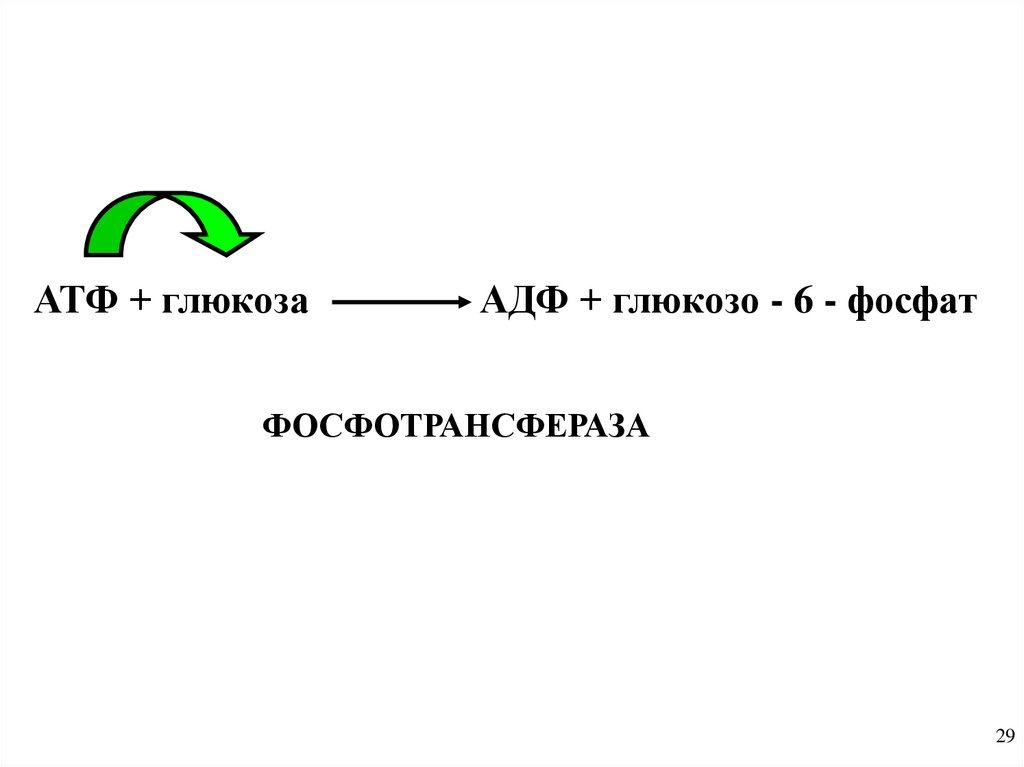
АТФ + глюкозаАДФ + глюкозо - 6 - фосфат
ФОСФОТРАНСФЕРАЗА
29
30.
3. Класс ГИДРОЛАЗЫ - катализируют разрыввнутримолекулярных связей
с присоединением Н2О
3.1. Эстеразы - разрывают эфирные связи
жир +3Н2О
глицерин +3 жир. к-ты
Липаза
3.2. Гликозидазы - гидролизуют гликозидные связи
углеводов
лактоза + Н2О
глюкоза + галактоза
лактаза
30
31.
4. Класс ЛИАЗЫ - катализируют отщепление отсубстратов негидролитическим путем
определенной группы с образованием двойной
связи (или присоединение группы к двойной
связи) с разрывом связей С - С, С - N, С - S,
С-О
31
32.
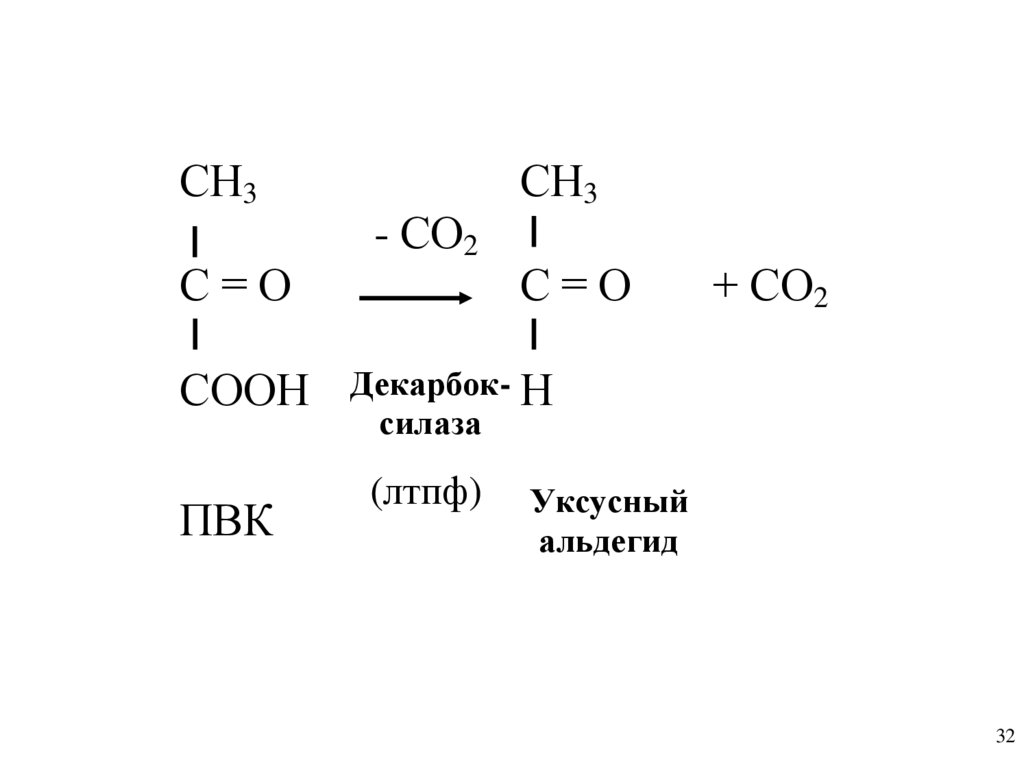
СН3С=О
СООН
ПВК
- СО2
СН3
С=О
+ СО2
Декарбок- Н
силаза
(лтпф)
Уксусный
альдегид
32
33.
5. Класс ИЗОМЕРАЗЫ - катализируютреакции
изомеризации(внутримолекулярного
переноса групп атомов)
ФРУКТОЗО - 6 -ФОСФАТ
ГЛЮКОЗО - 6 ФОСФАТ
изомераза
33
34.
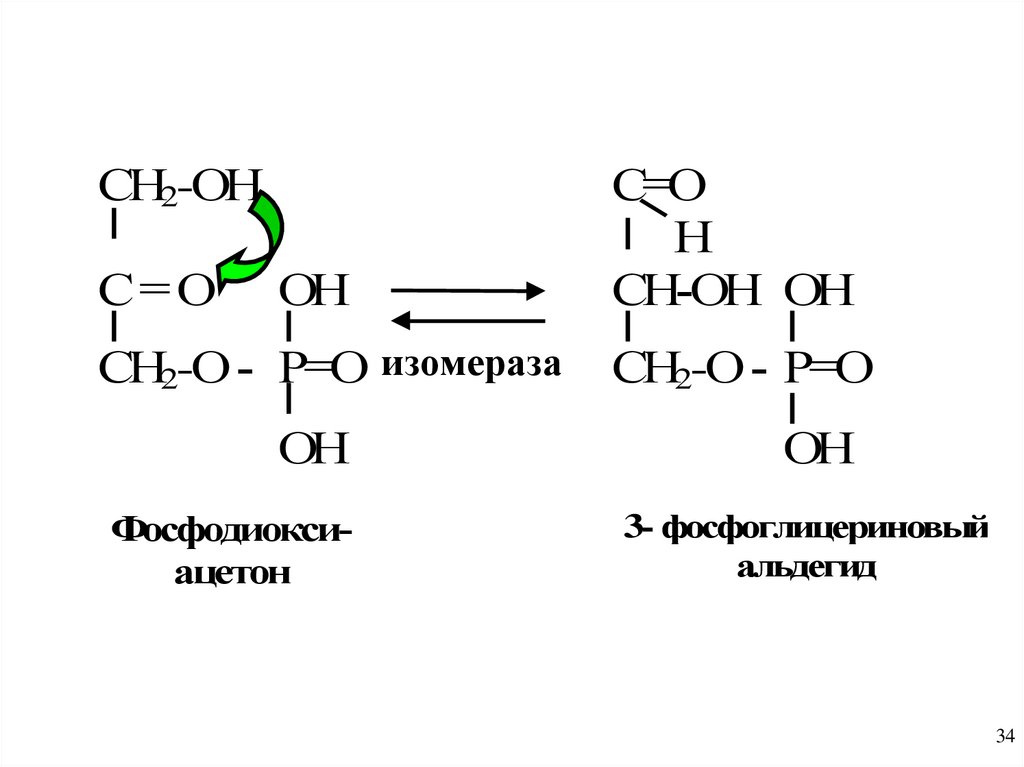
СН2-ОНОН
С=О
Н
СН-ОН ОН
СН2-О - Р=О изомераза
СН2-О - Р=О
С= О
ОН
Фосфодиоксиацетон
ОН
3- фосфоглицериновый
альдегид
34
35.
6. Класс ЛИГАЗЫ (СИНТЕТАЗЫ) - катализируютприсоединение друг к другу 2-х молекул, с
образованием связей С - С, С - N, С - S, С - О и
использованием энергии АТФ
СН3СООН + КоА-SН + АТФ
СН3СО-S-КоА + АМФ +Р-Р
ацетил-КоА-синтетаза
35
36.
Применение ферментов1. С диагностической и лечебной целью:
а) в прединфарктном состоянии повышается активность
аминотрансфераз, а при гепатите в крови снижается
активность амилазы.
б) пепсин назначается при заболевании желудка,
а фибринолизин - для разрушения тромбов после инсульта
2. В кормлении животных применяется:
Амилосубтилин Г 3х – сод. активную амилазу
Протосубтилин Г 3х – сод. активную протеазу
добавляют их к комбикормам 0,5 кг на 1 т.
36

























 Биология
Биология








