Похожие презентации:
Фосфор и его соединения
1.
Фосфори его соединения
2.
Открытие фосфораГамбургский алхимик Хеннинг Бранд
1669 год
«Фосфор» - от греческого «светоносный»
3.
Общая характеристика фосфора-3
PH3
Na3P
0
P
+3
P2O3
+5
P2O5
H3PO3
H3PO4
фосфористая
ортофосфорная
HPO3
метафосфорная
H2P2O7
пирофосфорная
4.
Аллотропные модификации фосфораБЕЛЫЙ
ЧЕРНЫЙ
КРАСНЫЙ
5.
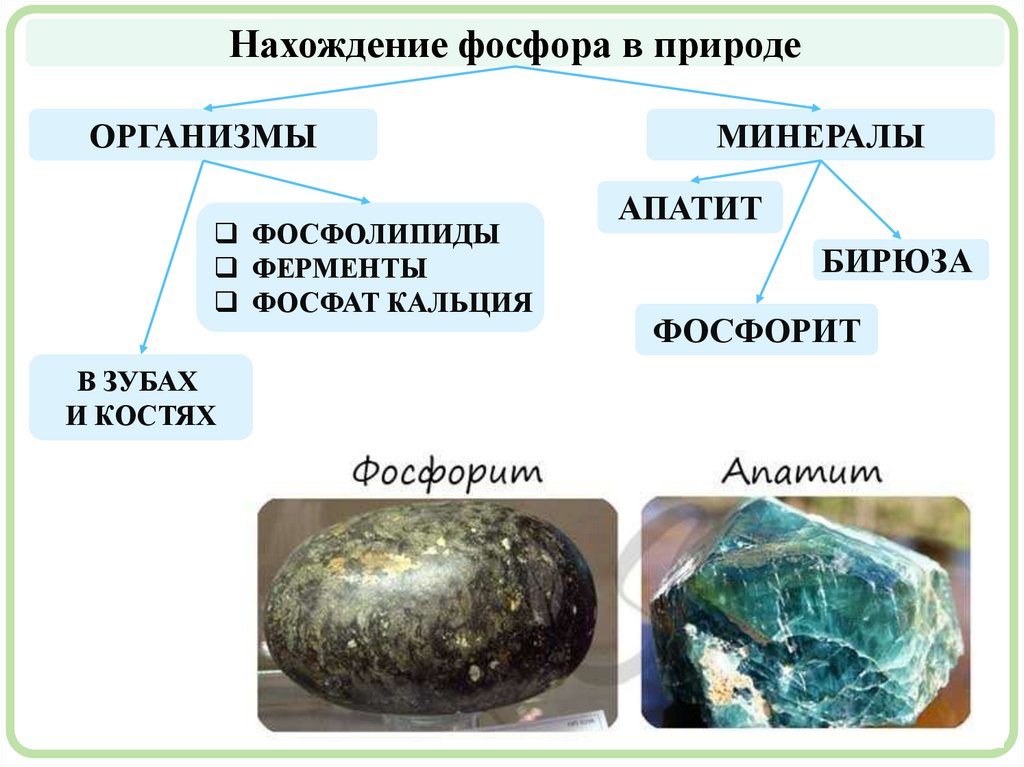
Нахождение фосфора в природеОРГАНИЗМЫ
ФОСФОЛИПИДЫ
ФЕРМЕНТЫ
ФОСФАТ КАЛЬЦИЯ
В ЗУБАХ
И КОСТЯХ
МИНЕРАЛЫ
АПАТИТ
БИРЮЗА
ФОСФОРИТ
6.
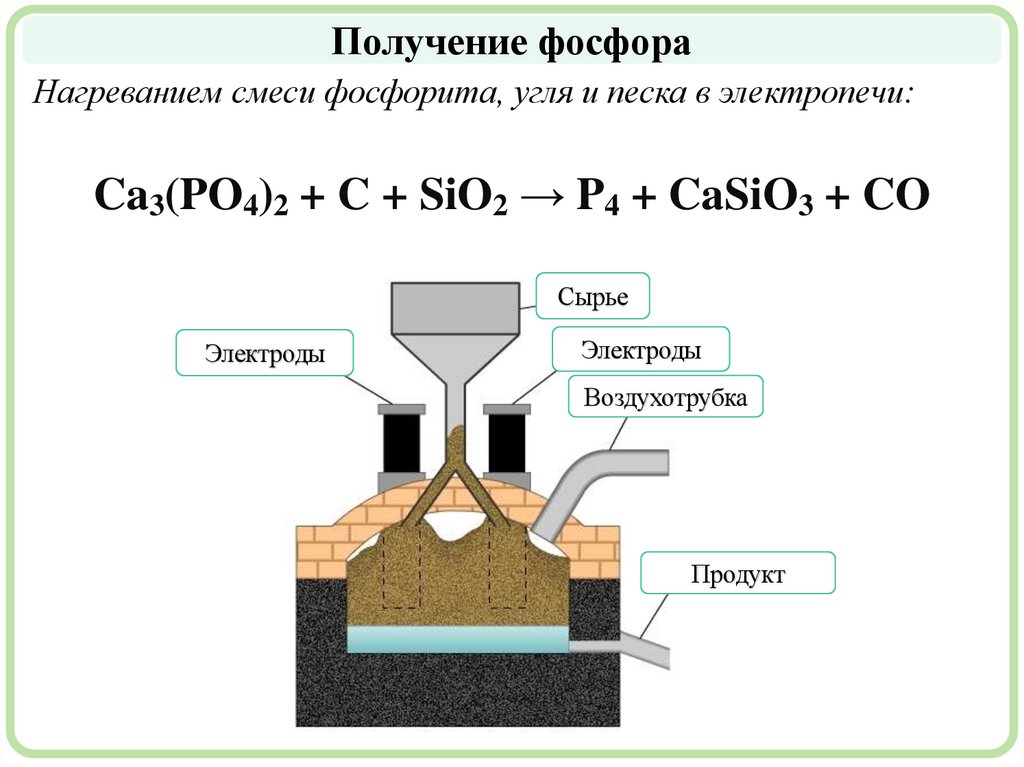
Получение фосфораНагреванием смеси фосфорита, угля и песка в электропечи:
Ca3(PO4)2 + C + SiO2 → P4 + CaSiO3 + CO
Сырье
Электроды
Электроды
Воздухотрубка
Продукт
7.
Химические свойства фосфорас металлами
с неметаллами
4P + 5O2 → 2P2O5
3Ca + 2P → Сa3P2
2P + 3S → P2S3
с бертолетовой солью
При ударе взрывается, воспламеняется:
5KClO3 + 6P → 3P2O5 + 5KCl
8.
Оксид фосфора (V)Получение
4P + 5O2 → 2P2O5
Химические свойства
Оксид фосфора (V) – это кислотный оксид,
• взаимодействует с водой, при обычных условиях (без нагревания),
образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O → HPO3
• при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O → 2H3PO4
Применение
Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает
воду от других соединений. Применяется как осушитель газов и
жидкостей.
9.
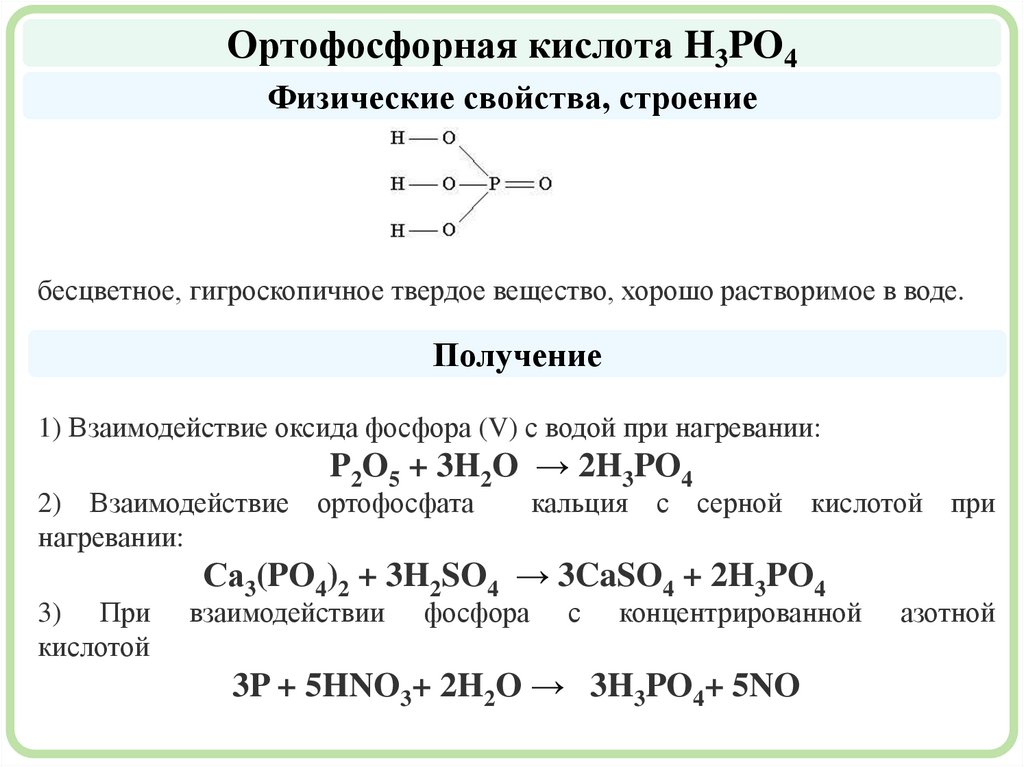
Ортофосфорная кислота H3PO4Физические свойства, строение
бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение
1) Взаимодействие оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O → 2H3PO4
2) Взаимодействие ортофосфата
нагревании:
3) При
кислотой
кальция с серной кислотой при
Сa3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
взаимодействии
фосфора
с
концентрированной
3P + 5HNO3+ 2H2O → 3H3PO4+ 5NO
азотной
10.
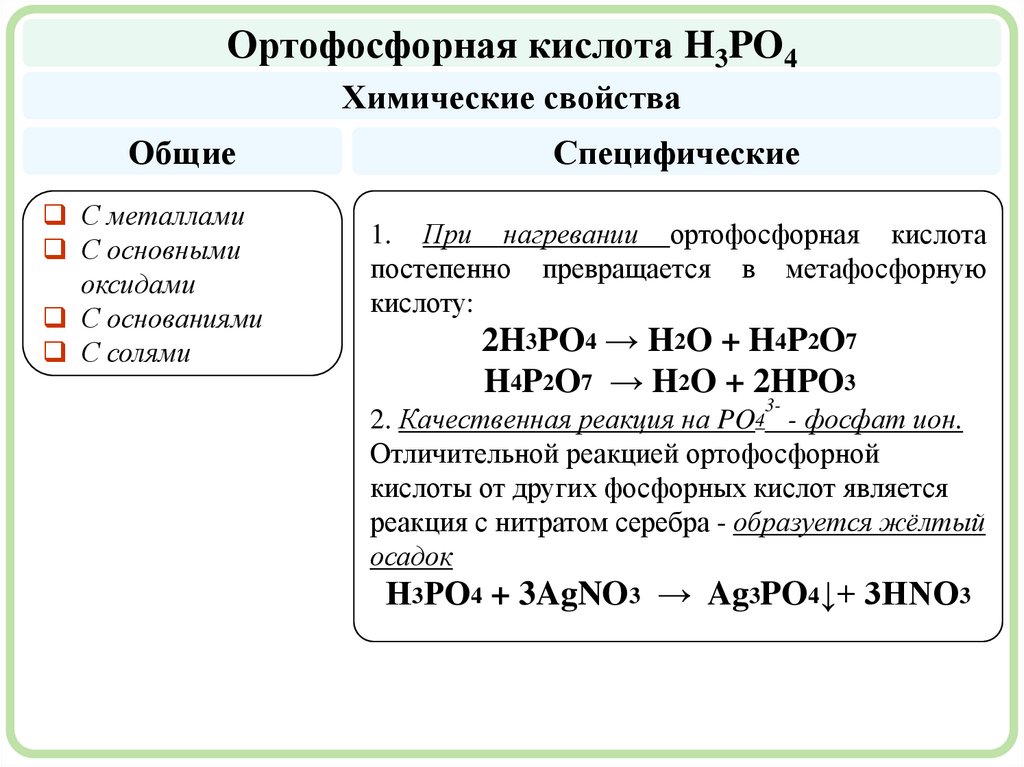
Ортофосфорная кислота H3PO4Химические свойства
Общие
С металлами
С основными
оксидами
С основаниями
С солями
Специфические
1. При нагревании ортофосфорная кислота
постепенно превращается в метафосфорную
кислоту:
2H3PO4 → H2O + H4P2O7
H4P2O7 → H2O + 2HPO3
3-
2. Качественная реакция на PO4 - фосфат ион.
Отличительной реакцией ортофосфорной
кислоты от других фосфорных кислот является
реакция с нитратом серебра - образуется жёлтый
осадок
Н3РО4 + 3AgNO3 → Ag3PO4↓+ 3HNO3
11.
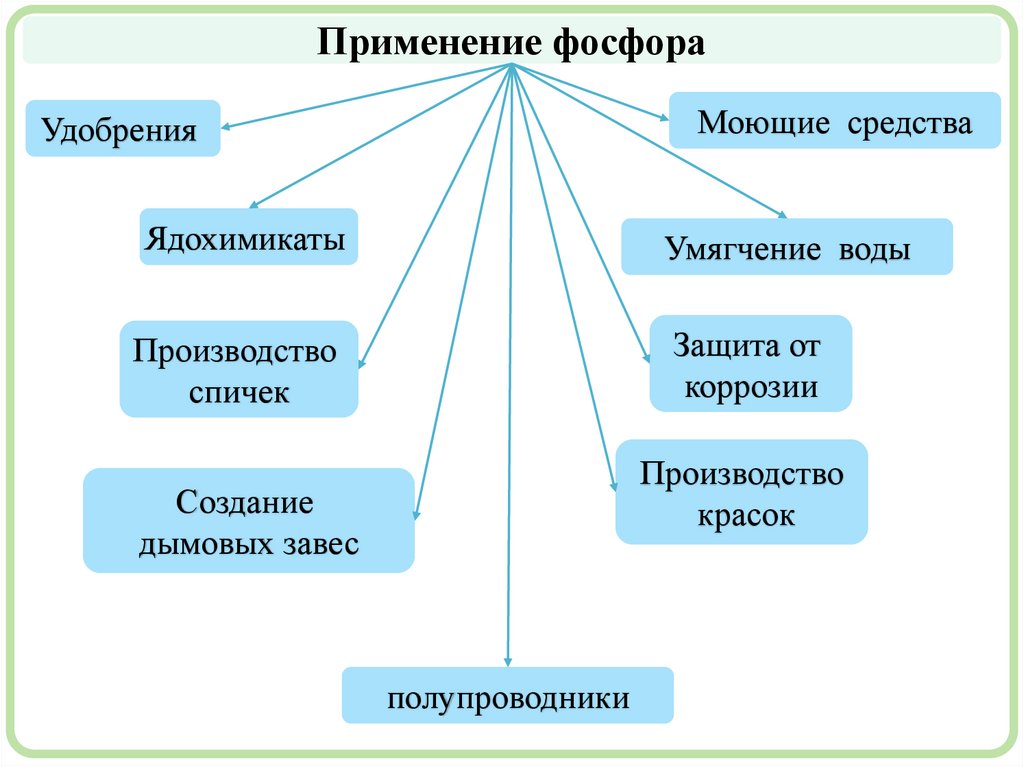
Применение фосфораМоющие средства
Удобрения
Ядохимикаты
Умягчение воды
Производство
спичек
Защита от
коррозии
Производство
красок
Создание
дымовых завес
полупроводники





 Химия
Химия








