Похожие презентации:
Органическая химия Лекция №1 Предельные соединения Алканы – номенклатура , получение, химические свойства
1.
Органическая химияЛекция №1
Предельные соединения
Алканы – номенклатура , получение,
химические свойства
2.
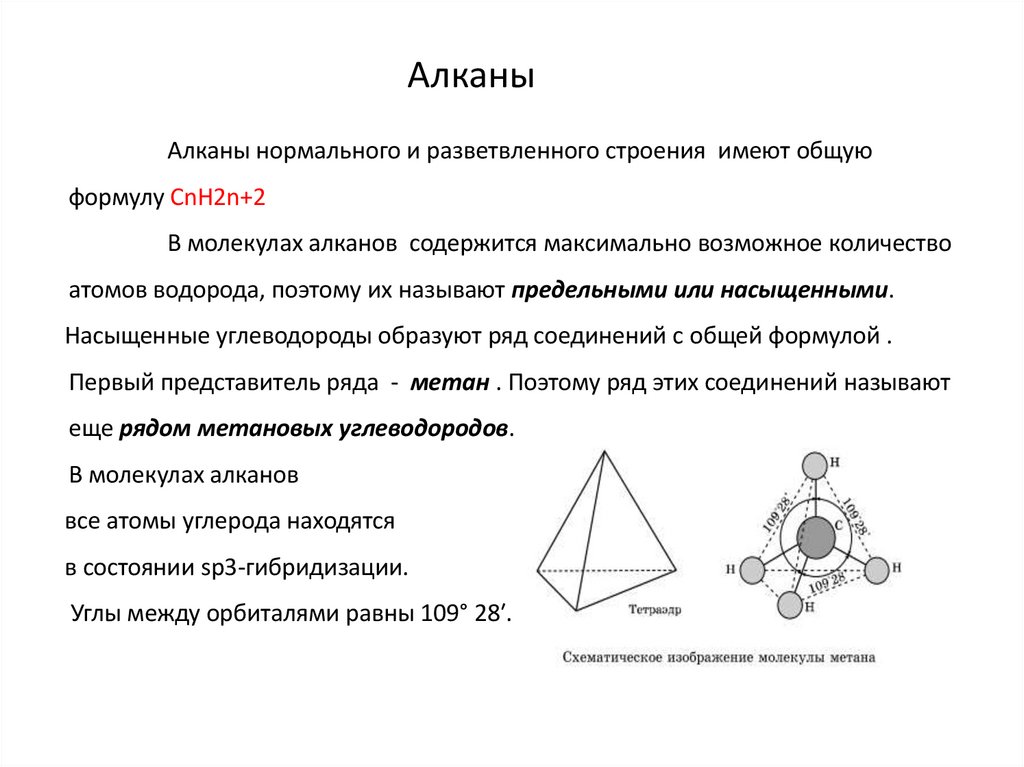
АлканыАлканы нормального и разветвленного строения имеют общую
формулу СnH2n+2
В молекулах алканов содержится максимально возможное количество
атомов водорода, поэтому их называют предельными или насыщенными.
Насыщенные углеводороды образуют ряд соединений с общей формулой .
Первый представитель ряда - метан . Поэтому ряд этих соединений называют
еще рядом метановых углеводородов.
В молекулах алканов
все атомы углерода находятся
в состоянии sр3-гибридизации.
Углы между орбиталями равны 109° 28′.
3.
Алканы• Все связи в молекулах предельных углеводородов
одинарные.
• Перекрывание происходит по оси, соединяющей ядра
атомов, т. е. это σ-связи.
• Связи углерод — углерод являются неполярными и плохо
поляризуемыми.
• Длина С—С связи в алканах равна 0,154 нм (1,54 • 10—10
м). Связи С—Н несколько короче.
• Электронная плотность немного смещена в сторону более
электроотрицательного атома углерода, т. е. связь С—Н
является слабополярной.
4.
Изомерия и номенклатура• Для алканов характерна - структурная
изомерия.
• Структурные изомеры отличаются друг от друга
строением углеродного скелета.
• Простейший алкан, для которого характерны
структурные изомеры — это бутан.
5.
Номенклатура1. Выбор главной цепи.
2. Нумерация атомов
главной цепи.
3. Формирование
названия ряда метана
6.
Физические свойства алкановАлканы, наряду с другими углеводородами (циклоалканами и аренами),
входят в состав нефти и подразделяются в зависимости от числа атомов
углерода на следующие группы:
1. Газообразные алканы соства С1-С4 содержатся в газообразной
фракции нефти;
2. Жидкие алканы от С5 до С10 входят в состав бензиновых фракций
3. Углеводороды С11-С20 входят в состав средних фракций нефти (с
темпе-ратурой кип 180-3500С)
4. Твердые алканы С16
7.
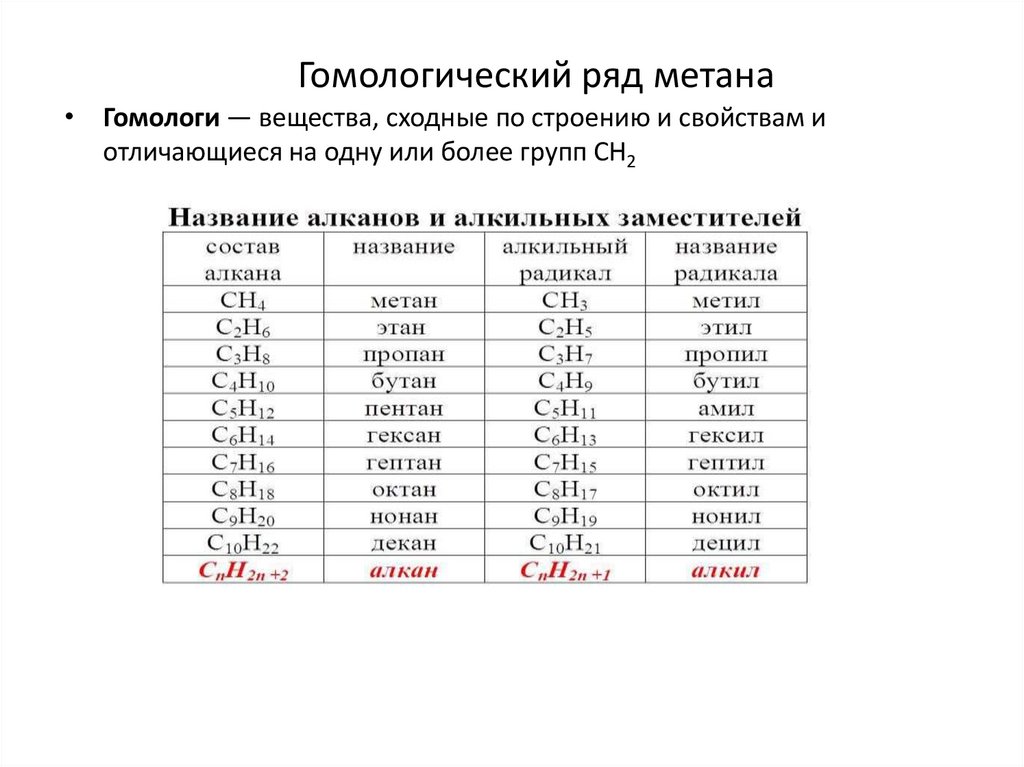
Гомологический ряд метана• Гомологи — вещества, сходные по строению и свойствам и
отличающиеся на одну или более групп СН2
8.
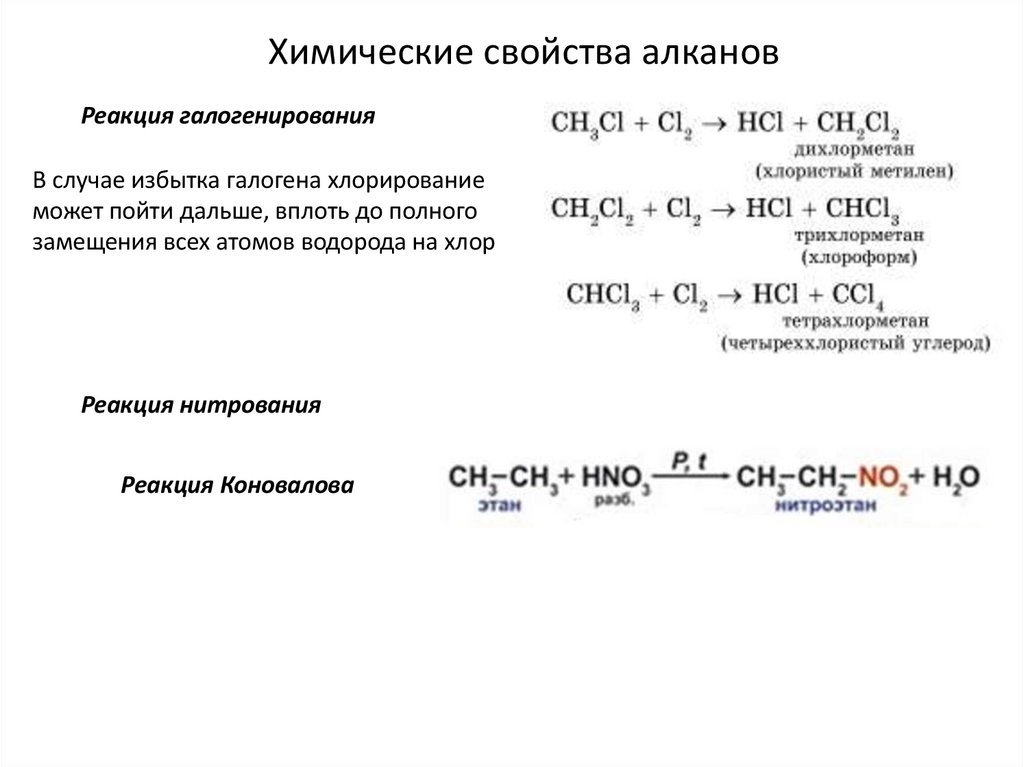
Химические свойства алкановРеакция галогенирования
9.
Химические свойства алкановРеакция галогенирования
В случае избытка галогена хлорирование
может пойти дальше, вплоть до полного
замещения всех атомов водорода на хлор
Реакция нитрования
Реакция Коновалова
10.
Химические свойства алкановРеакция дегидрирования (отщепления водорода)
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой
температуре (400-600 °С) происходит отщепление молекулы водорода и образование
алкена
11.
Химические свойства алкановРеакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды.
Газообразные углеводороды, смешанные с воздухом в определенных
соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная
экзотермическая реакция
2. Термическое расщепление углеводородов
12.
Химические свойства алкановРеакции, сопровождающиеся разрушением углеродной цепи.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается
пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование
ацетилена
4. Изомеризация. При нагревании линейных углеводородов с катализатором
изомеризации (хлоридом алюминия) происходит образование веществ с
разветвленным углеродным скелетом:
13.
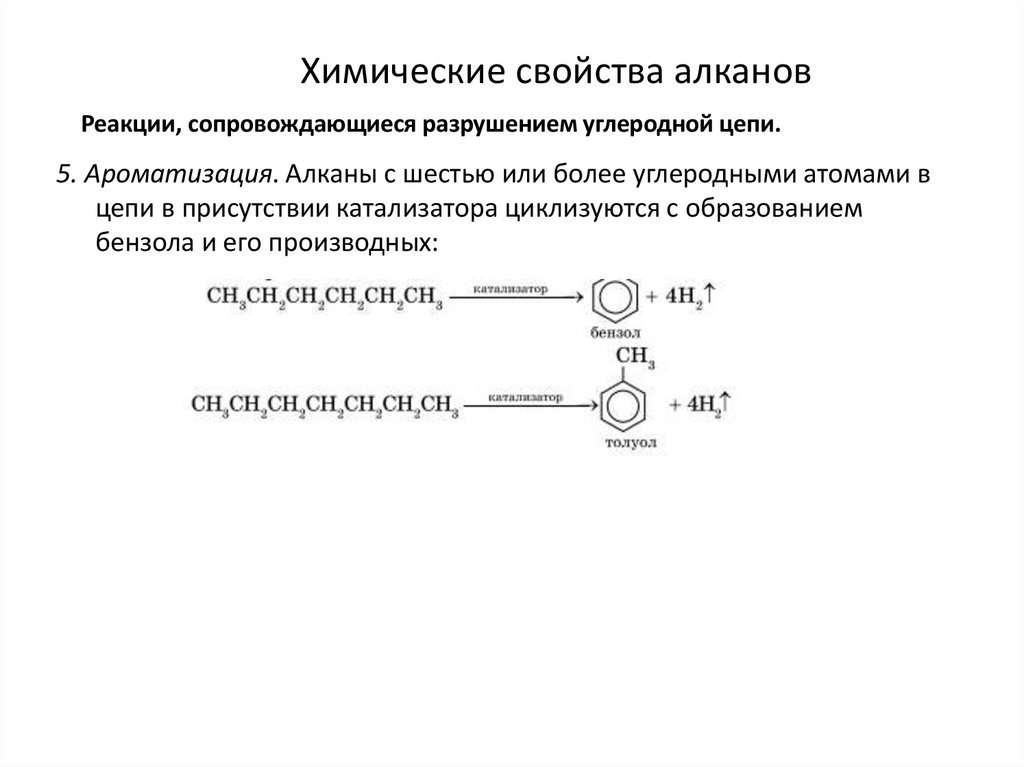
Химические свойства алкановРеакции, сопровождающиеся разрушением углеродной цепи.
5. Ароматизация. Алканы с шестью или более углеродными атомами в
цепи в присутствии катализатора циклизуются с образованием
бензола и его производных:










 Химия
Химия








