Похожие презентации:
Периодический закон, Периодическая система химических элементов Д.И. Менделеева и строение атома
1.
Раздел 1. Общая и неорганическая химияТема 1.2 Периодический закон, Периодическая
система химических элементов Д.И. Менделеева и
строение атома
Практическая работа 2
Периодическая система химических
элементов Д.И. Менделеева
2.
Цель:- овладение умением по моделированию периодической
таблицы
химических элементов;
- рассмотрение изменения химических свойств элементов и их
соединений
- построение строения атомов s, p, d – элементов на основании
их положения в Периодической системе Д.И. Менделеева в
зависимости от увеличения заряда ядра атома.
Задача: Закрепить знания по теме «Периодический закон Д.И.
Менделеева и периодическая система химических элементов».
Оборудование: Периодическая система химических
элементов Д.И.Менделеева, рисунки строения s, p, d элементов.
3.
Основные теоретические сведенияД.И. Менделеев определил, что свойства химических элементов и
образованных ими соединений находятся в периодической зависимости от их
атомных весов, т.е. общее у всех элементов – атомная масса. Изучение строение
атома вскрыло глубокий физический смысл периодического закона. Главной
характеристикой атома является не атомная масса, а заряд ядра атома. Теория
строения атомов объясняет периодическое изменение свойств элементов. Таким
образом, современная формулировка закона: Свойства химических элементов и
их соединений находятся в периодической зависимости от заряда ядра атома.
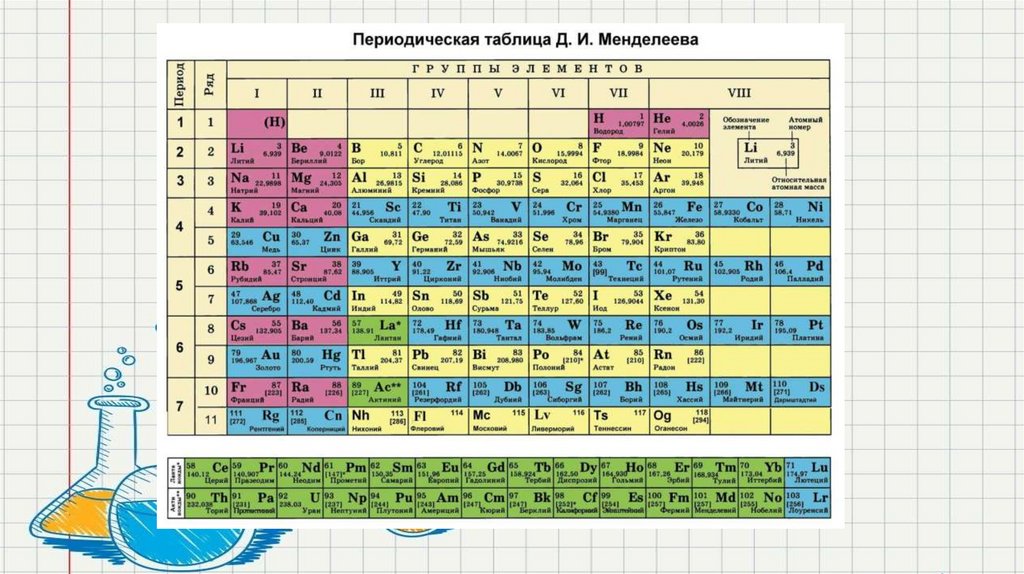
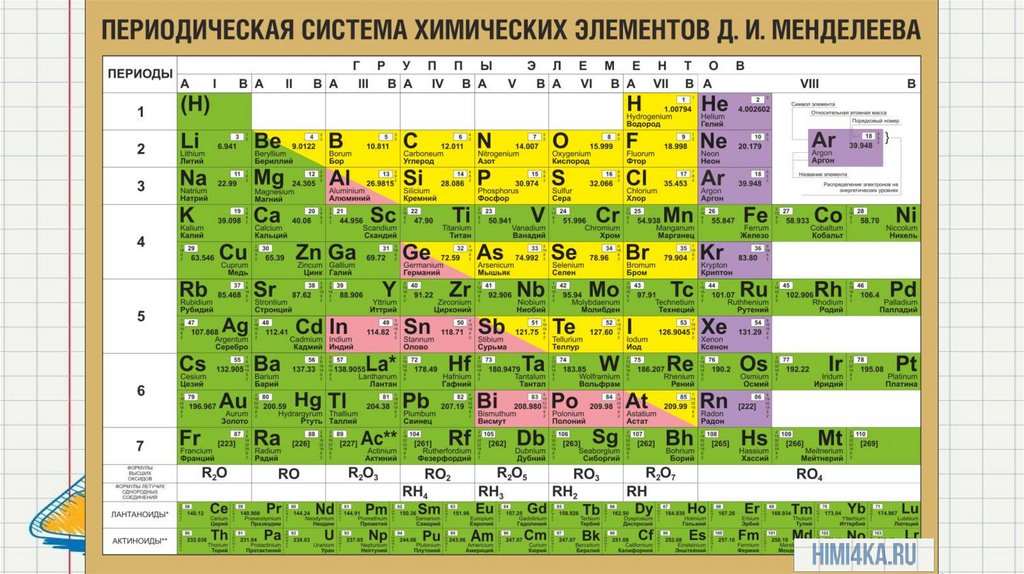
Периодический закон записан графически в виде таблицы.
Периодическая таблица химических элементов имеет горизонтальные ряды –
периоды, в которых прослеживается периодичность изменения свойств
элементов от металлических свойств к неметаллическим свойствам и свойств их
соединений от основных – амфотерных – к кислотным. А также вертикальные
ряды – группы, в которых объединены химические элементы, соединения
которых имеют сходные свойства.
4.
5.
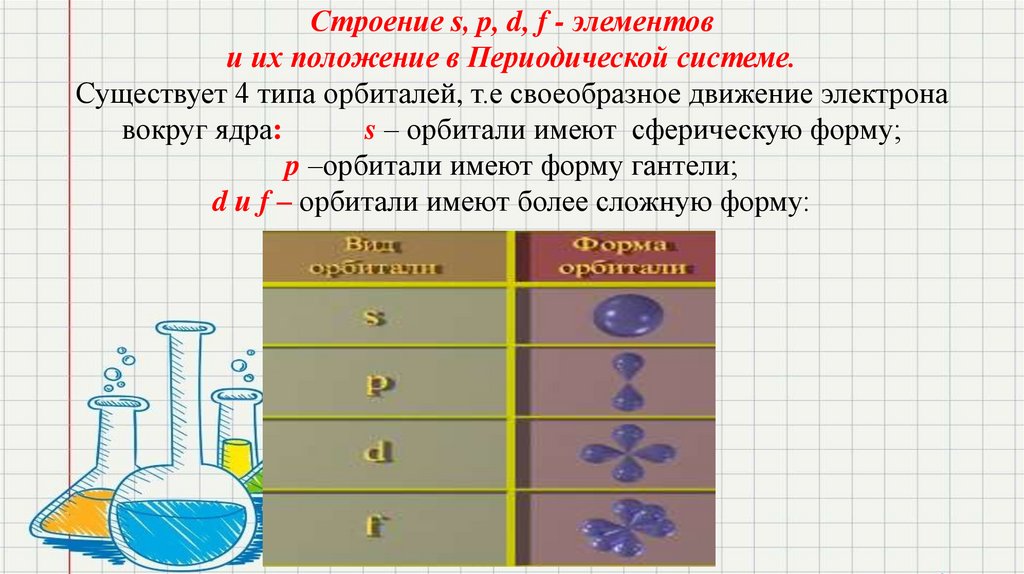
Строение s, p, d, f - элементови их положение в Периодической системе.
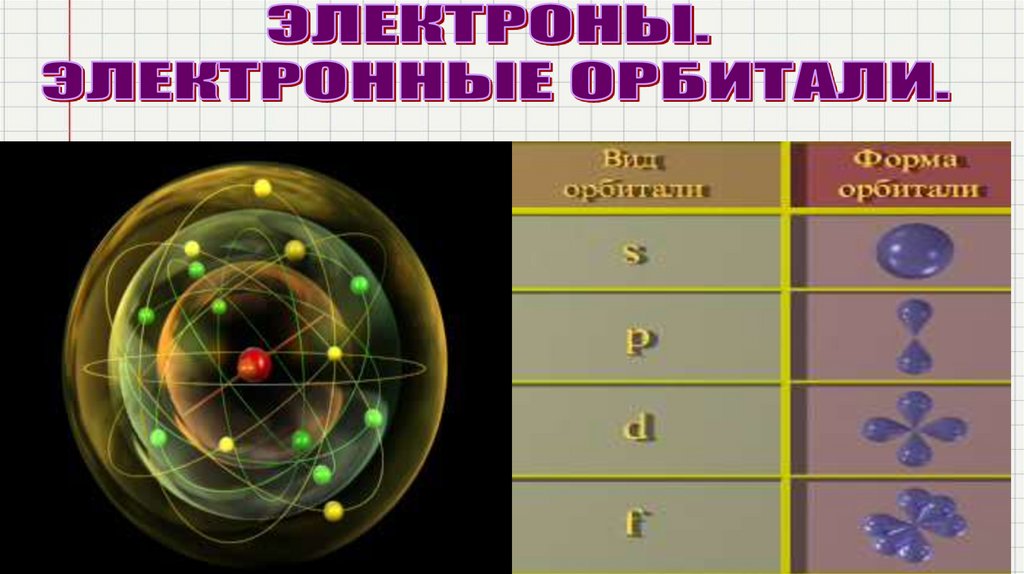
Существует 4 типа орбиталей, т.е своеобразное движение электрона
вокруг ядра:
s – орбитали имеют сферическую форму;
p –орбитали имеют форму гантели;
d и f – орбитали имеют более сложную форму:
6.
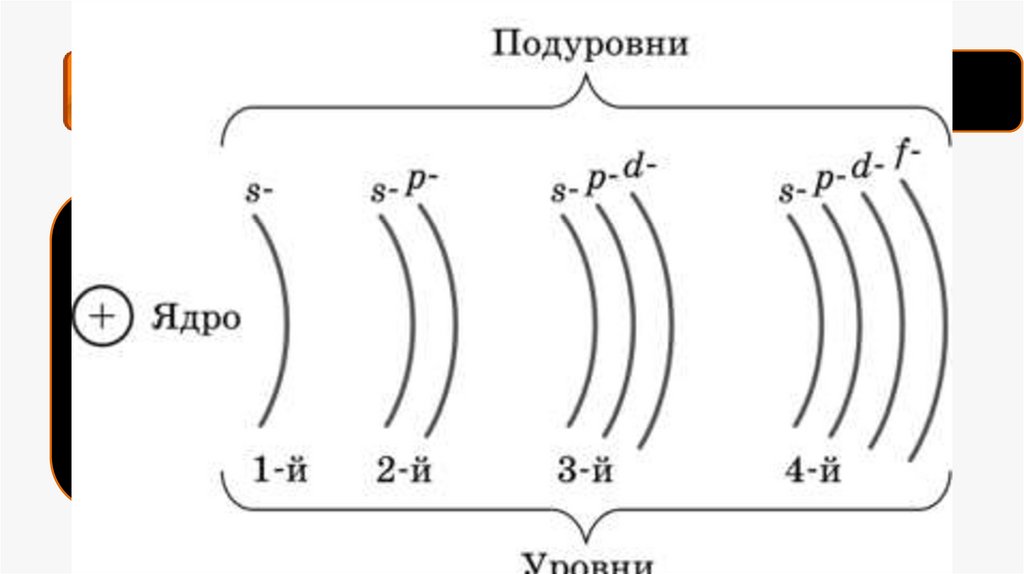
Каждую орбиталь могут занимать 2 электрона. Следовательно,максимальное число электронов, которые могут находиться на первом уровне
равно двум.
N=2 n2
где n-номер энергетического уровня, N-максимальное число электронов на
этом уровне.
На втором -8 (2 – на s – орбитали и 6 на р- орбитали).
На третьем - 18 электронов (2 на s, 6 на р, 10 на d и 14 на f).
В зависимости от того, на какую орбиталь отправлен последний
электрон, химические элементы можно разделить на семейства (блоки): s, p,
d, f.
К s-элементам относятся элементы I и II групп главных подгрупп, а также
гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f - элементам относятся лантаноиды и актиноиды.
7.
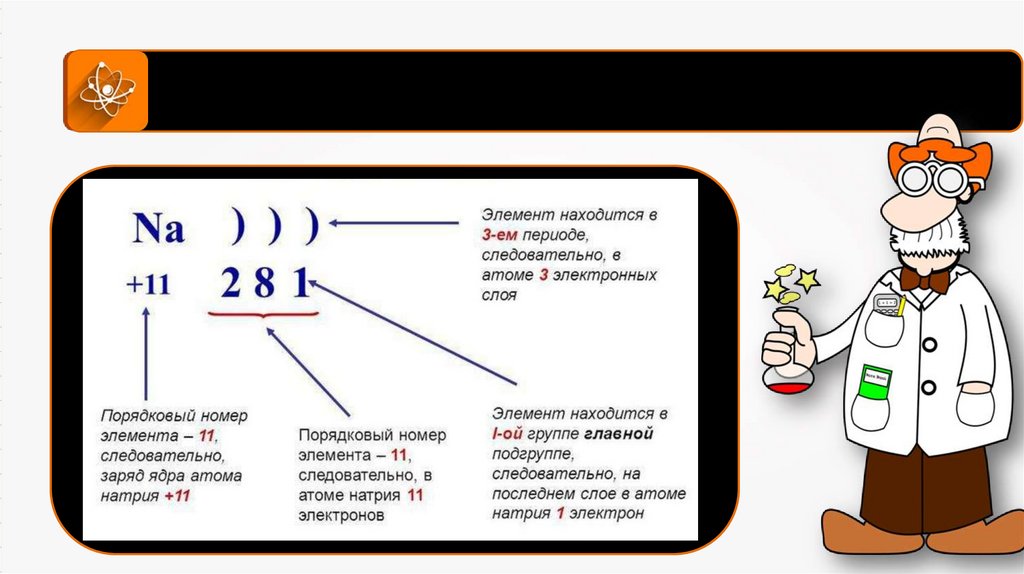
Схема написания атома по энергетическим уровням8.
9.
Схема написания атома по энергетическим уровням10.
11.
12.
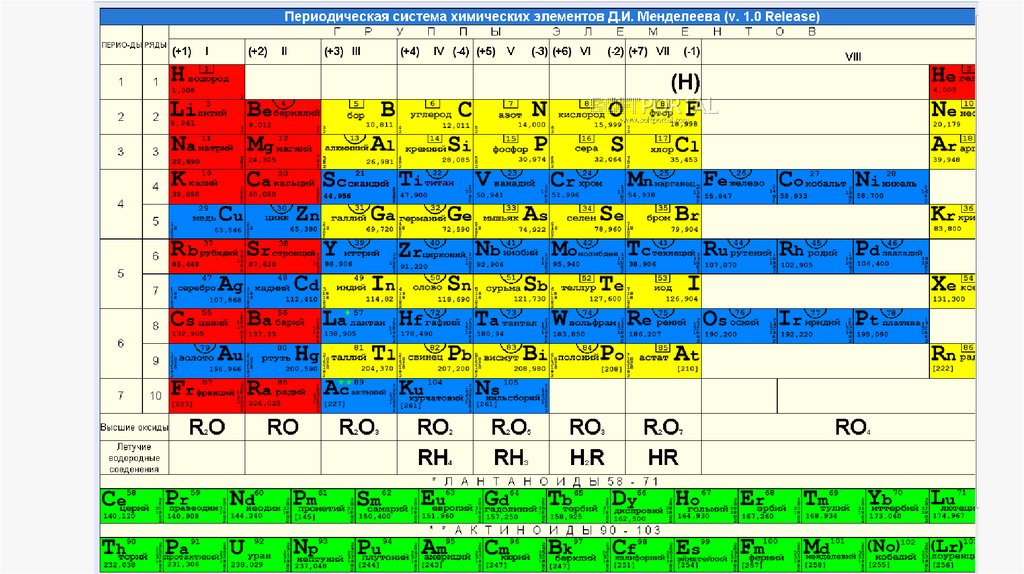
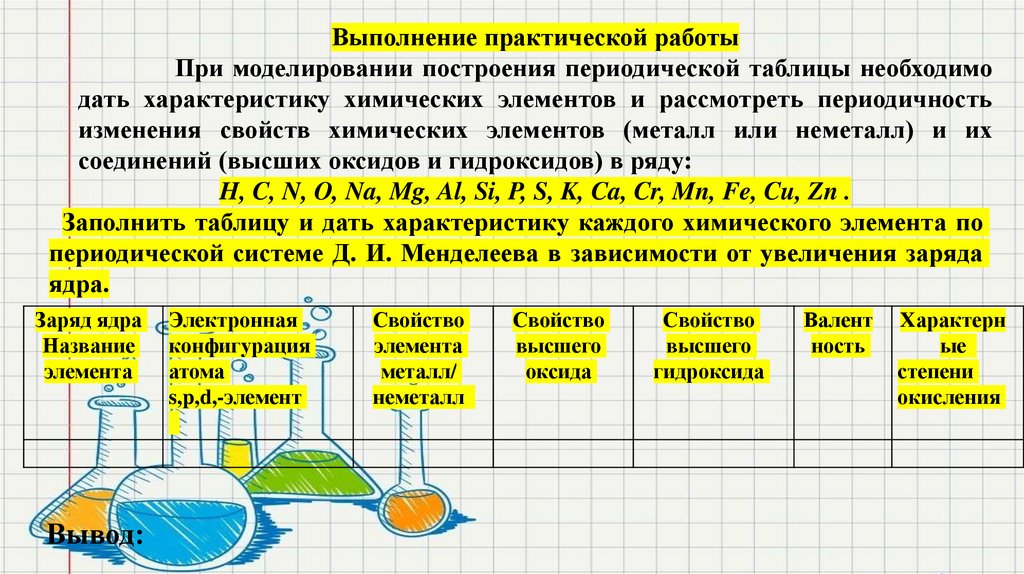
Выполнение практической работыПри моделировании построения периодической таблицы необходимо
дать характеристику химических элементов и рассмотреть периодичность
изменения свойств химических элементов (металл или неметалл) и их
соединений (высших оксидов и гидроксидов) в ряду:
H, C, N, O, Na, Mg, Al, Si, P, S, K, Ca, Cr, Mn, Fe, Cu, Zn .
Заполнить таблицу и дать характеристику каждого химического элемента по
периодической системе Д. И. Менделеева в зависимости от увеличения заряда
ядра.
Заряд ядра
Название
элемента
Вывод:
Электронная
конфигурация
атома
s,p,d,-элемент
Свойство
элемента
металл/
неметалл
Свойство
высшего
оксида
Свойство
высшего
гидроксида
Валент
ность
Характерн
ые
степени
окисления




 Химия
Химия








