Похожие презентации:
Соединительнотканные белки мяса
1. Соединительнотканные белки мяса
Самостоятельная работа:Состав и структура мукополисахаридов
Дополнительная литература:
1. В.И. Мазуров Биохимия коллагеновых волокон.- М, 1974
2. Л.В. Антипова Основы рационального использования вторичного
коллагеносодержаего сырья в мясной промышленности. Воронеж, 1997
3. Рогожин, В.В. Биохимия мышц и мяса / В.В.Рогожин. – СПб: ГИОРД. –
2006, С. 124-126
2.
Восновном соединительная ткань
представлена коллагеновыми и
эластиновыми волокнами, и
промежуточным веществом.
Последнее состоит из
мукополисахаридов и
мукополисахарид-белковых комплексовслизистых белков, выполняющих
защитные функции и облегчающие
скольжение мышечных пучков.
В
зависимости от соотношения в составе
соединительной ткани коллагеновых и
эластиновых волокон и других
морфологических элементов различают
плотную, рыхлую и эластическую ткань.
3. Строение плотной соединительной ткани: 1 – коллагеновые волокна; 2 – ядро; 3 – клетка; 4 – эластиновые волокна
Плотная соединительнаяткань содержит в
основном коллагеновые
волокна. Она входит в
состав сухожилий,
связок, оболочки
мускулов и внутренних
органов, содержится в
шкуре. Она служит
главным образом для
соединения тканей и
мускулов между собой,
связывает шкуру с
поверхностной фасцией.
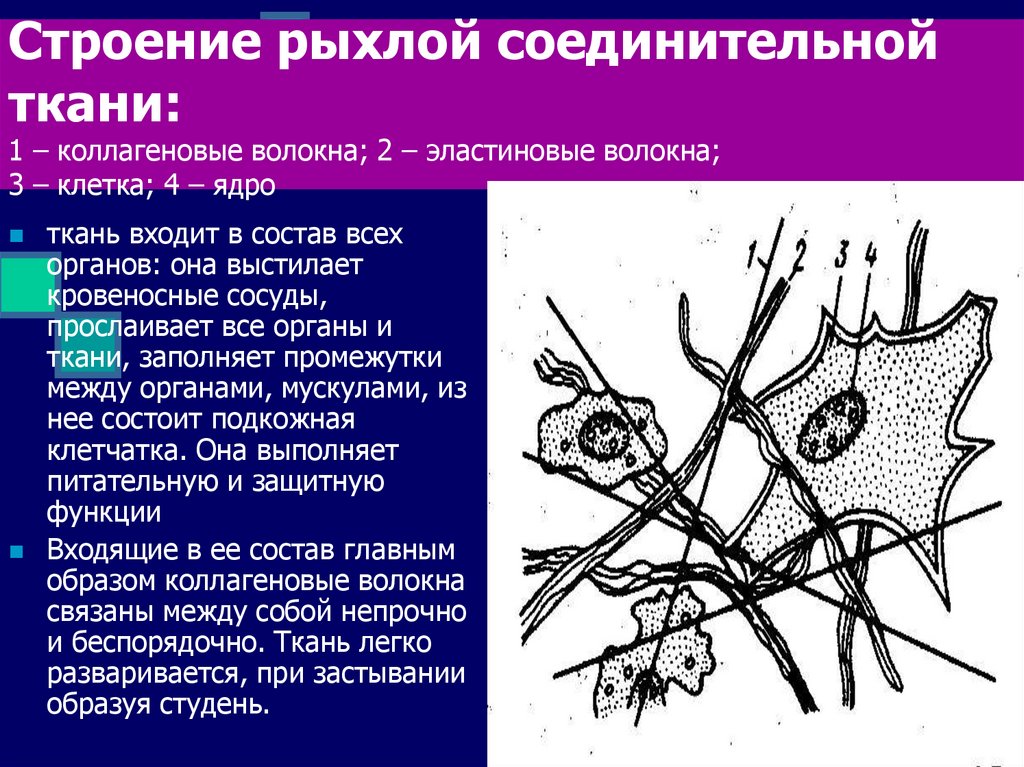
4. Строение рыхлой соединительной ткани: 1 – коллагеновые волокна; 2 – эластиновые волокна; 3 – клетка; 4 – ядро
ткань входит в состав всехорганов: она выстилает
кровеносные сосуды,
прослаивает все органы и
ткани, заполняет промежутки
между органами, мускулами, из
нее состоит подкожная
клетчатка. Она выполняет
питательную и защитную
функции
Входящие в ее состав главным
образом коллагеновые волокна
связаны между собой непрочно
и беспорядочно. Ткань легко
разваривается, при застывании
образуя студень.
5. Эластическая ткань
образуетвыйную связку, входит в
желтую фасцию живота и стенки
крупных кровеносных сосудов,
отличается малым содержанием
коллагеновых и большим количеством
эластиновых волокон, обладающих
способностью к растяжению.
Соединительная ткань, содержащая
эластичные волокна, очень твердая и
почти не поддается варке.
6. Белки стромы
коллаген, эластин, ретикулинЭти белки не растворяются в
водно-солевых растворах, а
извлекаются щелочными
растворами.
В коллагеновых волокнах содержится около 37
% сухого вещества, из которого до 36 %
составляют органические вещества, в
основном коллагена.
7. Коллаген – гликопротеид, основной белок соединительной ткани
неполноценен, снижает биологическую ценность,увеличивает жесткость мясного сырья
составляет около 30% всех белков животного
организма
не подвергается расщеплению пищеварительными
ферментами, нерастворим в водно-солевых
растворах, имеет высокую механическую
прочность
однако как с физиологической так и с
технологической точки зрения наличие в мясе до
10-15% соединительной ткани является
положительным
8. Технологическое значение
при достаточно высокой степени измельчения ипод воздействием термообработки коллаген
хорошо гидролизуется с образованием глютина и
желатоз, которые обладают выраженной
водосвязывающей и застудневающей
способностью, что позволяет частично
стабилизировать свойства готовых мясных
изделий.
при длительной выдержке в воде (особенно при
рН 5-7) –коллаген сильно набухает, его масса
увеличивается в 1,5-2 раза. В колбасном
производстве коллагенсодержащее сырье (свиная
шкурка) используется как компонент рецептур
низкосортных колбас)
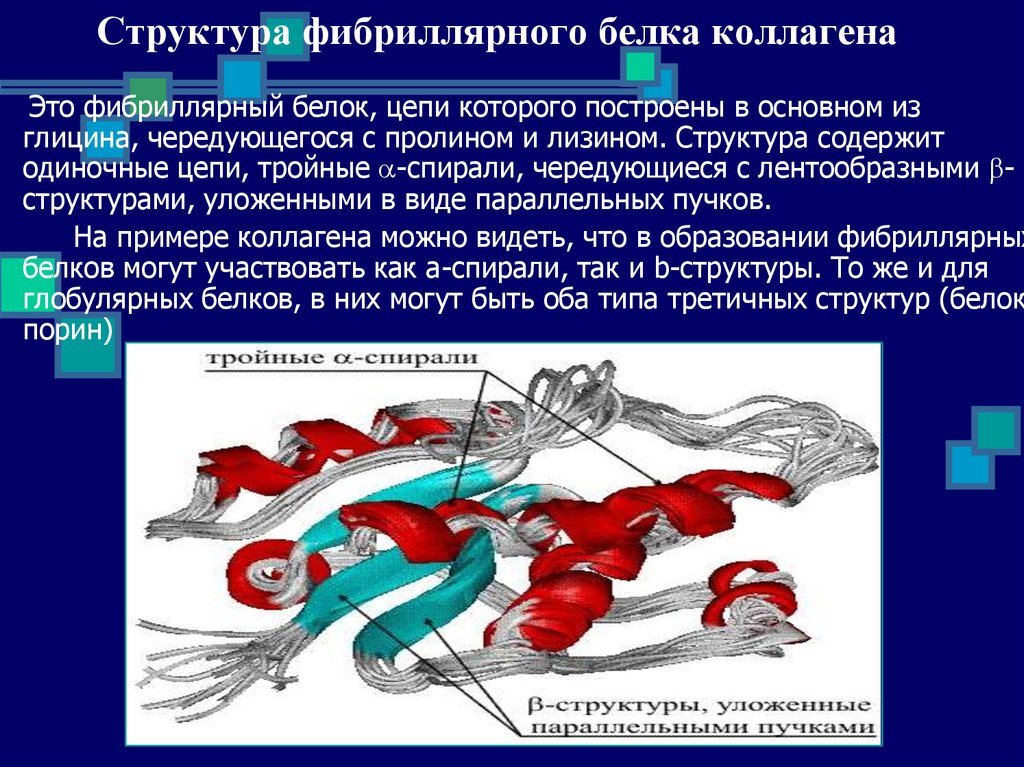
9. Структура фибриллярного белка коллагена
Это фибриллярный белок, цепи которого построены в основном изглицина, чередующегося с пролином и лизином. Структура содержит
одиночные цепи, тройные a-спирали, чередующиеся с лентообразными bструктурами, уложенными в виде параллельных пучков.
На примере коллагена можно видеть, что в образовании фибриллярных
белков могут участвовать как a-спирали, так и b-структуры. То же и для
глобулярных белков, в них могут быть оба типа третичных структур (белок
порин)
10. Установлено, что по глубине и характеру морфологических изменений в структуре соединительной ткани в процессе деструкции можно
выделить 4 стадии:1.Стадия набухания пучков
коллагеновых волокон,
характеризующаяся увеличением
объема пучков в результате
разрыхления компоновки
коллагеновых волокон, составляющих
пучок, связанная, в первую очередь, с
разрушением белковополисахаридных
комплексов
основного вещества;
2.Стадия деструкции коллагеновых
волокон, характеризующаяся
образованием взаимосвязанной сети,
сформированной из коллагеновых
фибрилл, разрушением взаимосвязи
коллагеновых фибрилл в волокне,
лизис ядер и клеток соединительной
ткани;
11.
3.Стадия деструкцииколлагеновых фибрилл, их
фрагментация;
4.Стадия лизиса
фрагментированных
коллагеновых фибрилл с
образованием
бесструктурной массы
глютина
12. Аминокислотный состав коллагена
Основными особенностями аминокислотного составаколлагена являются высокое содержание глицина; низкое
содержание тирозина и серусодержащих аминокислот;
отсутствие триптофана; наличие оксилизина и
оксипролина.
Анализируя данные аминокислотного состава различных
коллагенов, Eastoe, Leach (1958), обнаружили, что в
коллагене на каждые 3 аминокислотных остатка приходится
1 остаток глицина, на каждые 9 остатков — 1 остаток
аланина и 2 остатка пролина и оксипролина.
Следовательно, на эти 4 аминокислоты приходится по 2
остатка на каждые 3 и лишь 1/3 всей аминокислотной
последовательности полипептидных цепей составляют
остальные аминокислоты коллагена.
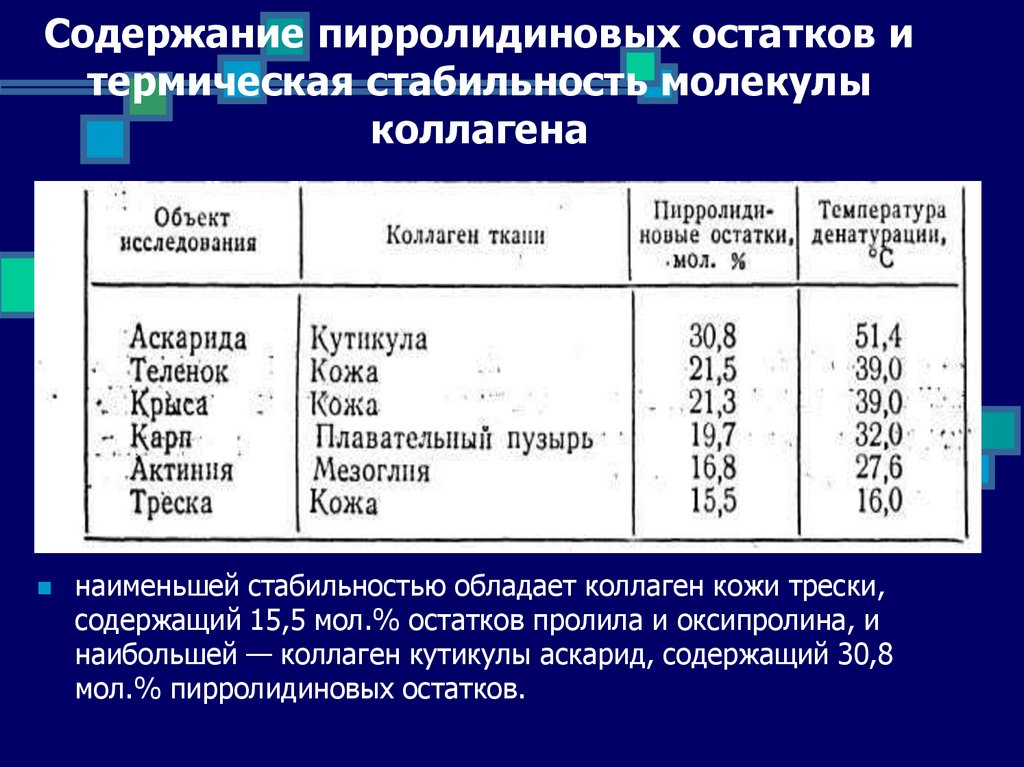
13. Содержание пирролидиновых остатков и термическая стабильность молекулы коллагена
наименьшей стабильностью обладает коллаген кожи трески,содержащий 15,5 мол.% остатков пролила и оксипролина, и
наибольшей — коллаген кутикулы аскарид, содержащий 30,8
мол.% пирролидиновых остатков.
14.
Коллагенобразует нити (фибриллы)
различной толщины. Расположение нитей
определяет их функцию, которая состоит
главным образом в придании тканям
прочности на разрыв. Коллагеновые нити
образованы субъединицами, называемыми
тропоколлагеном, которые расположены
регулярным образом и взаимно
ориентированы как в продольном, так и
поперечном направлении. Молекула
коллагена состоит из трех цепей двух
видов: α1 и α2, которые образуют
тройную спираль. Каждая нить
образована примерно 1000 остатками
аминокислот
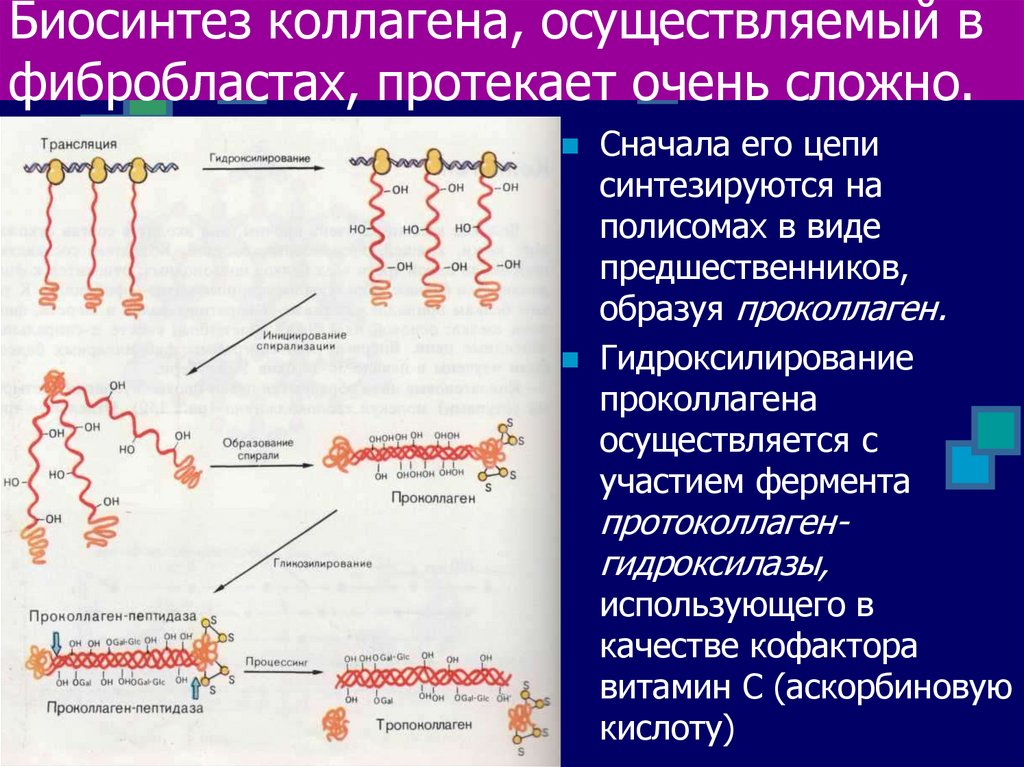
15. Биосинтез коллагена, осуществляемый в фибробластах, протекает очень сложно.
Сначала его цеписинтезируются на
полисомах в виде
предшественников,
образуя проколлаген.
Гидроксилирование
проколлагена
осуществляется с
участием фермента
протоколлагенгидроксилазы,
использующего в
качестве кофактора
витамин С (аскорбиновую
кислоту)
16.
Прочностьколлагеновых
волокон (нить
сечением около 1 мм
выдерживает
нагрузку более 10
кг) во многом
достигается за счет
дополнительных ко
валентных «сшивок»
между молекулами
тропоколлагена
17.
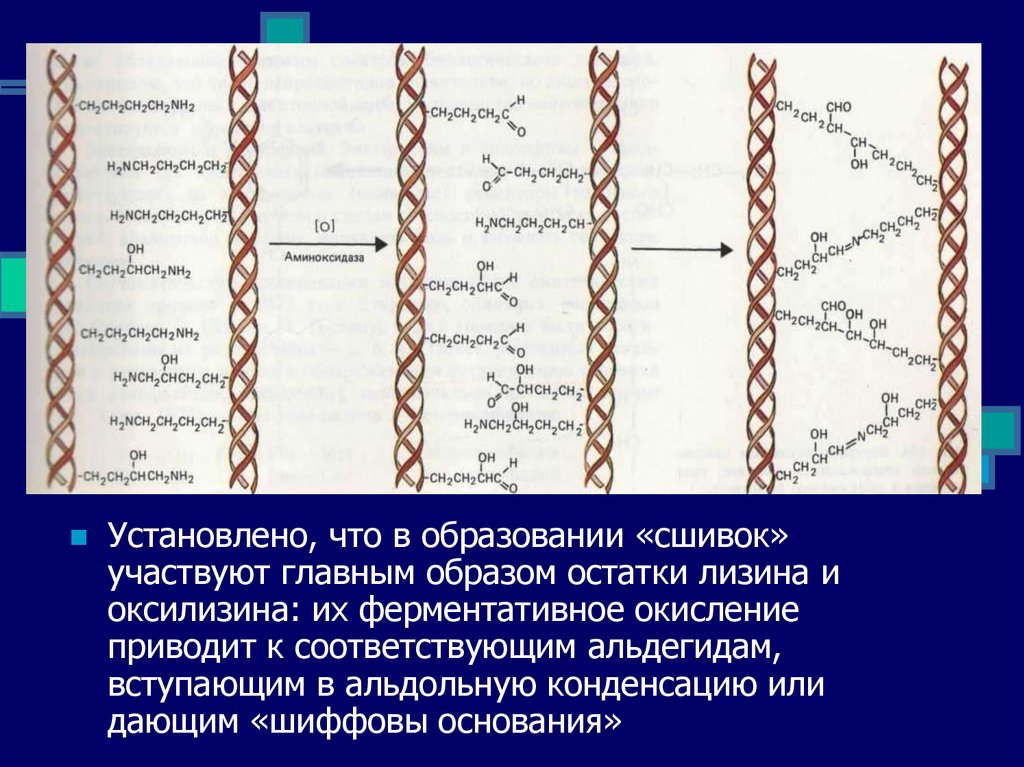
Установлено, что в образовании «сшивок»участвуют главным образом остатки лизина и
оксилизина: их ферментативное окисление
приводит к соответствующим альдегидам,
вступающим в альдольную конденсацию или
дающим «шиффовы основания»
18. Частота «сшивок» зависит
от функции ткани:коллагеновое волокно в мягких
тканях (язык, хвост и т. п.)
«сшито» слабо, а в случае
ахиллесова сухожилия —
прочно;
от возраста : молодые ткани
имеют сравнительно небольшой
процент «сшивок» и по этой
причине оказываются лучше
растворимыми.
19.
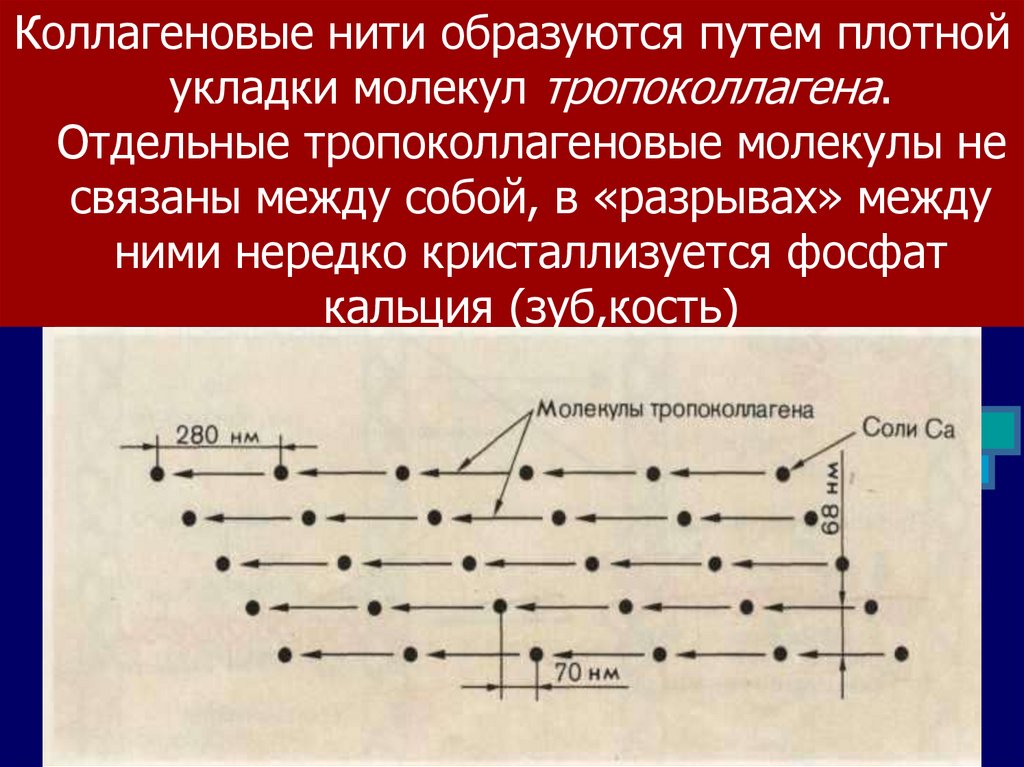
Коллагеновые нити образуются путем плотнойукладки молекул тропоколлагена.
Отдельные тропоколлагеновые молекулы не
связаны между собой, в «разрывах» между
ними нередко кристаллизуется фосфат
кальция (зуб,кость)
20. Структура коллагена
молекулы тропоколлагенадлиной 280 нм,
молекулярной массой 285
000 образуют цепи и
ориентированы
параллельно в
продольном направлении
с постоянным сдвигом
примерно на 1/4 длины.
молекулы тропоколлагена
не соприкасаются, так что
между ними остается
небольшая щель.
параллельные соседние
молекулы слегка
перекрывают друг друга.
существование щелей и
перекрытий приводит к
образованию темных и
светлых полос.
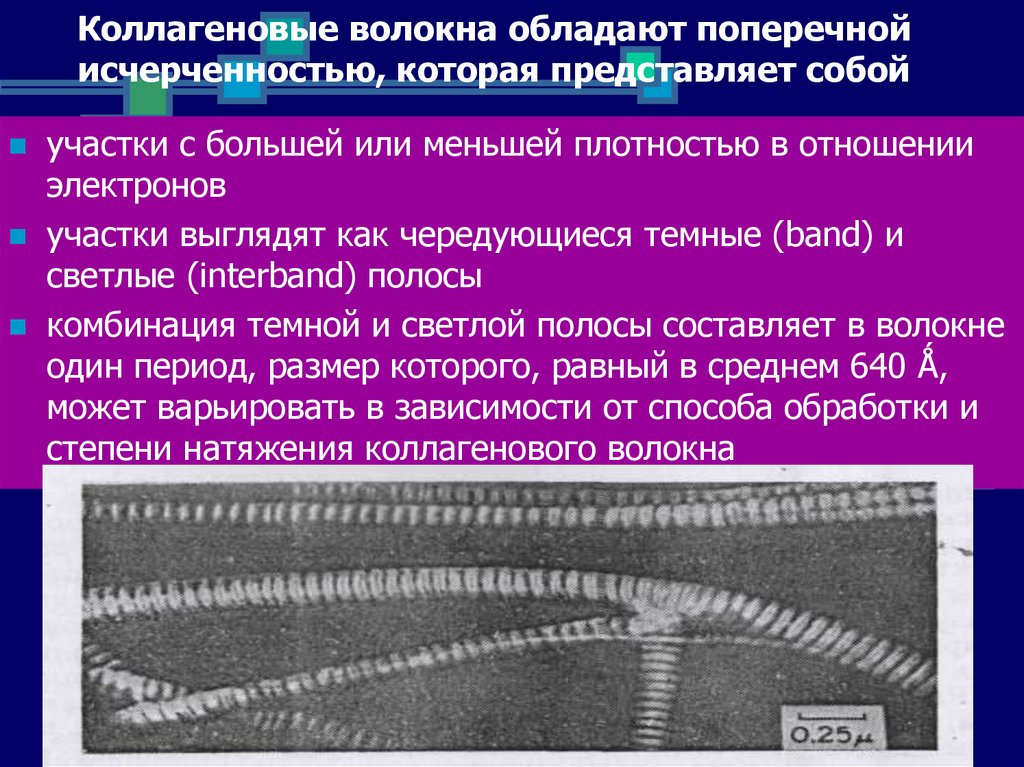
21. Коллагеновые волокна обладают поперечной исчерченностью, которая представляет собой
участки с большей или меньшей плотностью в отношенииэлектронов
участки выглядят как чередующиеся темные (band) и
светлые (interband) полосы
комбинация темной и светлой полосы составляет в волокне
один период, размер которого, равный в среднем 640 Ǻ,
может варьировать в зависимости от способа обработки и
степени натяжения коллагенового волокна
22. Природа поперечной исчерченности, происхождение которой обычно объясняют исходя из параллельной ориентации фибрилл по отношению
к оси макроволокна, в течение долгого времени оставалась неясной.
В настоящее время, основываясь на многочисленных данных,
полученных при изучении химического строения коллагеновых белков
и, в частности, при изучении первичной структуры полярных
(«кристаллических») и полярных («аморфных») участков молекулы
коллагена, следует считать, что поперечную исчерченность
коллагенового волокна в конечном счете определяет специфическая
последовательность расположения аминокислотных остатков в
полипептидных цепях индивидуальной молекулы коллагена
23. ОБРАЗОВАНИЕ И СТРОЕНИЕ КОЛЛАГЕНОВЫХ ФИБРИЛЛ
Молекулы тропоколлагена,выделенные в окружающую среду,
агрегируют, образуя микрофибриллы
и фибриллы.
Микрофибриллы обычно состоят из
пяти спирализованных волокон и
возникают в результате линейной и
боковой агрегации молекул
тропоколлагена, смещенных на
четверть их длины. Эти
микрофибриллы вместе с
различными гликопротеинами
(фибринопектином, гликопротеином)
образуют фибриллы.
Молекулы гликопротеинов обычно
находятся на поверхности фибрилл и
защищают их от действия
коллагеназы.
24. Эластин устойчивее коллагена
не растворяется в холодной и горячей воде,растворах солей, разбавленных кислотах и
щелочах; даже крепкая серная кислота на него
слабо воздействует
в эластине, как и в коллагене, присутствует
оксипролин (хотя его в 10 раз меньше), много
глицина и пролина, но отсутствуют триптофан и
метионин
Неполноценный и плохо усваивается, почти не
переваривается, но гидролизуется ферментом
поджелудочной железы эластазой.
В отличие от коллагена эластин слабо набухает,
при нагревании не образует желатина
25.
Эластиновые волокна очень эластичны, разветвлены илисоединены между собой, желтого цвета, их длина при
растяжении может увеличиваться вдвое (стенки
кровеносных сосудов, связки, ткань шеи у гусей и
лебедей).
Прочность эластиновых волокон меньше прочности
коллагеновых, однако, они легко растяжимы. В
составе эластиновых волокон содержится около 42
% сухого вещества, из которого 0,2 % составляют
минеральные вещества. Из органических веществ
31,7 % составляет эластин и 7,2 % коллаген.
Процент «сшивок» в молекуле эластина исключительно
высок, встречаются и многокомпонентные «сшивки» в
виде узлов
В отличие от коллагеновых волокон, эластиновые
имеют гомогенную структуру, в которой отсутствуют
фибриллярные структуры. Это объясняется особой
трехмерной упаковкой мономеров эластина
(проэластина), которые взаимно соединены
поперечными ковалентными связями.
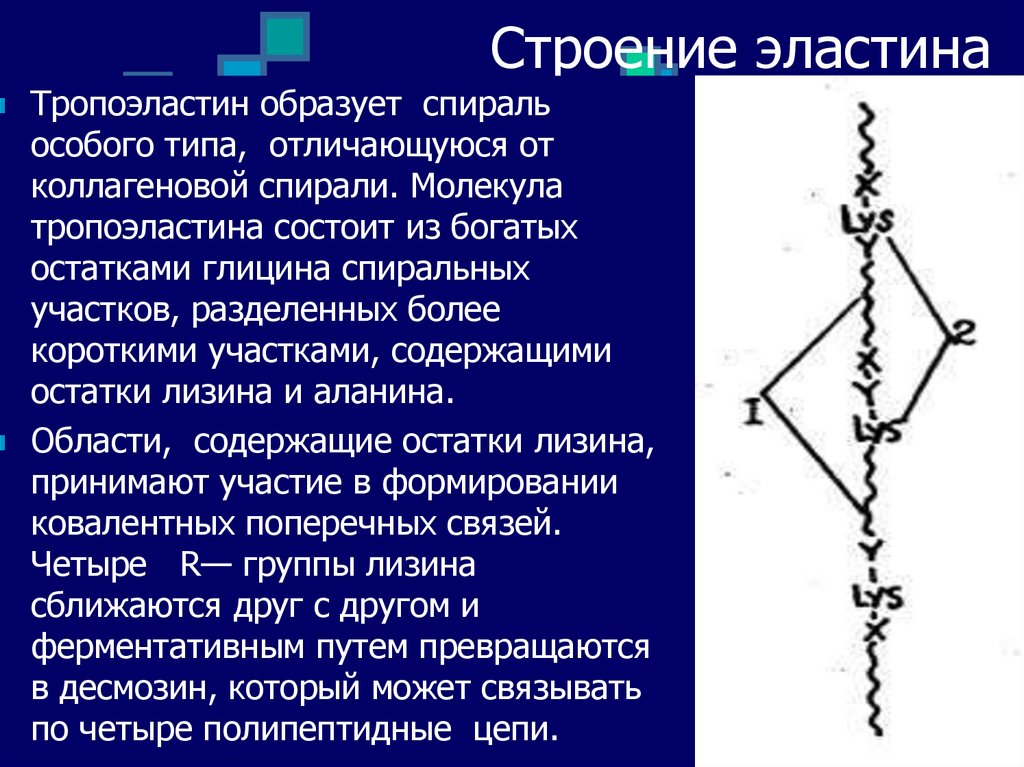
26. Строение эластина
Тропоэластин образует спиральособого типа, отличающуюся от
коллагеновой спирали. Молекула
тропоэластина состоит из богатых
остатками глицина спиральных
участков, разделенных более
короткими участками, содержащими
остатки лизина и аланина.
Области, содержащие остатки лизина,
принимают участие в формировании
ковалентных поперечных связей.
Четыре R— группы лизина
сближаются друг с другом и
ферментативным путем превращаются
в десмозин, который может связывать
по четыре полипептидные цепи.
27.
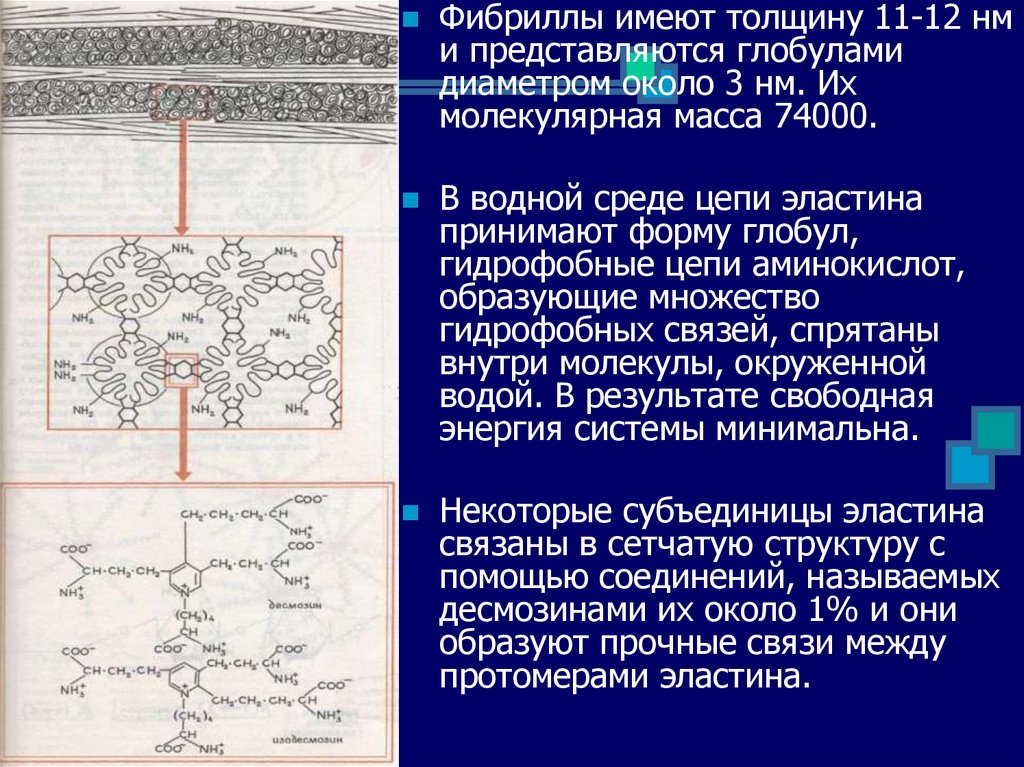
Фибриллы имеют толщину 11-12 нми представляются глобулами
диаметром около 3 нм. Их
молекулярная масса 74000.
В водной среде цепи эластина
принимают форму глобул,
гидрофобные цепи аминокислот,
образующие множество
гидрофобных связей, спрятаны
внутри молекулы, окруженной
водой. В результате свободная
энергия системы минимальна.
Некоторые субъединицы эластина
связаны в сетчатую структуру с
помощью соединений, называемых
десмозинами их около 1% и они
образуют прочные связи между
протомерами эластина.
28.
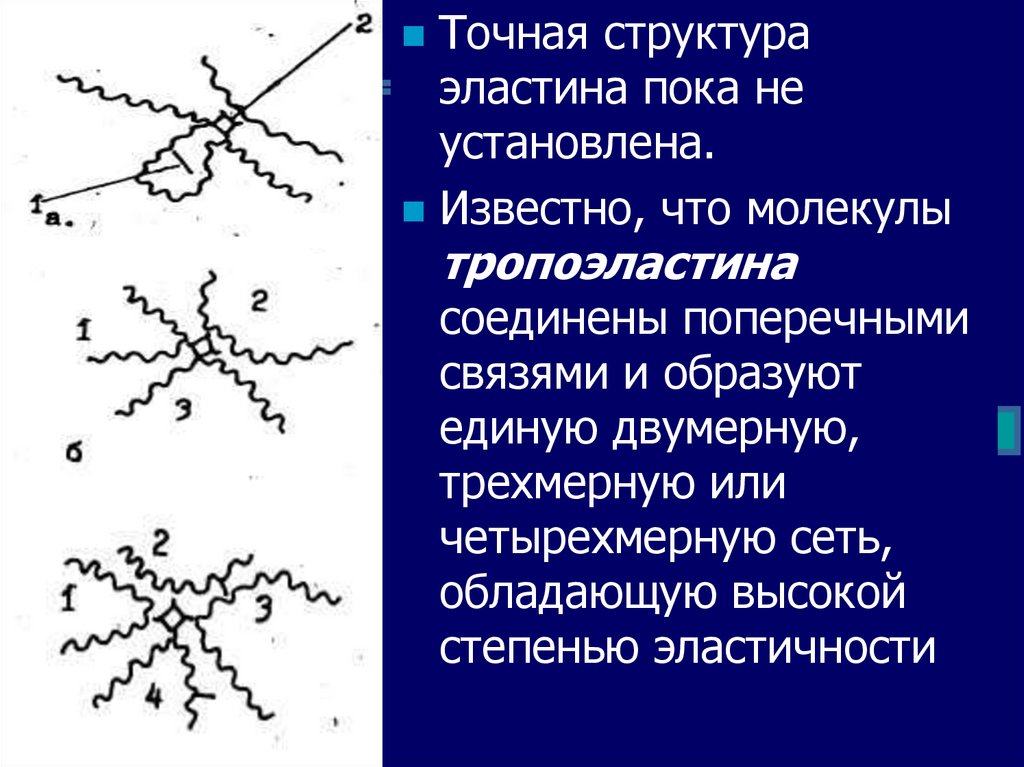
Точная структураэластина пока не
установлена.
Известно, что молекулы
тропоэластина
соединены поперечными
связями и образуют
единую двумерную,
трехмерную или
четырехмерную сеть,
обладающую высокой
степенью эластичности
29.
Ретикулин входит в состав как соединительной,так и ретикулиновой ткани, которая образует
основу кроветворных органов: костного мозга,
селезенки, легких.
Ретикулин состоит из тонких поперечно
исчерченных фибрилл с периодом 64 нм. Подобно
коллагену и эластину он отличается высоким
содержанием оксилизина, пролина и оксипролина.
В нем содержится до 4,5% углеводов, 10,12%
липидов, 0,16% гексозамина.
Ретикулин – неполноценный белок; он плохо
усваивается, почти не набухает в воде, не
растворяется в течение многих часов в крепких
растворах кислот и щелочей.
30.
Слизистые белкимуцины и
мукоиды выполняют защитные
функции и облегчающие
скольжение мышечных пучков, а
т.ж.выполняют роль
цементирующего межклеточного
компонента.
31. Муцины
Структура муцина довольно сложнаяВ растворе молекула муцина представляет собой довольно
жесткий клубок, состоящий из гибкой, беспорядочно скрученной
полипептидной цепи с заключенными внутрь молекулами воды.
Такая молекула ведет себя как сферическое тело, что
определяет гидродинамические свойства растворов муцинов.
32. Муцины составляют основу разных слизей организма
слюны,желудочного и кишечного сока
выполняют защитную роль — ослабляют или
исключают механическое и химическое
раздражение слизистой оболочки
пищеварительного тракта частицами корма и
примесями.
Муцины очень стойки к действию ферментов,
которые гидролизуют белок. В связи с этим
возможно, что они предохраняют стенки
кишечника и желудка от влияния собственных
ферментов («самопереваривание»).
33. Мукоиды
белки синовиальной жидкости суставов,сухожильных влагалищ,
хрящей,
жидкости глазного яблока и др.
Эти белки выполняют роль смазочного материала
в аппарате движения животных, а также
определенную защитную роль (как склеивающего
вещества), которые объединяют
соединительнотканные волокна и тем самым
создают тканевые барьеры.
В печени обнаружен комплекс белка с
гликогеном.
34. Где осуществляется синтез коллагена?
В клетках мезенхимального происхождения, которые взависимости от типа соединительной ткани получили
название фибробласты, хондробласты, остеобласты и т. д.
Это положение основано на многочисленных наблюдениях,
показывающих прямую взаимосвязь между наличием этих
клеток и образованием коллагена в процессе морфогенеза
соединительной ткани и эмбрионального развития, при
заживлении ран
Хотя фибробласты и имеют много общих свойств,
определенные морфологические особенности проявляются
в зависимости от типа соединительной ткани,
функционального состояния и степени дифференциации
клетки.
35. МОРФОЛОГИЯ ФИБРОГЕННЫХ КЛЕТОК
Фибробласт является типичной и наиболеечасто встречающейся в соединительной
ткани клеткой, которая в активно
функциональном состоянии имеет вытянутую,
веретенообразную, а иногда звездчатую
форму. В отличие от фибробласта остео- и
хондробласты овальной формы.
36.
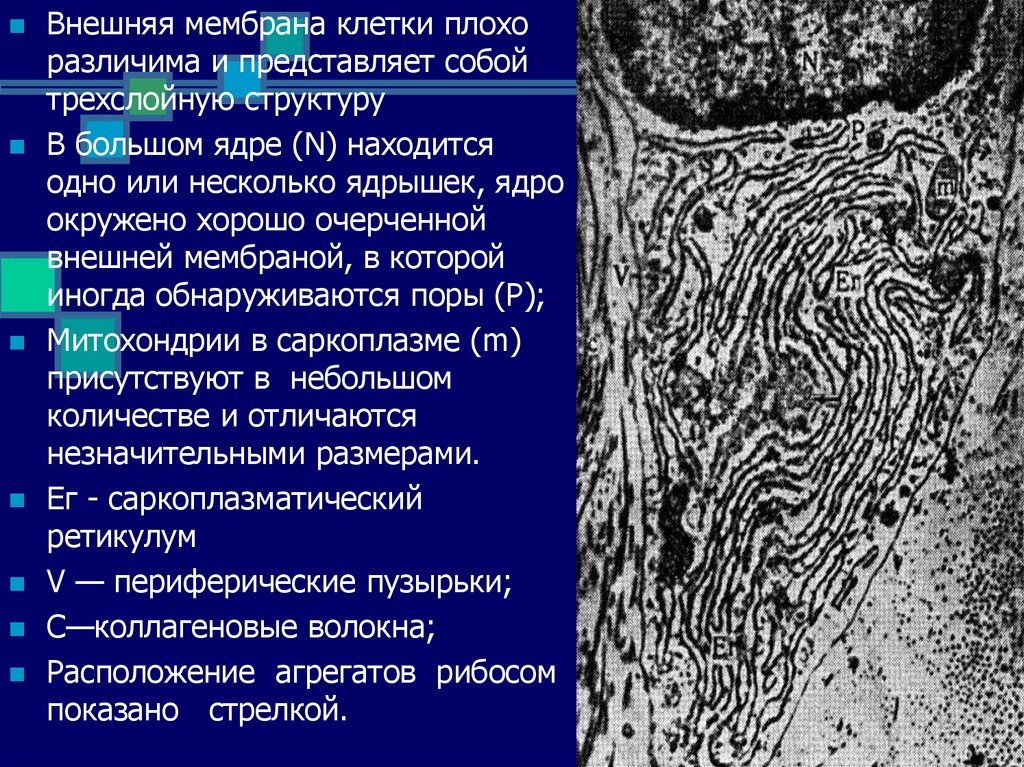
Внешняя мембрана клетки плохоразличима и представляет собой
трехслойную структуру
В большом ядре (N) находится
одно или несколько ядрышек, ядро
окружено хорошо очерченной
внешней мембраной, в которой
иногда обнаруживаются поры (Р);
Митохондрии в саркоплазме (m)
присутствуют в небольшом
количестве и отличаются
незначительными размерами.
Ег - саркоплазматический
ретикулум
V — периферические пузырьки;
С—коллагеновые волокна;
Расположение агрегатов рибосом
показано стрелкой.
37.
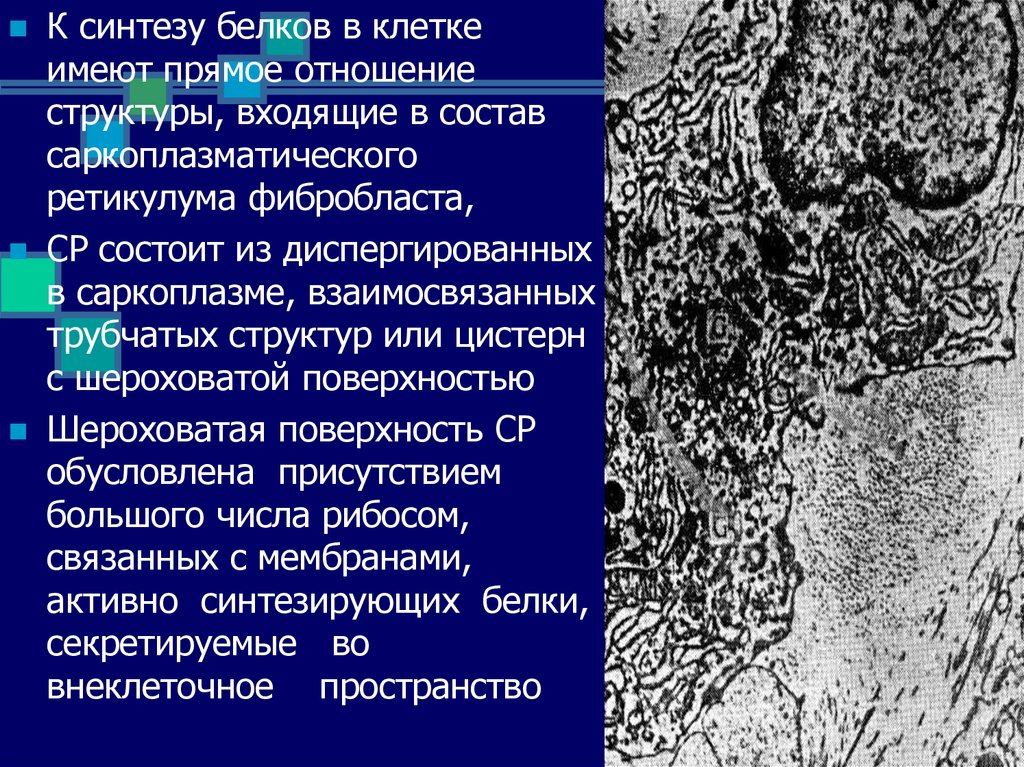
К синтезу белков в клеткеимеют прямое отношение
структуры, входящие в состав
саркоплазматического
ретикулума фибробласта,
СР состоит из диспергированных
в саркоплазме, взаимосвязанных
трубчатых структур или цистерн
с шероховатой поверхностью
Шероховатая поверхность СР
обусловлена присутствием
большого числа рибосом,
связанных с мембранами,
активно синтезирующих белки,
секретируемые во
внеклеточное пространство
38.
Мембраны СР фибробластовхарактеризуются большим
количеством связанных
рибосом, которые обычно
обнаруживаются в виде
больших агрегатов, имеющих
изогнутую или
спиралевидную форму.
Обнаружение в фибробластах
больших агрегатов рибосом
согласуется с рядом
биохимических наблюдений,
которые показывают, что
синтез коллагена
осуществляется на полисомах
чрезвычайно больших
размеров, содержащих 30
рибосом.
39. Как влияет возраст клетки на синтез коллагена?
Вариабельность структуры ретикулума в большой степениотражает функциональное состояние клетки, которое
может изменяться в процессе дифференциации и при
некоторых патологических процессах, протекающих в
соединительной ткани. Показано, например, что при
недостатке аскорбиновой кислоты в фибробластах прежде
всего и наиболее резко изменяется структура
эндоплазматического ретикулума (Ross, 1968). В мембранах
ретикулума обнаруживаются разрывы, цистерны
принимают округлую форму («вакуолизируются»).
Связанные с мембранами агрегаты рибосом почти
полностью исчезают; в результате при авитаминозе С
поверхность мембран ретикулума становится гладкой, и в
цитоплазме появляется большое количество свободных
рибосом. Остающиеся на мембранах рибосомы
распределены неупорядоченно.
40. Сколько времени потребуется на синтез коллагена?
В период быстрого роста клеток (около 4 дней) коллагенпрактически не образуется; когда же размножение клеток
заканчивается и их количество достигает максимума,
синтез коллагена резко увеличивается и продолжается в
течение 21 дня.
Синтез от начала до конца происходит путем
последовательного присоединения отдельных
аминокислотных остатков к растущей полипептидной цепи
со скоростью 209 остатков в 1 мин.
Так как содержание оксипролина в коллагене равно
12,2%, а пролина в белках клетки около 4%, в период
быстрого роста фибробластов отношение синтеза
коллаген/белок равно 0,2, а в стационарной фазе
увеличивается до 6,4.
41. Тогда где и в результате чего оксипролин образуется?
гидроксилирование пролина и лизина происходит после ихвключения в полипептидные цепи молекулы коллагена
Тогда на какой стадии осуществляется
реакция гидроксилирования — в процессе
синтеза полипептидных цепей коллагена или
после их освобождения из рибосом?
превращение пролиновых остатков в оксипролин скорее
всего осуществляется после освобождения полипептидных
цепей коллагена из рибосом.
Время требуемое для полной «сборки» полипептидных
цепей коллагена с включением пролина равно 1 мин в то
время как для синтеза максимального количества
оксипролина требуется 10 мин.
42. А каков механизм выведения коллагена во внеклеточное пространство из фибробластов?
секреция коллагена из клеток осуществляетсячерез внешние мембраны фибробластов,
которые содержат конденсированные участки,
тесно связанные с внутриклеточными тончайшими
фибриллярными элементами и с коллагеновыми
волокнами внеклеточного пространства.
Эти участки разрываться, в результате чего
содержимое саркоплазмы сразу после выхода
спирали коллагена из рибосомы переносится во
внеклеточное пространство.
43. А где происходит биосинтез полипептидных цепей эластина?
Известно малоСчитают, что эластин синтезируется в
фибробластах
Однако достаточно четкие биохимические
доказательства, подтверждающие
правильность этого положения, пока что
отсутствуют.
В отличие от других белков, изучение
биосинтеза эластина с помощью
общепринятых методов сопряжено с
большими трудностями ввиду его резко
выраженной нерастворимости и низкой
скорости обмена.
44.
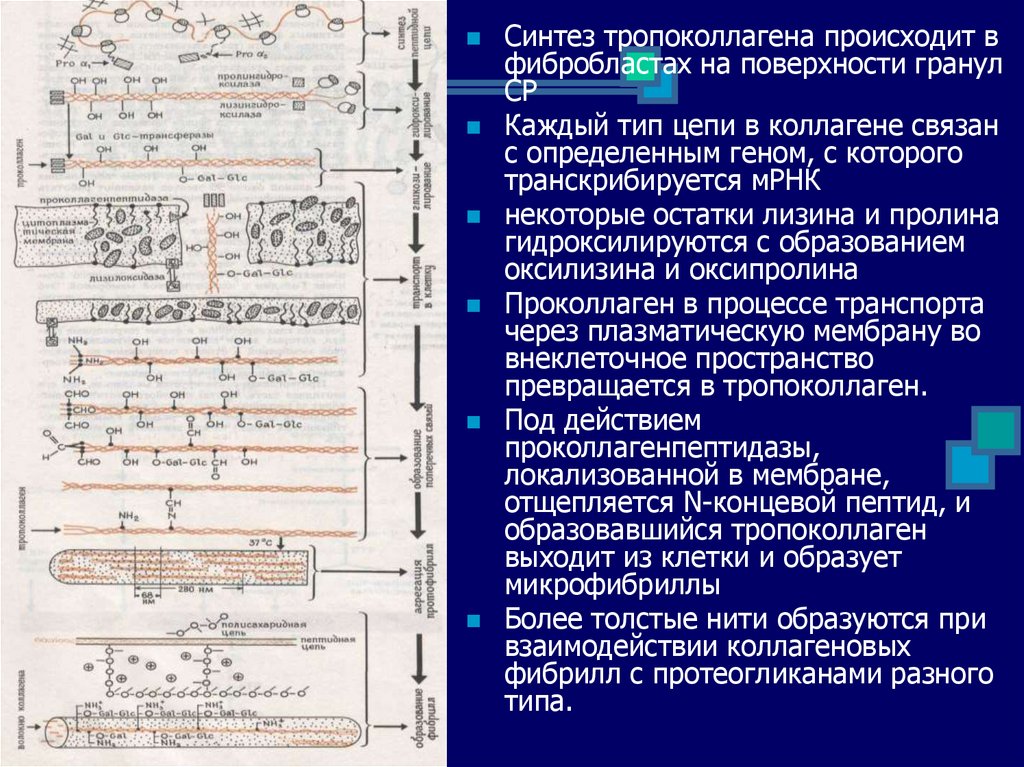
Синтез тропоколлагена происходит вфибробластах на поверхности гранул
СР
Каждый тип цепи в коллагене связан
с определенным геном, с которого
транскрибируется мРНК
некоторые остатки лизина и пролина
гидроксилируются с образованием
оксилизина и оксипролина
Проколлаген в процессе транспорта
через плазматическую мембрану во
внеклеточное пространство
превращается в тропоколлаген.
Под действием
проколлагенпептидазы,
локализованной в мембране,
отщепляется N-концевой пептид, и
образовавшийся тропоколлаген
выходит из клетки и образует
микрофибриллы
Более толстые нити образуются при
взаимодействии коллагеновых
фибрилл с протеогликанами разного
типа.































 Биология
Биология








