Похожие презентации:
Предмет органической химии
1.
Урок Химии № 7ТЕМА: Предмет органической химии.
Природные, искусственные и синтетические органические вещества.
Сравнение органических веществ с неорганическими.
Валентность. Химическое строение как порядок соединения атомов в
молекулы по валентности.
Теория строения органических соединений А.М. Бутлерова. Основные
положения теории химического строения. Изомерия и изомеры. Химические
формулы и модели молекул в органической химии.
Классификация органических веществ. Классификация веществ по строению
углеродного скелета и наличию функциональных групп. Гомологи и
гомология. Начала номенклатуры IUPAC.
Классификация реакций в органической химии. Реакции присоединения
(гидрирования, галогенирования, гидрогалогенирования, гидратации).
Реакции отщепления (дегидрирования, дегидрогалогенирования,
дегидратации). Реакции замещения. Реакции изомеризации.
2.
Органическая химия –это химия углеводородов и их производных
Число соединений углерода- больше всех остальных
соединений, его не содержащих.
*Количество известных органических соединений
составляет почти 27 млн. (против 700 тысяч
неорганических). Таким образом, органические
соединения — самый обширный класс химических
соединений.
3.
СН
4.
5.
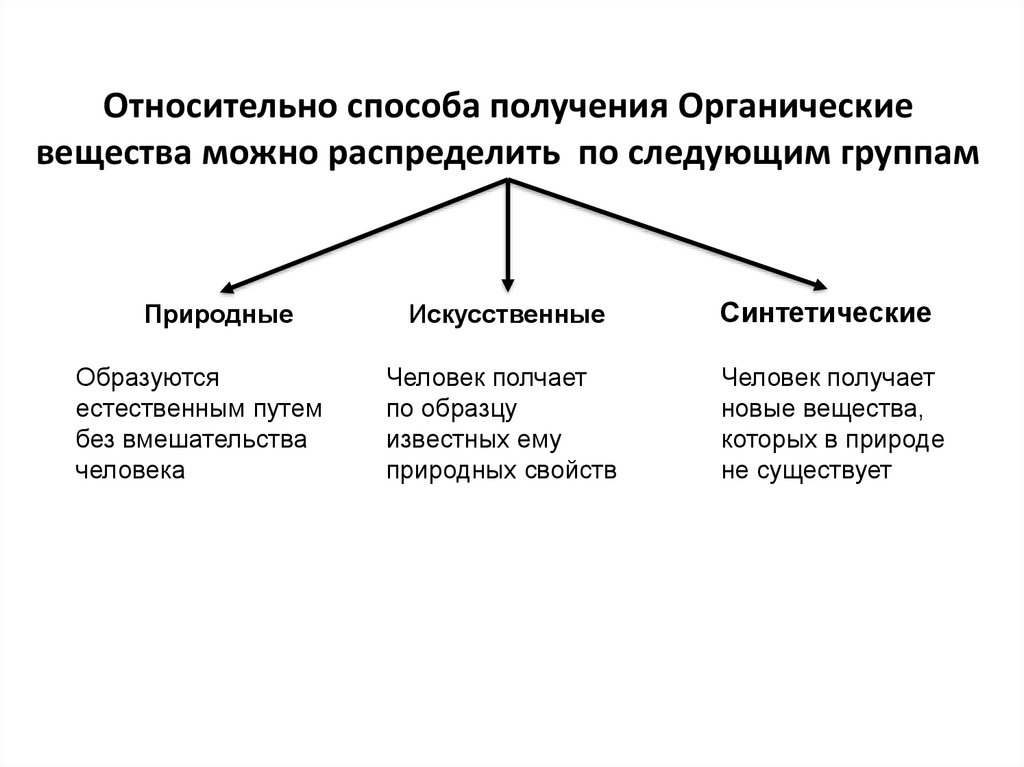
Относительно способа получения Органическиевещества можно распределить по следующим группам
Природные
Образуются
естественным путем
без вмешательства
человека
Искусственные
Синтетические
Человек полчает
по образцу
известных ему
природных свойств
Человек получает
новые вещества,
которых в природе
не существует
6.
Не писать. Понять, уяснить7.
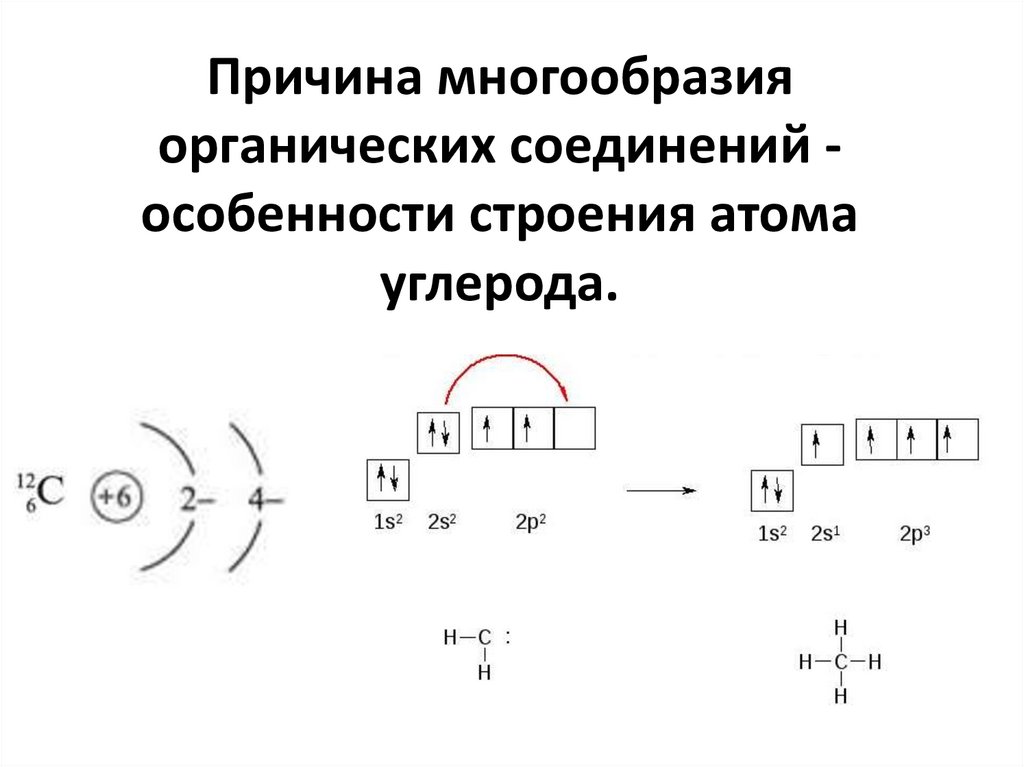
Причина многообразияорганических соединений особенности строения атома
углерода.
8.
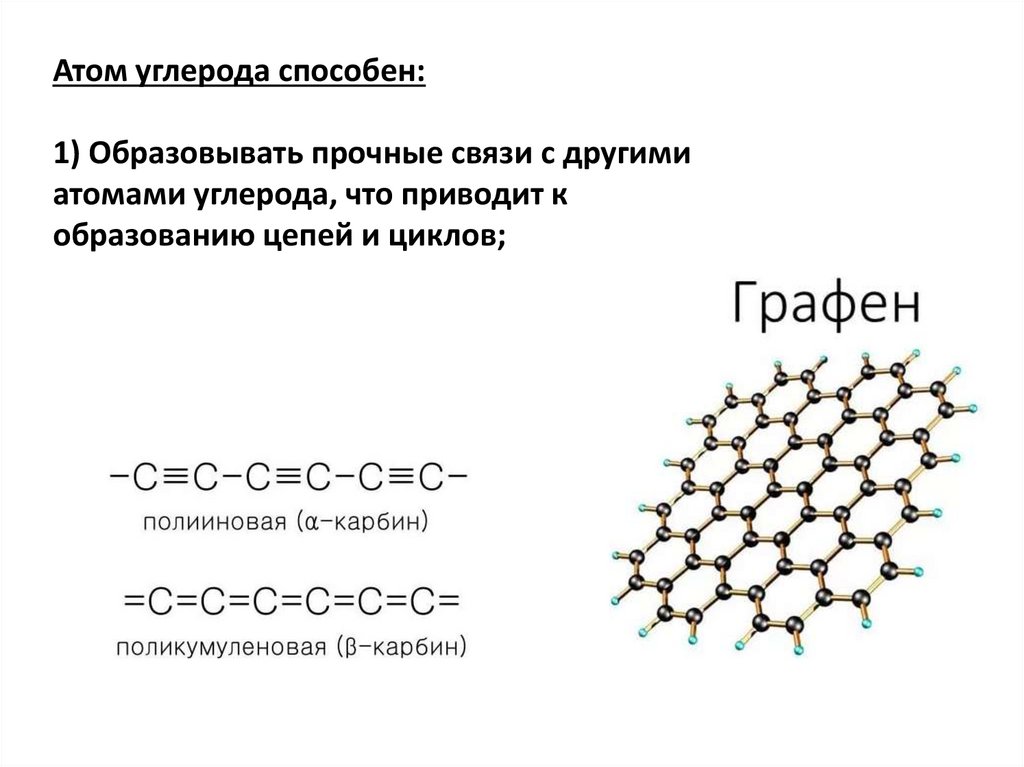
Атом углерода способен:1) Образовывать прочные связи с другими
атомами углерода, что приводит к
образованию цепей и циклов;
9.
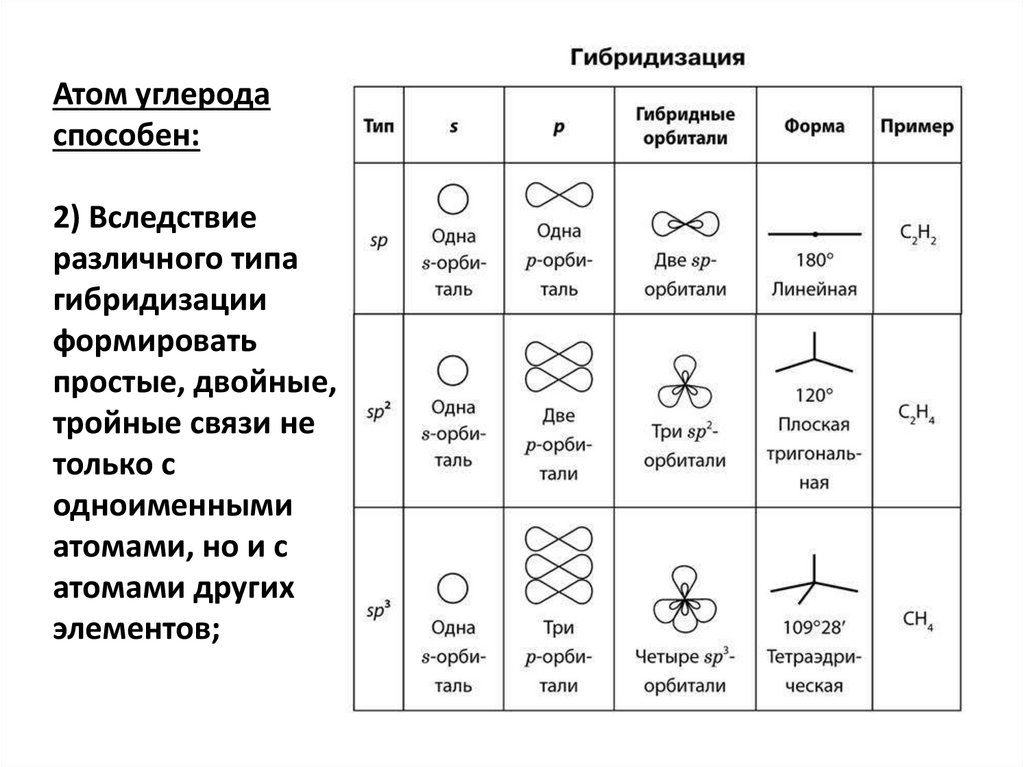
Атом углеродаспособен:
2) Вследствие
различного типа
гибридизации
формировать
простые, двойные,
тройные связи не
только с
одноименными
атомами, но и с
атомами других
элементов;
10.
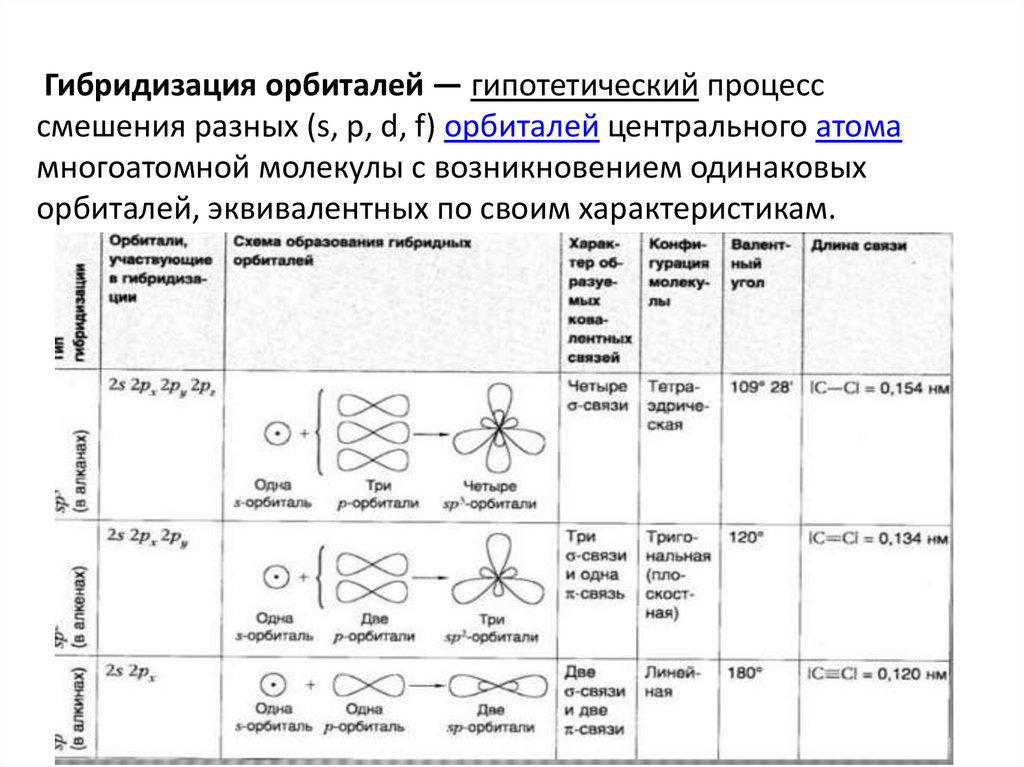
Гибридизация орбиталей — гипотетический процесссмешения разных (s, p, d, f) орбиталей центрального атома
многоатомной молекулы с возникновением одинаковых
орбиталей, эквивалентных по своим характеристикам.
11.
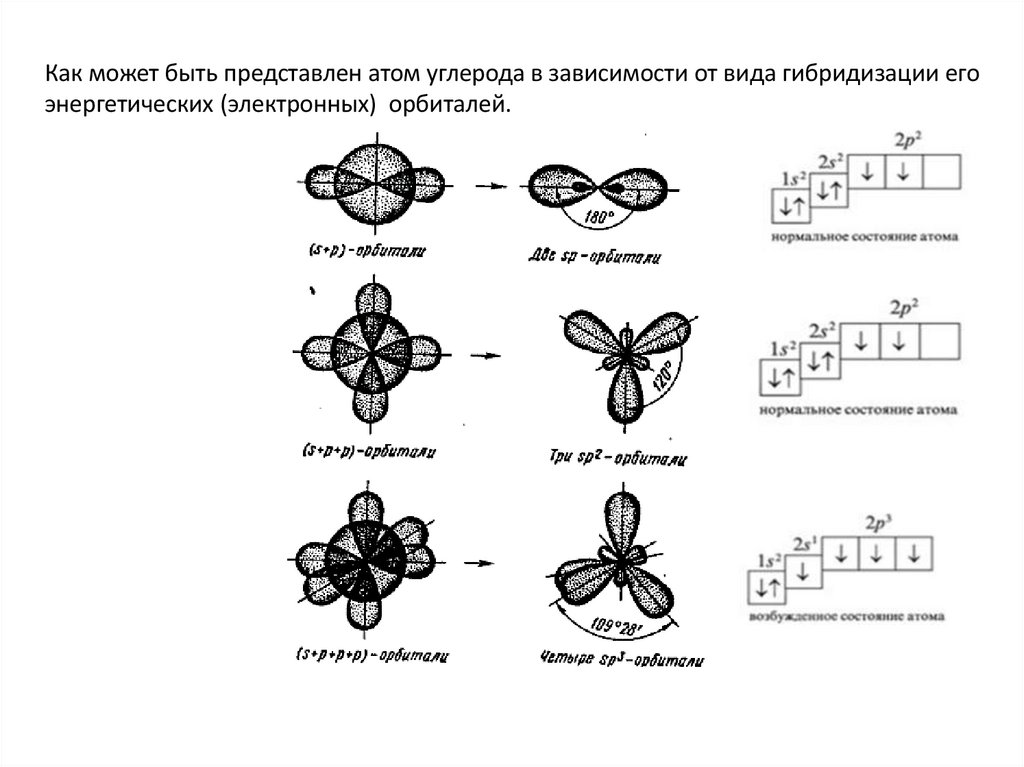
Как может быть представлен атом углерода в зависимости от вида гибридизации егоэнергетических (электронных) орбиталей.
12.
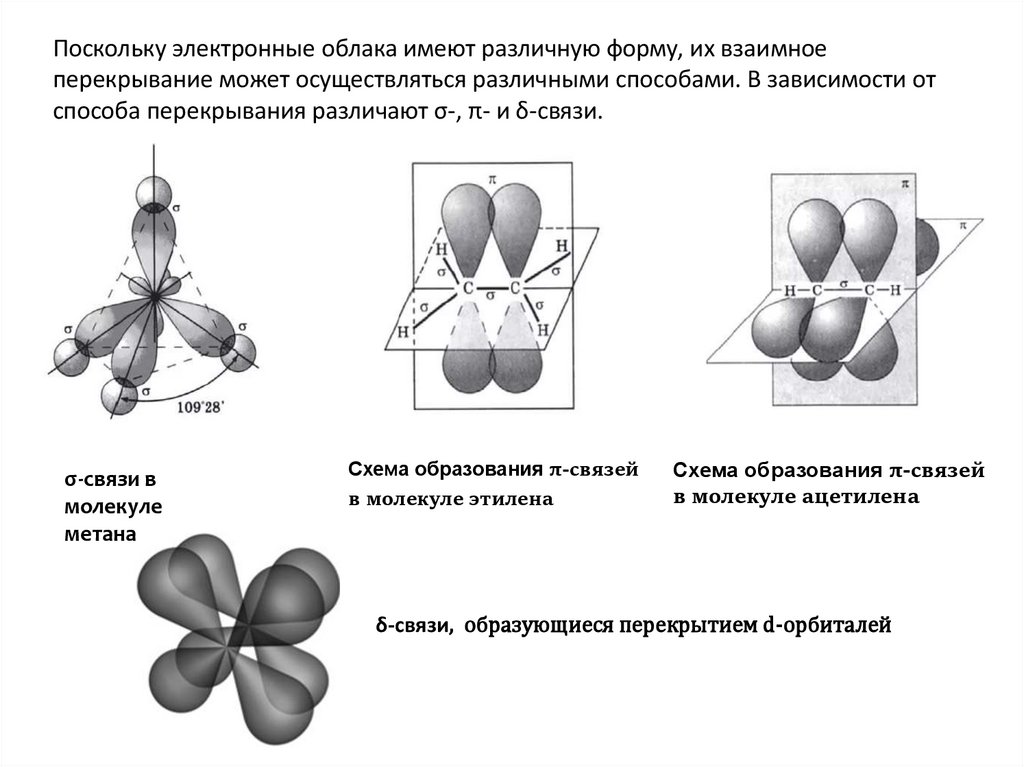
Поскольку электронные облака имеют различную форму, их взаимноеперекрывание может осуществляться различными способами. В зависимости от
способа перекрывания различают σ-, π- и δ-связи.
σ-связи в
молекуле
метана
Схема образования π-связей
в молекуле этилена
Схема образования π-связей
в молекуле ацетилена
δ-связи, образующиеся перекрытием d-орбиталей
13.
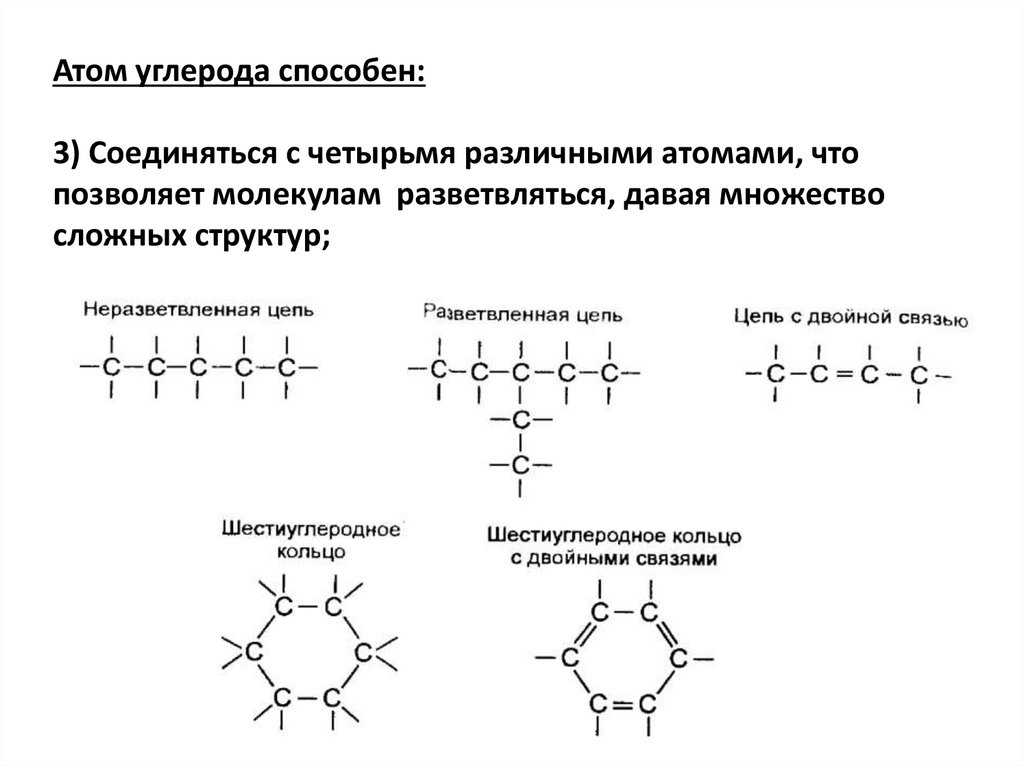
Атом углерода способен:3) Соединяться с четырьмя различными атомами, что
позволяет молекулам разветвляться, давая множество
сложных структур;
14.
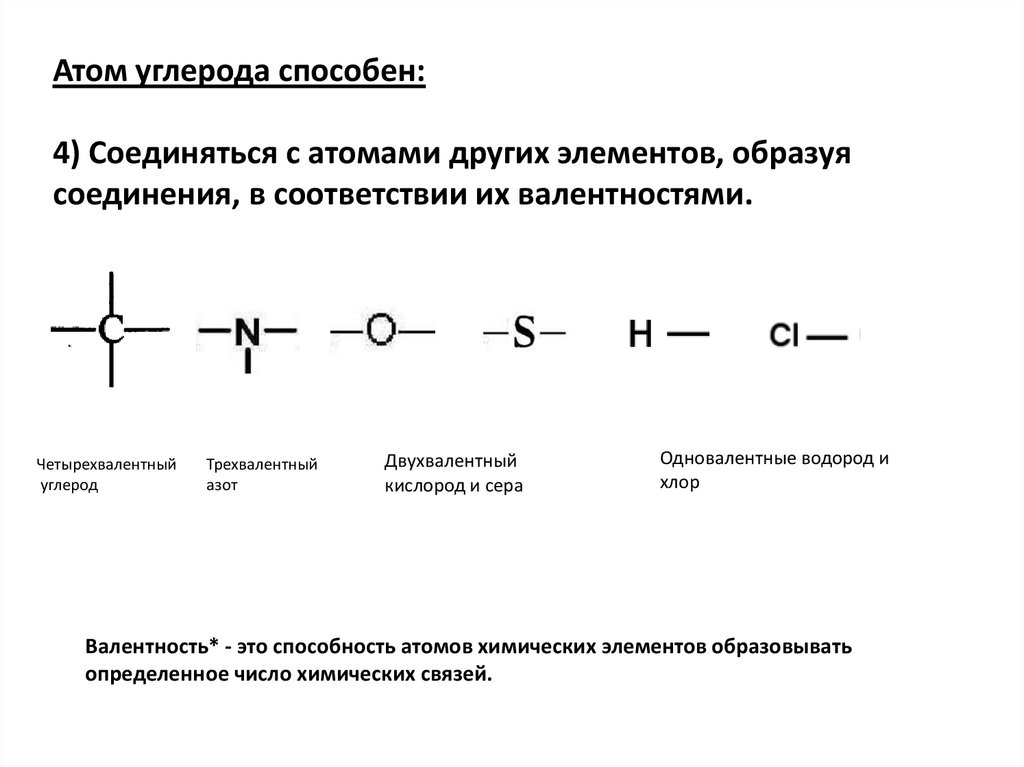
Атом углерода способен:4) Соединяться с атомами других элементов, образуя
соединения, в соответствии их валентностями.
Четырехвалентный
углерод
Трехвалентный
азот
Двухвалентный
кислород и сера
Одновалентные водород и
хлор
Валентность* - это способность атомов химических элементов образовывать
определенное число химических связей.
15. Александр Михайлович Бутлеров
1828-1886• Окончил физико-математический
факультет Казанского университета в
1849 г
• Основал химическую лабораторию,
ставшую важнейшим
исследовательским центром России.
• Разработал теорию химического
строения тел, согласно которой
свойства вещества определяются
порядком расположения и связями
атомов в молекулах. Также он
впервые получил искусственную
глюкозу
16.
Основные положения теории АлександраМихайловича Бутлерова (1828-1886)
1) Атомы в молекулах соединены друг с другом в определенной
последовательности согласно их валентностям. Последовательность
межатомных связей в молекуле называется ее химическим
строением и отражается одной структурной формулой (формулой
строения).
(В соответствии с этими представлениями валентность элементов условно
изображают черточками,) Такое схематичное изображение строения молекул
называют формулами строения и структурными формулами.
17.
2) Атом углерода в составе органических соединений имеет валентностьравную четырем.
атомы четырехвалентного углерода могут соединяться друг с другом, образуя различные
цепи:
- открытые разветвленные;
- открытые неразветвленные:
- замкнутые .
3) Свойства веществ зависят от их химического строения. Свойства вещества
зависят не только от того какие атомы и сколько их входит в состав молекул, но и
от порядка соединения атомов в молекулах.(т.е. свойства зависят от строения)
Данное положение теории строения органических веществ объяснило, в
частности, явление изомерии. Существуют соединения, которые содержат
одинаковое число атомов одних и тех же элементов, но связанных в различном
порядке. Такие соединения обладают разными свойствами и называются
изомерами*.
18.
4) Зная строение органического соединения можно предсказать егосвойства; зная свойства органического соединения можно предсказать
его строение.
5) Атомы и группы атомов в молекуле оказывают взаимное влияние
друг на друга, что определяет их реакционную способность.
Непосредственно связанные атомы оказывают большее влияние друг
на друга, влияние не связанных непосредственно атомов значительно
слабее.
19.
Запомним понятие!!!Структурная формула –это изображение
последовательности связывания атомов в
молекуле.
Даже в молекулярной формуле необходимо
использовать элементы струкурной
формулы, чтобы показать детали строения
молекулы, например молекулу металнола не
изображают СН4О, а только СН3ОН.
20.
Явление изомерииВещества, имеющие одинаковый состав, но разное
химическое или пространственное строение, а
следовательно, и разные свойства, называют изомерами.
Основные виды изомерии:
Структурная изомерия, при которой вещества различаются порядком
связи атомов в молекулах:
1) изомерия углеродного скелета
*н-значит нормальный
21.
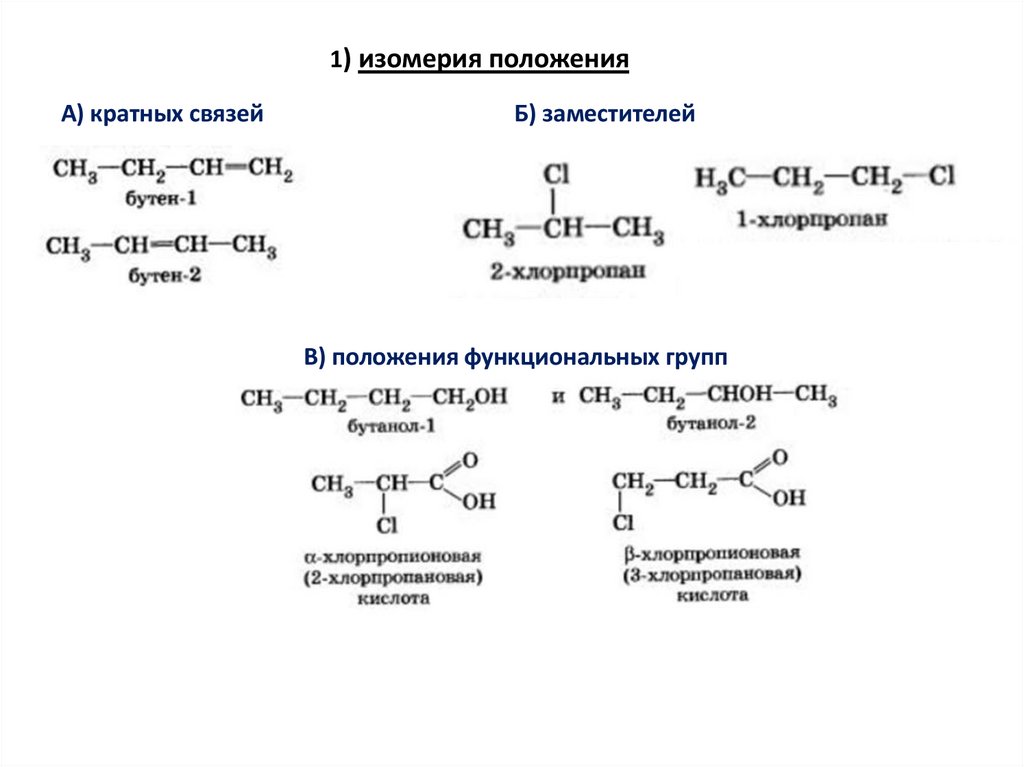
1) изомерия положенияА) кратных связей
Б) заместителей
В) положения функциональных групп
22.
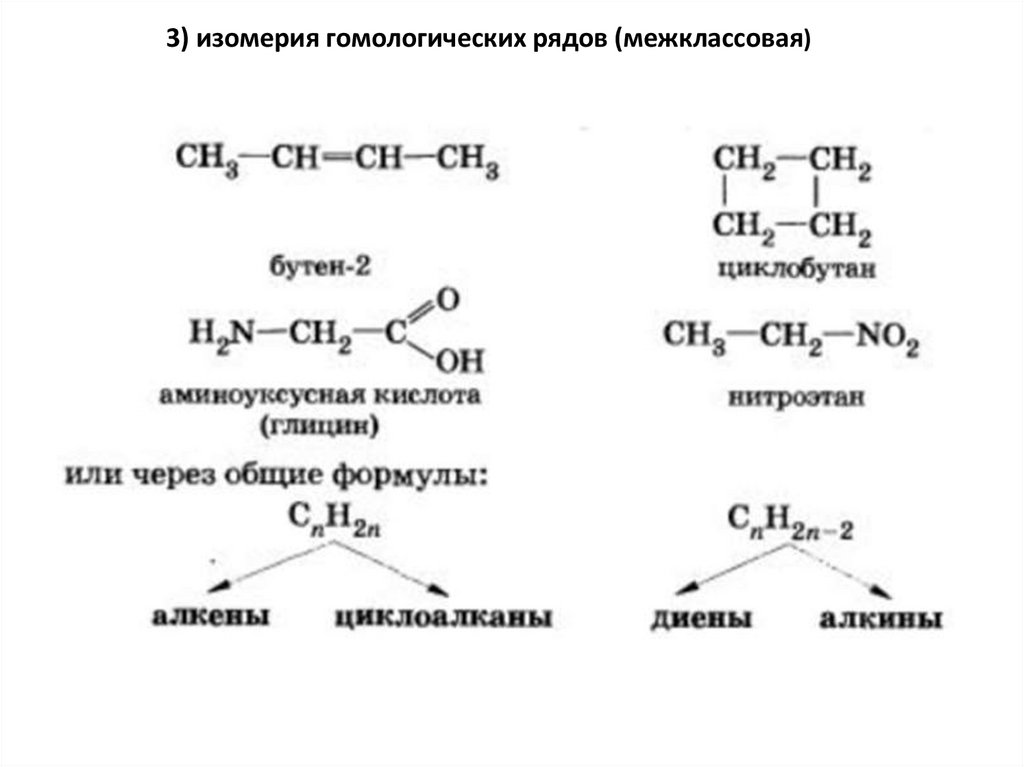
3) изомерия гомологических рядов (межклассовая)23.
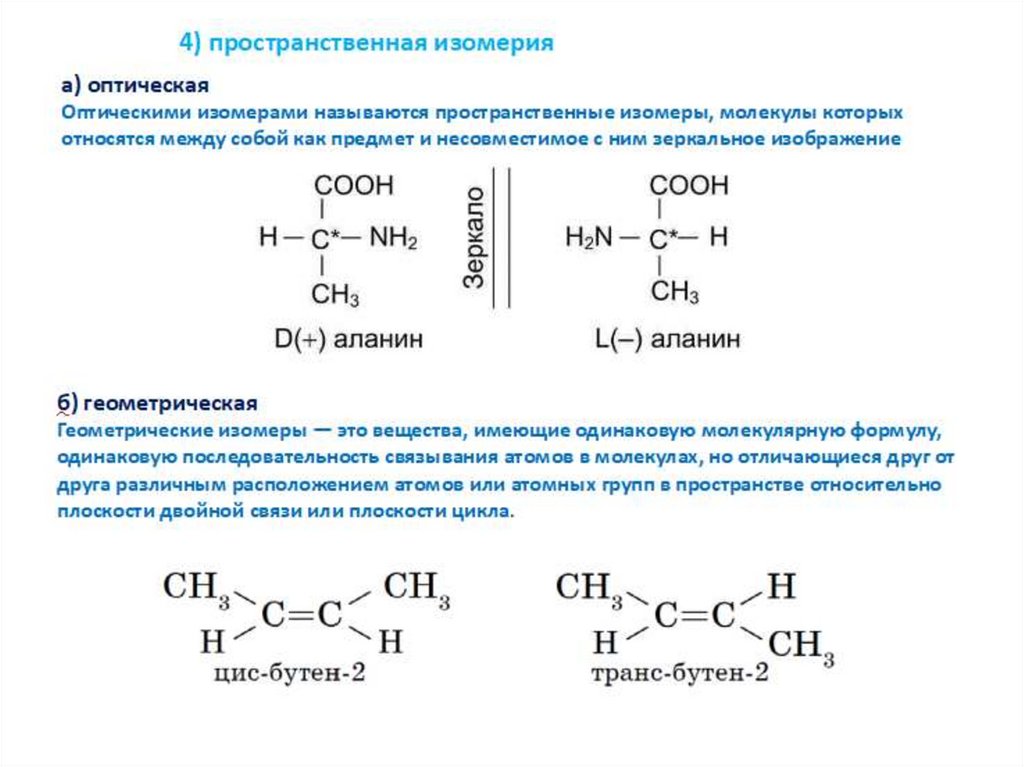
4) пространственная изомерияа) оптическая
Оптическими изомерами называются пространственные изомеры, молекулы которых
относятся между собой как предмет и несовместимое с ним зеркальное изображение
24.
Не писатьПример значимости пространственной изомерии:
Вред трансжиров для уровня холестерина в крови четко установлен. Трансизомеры
повышают уровень «плохого» холестерина в крови и снижают уровень «хорошего».
Они содействуют развитию болезней сердца и сосудов. Исследования на людях
показали, что трансизомеры усиливают воспалительные процессы в организме –
фактор риска сердечно-сосудистых заболеваний, диабета и других болезней.
Вред трансжиров также заключается в ухудшении состояния здоровья эндотелия,
пласта клеток, выстилающих поверхность кровеносных сосудов. Исследования на
приматах показали, что такие жиры способствуют набору веса, особенно в
брюшной области и инсулиновому сопротивлению – вестнику диабета.
25.
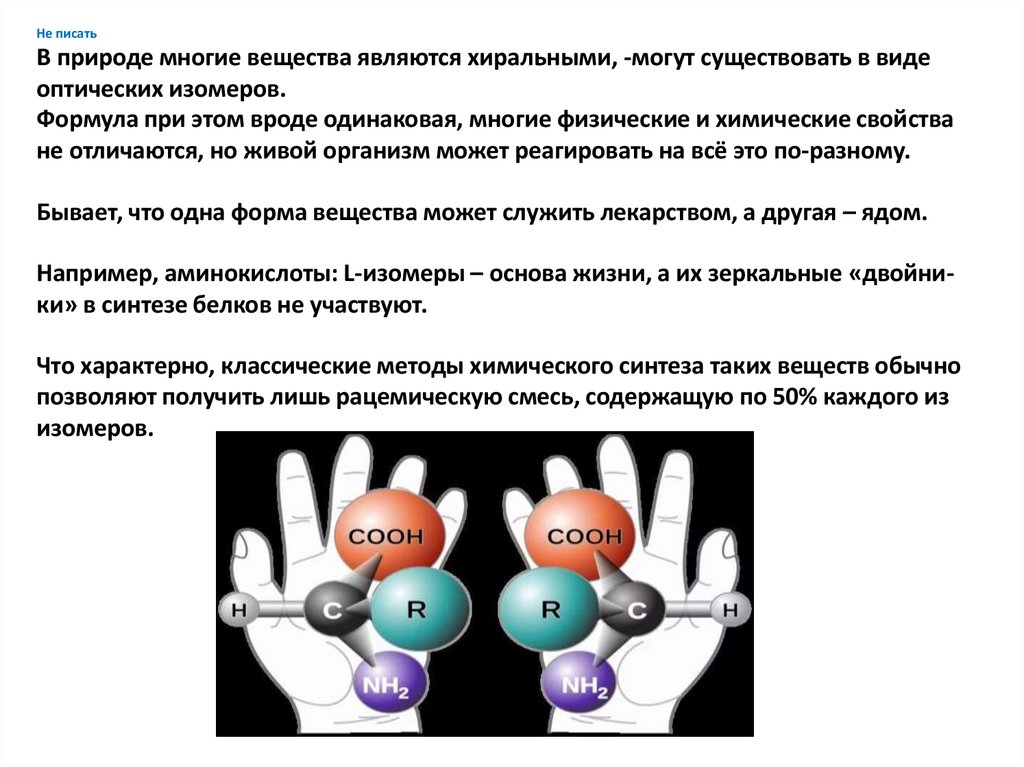
Не писатьВ природе многие вещества являются хиральными, -могут существовать в виде
оптических изомеров.
Формула при этом вроде одинаковая, многие физические и химические свойства
не отличаются, но живой организм может реагировать на всё это по-разному.
Бывает, что одна форма вещества может служить лекарством, а другая – ядом.
Например, аминокислоты: L-изомеры – основа жизни, а их зеркальные «двойники» в синтезе белков не участвуют.
Что характерно, классические методы химического синтеза таких веществ обычно
позволяют получить лишь рацемическую смесь, содержащую по 50% каждого из
изомеров.
26.
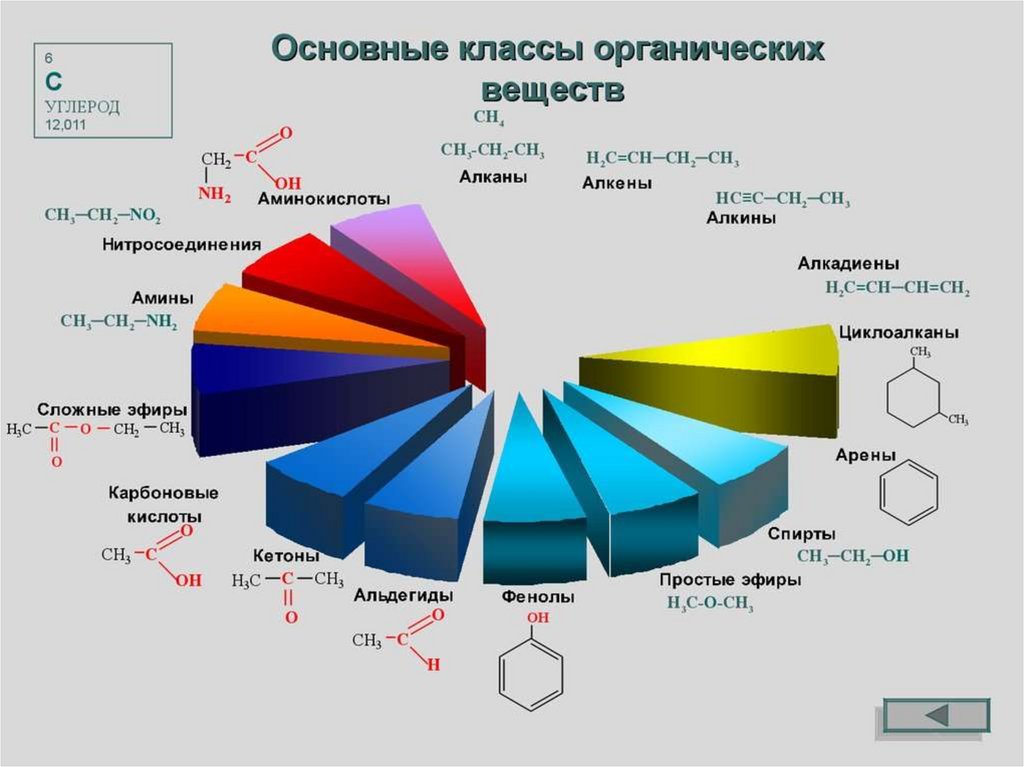
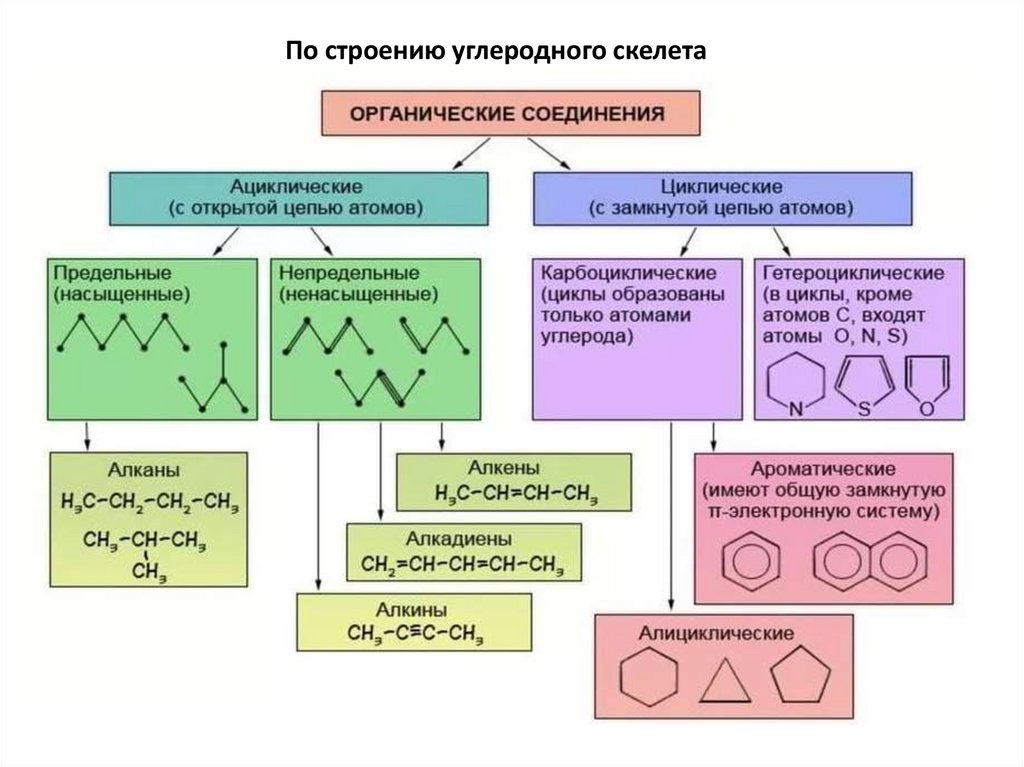
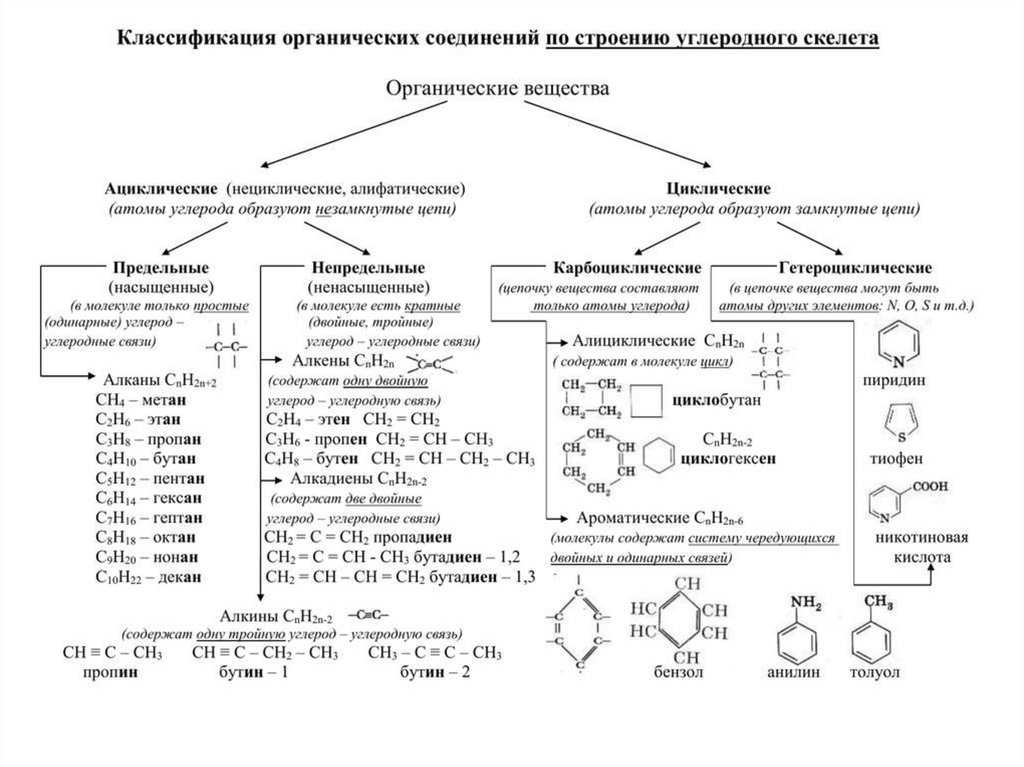
Классификация органических соединенийчаще всего осуществляется по двум критериям:
по строению
углеродного скелета
по природе
функциональной
группы
27.
По строению углеродного скелета28.
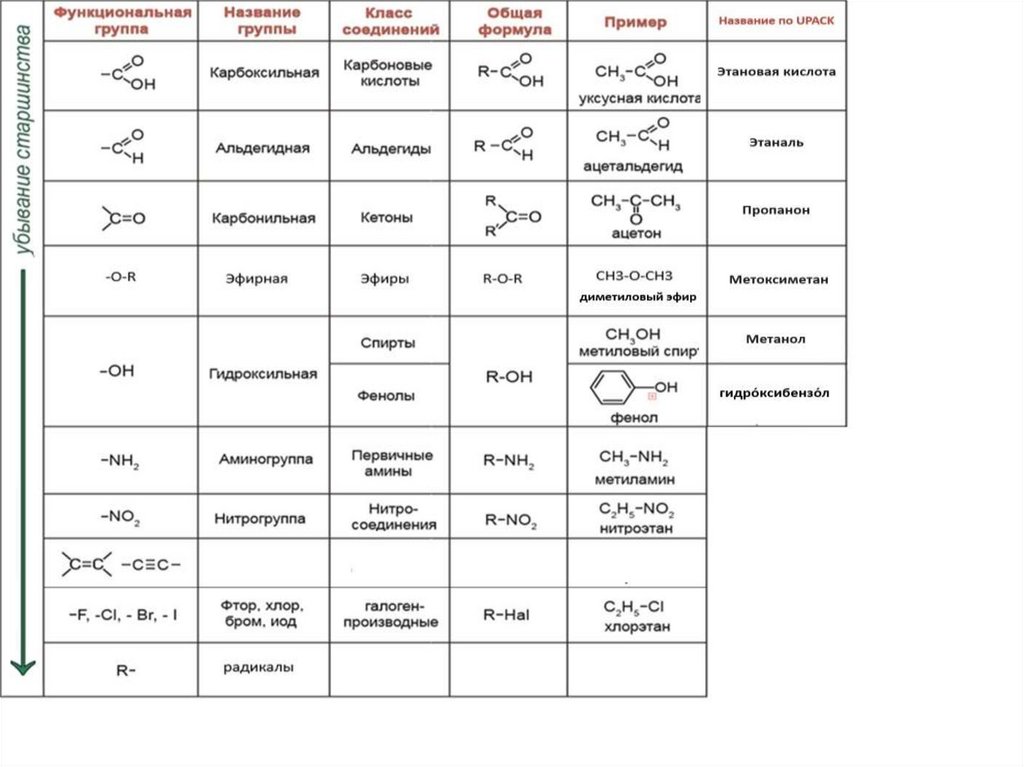
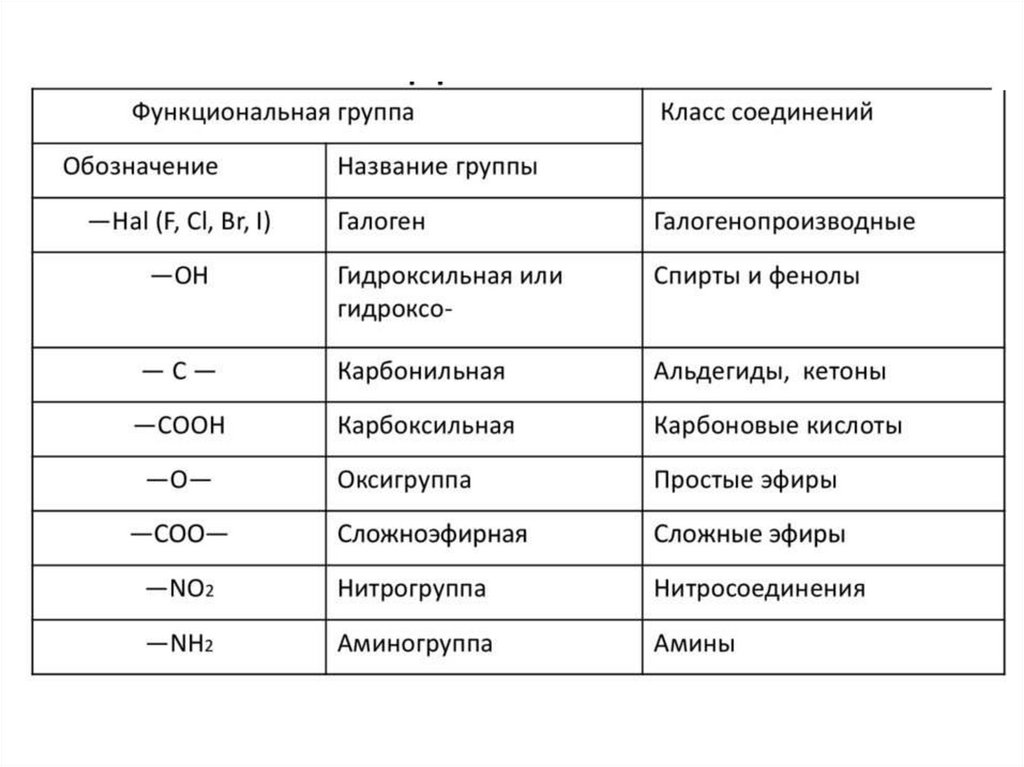
В зависимости от природы функциональной группыпроизводные углеводородов делят на классы органических
соединений.
• Функциональная группа – это атом или группа атомов,
которые определяют типичные химические свойства
соединения и его принадлежность к определенному классу
органических соединений.
• В качестве функциональной группы у ненасыщенных молекул
выступают двойные или тройные связи.
• Заместитель- любой атом, или группа атомов, замещающие в
исходном соединении атом водорода.
29.
30.
31.
32.
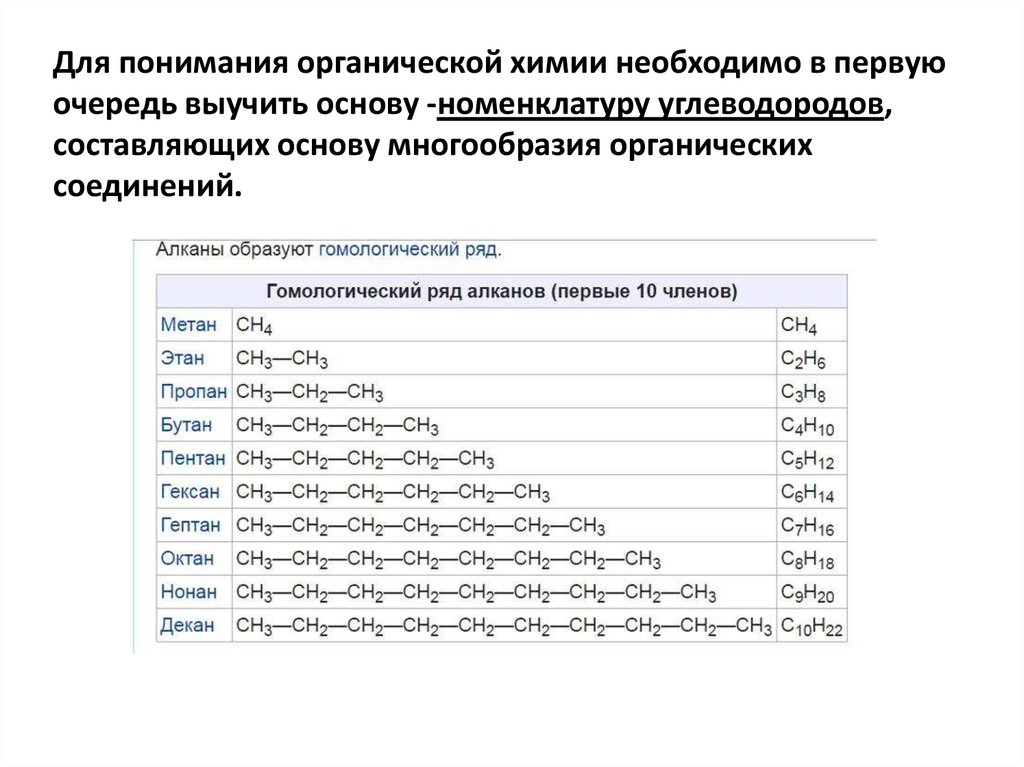
НЕОБХОДИМО ЗНАТЬ ПОНЯТИЕ:Гомологи́ческий ряд (от др.-греч. ὅμοιος «подобный,
похожий» + λογος «слово, закон») — ряд химических
соединений одного структурного типа (например, алканы),
отличающихся друг от друга по составу на определённое
число повторяющихся структурных единиц — так
называемую гомологическую разность.
Гомо́логи — вещества, входящие в один и тот же
гомологический ряд.
Простейший пример гомологического ряда — алканы
(общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8
и т. д.; гомологической разностью этого ряда является
метиленовое звено —СН2—.
33.
Сравнение понятий гомологии и изомерииПОНЯТИЕ
КАЧЕСТВЕННЫЙ
СОСТАВ
КОЛИЧЕСТВЕННЫЙ
СОСТАВ
ХИМИЧЕСКОЕ
СТРОЕНИЕ
ХИМИЧЕСКИЕ
СВОЙСТВА
Изомеры
одинаковый
одинаковый
различное
различные
Гомологи
одинаковый
различный
сходное
сходные
34.
35.
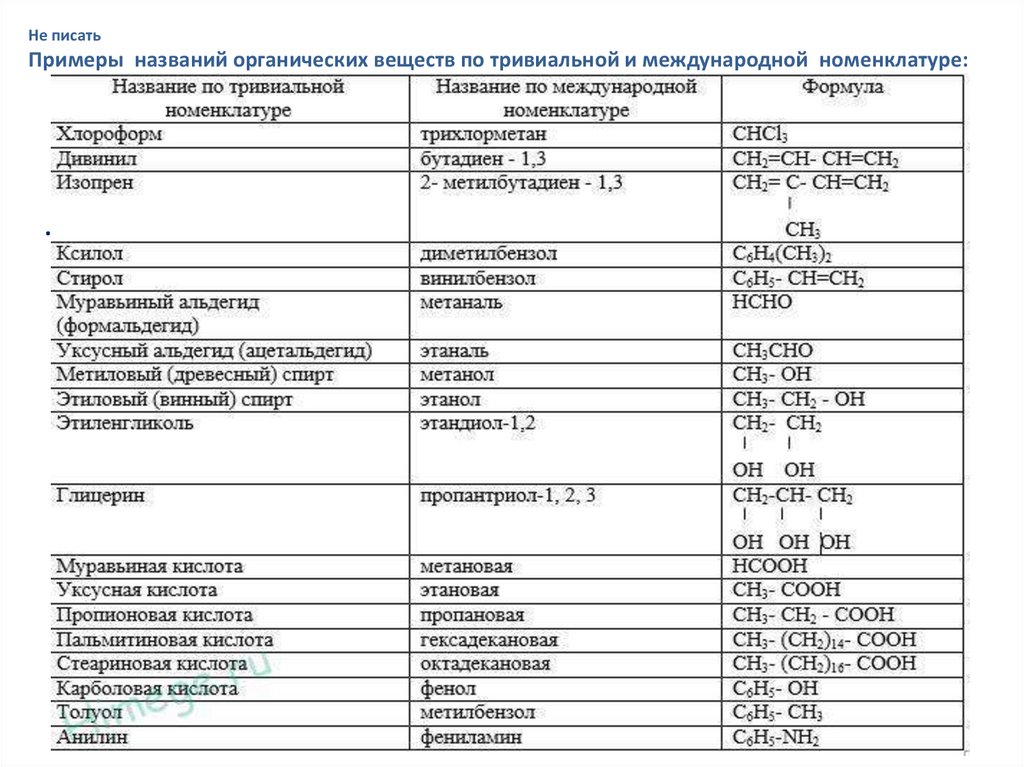
Не писатьПримеры названий органических веществ по тривиальной и международной номенклатуре:
.
36.
Не писатьЗначение тривиальных названий : остается актуальным, т.к. они
порой, более простые и удобные.
37.
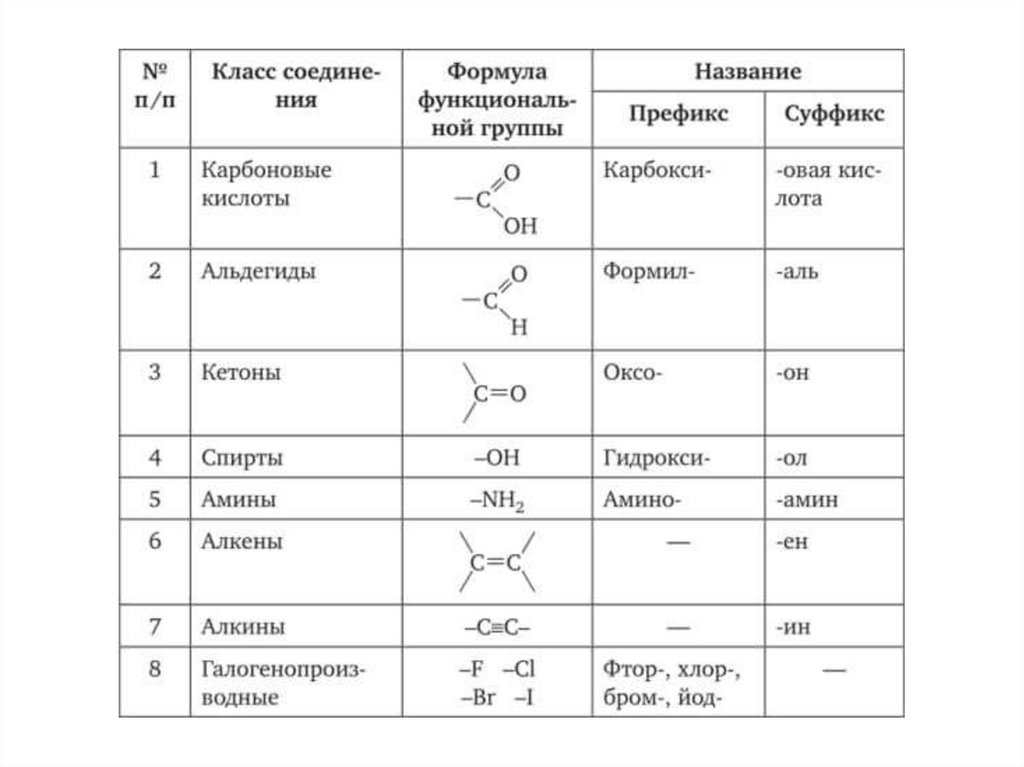
Для понимания органической химии необходимо в первуюочередь выучить основу -номенклатуру углеводородов,
составляющих основу многообразия органических
соединений.
38.
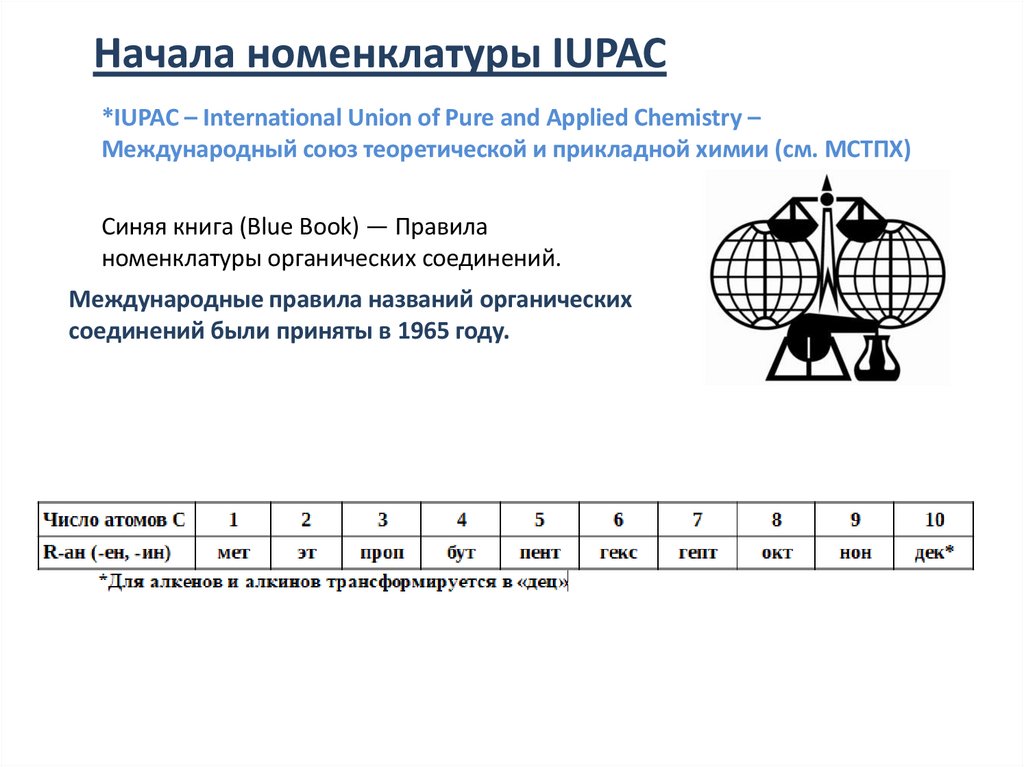
Начала номенклатуры IUPAC*IUPAC – International Union of Pure and Applied Chemistry –
Международный союз теоретической и прикладной химии (см. МСТПХ)
Синяя книга (Blue Book) — Правила
номенклатуры органических соединений.
Международные правила названий органических
соединений были приняты в 1965 году.
39.
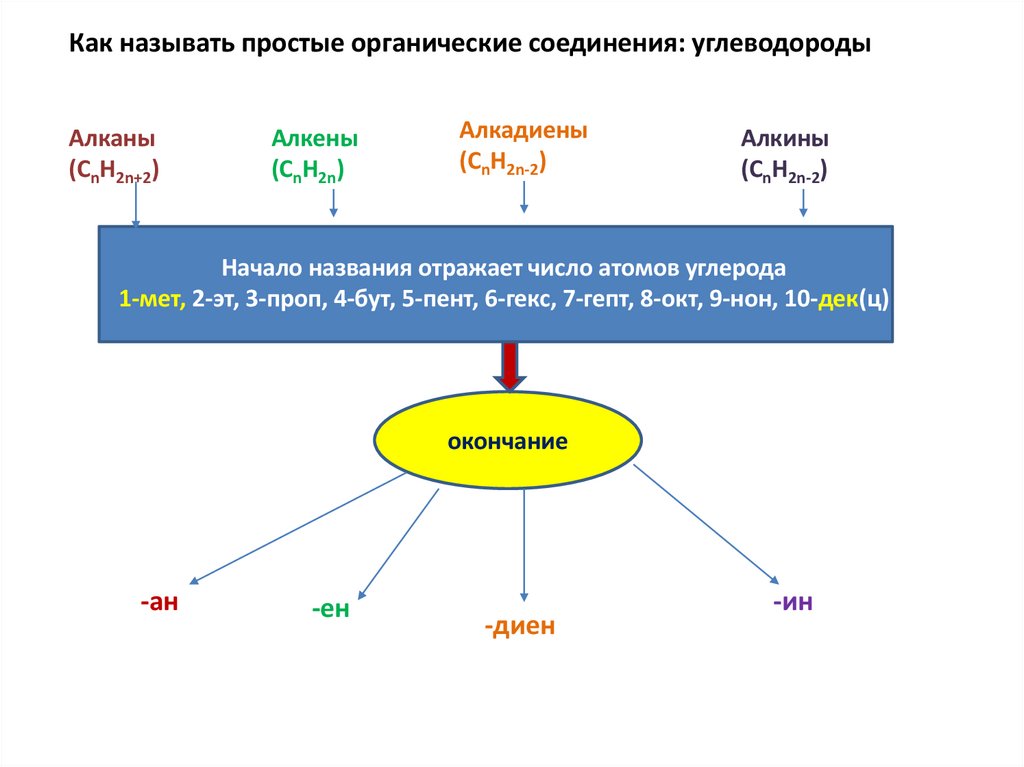
Как называть простые органические соединения: углеводородыАлканы
(СnH2n+2)
Алкены
(CnH2n)
Алкадиены
(CnH2n-2)
Алкины
(CnH2n-2)
Начало названия отражает число атомов углерода
1-мет, 2-эт, 3-проп, 4-бут, 5-пент, 6-гекс, 7-гепт, 8-окт, 9-нон, 10-дек(ц)
окончание
-ан
-ен
-диен
-ин
40.
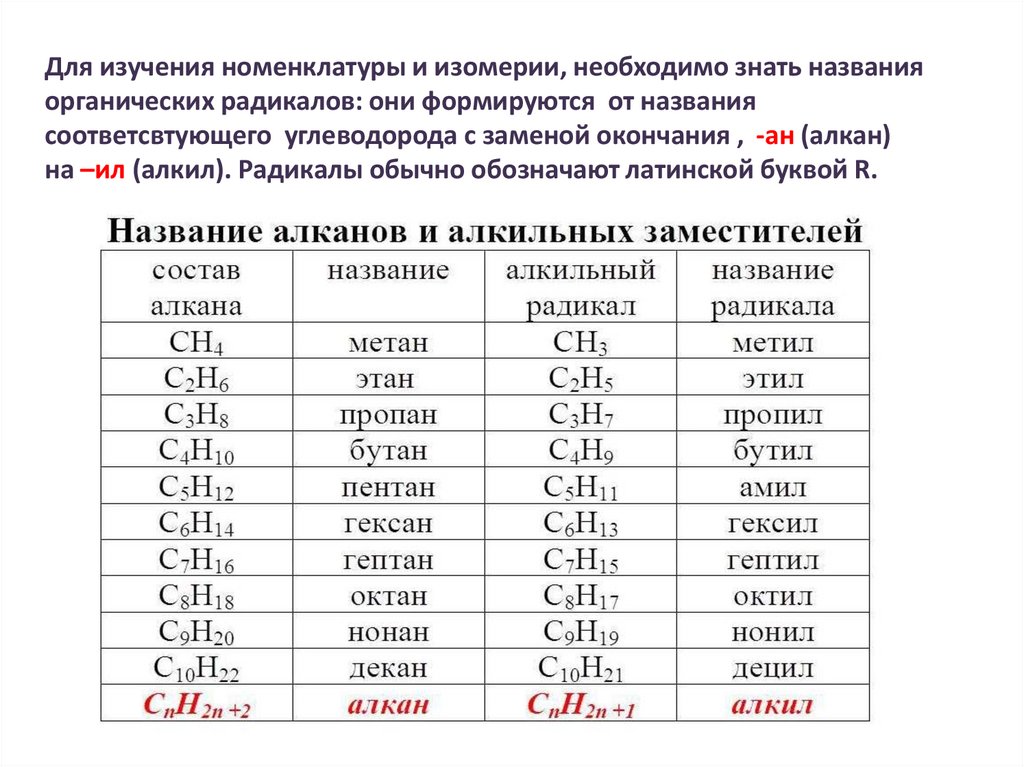
Для изучения номенклатуры и изомерии, необходимо знать названияорганических радикалов: они формируются от названия
соответсвтующего углеводорода с заменой окончания , -ан (алкан)
на –ил (алкил). Радикалы обычно обозначают латинской буквой R.
41.
Углеводородный радика́л (от лат. radix «корень»), также углеводоро́дный оста́токв химии — группа атомов, соединённая с функциональной группой молекулы,
имеющая неспаренные электроны.
Углеводородными радикалами обычно являются остатки углеводородов,
которые входят в состав многих органических соединений.
(Сокращенно, упрощенно)
42.
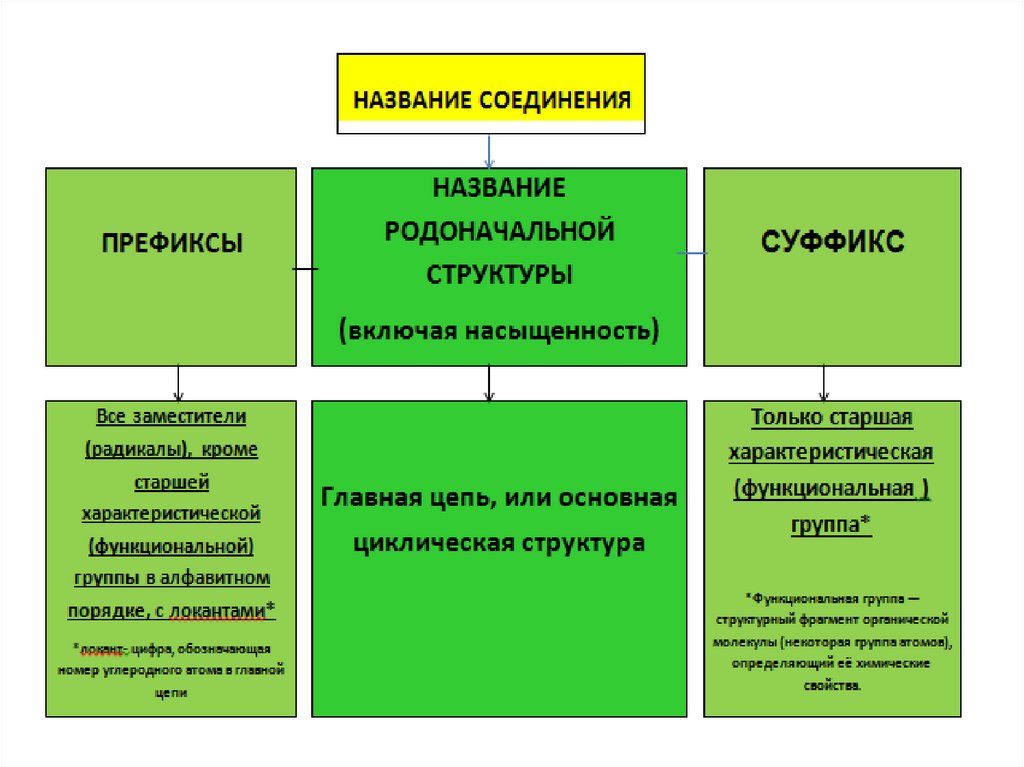
Алгоритм составления названия органическогосоединения по номенклатуре ИЮПАК
1) Выбрать самую длинную углеродную цепь. Она определит название.
2) Пронумеровать атомы углерода в этой цепи с того края, к которому
ближе старшая группа, либо кратная связь , либо разветвление .
3) Обозначить ненасыщенность, соответсвующим суффиксом (-ен, или -ин)
4) Назвать радикалы, начиная с простейшего, с указанием локации (номера
атома углерода в цепи). Если один и тот же радикал встречается несколько
раз, использовать приставку ди-, три-, тетра- соответственно.
5) Заканчивают название соединения старшей углеводородной цепью и
старшей функциональной группой, определяющей класс вещества в
соответствии со схемой:
43.
44.
Функциональные группы обозначаются префиксом , либо суффиксом, взависимости от условно принятого старшинства
45.
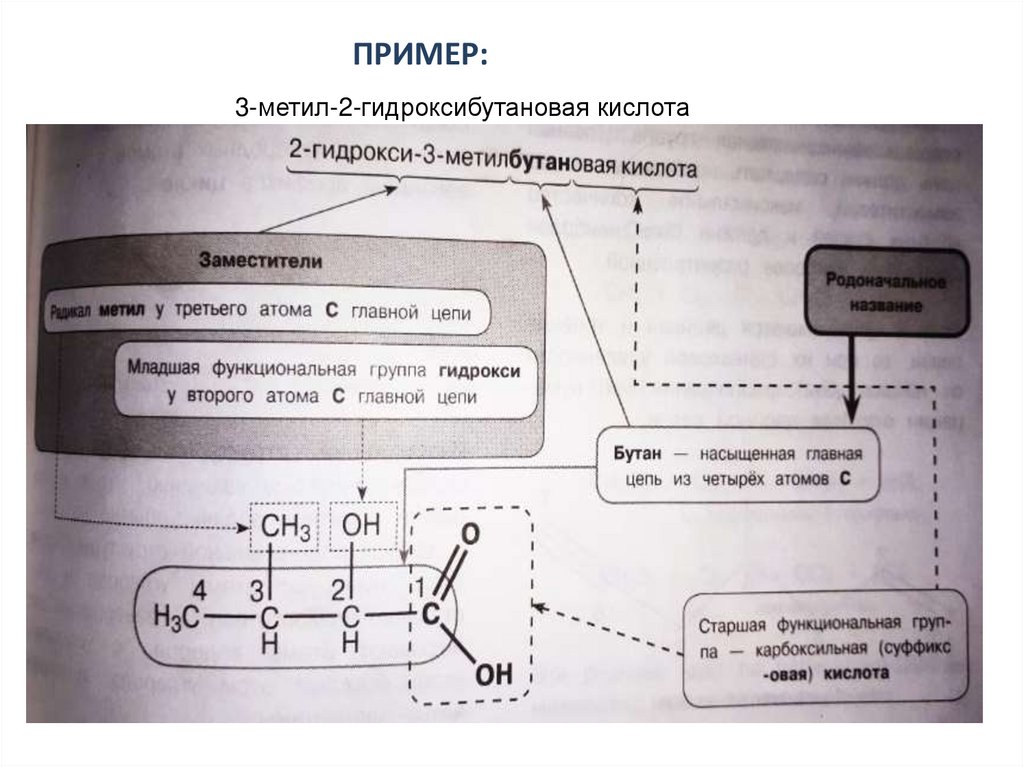
ПРИМЕР:3-метил-2-гидроксибутановая кислота
46.
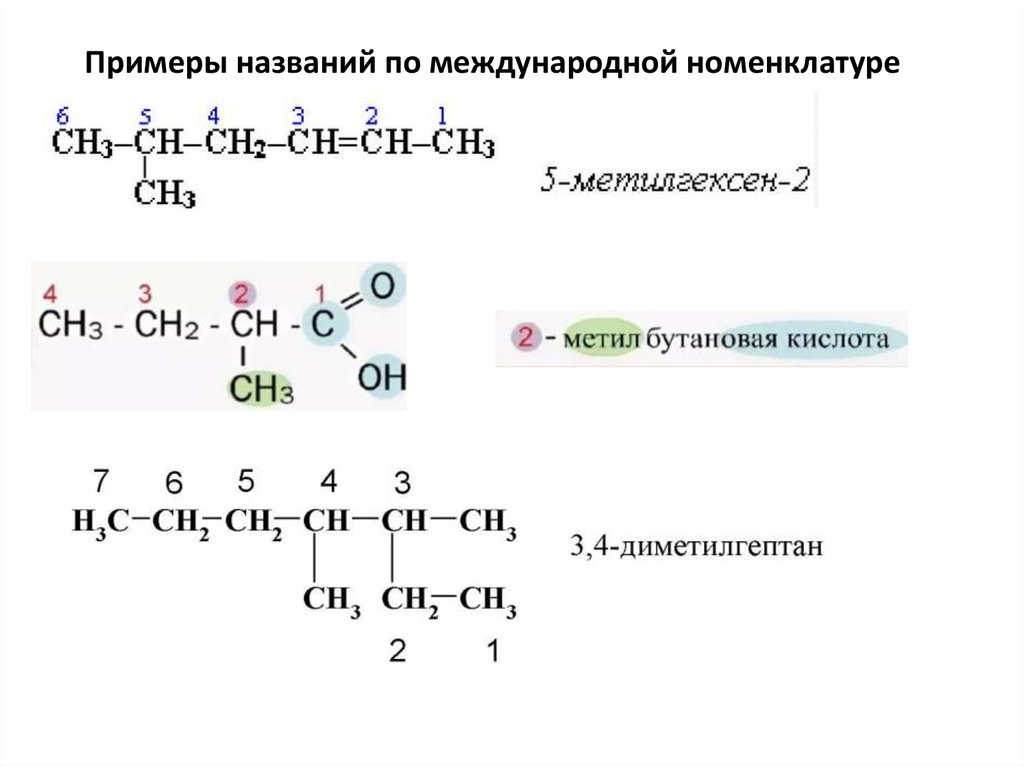
Примеры названий по международной номенклатуре47.
Мы узнали:48.
49.
Классификация химических реакций ворганической химии
Существует несколько критериев для классификации химических
реакций в органической химии. Наиболее общей является
классификация на основе связывания или удаления структурных
элементов, согласно которой различают реакции следующих типов:
50.
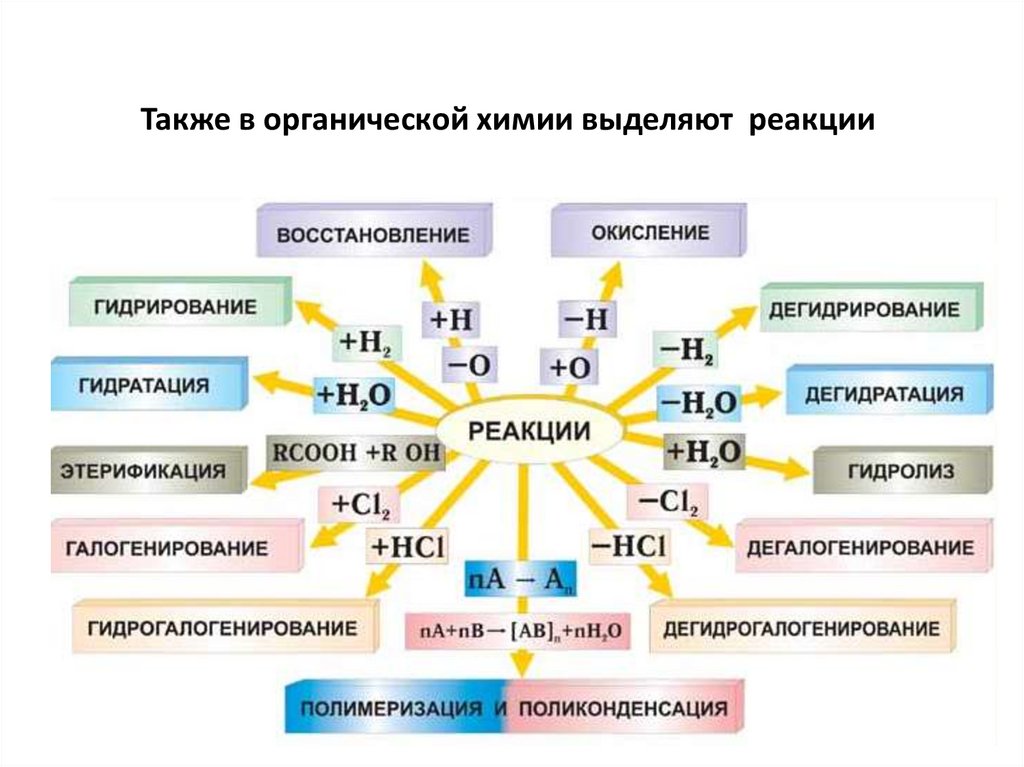
Также в органической химии выделяют реакции51.
Домашнее задание:1.Разобраться в материале лекции, выучить
наизусть.
2. Подготовиться к лабораторной работе № 9.






















 Химия
Химия








