Похожие презентации:
Предмет органической химии. Основные понятия. Лекция 1
1. 14.01.2022 Лекция 1. Предмет органической химии. Основные понятия
2. Навигация
темы2
3. Рекомендуемая литература:
Книги:1. Артеменко А. И. Органическая химия : учеб. пособие для студ. нехим.
специальностей вузов / А.И. Артеменко.— Изд. 2-е, перераб. — М. : Высш.
шк., 2005 .— 604 с.
2. Органическая химия. Черных В.П., Зименковский Б.С., Гриценко И.С.
3. Щербань А. И. Органическая химия : учебник для студ. вузов, обуч. по
направлению "Хим. технология и биотехнология", специальности "Хим.
технология" / А. И. Щербань .— Воронеж : Воронеж. гос. ун-т, 1998 .— 358 с.
4. Травень В. Ф. Органическая химия. 1, 2 том.
Методичка для лабораторных работ:
Органическая химия : учебно-методическое пособие для студ. 2 к. сред.
проф. образования фармацевт. фак. специальности 33.02.01 - Фармация / А.
Л. Сабынин, С. М. Медведева. — Воронеж : Издательский дом ВГУ, 2018 . – 42
с.
3
4.
План лекции• Предмет и задачи органической химии, ее значение для
фармации.
• История развития органической химии.
• Теория строения А.М. Бутлерова.
• Изображение органических соединений
• Классификация и номенклатура органических
соединений. Понятие о функциональных группах.
Основные классы органических соединений.
4
5. Предмет органической химии
Органическая химия – наука, изучающая вещества, выделенные из животных
и растений 1808 г. Теория витализма, Берцелиус
Органическая химия – раздел химии, который изучает соединения углерода.
Органическая химия –наука, изучающая углеводороды и их производные.
1889 г. Карл Шорлеммер
• Органическая химия – раздел химии, посвященный изучению
строения, способов синтеза и химических превращений
углеводородов и их функциональных производных.
К началу XXI века химики выделили в чистом виде более 18
миллионов соединений углерода и меньше миллиона
соединений всех остальных элементов.
5
6. История развития органической химии
• Теория радикалов (Ю. Либих, Ф. Вёлер, Й. Берцелиус).Авторы этой теории считали, что если радикалы не изменяются при химических
превращениях, то подобно тому, как неорганические вещества состоят из атомов,
органические — состоят из радикалов.
• Теория типов (Шарль Фредерик Жерар).
В отличие от теории радикалов, акцентирующей внимание в химических превращениях на
неизменяемой части молекулы — радикале, теория типов появилась в результате
обобщения наблюдений за изменяемой частью молекулы (то, что сегодня мы называем
функциональной группой). Эти наблюдения легли в основу классификации органических
соединений по типам химических превращений. Первоначально были выделены аналоги
(типы) воды, хлороводорода, аммиака, водорода, затем появился тип метана.
6
7. Теория химического строения органических соединений. Используя открытие немецкого химика Фридриха Августа Кекуле о
четырехвалентности атома углерода (1857) ишотландского химика Арчибальда Скотта Купера о способности атомов углерода
соединяться в длинные цепи (1858), А. М. Бутлеров создал теорию хим. стр. орг. соед-ий.
7
8.
А. М. Бутлеров создал теорию хим. стр. орг. соед-ий.
Основные положения теории химического строения:
1. Химическое строение.
Входящие в состав молекулы органических соединений атомы связаны друг с другом в
строго определенном порядке, согласно их валентности. Последовательность связывания
атомов в молекуле называется химическим строением.
С-4; Н-1; O-2; N-3 (С-N); S-2
2. Явление изомерии.
Свойства вещества зависят не только от того, какие атомы и в каком количестве входят
в состав молекулы, но и от того, в какой последовательности они связаны между собой, то
есть от химического строения молекулы.
*Изомеры – это вещества с одинаковым количественным и качественным составом (химической
формулой), но разным строением.
3. Взаимная зависимость строения и свойств.
Изучив реакционную способность вещества, можно установить его строение и,
наоборот, по строению вещества судить о его свойствах.
4. Взаимное влияние атомов.
Образующие молекулу атомы или группы атомов, связанные непосредственно или через
другие атомы, оказывают взаимное влияние друг на друга, от чего зависит реакционная
способность молекулы.
Зная строение молекулы можно предположить его свойства и наоборот.
8
9. Значение теории химического строения А.М. Бутлерова
910.
Теория пространственного расположения атомов в молекулах (стереохимическая
теория), 70-х гг. XIX в. Вант-Гофф и Ле Бель.
Пришли к выводу о тетраэдрической направленности связей атома углерода в пространстве
(четыре валентности атома углерода направлены к углам тетраэдра, в центре которого
находится углеродный атом). Эта теория позволила объяснить загадочный до того вид
изомерии – оптическую изомерию.
Электронная теория химической связи (теория электронных пар), 1916 год Гильберт
Ньютон Льюис
Предложена теория, согласно которой химическая связь в органических соединениях
представлена парой электронов, выделяемых по одному каждым из связываемых атомов.
Кроме того, Г. Н. Льюис высказал предположение, что электронная пара, участвующая в
образовании химической связи, может смещаться к одному из атомов.
• Теория электронных смещений. Р. Робинсон (1922 К. Ингольд (1926—1934). Введены и
развиты представления о смещении электронов в простых связях (индуктивный эффект) и
кратных (мезомерный эффект).
• Теория резонанса. Л. Полинг
Теория основана на квантово-механических методах описания структуры молекул — метод
молекулярных орбиталей (Джо Эдвард Леннард-Джонс, Роберт Сандерсон Малликен, Фридрих
Хунд, 1928—1932) и метод валентных связей (Лайнус Карл Полинг, Джон Кларк Слейтер,
1931—1934).
10
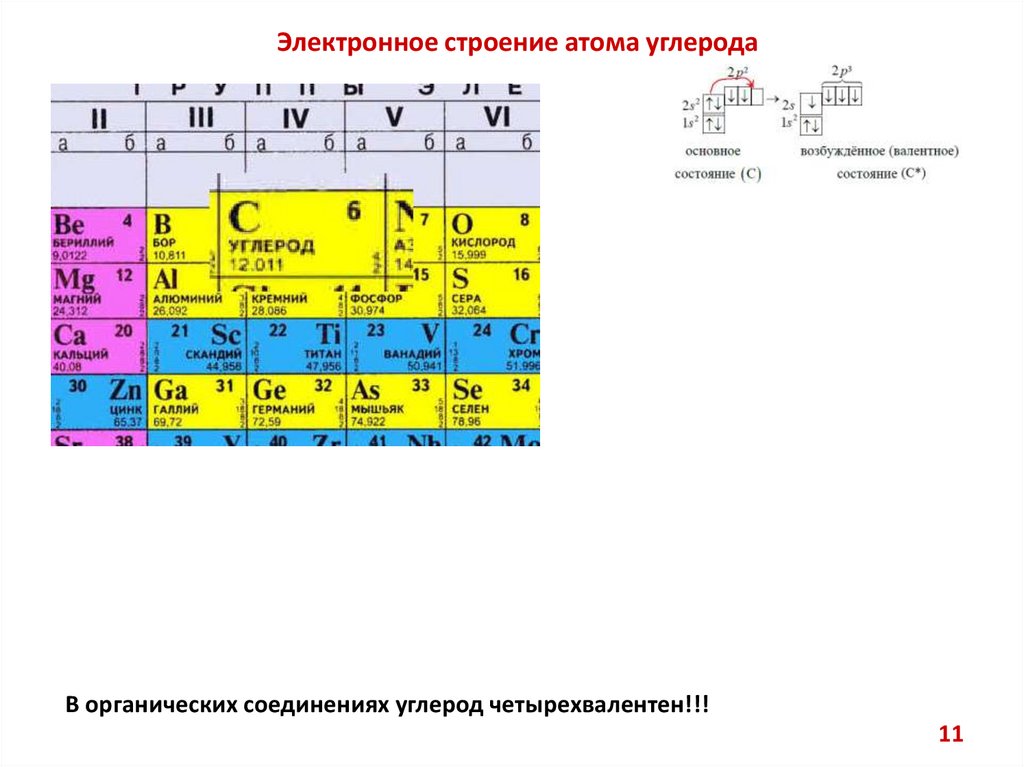
11.
Электронное строение атома углеродаВ органических соединениях углерод четырехвалентен!!!
11
12. Первичным называют атом углерода, непосредственно связанный только с одним атомом углерода, вторичный — с двумя, третичный —с
тремя, четвертичный счетырьмя, соответственно.
12
13. Изображение органических соединений
Брутто-формула или молекулярная формулаПолная структурная формула
Сокращенные структурные формулы
Графические формулы
13
14. Изображение органических соединений
Брутто-формула или молекулярная формула. показывает, какие атомы и в каком
количестве входят в состав молекулы.
• Полная структурная формула. Структурная формула отражает природу атомов,
входящих в состав молекулы, их число и последовательность связывания, а также
тип связей между ними.
Химические связи в структурной формуле условно принято обозначать черточкой
(каждая связь – это пара электронов).
• Сокращенные структурные формулы. Часть связей не обозначается, а приводятся
лишь те, которые необходимы для однозначного описания структуры молекулы.
• Графические формулы. углеродный остов молекулы изображают только посредством
валентных связей без обозначения атомов углерода и связей С—Н. Предполагают, что
координационное число каждого углеродного атома дополняется до четырёх атомами
водорода. Таким образом, концевые прямые линии обозначают метильные группы, а
не атомы водорода.
14
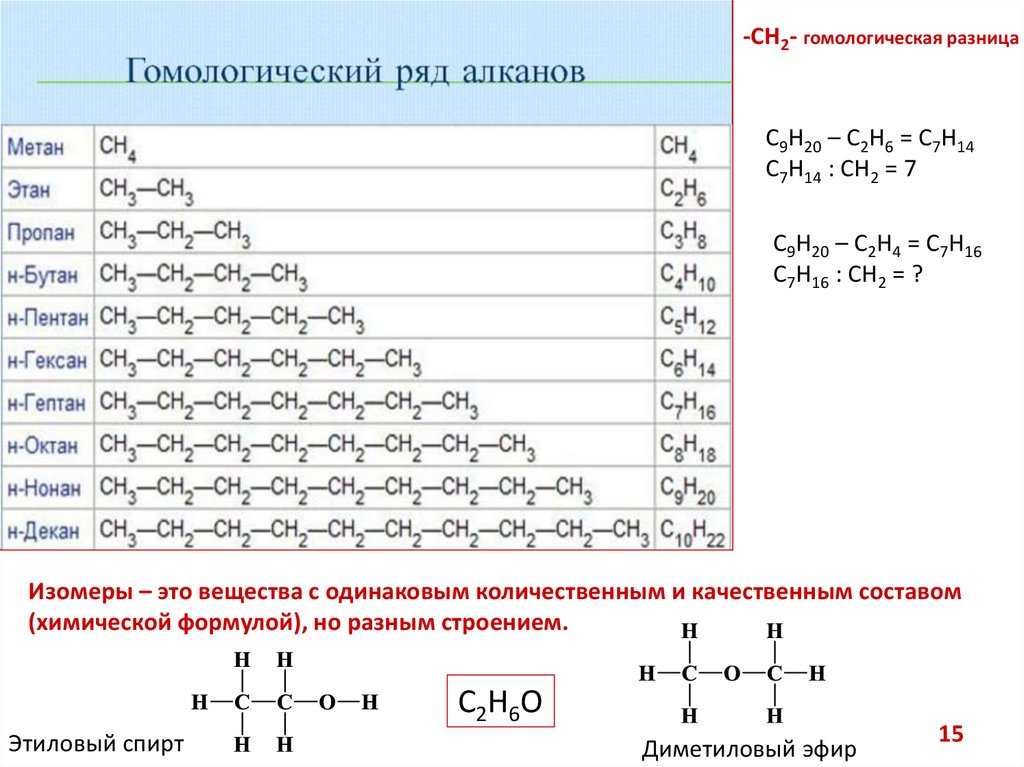
15.
-СH2- гомологическая разницаC9H20 – C2H6 = C7H14
C7H14 : CH2 = 7
C9H20 – C2H4 = C7H16
C7H16 : CH2 = ?
Изомеры – это вещества с одинаковым количественным и качественным составом
(химической формулой), но разным строением.
С2H6O
Этиловый спирт
Диметиловый эфир
15
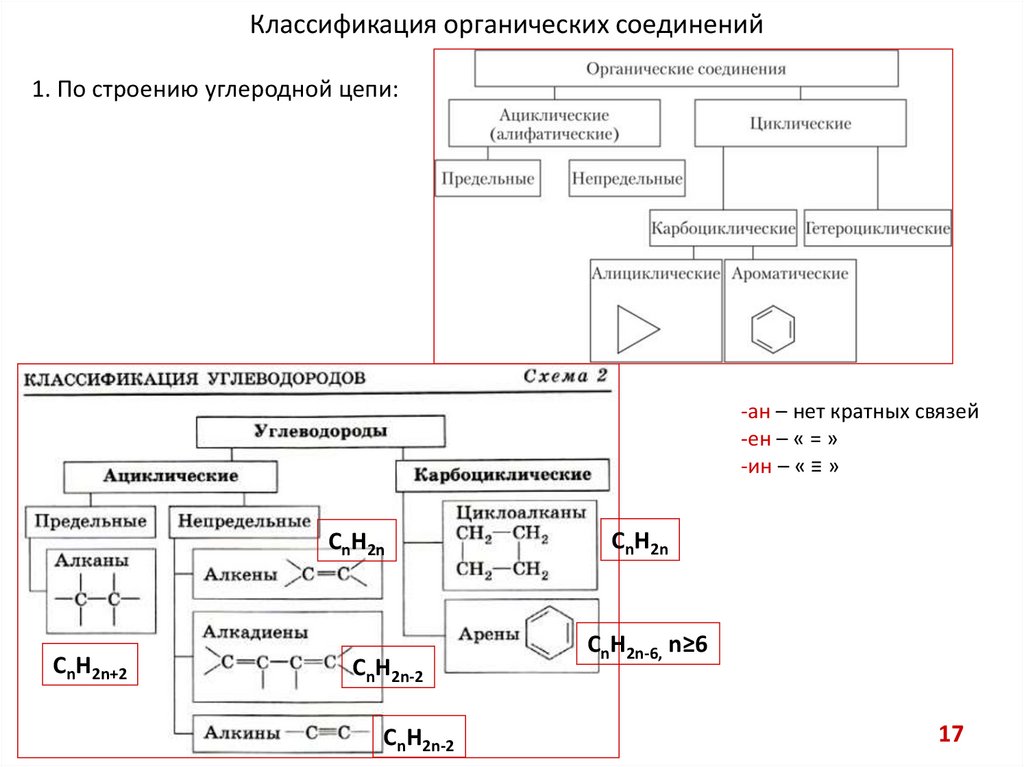
16. Классификация органических соединений (ф.гр)
1617.
Классификация органических соединений1. По строению углеродной цепи:
-ан – нет кратных связей
-ен – « = »
-ин – « ≡ »
CnH2n
CnH2n+2
CnH2n-2
CnH2n-2
CnH2n
CnH2n-6, n≥6
17
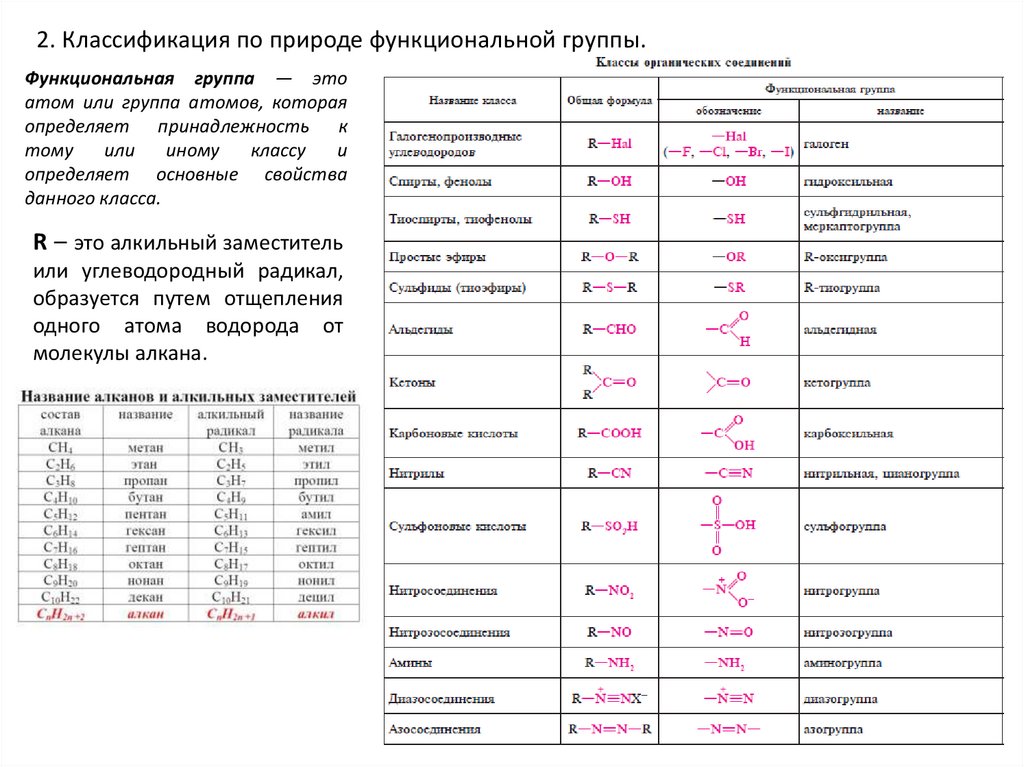
18.
2. Классификация по природе функциональной группы.Функциональная группа — это
атом или группа атомов, которая
определяет принадлежность к
тому
или
иному
классу
и
определяет основные свойства
данного класса.
R – это алкильный заместитель
или углеводородный радикал,
образуется путем отщепления
одного атома водорода от
молекулы алкана.
18
19.
По количеству и однородности функциональных групп органические соединения делят
на монофункциональные, полифункциональные и гетерофункциональные.
Монофункциональные содержат одну функциональную группу, полифункциональные —
несколько одинаковых, а гетерофункциональные — несколько различных групп:
19
20. Номенклатура органических соединений
2021. Номенклатура органических соединений
Тривиальная (природные источники соединений, способы получения, характерные свойства). Тривиальные
названия не отражают реального химического строения. (Муравьиная, уксусная, лимонная кислоты и др.)
Рациональная. В основе рациональных названий используется принцип деления органических соединений
на гомологические ряды.
Гомологическим называют ряд соединений, в котором каждый последующий представитель отличается от
предыдущего на группу СН2.
международная номенклатура (систематическая) ИЮПАК
В основу названия положена самая длинная углеродная цепь или цикл, в состав которой входит одна или
несколько функциональных групп.
Нумерацию углеродной цепи начинают с того конца к которому ближе расположена функциональная группа
(если их несколько определяется старшинство функциональных групп, согласно таблице). Если в структуре
соединения нет функциональных групп, то нумерация начинается с конца, к которому ближе всего расположен
заместитель или алкильный радикал.
Самая старшая функциональная группа является характеристической группой и указывается в суффиксе названия
соединения
Все заместители и не старшие функциональные группы нужно указывать в префиксе (приставке) названия
соединения.
Предельные углеводороды (алканы) имеют суффикс – ан (одинарная связь), непредельные – алкены – ен
(двойная связь), алкины – ин (тройная связь)
Положение заместителей и кратных связей указывают цифрами или буквами (локантами). При наличии в
молекуле нескольких одинаковых заместителей или кратных связей для их обозначения применяют
множительные приставки: ди( два), три (три), тетра( четыре), пента(пять) и т. д.
3-хлорбутаналь
2-метилбутан
21
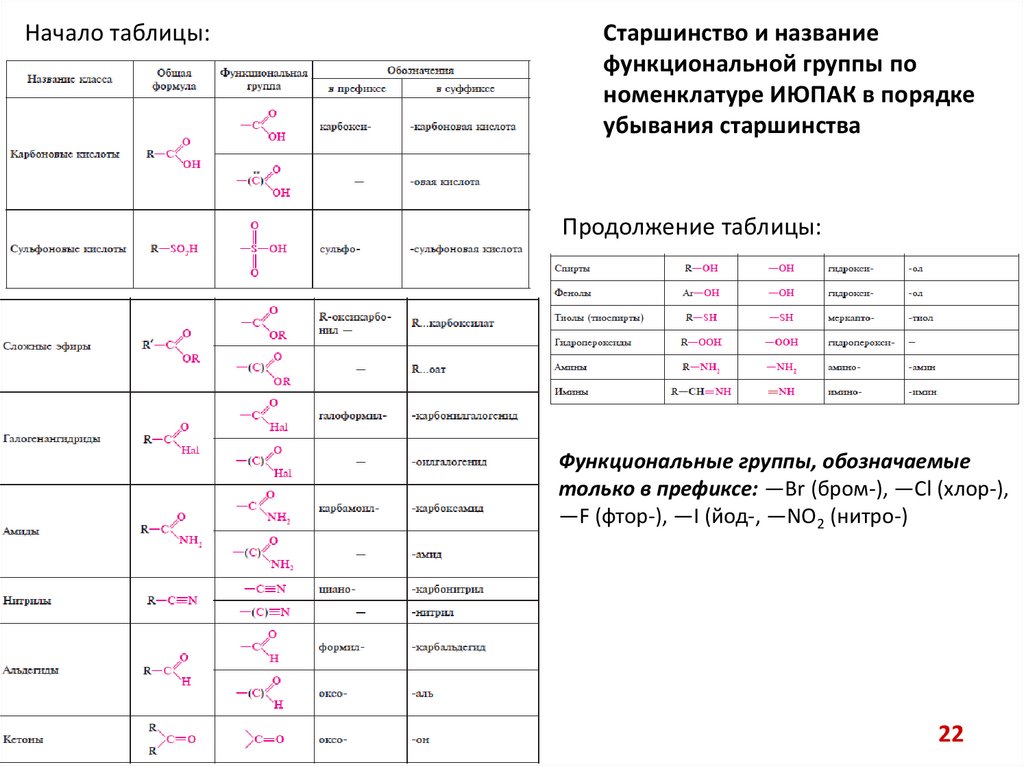
22.
Начало таблицы:Старшинство и название
функциональной группы по
номенклатуре ИЮПАК в порядке
убывания старшинства
Продолжение таблицы:
Функциональные группы, обозначаемые
только в префиксе: —Br (бром-), —Cl (хлор-),
—F (фтор-), —I (йод-, —NO2 (нитро-)
22
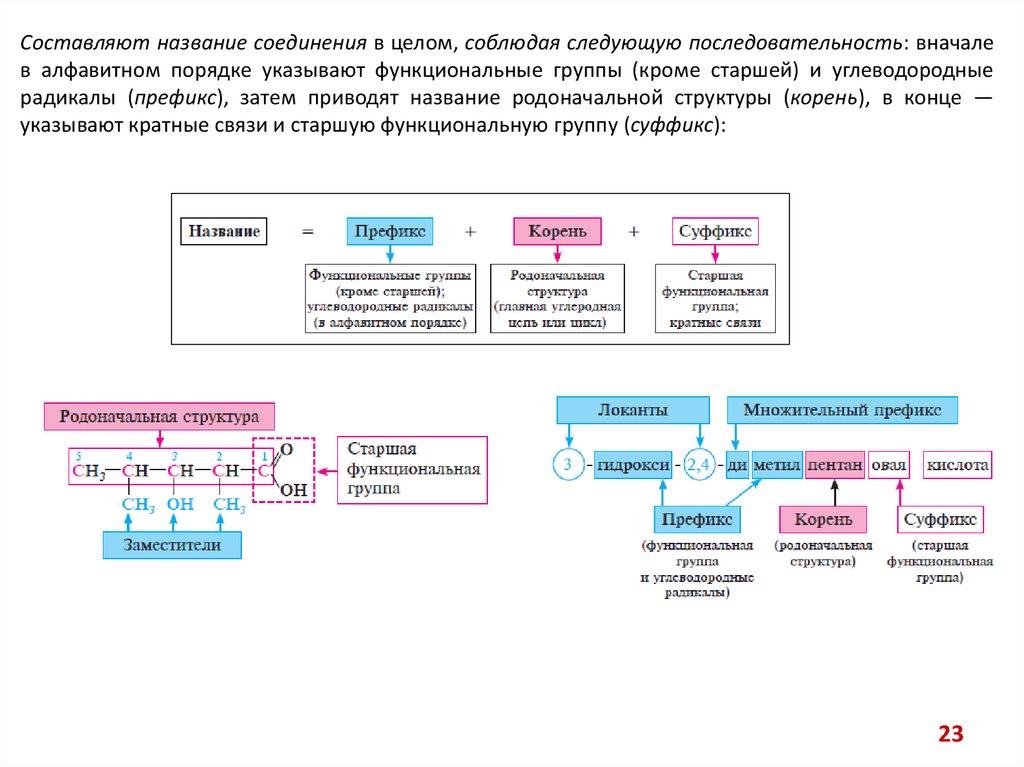
23.
Составляют название соединения в целом, соблюдая следующую последовательность: вначалев алфавитном порядке указывают функциональные группы (кроме старшей) и углеводородные
радикалы (префикс), затем приводят название родоначальной структуры (корень), в конце —
указывают кратные связи и старшую функциональную группу (суффикс):
23
24.
Алгоритм составления названия органических соединенийЧтобы назвать соединение по систематической номенклатуре ИЮПАК нужно:
1) выбрать родоначальную структуру, которая будет корнем названия;
2) выявить все имеющиеся в соединении функциональные группы;
3) установить, какая группа является старшей; название этой группы отражается
окончанием в названии соединения; все остальные функциональные группы дают в
виде префиксов (приставок);
4) обозначить ненасыщенность соответствующим суффиксом (-ен или –ин);
5) пронумеровать главную цепь, придавая старшей группе наименьший из возможных
номеров (локантов);
6) перечислить префиксы (приставки) в алфавитном порядке ( при этом умножающие
приставки ди-, три- и т. д. не учитываются), цифрами отмечая места примыкания их к
родоначальной структуре;
7) составить полное название соединения
24



















 Химия
Химия








