Похожие презентации:
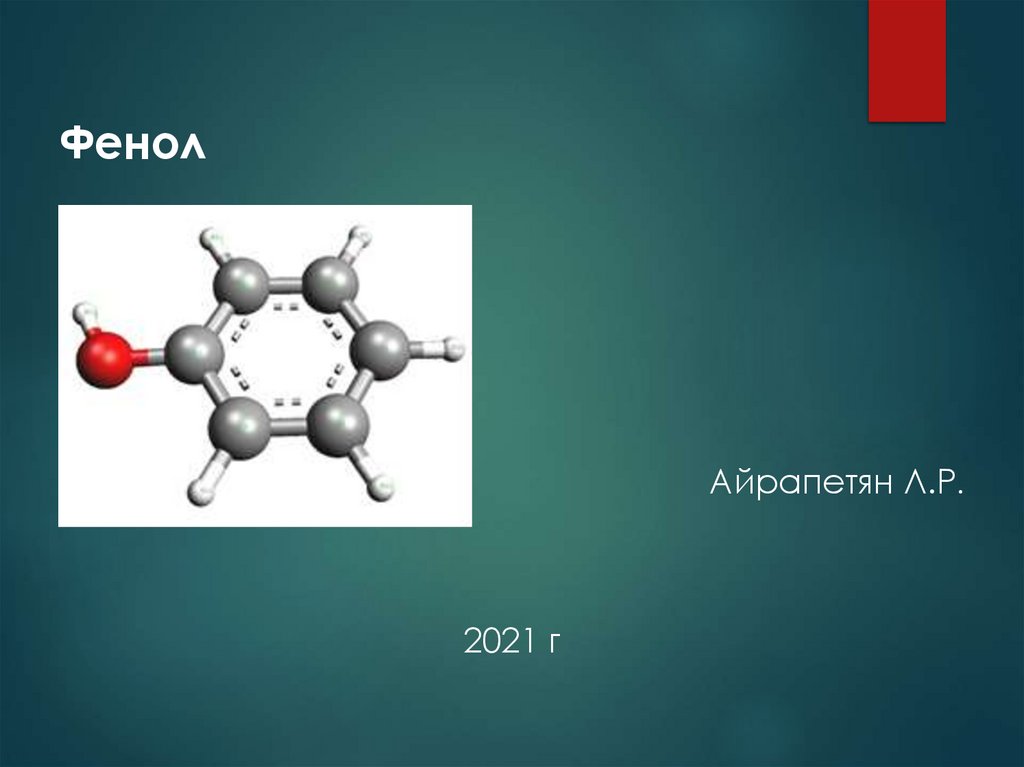
Фенол
1.
ФенолАйрапетян Л.Р.
2021 г
2. Применение
- для производства поликарбонатов и эпоксидных смол;- производство фенолформальдегидных смол;
- для получения искусственных волокон — нейлона и
капрона;
- используется в нефтепереработке для селективной
очистки масел;
- на производство антиоксидантов (ионол), неионогенных
ПАВ, лекарственных препаратов (аспирин), антисептиков
(ксероформа) и пестицидов.
- раствор 1,4 % фенола применяется в медицине
(«Орасепт» и «Фукорцин») как обезболивающее и
антисептическое средство.
- используют в качестве консерванта в вакцинах.
- как химический пилинг в косметологии (токсично).
- в скотоводстве: дезинфекция животных растворами
фенола и его производных.
3. Токсические свойства
Фенол ядовит. Относится к высокоопаснымвеществам (Класс опасности II). При вдыхании
вызывает нарушение функций нервной системы.
Пыль, пары и раствор фенола раздражают
слизистые оболочки глаз, дыхательных путей, кожу,
вызывая химические ожоги.
4.
5.
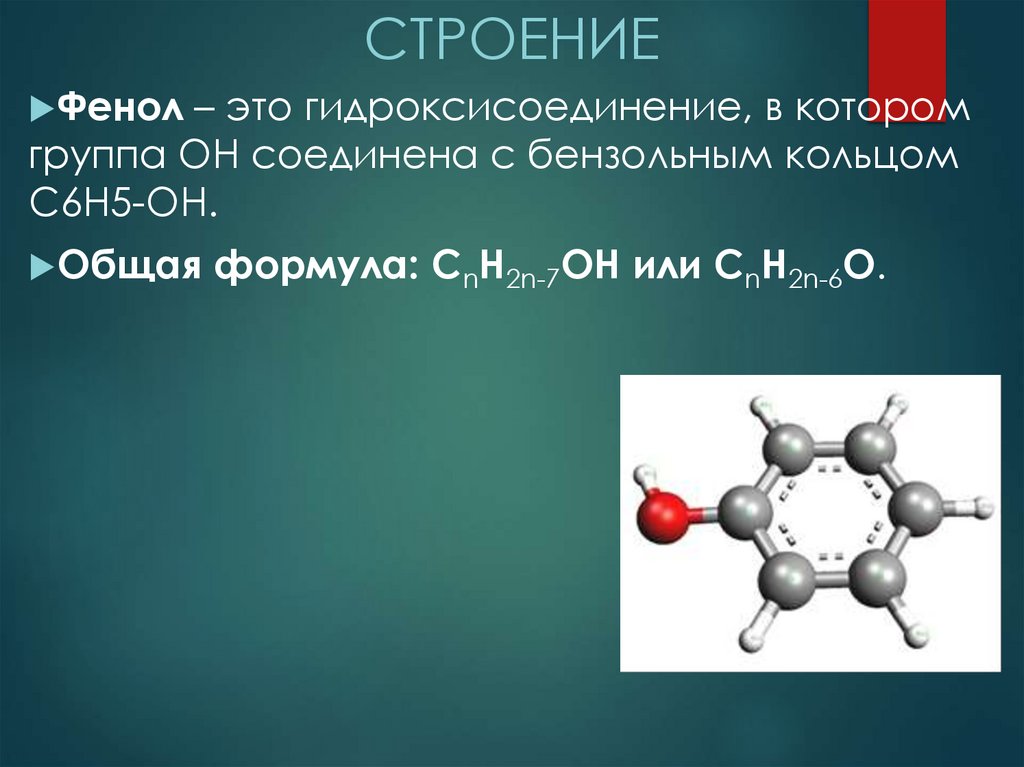
СТРОЕНИЕФенол – это гидроксисоединение, в котором
группа ОН соединена с бензольным кольцом
С6Н5-OH.
Общая формула: CnH2n-7OH или CnH2n-6O.
6. Химические свойства
Сходство и отличие фенола и спиртов.Сходство: как фенол, так и спирты реагируют с щелочными
металлами с выделением водорода.
Отличия:
• Фенол не реагирует с галогеноводородами: ОН- группа
очень прочно связана с бензольным кольцом, её нельзя
заместить;
• Фенол не вступает в реакцию этерификации, эфиры
фенола получают косвенным путем;
• фенол не вступает в реакции дегидратации.
• фенол обладает более сильными кислотными свойствами и
вступает в реакцию со щелочами.
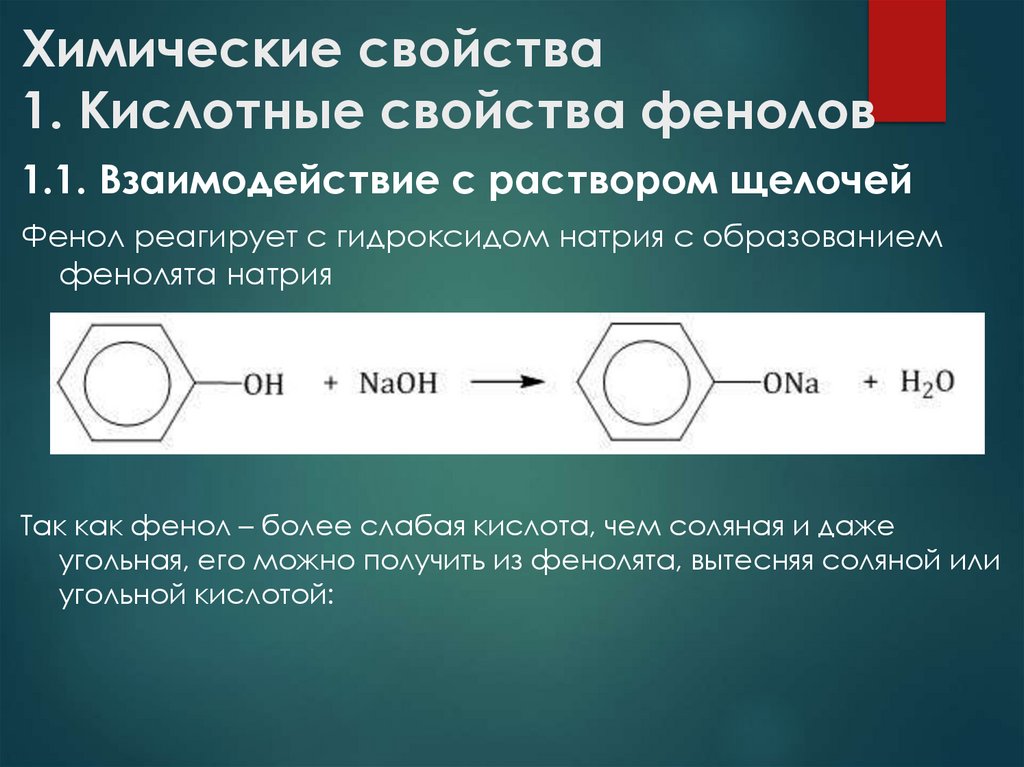
7. Химические свойства 1. Кислотные свойства фенолов
1.1. Взаимодействие с раствором щелочейФенол реагирует с гидроксидом натрия с образованием
фенолята натрия
Так как фенол – более слабая кислота, чем соляная и даже
угольная, его можно получить из фенолята, вытесняя соляной или
угольной кислотой:
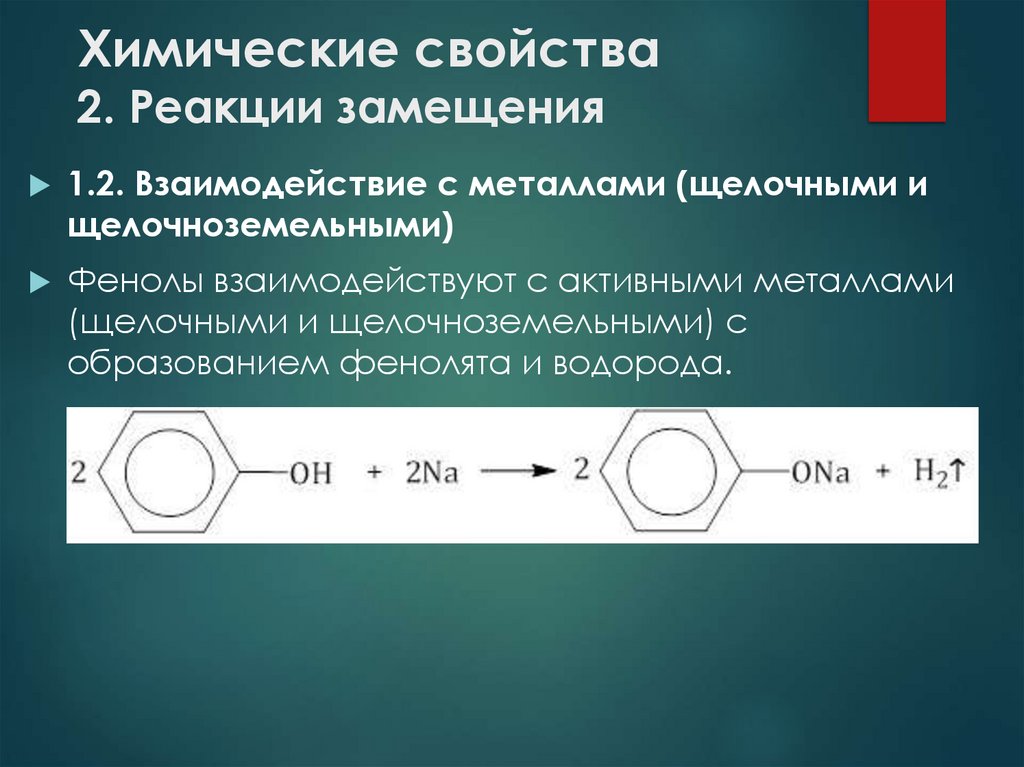
8. Химические свойства 2. Реакции замещения
1.2. Взаимодействие с металлами (щелочными ищелочноземельными)
Фенолы взаимодействуют с активными металлами
(щелочными и щелочноземельными) с
образованием фенолята и водорода.
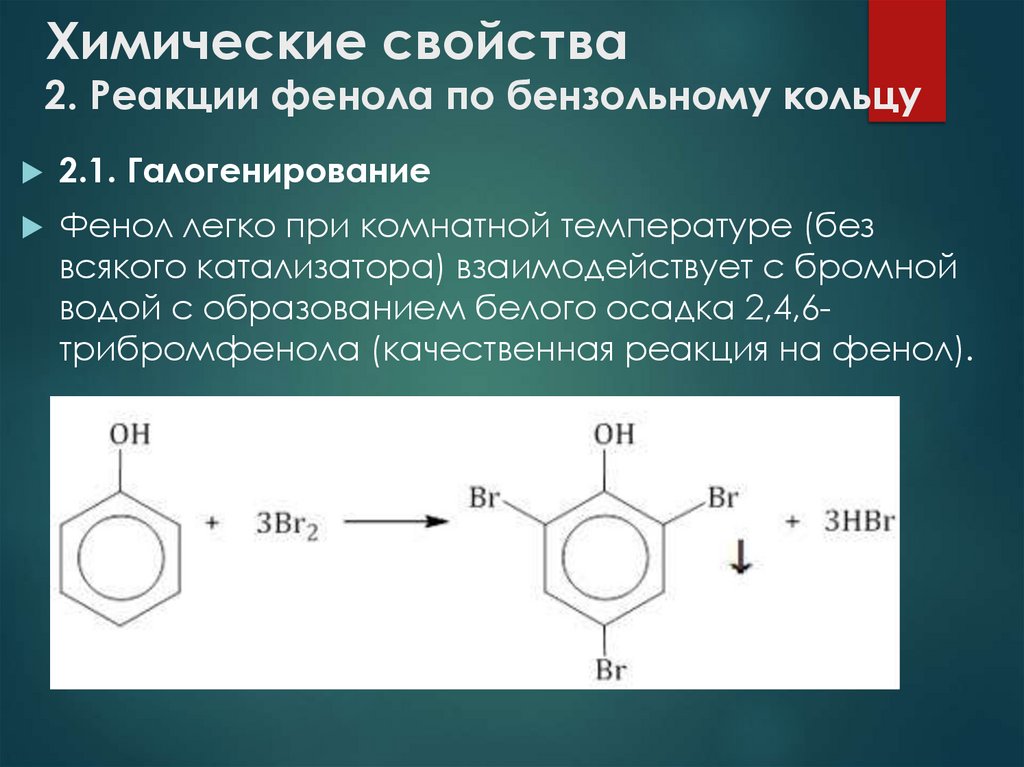
9. Химические свойства 2. Реакции фенола по бензольному кольцу
2.1. ГалогенированиеФенол легко при комнатной температуре (без
всякого катализатора) взаимодействует с бромной
водой с образованием белого осадка 2,4,6трибромфенола (качественная реакция на фенол).
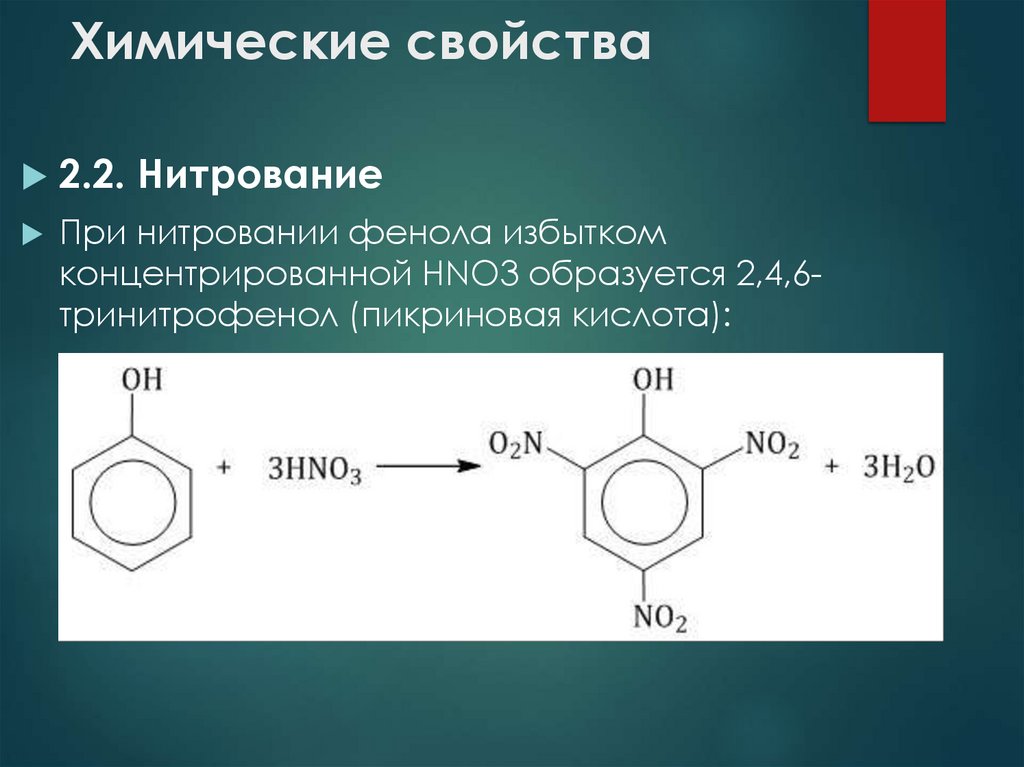
10. Химические свойства
2.2. НитрованиеПри нитровании фенола избытком
концентрированной HNO3 образуется 2,4,6тринитрофенол (пикриновая кислота):
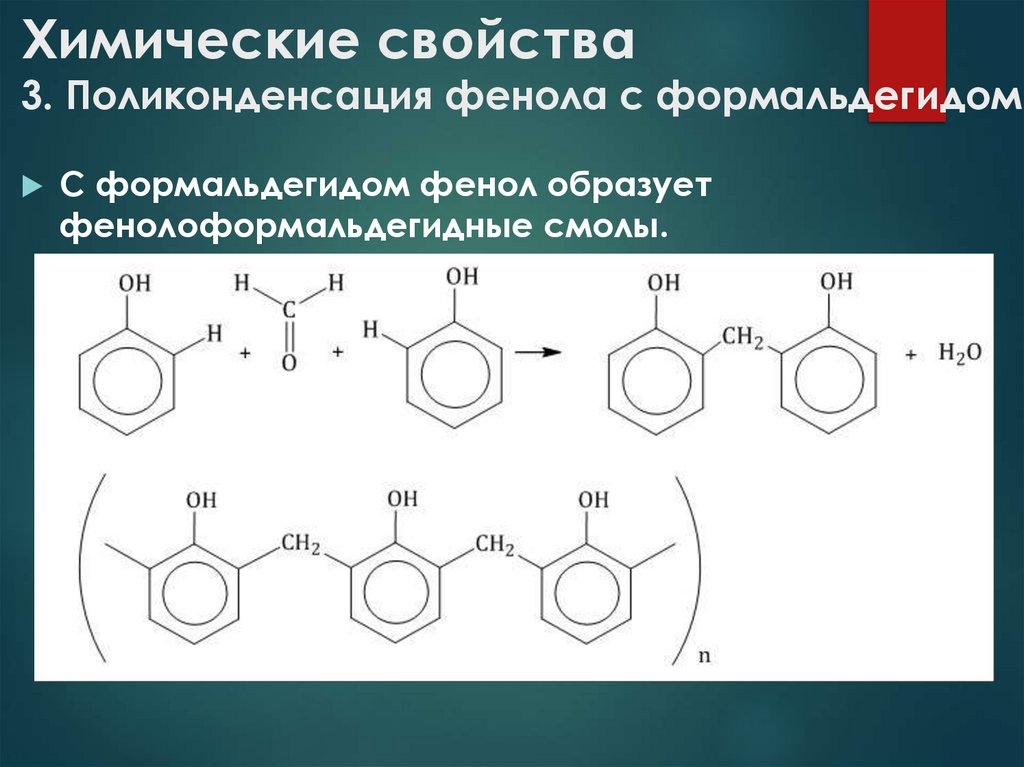
11. Химические свойства 3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образуетфенолоформальдегидные смолы.
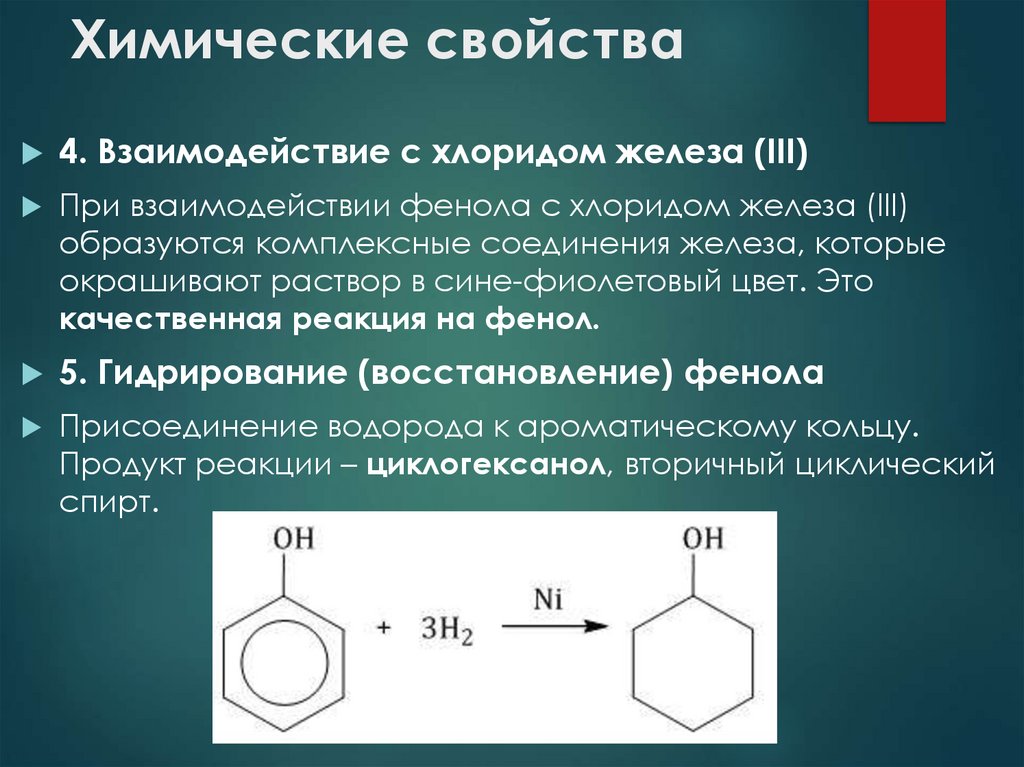
12. Химические свойства
4. Взаимодействие с хлоридом железа (III)При взаимодействии фенола с хлоридом железа (III)
образуются комплексные соединения железа, которые
окрашивают раствор в сине-фиолетовый цвет. Это
качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический
спирт.
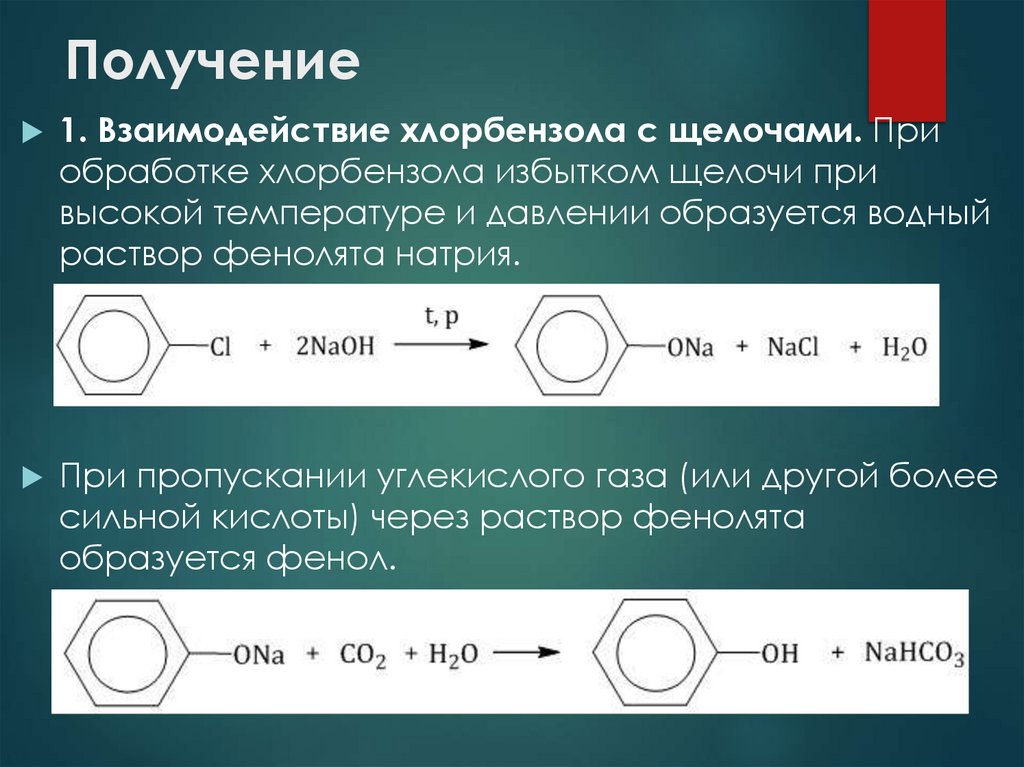
13. Получение
1. Взаимодействие хлорбензола с щелочами. Приобработке хлорбензола избытком щелочи при
высокой температуре и давлении образуется водный
раствор фенолята натрия.
При пропускании углекислого газа (или другой более
сильной кислоты) через раствор фенолята
образуется фенол.
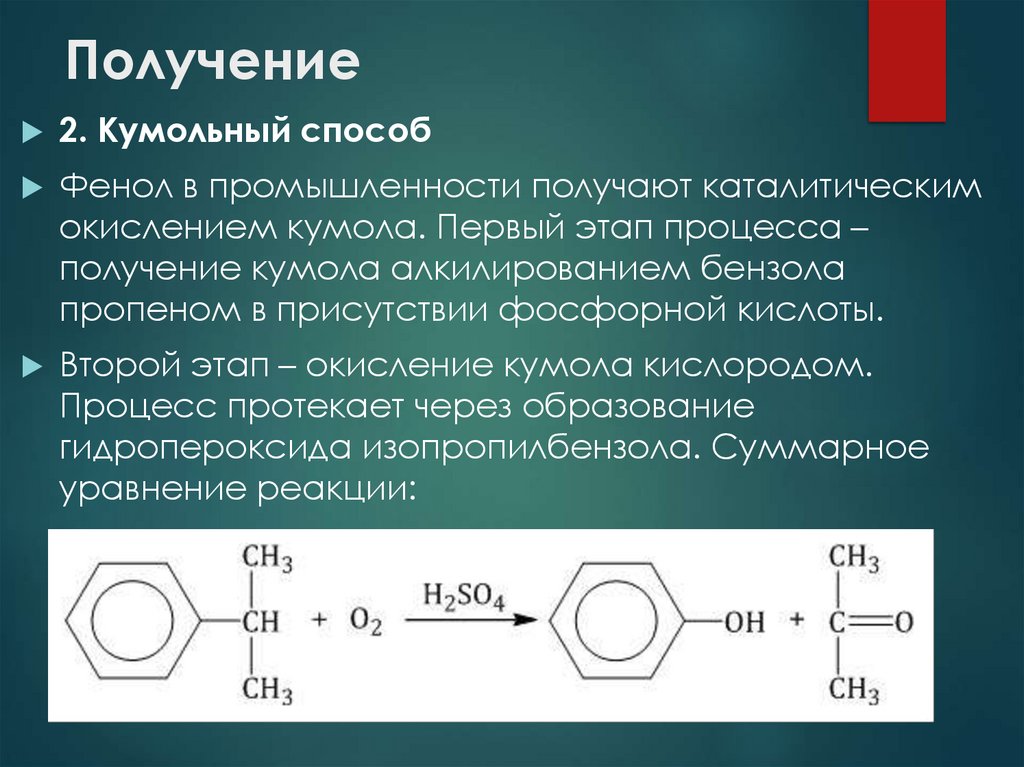
14. Получение
2. Кумольный способФенол в промышленности получают каталитическим
окислением кумола. Первый этап процесса –
получение кумола алкилированием бензола
пропеном в присутствии фосфорной кислоты.
Второй этап – окисление кумола кислородом.
Процесс протекает через образование
гидропероксида изопропилбензола. Суммарное
уравнение реакции:
15. Получение
3. Замещение сульфогруппы в бензолсульфокислотеБензол-сульфокислота реагирует с гидроксидом
натрия с образованием фенолята натрия:
Получается фенолят натрия, из которого затем
выделяют фенол:
16. Домашнее задание
Прочитать § 10.2. Вопросы и задания 1,4 стр.19617. литература
1. О.С. Габриелян, И.Г. Остроумов «Химия дляпрофессий и специальностей технического
профиля», Москва, Издательский центр «Академия»,
2018.
2. О.С. Габриелян, Г.Г. Лысова «Химия: тесты, задачи и
упражнения», Москва, Издательский центр
«Академия», 2018.








 Химия
Химия








