Похожие презентации:
Введение. Основные химические понятия. Основные законы химии
1. КГТУ им. И. Раззакова Кафедра «Химия и химические технологии»
Ст. преп.: Молдоканова Д.А.2. Введение. Основные химические понятия. Основные законы химии.
1. Предмет химии. Основные химические понятия. Основныеположения атомно-молекулярной теории.
2. Основные законы химии:
а) закон сохранения массы и энергии
б) закон постоянства состава
в) закон кратных отношений
г) закон Авогадро
д) закон эквивалентов
3. Предмет химии. Основные химические понятия. Основные положения атомно-молекулярной теории.
Химия – наука о строении и свойствах веществ, ихпревращениях и сопровождающихся явлениях. Она изучает
состав и строение веществ, зависимость свойств веществ от их
состава и строения, условия и пути превращения одних
веществ в другие. В результате превращений возникают новые
вещества с новыми физическими и химическими свойствами,
таким образом, химия - это наука о веществах и законах их
превращений.
Объектом изучения химии являются химические
элементы и их соединения. Вещество – это то, из чего состоят
физические тела. Химия изучает главным образом вещество,
организованное в атомы, молекулы, ионы и радикалы. Такие
вещества (принято подразделять) делятся на простые и
сложные.
4.
Если молекулы образованы атомами одного химическогоэлемента, то вещество называется простым. Например: S, Fe,
O3, алмаз, N2, O2, Cu, Mg.
В зависимости от типа химической связи между атомами
простые вещества могут быть металлами (Na, Mg, Al, Bi и др.)
и неметаллами (H2, N2, Br2, Si и др.).
5.
Сложные вещества образованы разнымиэлементами. Если молекулы образованы из двух
и более атомов, то вещество называется
сложным. Например: H2O, H2SO4, Fe2O3,
NaOH, K2SO4. Вода (H₂O) состоит из двух
атомов водорода и одного атома кислорода,
метан (CH₄) — из одного атома углерода и
четырех атомов водорода.
К сложным веществам относятся как
органические (глюкоза C₆H₁₂O₆), так и
неорганические соединения (серная кислота
H₂SO₄, углекислый газ CO₂).
6. Атомно-молекулярная теория строения вещества
Основные понятия химии даны в атомномолекулярной теории, создателем которой являетсяМ.В. Ломоносов (1742г.) и он по праву считается
основателем научной химии.
Основные положения атомно-молекулярной теории:
1. Все вещества состоят из молекул, атомов или ионов.
При физических явлениях, молекулы сохраняются и
изменяется только агрегатное состояние, при
химических явлениях молекулы разрушаются и
изменяется – цвет, запах, выпадает осадок, выделяется
газ и т.д...
7.
8.
Атом (лат. atomos - неделимый) электронейтральнаячастица,
состоящая
из
положительно заряженного ядра и отрицательно
заряженных электронов. Атомы состоят из
положительно
заряженных
электронов,
движущихся
вокруг
него,
образуя
электронейтральную систему.
Атомы элементов могут существовать в
свободном состоянии и в соединении с атомами
того же элемента или атомами других элементов,
образуя молекулы.
Молекула (лат. moles - масса) - наименьшая
частица простого или сложного вещества,
обладающая
его
основными
химическими
свойствами. Молекулы построены из атомов.
Молекулы состоят как из одинаковых, так и
различных атомов.
По числу входящих в молекулу атомов
различают двухатомные, трехатомные и т.д.
молекулы. Молекулы инертных газов состоят из
одного атома, водорода и азота из двух атомов, а
молекулы воды – из трех атомов. Если число атомов
в молекуле велико - это макромолекула (молекулы
белка, нуклеиновых кислот).
9.
Атомное ядро - центральная часть атома,состоящая из Z протонов и N нейтронов, в
которой сосредоточена основная масса атомов.
Заряд ядра - положительный, по
величине равен количеству протонов в ядре
или электронов в нейтральном атоме и
совпадает с порядковым номером элемента в
периодической системе. Сумма протонов и
нейтронов
атомного
ядра
называется
массовым числом A=Z+N.
10.
11.
12.
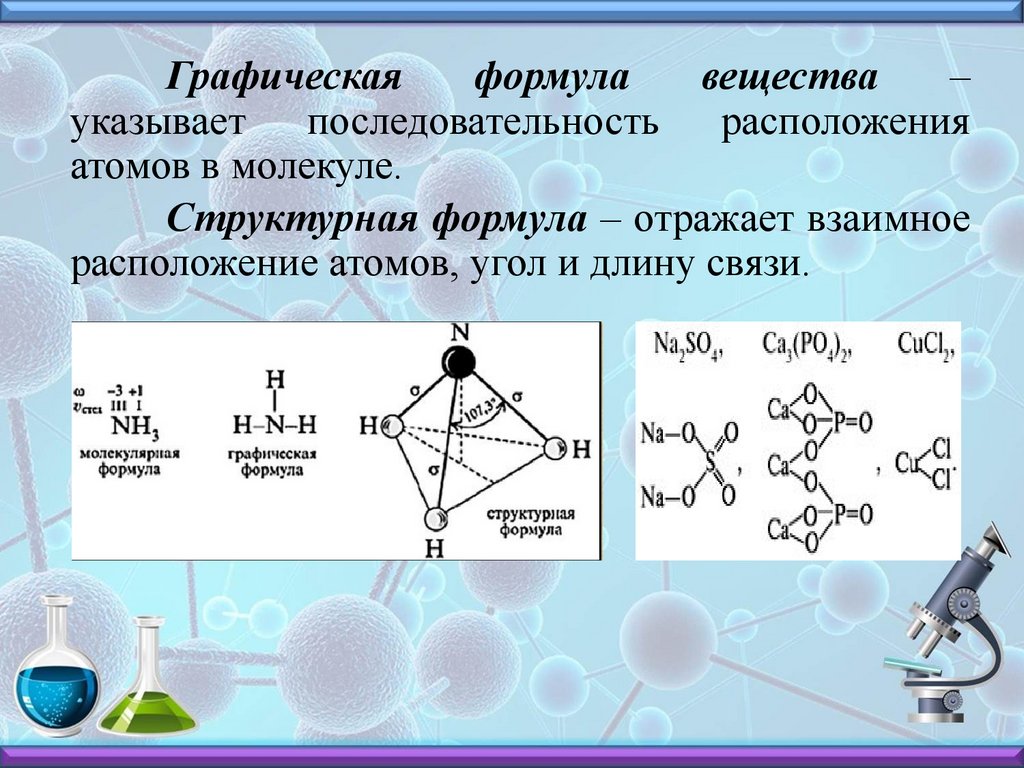
Графическаяформула
вещества
–
указывает последовательность расположения
атомов в молекуле.
Структурная формула – отражает взаимное
расположение атомов, угол и длину связи.
13.
Ионы - (от греч. ion - идущий), одноатомные илимногоатомные частицы, несущие электрические заряды.
Для атомов элементов–металлов характерно образование
положительно заряженных ионов т.е. катионов.
Na0 – 1e- = Na+
Для атомов элементов-неметаллов характерно образование
отрицательно заряженных ионов т.е. анионов.
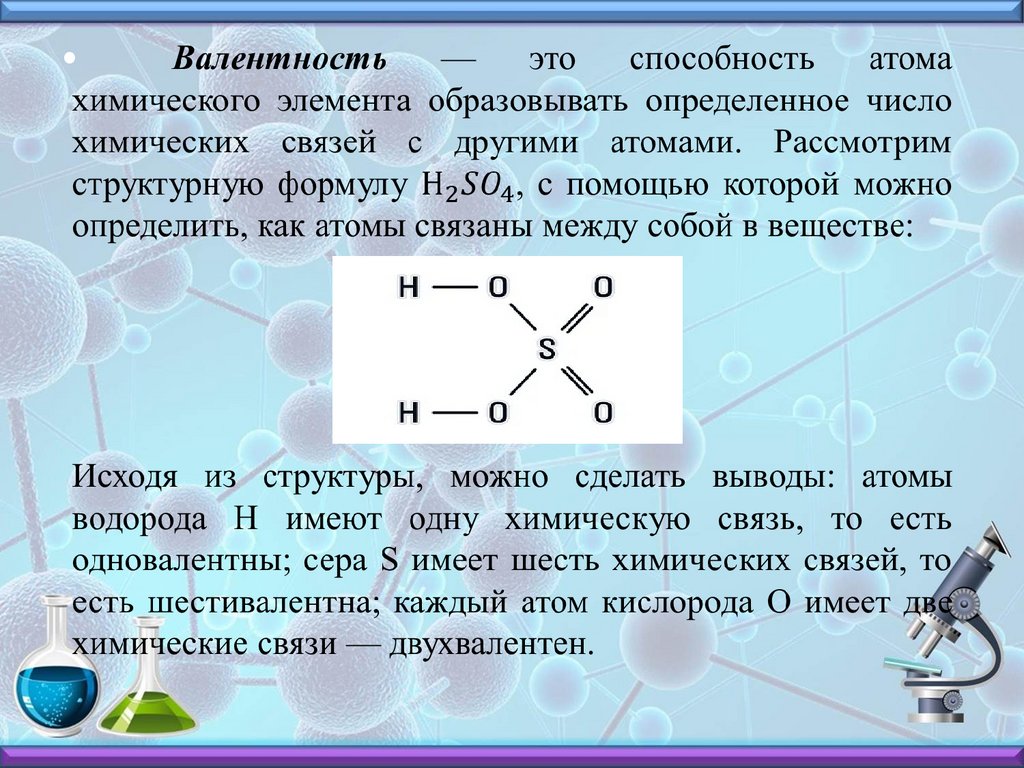
Cl0 + 1e- = ClВалентность (от лат. valentia - сила), способность
атома присоединять или замещать определенное число
других атомов или атомных групп с образованием
химической связи.
14.
15.
Валентность обозначается римской цифрой над знакомхимического элемента в формуле. Например:
Атом натрия имеет валентность, равную 1, а атом
кислорода — равную 2.
Среди всех элементов выделяют две группы: с
постоянной и переменной валентностью. У элементов с
постоянной валентностью в любом соединении она
одинакова. Эти элементы и проявляемую ими валентность
придется выучить.
H, F, Li, Na, K, Ag
-I
O, Be, Mg, Ca, Ba, Zn - II
Al
- III
16.
Переменная валентность меняется взависимости от соединения. Элементов с
переменной валентностью большинство. Как
правило,
они
характеризуются
высшей,
промежуточной и низшей валентностью: высшая
валентность для элементов главных подгрупп
совпадает с номером группы (№гр); низшая
валентность вычисляется по формуле: 8−№гр;
промежуточная валентность — число между
низшей и высшей валентностью. Обычно
промежуточные валентности соответствуют
четности группы.
17.
Пример: как определить валентность по таблицеМенделеева. Сера S располагается в группе VI А таблицы
Менделеева. Значит: высшая валентность серы равна VI;
вычислим низшую валентность: 8−6=2. Низшая
валентность равна II; сера расположена в группе VI — это
четное число. Значит, промежуточными валентностями
будут все четные числа между низшей и высшей
валентностью. В случае с серой между числами 2 и 6
расположено только одно четное число — 4.
Промежуточная валентность серы — IV. Валентность серы
- это способность атома серы образовывать химические
связи, которая может менять значение в зависимости от
соединения. Сера (S) проявляет переменные валентности,
часто II, IV и VI. Примеры: H₂S (валентность II), SO₂
(валентность IV), H₂SO₄ (валентность VI).
18.
19.
20.
21. Основные законы химии
До середины XVIII века химия была качественной наукой.Ломоносов ввёл в химию количественное измерение, то есть весы. И
появилась возможность сформулировать основные законы химии.
1. Закон сохранения массы веществ. Закон сохранения массы
вещества открыли М. В. Ломоносов и А. Л. Лавуазье почти
независимо друг от друга.
Масса веществ вступивших в реакцию равна массе веществ
образующихся в результате реакции. Масса всех веществ
вступивших в химическую реакцию равна массе всех продуктов
реакции. В результате химических реакций атомы не исчезают и не
возникают, а происходит их перегруппировка (то есть химическое
превращение - это процесс разрыва одних связи между атомами и
образования других, в результате чего из молекул исходных веществ
получаются молекулы продуктов реакции).
Поскольку число атомов до и после реакции остаётся неизменным, то
их общая масса также изменяться не должна.
22.
Например: если в реакцию вступили оксидкальция и вода, общей массы 74 г, то в результате
образуется гидроксид кальция, общая масса
которого также равна 74 г.
СаО + H2O = Са(ОH)2
40+16 + 2·1+16 = 40+2·(16+1)
74 = 74
При химических реакциях сохраняется не
только общая масса веществ, но и масса каждого из
элементов, входящих в состав взаимодействующих
веществ.
23.
2. Закон постоянства состава. К основным законамхимии относятся закон постоянства состава. Этот
закон установлен в начале XIX века французским
учёным Ж. Прустом: каждое химическое соединение,
независимо от способа его получения всегда имеет
постоянный качественный и количественный
элементный
состав.
Все
индивидуальные
химические
вещества
имеют
постоянный
качественный
и
количественный
состав
и
определённые химическое строение, независимо от
способа получения. Из закона постоянства состава
следует, что при образовании сложного вещества
элементы соединяются друг с другом в определённых
массовых соотношениях.
24.
Например: состав оксида кальция CaO. Он состоитиз кальция и кислорода (качественный состав).
Содержание кальция в оксиде кальция (CaO) 74,5 %,
кислорода 25,5% (количественный состав). Оксид
кальция можно получить разными способами:
1.
2.
3.
Во всех случаях оксид кальция будет иметь
приведённый выше состав независимо от способа
получения.
25.
3. Закон кратных отношений. Многие элементы,соединяясь друг с другом могут образовать разные
соединения. Английский учёный Джон Дальтон
установил закон кратных отношений: если два
элемента образуют друг с другом несколько
химических соединений, то масса одного из
элементов приходящаяся в этих соединениях на
одну и ту же массу другого элемента, относятся
между собой как наибольшие целые числа.
Например, углерод образует с кислородом два
соединения: оксид углерода СО и диоксид углерода
СО2. СО содержит 42,88% углерода и 57,12%
кислорода, СО2 содержит 27, 29% углерода и 72,71%
кислорода.
26.
СО СО212:16
12:32
В нашем примере масса кислорода,
приходящаяся на одну и ту же массу углерода,
относятся друг к другу как 1:2, так как для СО
отношение массы кислорода к массе углерода
равно 57,12:42,88=1,33, а для СО2 - это отношение
составляет
72,71:27,29=2,66.
Отсюда
1,33:2,66=1:2.
27.
4. Закон Авогадро. Что такое моль? Мольмолекулярная масса вещества, выраженное в граммах.1 моль H2O равно 18 г.
Значение 6,02·1023 называется постоянной Авогадро в
честь итальянского химика Амедео Авогадро. Это
универсальная постоянная для мельчайших частиц
любого вещества. Она имеет обозначение NA. Иногда
ее также называют числом Авогадро. Постоянная
Авогадро показывает число структурных единиц в
одном моле любого вещества. Поэтому можно
сказать, что моль - это количество вещества, которое
содержит 6,02·1023 атомов, молекул, ионов данного
вещества.































 Химия
Химия








