Похожие презентации:
Карбоновые кислоты
1.
КАРБОНОВЫЕКИСЛОТЫ
2.
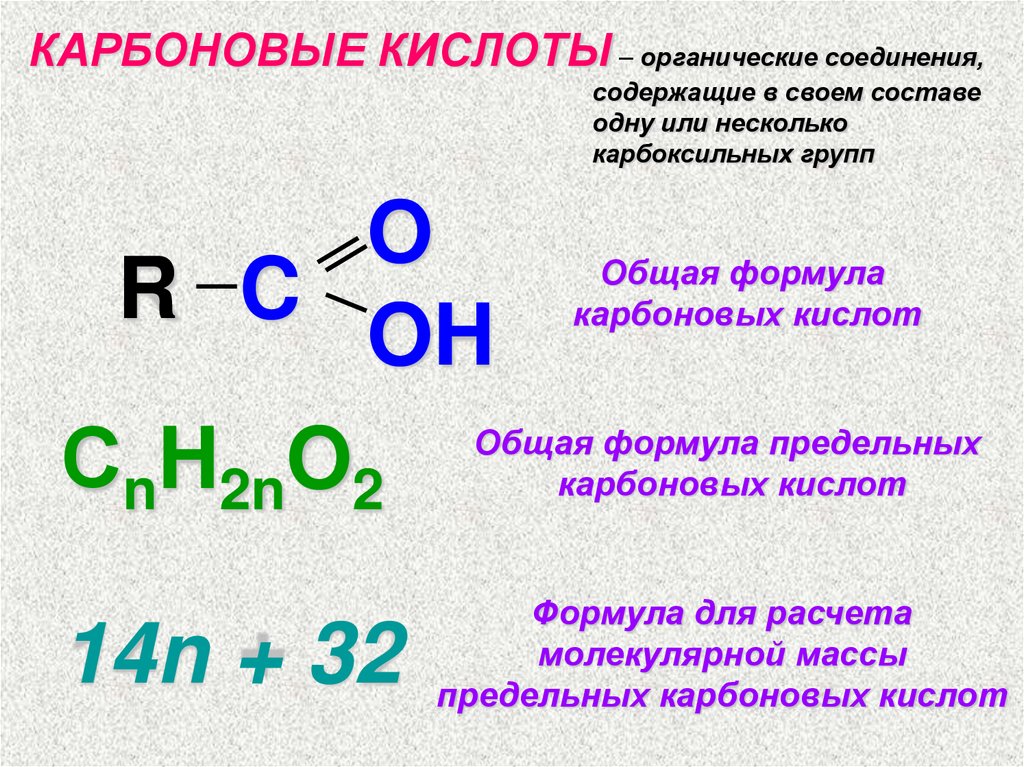
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,содержащие в своем составе
одну или несколько
карбоксильных групп
O
R C
OH
СnH2nO2
Общая формула
карбоновых кислот
Общая формула предельных
карбоновых кислот
14n + 32
Формула для расчета
молекулярной массы
предельных карбоновых кислот
3.
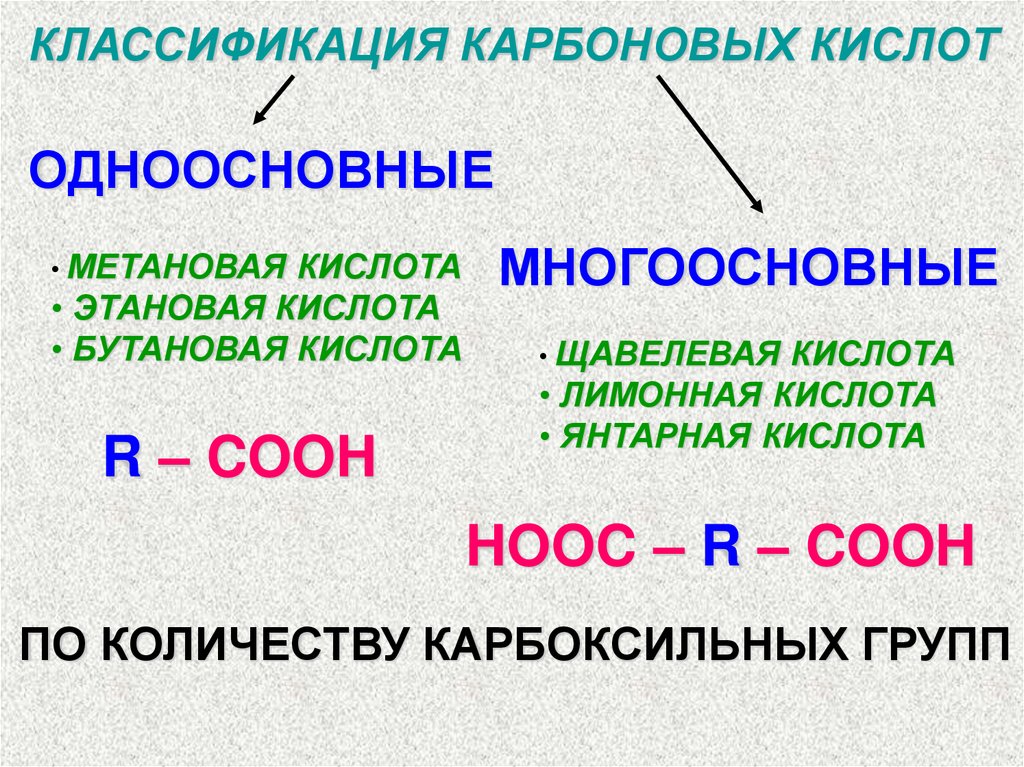
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТОДНООСНОВНЫЕ
• МЕТАНОВАЯ КИСЛОТА
• ЭТАНОВАЯ КИСЛОТА
• БУТАНОВАЯ КИСЛОТА
R – COOH
МНОГООСНОВНЫЕ
• ЩАВЕЛЕВАЯ КИСЛОТА
• ЛИМОННАЯ КИСЛОТА
• ЯНТАРНАЯ КИСЛОТА
HOOC – R – COOH
ПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУПП
4.
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПРЕДЕЛЬНЫЕ
НЕПРЕДЕЛЬНЫЕ
МЕТАНОВАЯ КИСЛОТА
ЭТАНОВАЯ КИСЛОТА
БУТАНОВАЯ КИСЛОТА
ОЛЕИНОВАЯ КИСЛОТА
ЛИНОЛЕВАЯ КИСЛОТА
ЛИНОЛЕНОВАЯ КИСЛОТА
АРОМАТИЧЕСКИЕ
БЕНЗОЙНАЯ КИСЛОТА
ПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТА
задание
5.
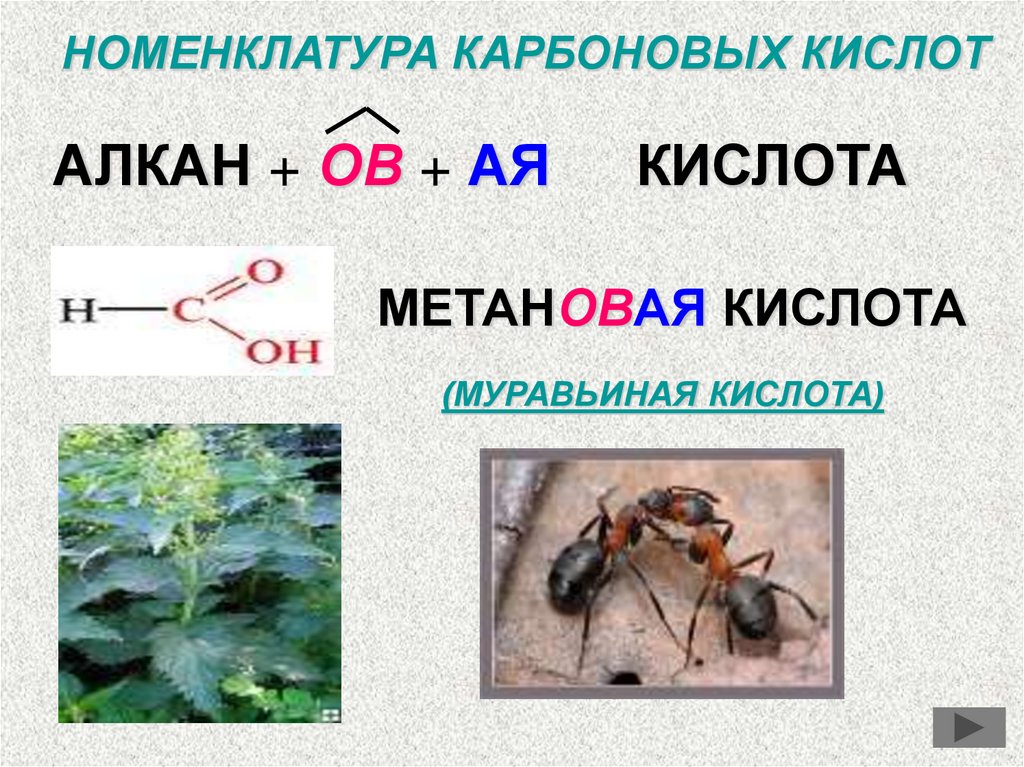
НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТАЛКАН + ОВ + АЯ
КИСЛОТА
МЕТАНОВАЯ КИСЛОТА
(МУРАВЬИНАЯ КИСЛОТА)
6.
21
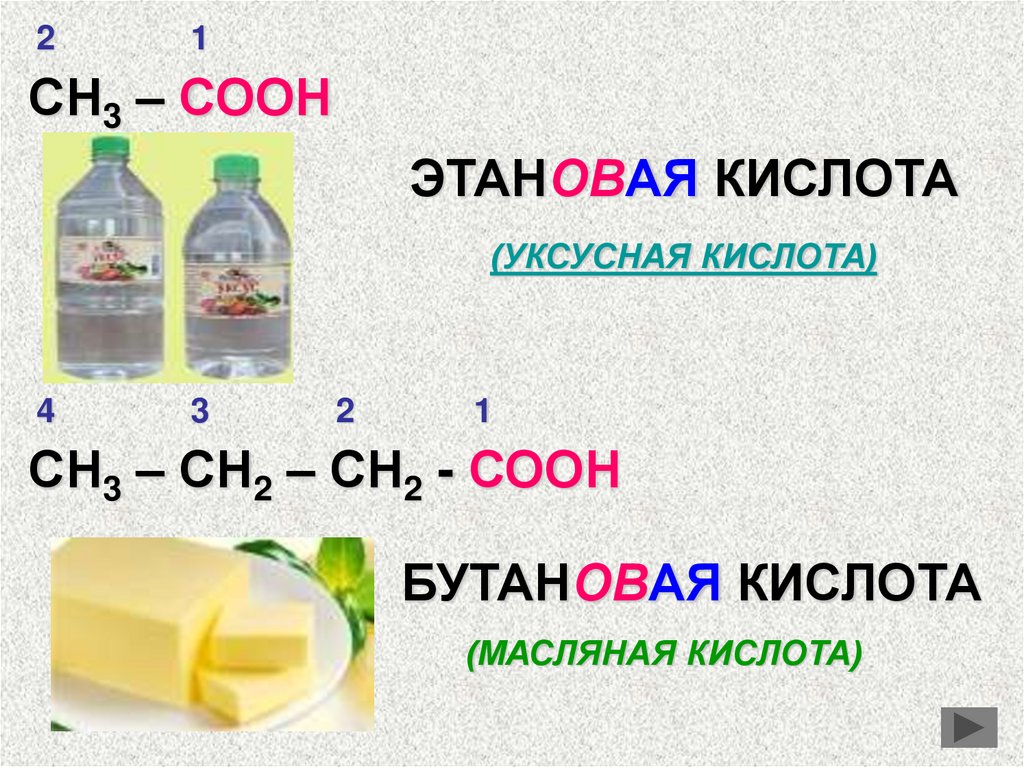
СН3 – СООН
ЭТАНОВАЯ КИСЛОТА
(УКСУСНАЯ КИСЛОТА)
4
3
2
1
СН3 – СН2 – СН2 - СООН
БУТАНОВАЯ КИСЛОТА
(МАСЛЯНАЯ КИСЛОТА)
7.
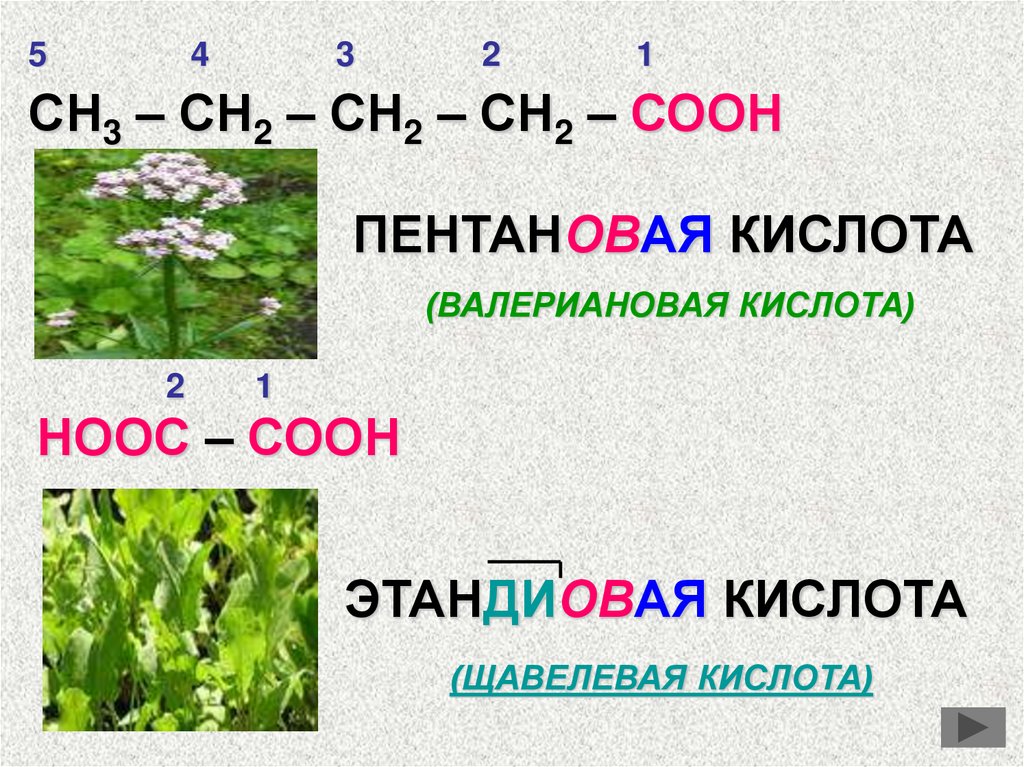
54
3
2
1
СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ КИСЛОТА)
2
1
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
8.
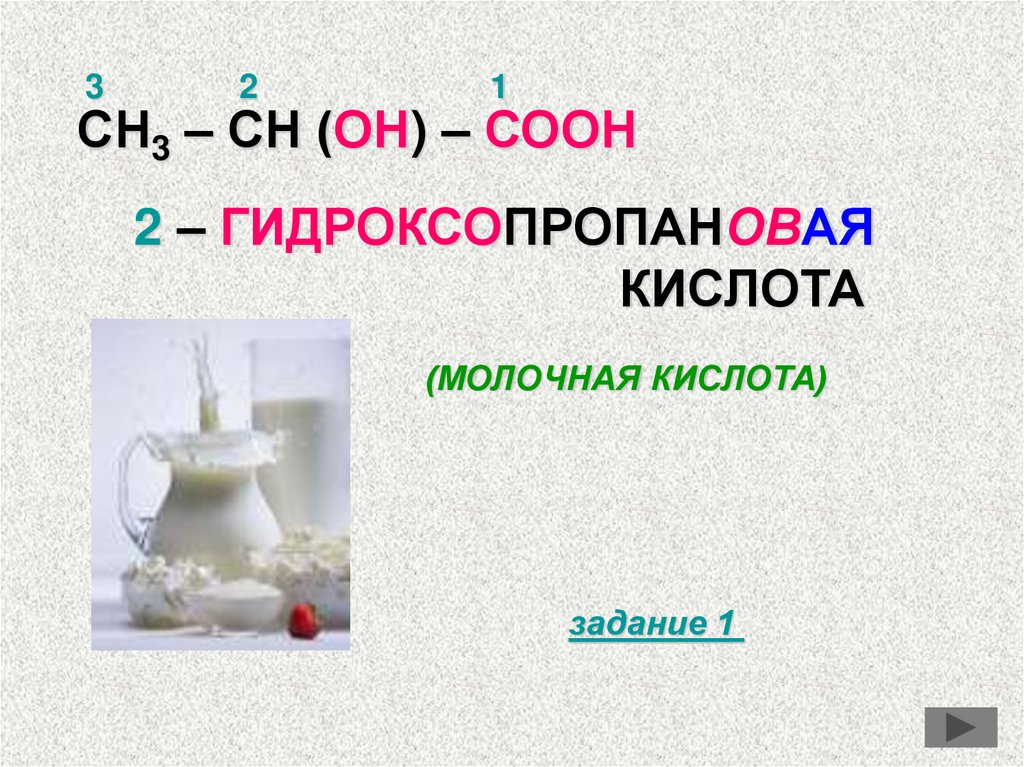
32
1
СН3 – СН (ОН) – СООН
2 – ГИДРОКСОПРОПАНОВАЯ
КИСЛОТА
(МОЛОЧНАЯ КИСЛОТА)
задание 1
9.
ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТДля предельных карбоновых кислот
• УГЛЕРОДНОГО СКЕЛЕТА
• МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ)
Для непредельных карбоновых кислот
• УГЛЕРОДНОГО СКЕЛЕТА
• ПОЛОЖЕНИЯ КРАТНОЙ СВЯЗИ
• МЕЖКЛАССОВАЯ
10.
ФИЗИЧЕСКИЕ СВОЙСТВАС1 – С3
Жидкости с характерным резким
запахом,
хорошо растворимые в воде
С4 – С9
Вязкие маслянистые жидкости с
неприятным запахом, плохо
растворимые
в воде
C10 и >
Твердые вещества,
не имеющие запаха, не растворимые
в воде
11.
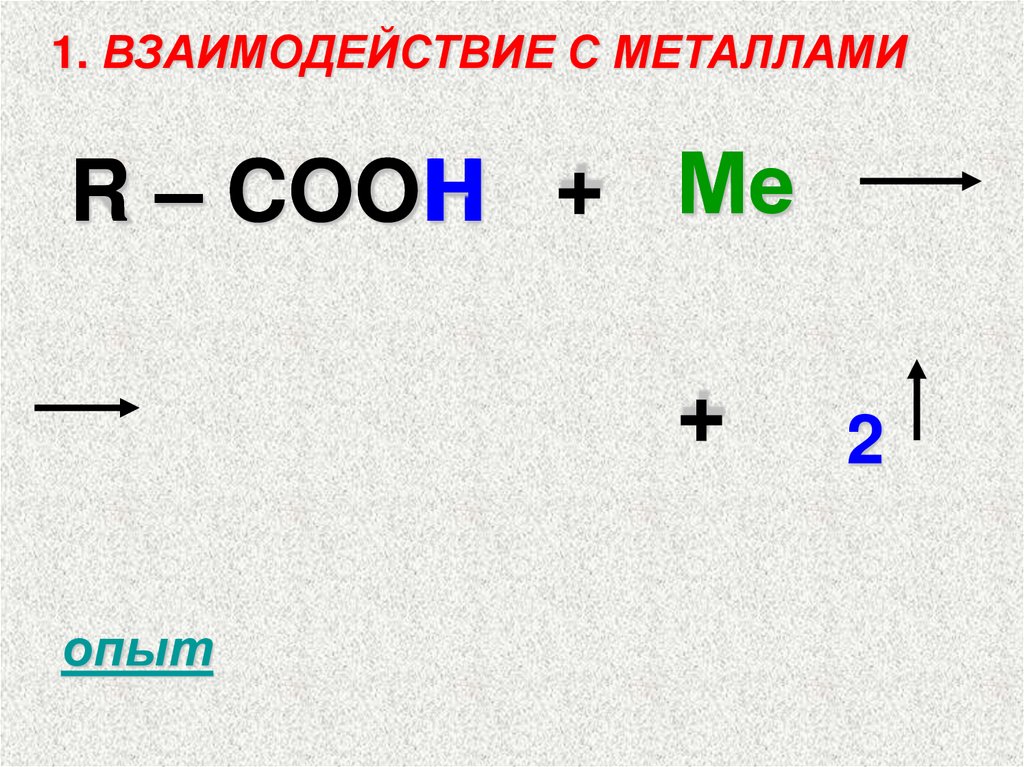
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИR – COOH + Ме
+
опыт
2
12.
2.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ2 R – COOH + MgO =
=(R – COO)2Mg + H2O
3.ВЗАИМОДЕЙСТВИЕ С ЩЕЛОЧАМИ
R – COOH + NaOH =
=R – COONa + H2O
13.
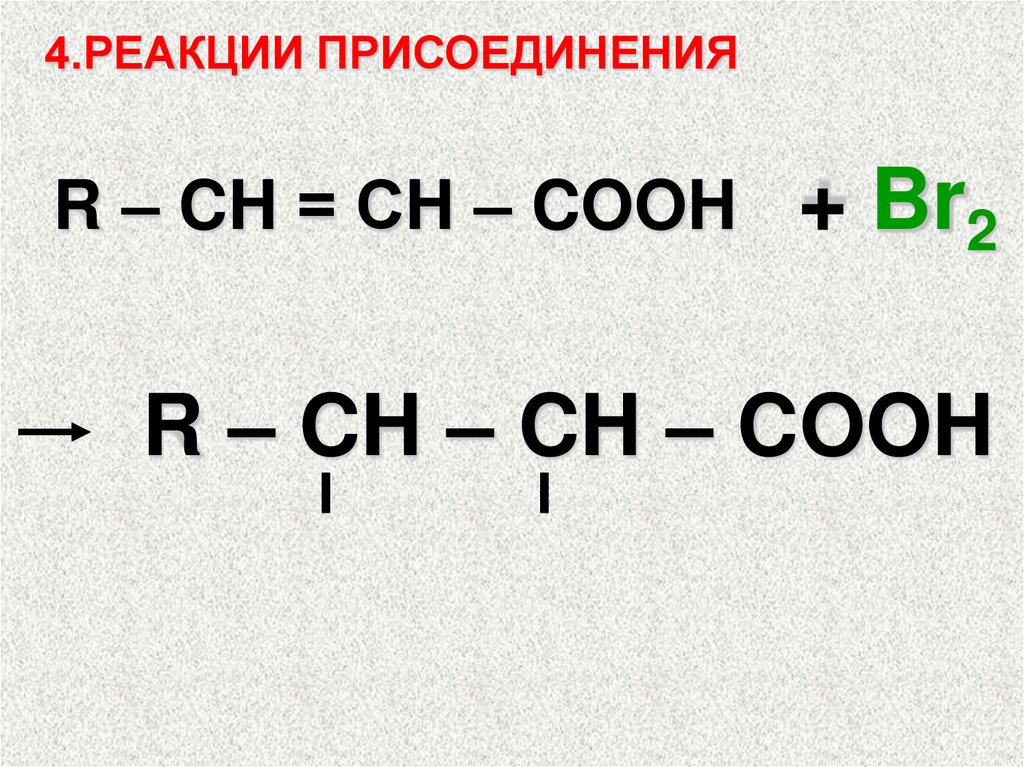
4.РЕАКЦИИ ПРИСОЕДИНЕНИЯR – CH = СH – COOH
+ Br2
R – CH – CH – COOH
14.
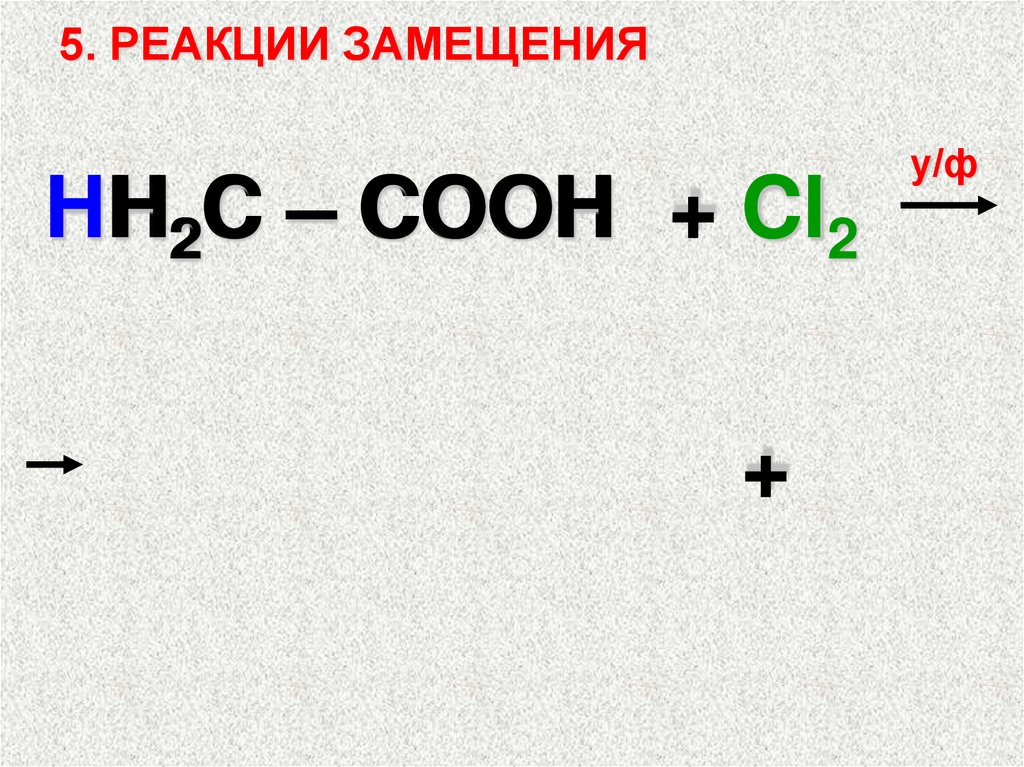
5. РЕАКЦИИ ЗАМЕЩЕНИЯHH
H
H2C – COOH + Cl2
+
у/ф
15.
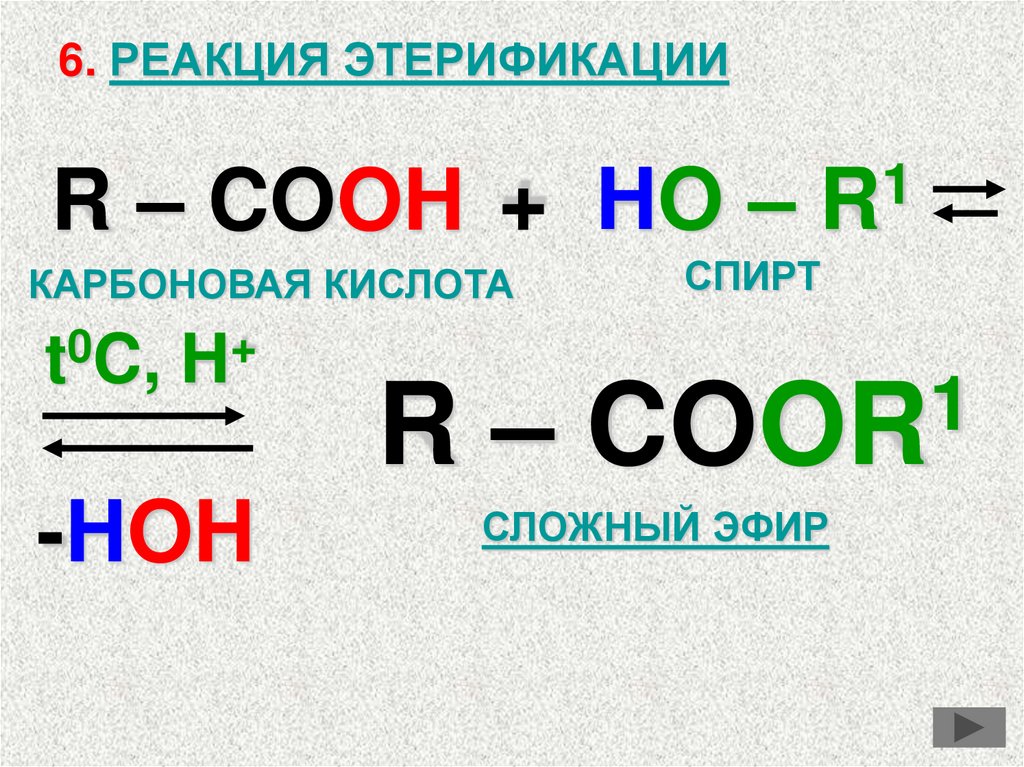
6. РЕАКЦИЯ ЭТЕРИФИКАЦИИR – COOH +
КАРБОНОВАЯ КИСЛОТА
0
+
t C, H
-HOH
1
HO – R
СПИРТ
1
R – COOR
СЛОЖНЫЙ ЭФИР
16.
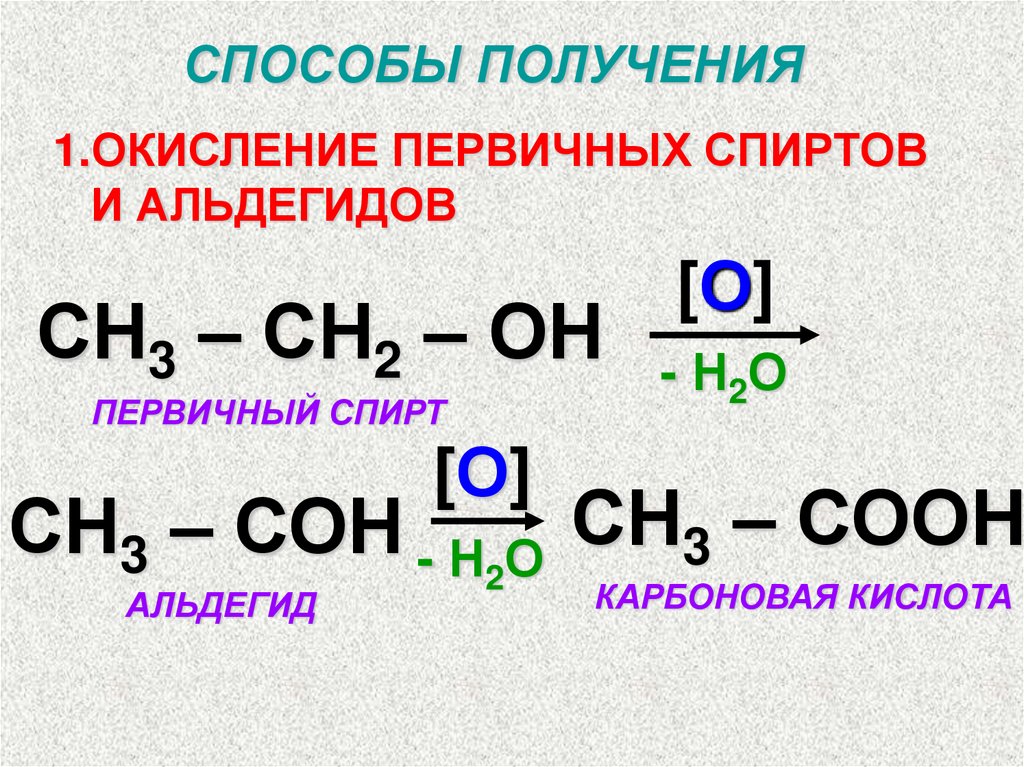
СПОСОБЫ ПОЛУЧЕНИЯ1.ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ
И АЛЬДЕГИДОВ
СН3 – СН2 – ОН
ПЕРВИЧНЫЙ СПИРТ
[О]
- Н2О
[О]
СН3 – СОН - Н2О СН3 – СООН
АЛЬДЕГИД
КАРБОНОВАЯ КИСЛОТА
17.
2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСН3 – СООС2Н5 + НОН
Н+
СН3 – СООН + С2Н5ОН
18.
ОБЛАСТИ ПРИМЕНЕНИЯМУРАВЬИНАЯ
КИСЛОТА
ЩАВЕЛЕВАЯ
КИСЛОТА
УКСУСНАЯ
КИСЛОТА
19.
МУРАВЬИНАЯ КИСЛОТА• в текстильной промышленности
(в качестве протравы при крашении тканей);
• в кожевенной (при дублении кож);
• в пищевой (для консервирования фруктов);
• в производстве некоторых полимеров;
• хороший растворитель для многих полимеров
(капрона, найлона, поливинилхлорида),
• в медицине
20.
УКСУСНАЯ КИСЛОТА• для получения полимеров,
красителей, сложных эфиров,
ацетатного шелка, негорючей фото – и
кинопленки;
• широко используют соли уксусной
кислоты:
АЦЕТАТ ЖЕЛЕЗА, АЦЕТАТ ХРОМА,
АЦЕТАТ АЛЮМИНИЯ в качестве протравы
при крашении тканей;
АЦЕТАТ СВИНЦА – для изготовления
свинцовых белил;
АЦЕТАТ МЕДИ (II) – для борьбы
с вредителями сельского хозяйства.
21.
ЩАВЕЛЕВАЯ КИСЛОТА• для отбеливания тканей;
• в производстве красителей;
• в кожевенной и деревообрабатывающей
промышленности;
• для удаления ржавчины и накипи;
• в пищевой промышленности
(как пищевая добавка)




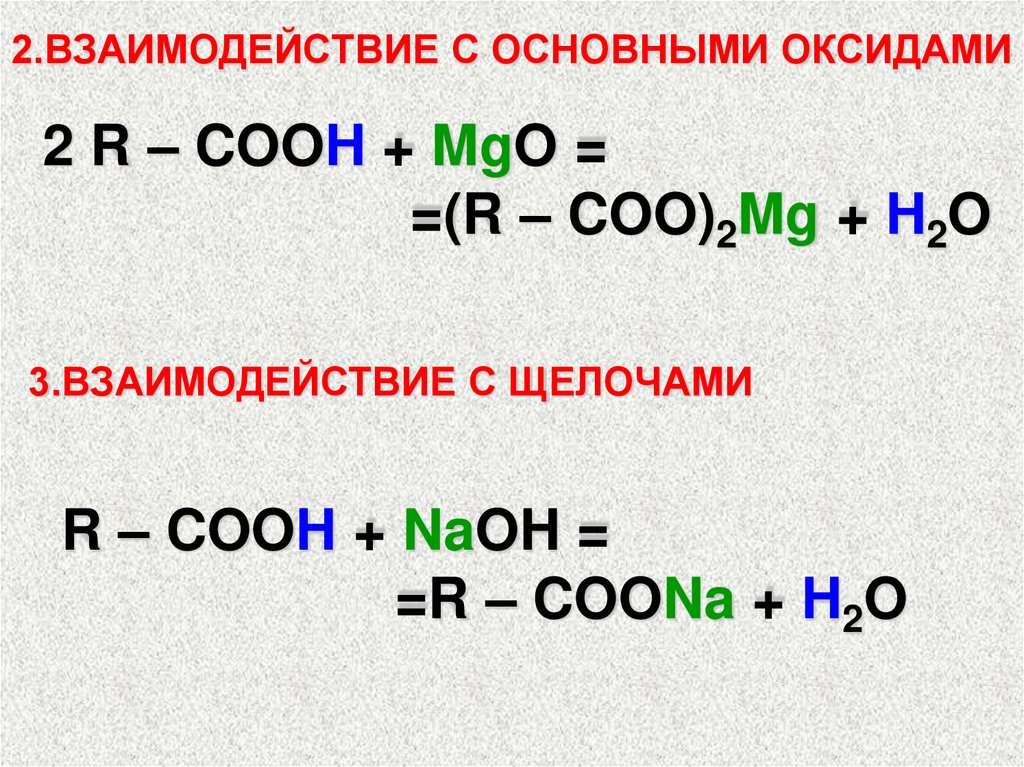




 Химия
Химия








