Похожие презентации:
Ионное произведение воды. Водородный показатель
1.
Федеральное государственное образовательное учреждениевысшего образования
«РОССИЙСКИЙ УНИВЕРСИТЕТ МЕДИЦИНЫ»
Министерства здравоохранения Российской Федерации
Кафедра общей и биоорганической химии
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ
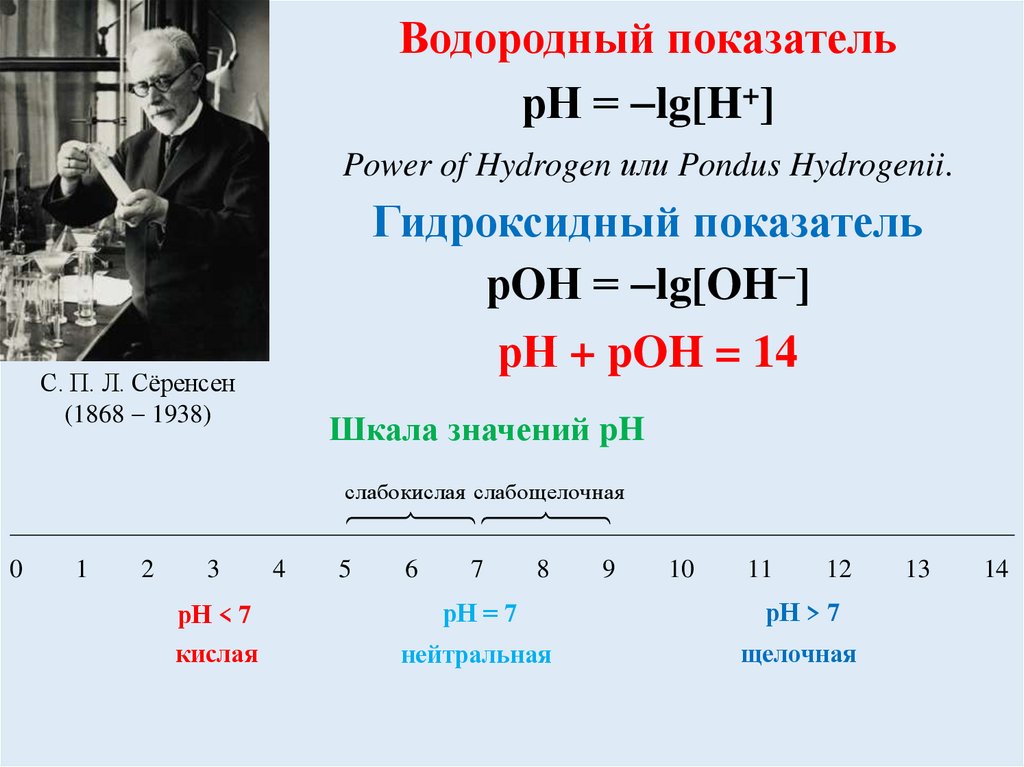
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Москва 2024
2. Вода является слабым электролитом:
H2O ⇄ Н+ ОНКак растворитель вода подвергается самодиссоциации
(автопротолизу):
2H2O ⇄ Н3O+ ОН
Однако для простоты пишут Н+.
] [OH ]
[H
K д (H 2O)
1,8 10 16
[H 2O]
Так как [H2O] >> [H+]·[OH ], то можно считать
[H2O] = CONST
K д (H 2O) [H 2O] [H ] [OH ] K W
Kw Ионное произведение воды («water» – вода)
3.
Ионное произведение воды Кw зависит только от температурыи при увеличении температуры от 180 до 1000 возрастает в 100 раз.
В интервале 220 250С
K W [H ] [OH ] 10 14
СРЕДА НЕЙТРАЛЬНАЯ:
[H+] [OH ] 10 7 моль/л
КИСЛАЯ:
[H+] > [OH ]
[H+] > 10 7 моль/л; [OH ] < 10 7 моль/л
ЩЕЛОЧНАЯ:
[H+] < [OH ]
[H+] < 10 7 моль/л;
[OH ] > 10 7 моль/л
4.
Водородный показательрН = lg[H+]
Power of Hydrogen или Pondus Hydrogenii.
Гидроксидный показатель
рOН = lg[OH ]
рН + pOH = 14
С. П. Л. Сёренсен
(1868 1938)
Шкала значений pH
слабокислая слабощелочная
0
1
2
3
4
5
6
7
8
9
10
11
12
рН < 7
рН = 7
рН > 7
кислая
нейтральная
щелочная
13
14
5.
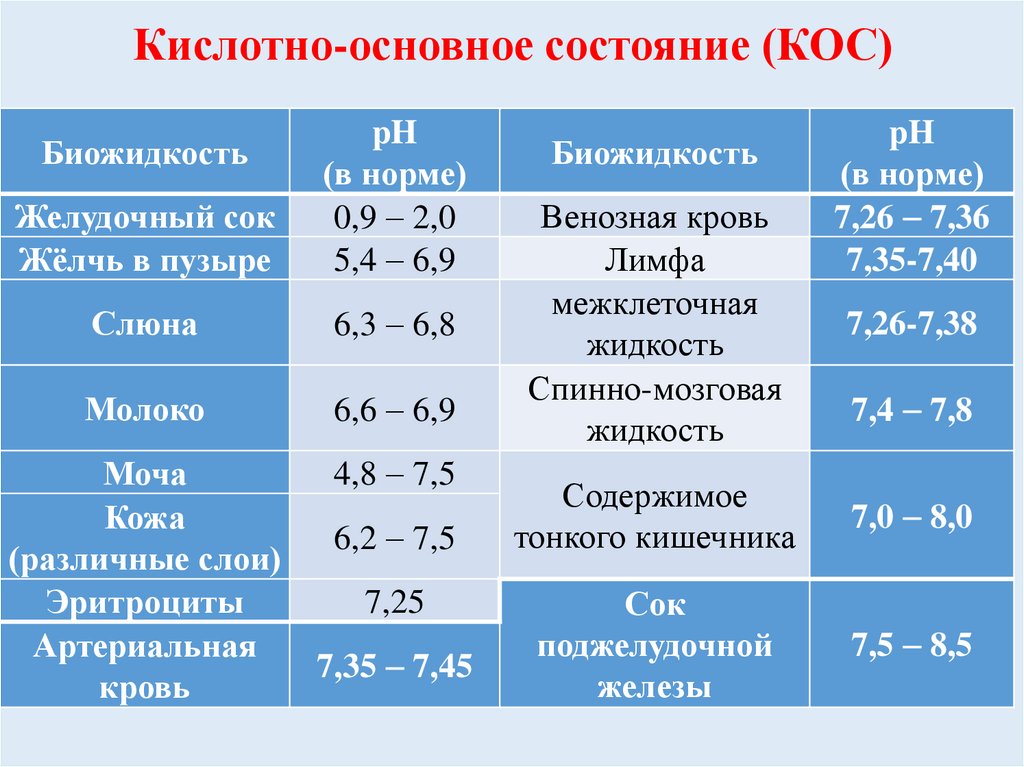
Кислотно-основное состояние (КОС)Желудочный сок
Жёлчь в пузыре
pH
(в норме)
0,9 2,0
5,4 6,9
Слюна
6,3 6,8
Молоко
6,6 6,9
Моча
Кожа
(различные слои)
Эритроциты
Артериальная
кровь
4,8 7,5
Биожидкость
6,2 7,5
7,25
7,35 7,45
Биожидкость
Венозная кровь
Лимфа
межклеточная
жидкость
Спинно-мозговая
жидкость
pH
(в норме)
7,26 7,36
7,35-7,40
7,26-7,38
7,4 7,8
Содержимое
тонкого кишечника
7,0 8,0
Сок
поджелудочной
железы
7,5 8,5
6.
Смещение кислотно-основного равновесияв
организме приводит к изменению рН биожидкостей, что
нарушает
нормальное
течение
физиологических
процессов.
При существенных сдвигах рН в ту или иную сторону:
нарушаются функции многочисленных ферментных систем;
изменяется направленность и интенсивность окислительновосстановительных процессов;
нарушается способность гемоглобина связывать и отдавать
кислород;
изменяются все виды обмена веществ, в первую очередь
водного и электролитного;
нарушается
чувствительность
клеточных
рецепторов,
проницаемость мембран, возбудимость и проводимость клеток, а
также многие другие физиологические функции.
При значительных сдвигах рН клетки гибнут.
7.
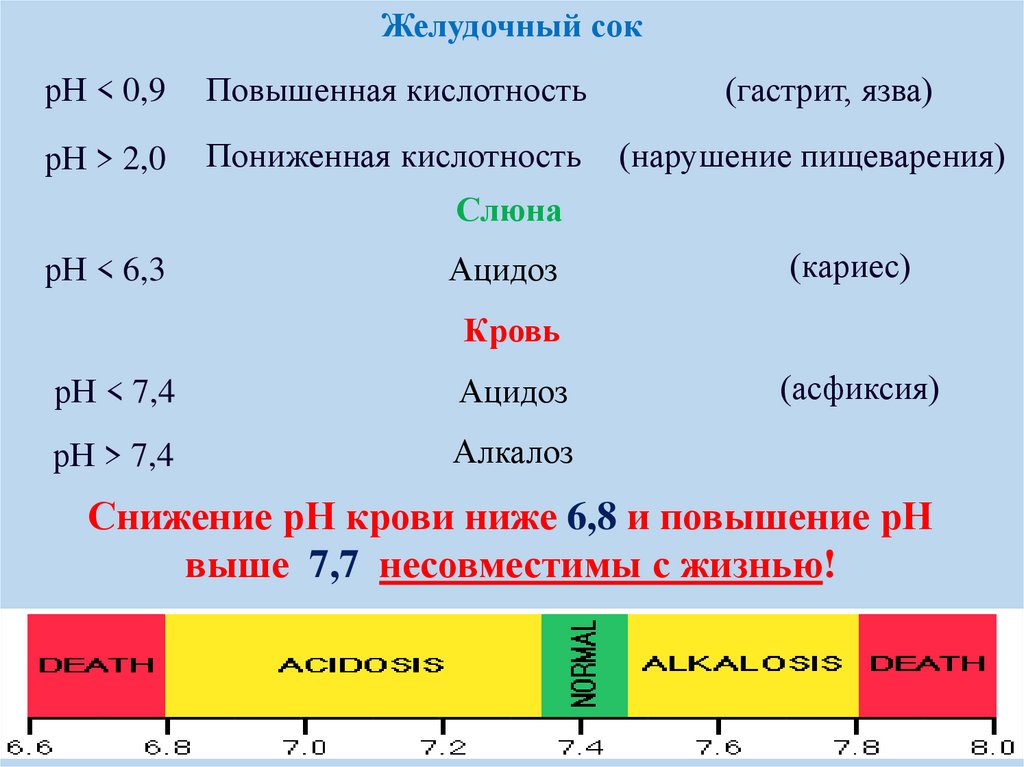
Желудочный сокрН < 0,9
Повышенная кислотность
(гастрит, язва)
рН > 2,0
Пониженная кислотность
(нарушение пищеварения)
Слюна
рН < 6,3
Ацидоз
(кариес)
Кровь
рН < 7,4
Ацидоз
рН > 7,4
Алкалоз
(асфиксия)
Снижение рН крови ниже 6,8 и повышение рН
выше 7,7 несовместимы с жизнью!
8.
Интересной научной проблемой являетсяфункциональная асимметрия в организме
человека и участие в ней ионов водорода.
Так, у человека обнаружены небольшие, но
достоверные, различия в величине внутриклеточного pH в лобных долях головного мозга:
слева pH 7,05; справа pH 7,04.
У больных эпилепсией это соотношение
изменено
Изменения pH головного мозга
приводят к ухудшению памяти,
нарушению сна и т. д.
9.
Расчёт рН в растворах кислот и оснований1. В растворах сильных кислот и оснований:
1
к C( z к та);
[OH ] αк С( 1z осн).
[H ] α
2. В растворах слабых кислот и оснований:
[H ] α C(к та) или [H ] K a C(к та) ;
[OH ] α C(осн) или [OH ] K b C(осн).
Для многоосновных кислот:
[H ] K a C(к та).
1






 Химия
Химия








