Похожие презентации:
Визит инициации по КИ ЛП Рифаксимин
1. Визит инициации по КИ ЛП Рифаксимин
2. Рассматриваемые вопросы
1. Специалисты по мониторингу (контактная информация);2. Краткая характеристика проекта;
3. Резюме проекта;
4. Планируемый период проведения исследования;
5. Содержание визитов.
2
3. Специалисты по мониторингу (контактная информация)
Заслепленныйспециалист
по
мониторингу
клинических
исследований:
• Тельнова Екатерина Геннадьевна - clin_dep3@iphar.ru, +7 961 890 88 42
Разослепленный специалист по мониторингу клинических
исследований:
• Репина Полина Николаевна - clin_dep6@iphar.ru, +7 913 103 74 53
3
4. 2. Краткая характеристика проекта
Номер будущего проекта: 106-ICT-202301Название
клинического
исследования:
Многоцентровое,
слепое,
рандомизированное клиническое исследование, проводимое в параллельных
группах, для оценки сравнительной клинической эффективности и
безопасности таблетированных препаратов Рифаксимина в дозе 400 мг при
лечении пациентов с острой диареей бактериального генеза
Тестовый препарат (Т - тест)
Рифаксимин, 400 мг, таблетки,
«ПРО.МЕД.ЦС
Прага
а.о.»,
Чешская Республика
Препарат сравнения (R–референтный
препарат)
Альфа Нормикс®, 400 мг, таблетки,
покрытые
пленочной
оболочкой,
«Альфасигма С.п.А.», Италия
5. 3. Резюме дизайна исследования
Количество и контингент пациентов:• В КИ будут включены пациенты мужского и женского пола европеоидной
расы в возрасте от 18 до 65 лет (включительно).
• У пациентов должно быть зарегистрировано не менее 3 эпизодов
неоформленного стула в течение 24 ч до рандомизации, и, по крайней мере,
один из следующих симптомов кишечной инфекции:
- Боль в животе (в том числе спазмы);
- Тошнота;
- Рвота;
- Императивные позывы к дефекации;
- Избыточное газообразование / вздутие живота или тенезмы.
5
6. Всего будет скринировано до 250 человек. Рандомизированно будет: 192 пациента.
67. 4. Планируемый период проведения исследования
31 марта 2025 г. — 31 декабря 2026 г.8. 5. Содержание визитов
89. Скрининг, рандомизация и начало терапии. Визит 0 (день 0)
10.
Началом клинического исследованиябудет считаться подписание первого
ИС первым пациентом
В течение 3-х дней нужно будет отправить
уведомление о начале КИ в МЗ РФ, ЛЭК.
Сканы этих уведомлений необходимо скинуть мне на
электронную почту.
11.
Добровольное согласие на участие в КИ подтверждаетсяподписью пациента в двух экземплярах ИС. Один экземпляр
остается у пациента, второй — в исследовательском центре.
После этого пациенту будет присвоен скрининговый номер,
состоящий
из
5
цифр
(первые
2
цифры
—
номер
исследовательского центра по разрешению МЗ РФ, последние
3 цифры — скрининговый номер пациента).
11
12.
После подписания ИС на каждого пациента долженбыть оформлен полис страхования жизни. Оригинал
полиса,
как
и
один
экземпляр
подписанного
и
датированного ИС, должен быть выдан на руки каждому
пациенту, копия страхового полиса будет храниться
вместе с первичной документацией в исследовательском
центре. Только после этого будут проводиться все
необходимые процедуры скрининга (визит 0).
12
13. Врач-исследователь должен донести до пациента следующую информацию:
1. Пациентам в ходе КИ запрещено употреблять в пищупродукты, содержащие клетчатку и растительные волокна:
груша, клубника, авокадо, яблоки, малина, бананы,
морковь, свекла, брокколи, бобовые, овес, хлеб, мука, рис,
попкорн, темный шоколад.
2. Пациенты не должны употреблять продукты и напитки,
способные усиливать диарею: яблочный, грушевый или
виноградный сок, финики, орехи, инжир, сливы, вафли,
алкогольные напитки, молочные продукты (молоко,
мороженое, йогурт или мягкий сыр), кофе, напитки на
основе колы.
13
14. После подписания ИС на визите будут проводиться следующие процедуры:
- сбор демографических (возраст, пол, расовая принадлежность) иантропометрических (измерение массы тела, роста, расчет ИМТ (одна
цифра после запятой)) данных;
- сбор жалоб и анамнеза, в том числе информации о сопутствующей
терапии;
- оценка степени дегидратации и тяжести состояния пациента;
- физикальное обследование;
- измерение показателей жизненно важных функций (АД, ЧСС, ЧДД);
- термометрия;
- регистрация ЭКГ в 12 отведениях;
14
15.
экспресс-тестыкала
на
вирусные
инфекции
(ротавирусная, норовирусная, аденовирусная инфекции);
- экспресс-тест кала на Salmonella spp (добавлен для
снижения риска ошибочного включения пациентов,
будет оформлено уведомление ЛЭК);
- бактериологическое исследование кала*;
- копрологическое исследование кала (копрограмма)*;
- общий анализ крови (определение содержания
эритроцитов, лейкоцитов, тромбоцитов, гемоглобина,
гематокрита, лейкоцитарной формулы, СОЭ);
- биохимический анализ крови (определение общего белка,
креатинина, глюкозы, общего билирубина, АЛТ, АСТ, ЩФ);
-
15
16.
- общий анализ мочи (определение цвета мочи, рН, удельного веса,прозрачности,
наличия
белка,
глюкозы,
билирубина,
уробилиногена, кетоновых тел, эритроцитов, лейкоцитов,
эпителия, цилиндров);
- тест на беременность (для женщин детородного возраста);
- тест на алкоголь в слюне;
- тест для выявления наркотиков в моче;
- оценка критериев включения / невключения;
- рандомизация пациентов в одну из двух групп и начало терапии;
- выдача ЛП разослепленным фармацевтом;
- выдача и первое заполнение Дневника пациента;
- регистрация НЯ/СНЯ.
16
17.
Примечание—
*
Результаты
бактериологического исследования кала и
копрограмма могут быть получены после
начала антибактериальной терапии.
17
18. Оценка показателей жизненно важных функций
Приопределении
показателей
жизненно
важных
функций
(измерение ЧСС, ЧДД, САД, ДАД), термометрия будут проведены в
покое (после 15 мин отдыха, не ранее чем через 1 ч после курения
сигарет и 2 ч после приема пищи).
Уровень САД, измеренного в положении «сидя», 100 мм рт. ст. —
139 мм рт. ст. и ДАД 60 мм рт. ст. — 89 мм рт. ст.; ЧСС в покое 60 —
90 уд/мин; ЧДД 12 — 18 в 1 мин; температура тела 36,0 — 36,9 ºC.
18
19. Экспресс-тест кала на Salmonella spp
1920. Экспресс-тест кала на Salmonella spp
Так как бактериологический посев каладелается от 2 до 9 дней, для исключения у
пациентов
сальмонеллеза
Вам
будут
предоставлены экспресс-тесты, для быстрого
определения.
При этом бактериологический посев кала
НЕ отменяется!
21. Оценка критериев включения
2122. Пациенты должны соответствовать следующим критериям включения:
1. Подписание пациентом ИС на участие в КИ.2. Мужчины и женщины европеоидной расы в возрасте от 18 до 65 лет
включительно.
3. Острая диарея бактериального генеза со сроком давности не более 72 ч
на момент рандомизации.
4. Как минимум, трехкратный неоформленный стул в течение 24 ч до
рандомизации.
23. 5. Как минимум, один из следующих признаков кишечной инфекции:
- боль в животе (в том числе спастического характера);- тошнота;
- рвота;
- императивные позывы к дефекации;
- избыточное газообразование / вздутие живота;
- тенезмы.
23
24.
6. Амбулаторные и стационарные пациенты, госпитализированные по эпидемиологическимпоказаниям, с диагнозом A04 (МКБ-10) легкой и средней степени тяжести, без осложнений.
Степень тяжести будет определяться согласно клиническим рекомендациям.
7. Способность к регулярному приему изучаемых ЛП и выполнению процедур КИ.
8. Согласие пациента-женщины, способной к деторождению, а также ее полового партнера
полностью
воздерживаться
от
половых
контактов
или
использовать
2 адекватных метода контрацепции (один из методов должен быть барьерным) на протяжении
всего КИ и в течение 30 дней после его завершения.
9. Отрицательный результат анализа мочи на беременность на скрининге для женщин.
10. Пациент-мужчина и его половая партнерша должны использовать адекватные методы
контрацепции в ходе всего КИ и в течение 30 дней после его завершения.
24
25. Оценка критериев невключения
2526. Пациенты не могут быть включены в исследование, если присутствует любой из следующих критериев:
1. Повышенная чувствительность к рифаксимину или другимрифамицинам, или любому другому компоненту исследуемого ЛП или
референтного ЛП.
27.
2. Прием пациентом любых антибактериальных ЛП, препаратовцинка, висмута, лоперамида, рацекадотрила, обволакивающих средств,
прокинетиков в связи с настоящим эпизодом диареи (допускается
включение в КИ пациентов, принимавших до момента включения в
исследование пробиотики и/или энтеросорбенты без уменьшения
выраженности симптомов, что свидетельствует об отсутствии эффекта
такой терапии к моменту включения в КИ; допускается прием не более
2 доз описанных препаратов в течение не менее 8 ч до рандомизации.
27
28.
3. Прием антибактериальных препаратов в течение 30 дней, предшествующихданному эпизоду (для исключения антибиотик-ассоциированной диареи).
4. Положительный результат экспресс-диагностики кала на вирусные инфекции:
ротавирусы, аденовирусы, норовирусы.
5. Другие желудочно-кишечные заболевания, сопровождающиеся диареей (коды
K52, K57, K59.1, K63.8.0, K72 по МКБ-10).
6. Клинические признаки тяжелой дегидратации (III и IV степени по
классификации В. И. Покровского).
7. Лихорадка ≥ 37,8 °C на момент включения пациента в КИ.
28
29.
8. Кровь и/или гной в стуле.9. Активные, неконтролируемые или клинически значимые заболевания или
расстройства сердца, легких, почек, ЖКТ (кроме пациентов с острой диареей
бактериального генеза) или центральной нервной системы.
10. Известное или предполагаемое злокачественное новообразование на
момент скрининга или в предшествующие 2 года, кроме полностью излеченного
рака кожи in situ.
11. Язва желудка или двенадцатиперстной кишки или острые эрозии, или
желудочно-кишечное кровотечение, требующие неотложных мероприятий.
29
30.
12. Хронические воспалительные заболевания кишечника, кровотечения изпрямой кишки.
13. Состояние пациента, требующее проведения системной антибактериальной
терапии (признаки сепсиса и т. д.).
14. Нарушение функции почек (клиренс креатинина менее 50 мл/мин) на
скрининге.
15. Тяжелое нарушение функции печени (уровень АЛТ, АСТ в 3 раза и более
превышающий верхнюю границу нормы, и/или уровень общего билирубина в 1,5
раза и более превышающий верхнюю границу нормы).
30
31.
16. Наличие коло- либо илеостомы.17. Психические и/или неврологические заболевания с частичной или полной утратой
дееспособности.
18. Наличие или подозрение на наркотическую, алкогольную либо лекарственную
зависимость.
19. Сахарный диабет, ВИЧ-инфекция и другие заболевания, при которых, по мнению
врача-исследователя, участие в КИ может представлять риск для пациента.
20. Участие в другом КИ менее чем за 3 месяца до скрининга.
21. Беременность, период грудного вскармливания.
22. Пациентки с сохраненным репродуктивным потенциалом, отказывающиеся
применять эффективные методы контрацепции на протяжении всего КИ.
31
32.
23. Лечение иммуномодулирующими ЛП за 2 недели до скрининга.24. Применение любых препаратов, таких как ацетилсалициловая кислота или
ибупрофен, которые могут вызвать желудочно-кишечное кровотечение (при этом
прием парацетамола допустим).
25. Неспособность пациента следовать процедурам протокола КИ, по мнению
врача-исследователя.
26. Выезд за пределы постоянного пребывания в предшествующие 7 дней в
районы, эндемичные по холере и/или брюшному тифу, или проживание в таких
районах.
27. Любые заболевания, сопровождающиеся диареей (болезнь Крона,
неспецифический язвенный колит, целиакия и др.).
32
33.
28. Известные гельминтозы на момент включения пациента в КИ.29. Наличие в анализе кала яйц глист, простейших.
30. Подозрение на дизентерийную или сальмонеллезную этиологию
заболевания.
31. Указание на любую природу острой диареи, кроме инфекционной.
32. Псевдомембранозный колит.
33. Если от окончания последней госпитализации, независимо от ее
причины, прошло менее 14 дней до скрининга.
33
34. Подозрение на дизентерийную или сальмонеллезную этиологию заболевания
3435.
При обнаружении вбактериальном
посеве кала возбудителей дизентерии и
сальмонеллеза – пациент исключается из КИ.
Даже если терапия оказалась эффективной.
36. Критерии исключения
3637. Пациент подлежит исключению из исследования при появлении следующих критериев:
1. Отказ пациента от участия в КИ.2. Развитие СНЯ.
3. Развитие НЯ, при котором дальнейшее участие в исследовании невозможно.
4. Ухудшение клинического состояния пациента, которое требует проведения
соответствующей дополнительной терапии, не разрешенной в рамках настоящего
протокола КИ (запрещенная сопутствующая терапия).
38.
5. Отсутствие эффективности терапии.6. Несоблюдение пациентом требований протокола КИ.
7. Диета с преимущественным содержанием продуктов, богатых клетчаткой и
растительными волокнами.
8. Наступление беременности.
9.
Ошибочное
включение
пациента
(нарушение
критериев
включения/
невключения).
10.
Лабораторно
подтвержденная
инфекция
этиологии,
отличной
от
бактериальной.
38
39. Запрещенная сопутствующая терапия
3940.
В ходе КИ запрещено применение следующих ЛП:- любая антибактериальная терапия, кроме изучаемых ЛП;
- любые пребиотики, пробиотики, эубиотики, симптоматические противодиарейные ЛП, в том числе препараты цинка, висмута, лоперамид, рацекадотрил,
энтеросорбенты, обволакивающие средства, прокинетики;
- опиоидные анальгетики;
- любые препараты, такие как ацетилсалициловая кислота или ибупрофен,
которые могут вызвать желудочно-кишечное кровотечение (при этом прием
парацетамола допустим);
- гормональные противозачаточные средства.
41. Разрешенная сопутствующая терапия
4142.
В ходе КИ пациентам разрешен прием ЛП, принимаемых при леченииинфекций, сопровождающихся диарейным синдромом:
- солевые пероральные растворы (например, ЛП Регидрон) для регидратации;
- по показаниям — парацетамол (в случае приема парацетамола температура
измеряется спустя > 4 ч после его приема);
- спазмолитики (например, дротаверин);
- ферментные препараты (например, панкреатин).
ЛП сопутствующей терапии должны фиксироваться в Дневнике пациента и
оцениваться врачом-исследователем на каждом визите.
43. Рандомизация пациентов в одну из двух групп и начало терапии
4344.
Если пациент соответствует критериям включения, и у него отсутствуют критерииневключения, он включается в КИ. Для получения рандомизационного кода врачу-
исследователю
необходимо
создать
карточку
пациента,
нажать
на
кнопку
рандомизации. Полученный код врачу-исследователю нужно вписать в дневник
пациента.
Врачу-исследователю необходимо позвонить фармацевту и сообщить, что был
включен в КИ пациент и сейчас ему нужно будет выдавать ЛП, согласно плану
рандомизации.
Пациенту будет присвоен рандомизационный код на визите 0, который определяет
прием исследуемого ЛП или референтного ЛП в соответствии с планом рандомизации.
Рандомизационный код пациента будет состоять из 3-х цифр (пример 001).
45. Выдача ЛП разослепленным фармацевтом
4546.
В каждом ИЦ будет выбран «разослепленныйфармацевт» – не обязательно иметь фармацевтическое
образование.
Разослепленный фармацевт будет контактировать только
с пациентом и с разослепленными участниками КИ.
Первую
дозу
исследовательском
ЛП
пациент
центре
должен
на
принять
визите
в
0
(день 0) под наблюдением разослепленного фармацевта.
Пациентам следует начать прием первой дозы ЛП после
предоставления образцов кала.
47.
Пациента необходимо предупредить о том, что из за приемаРифаксимина моча может приобретать красноватый цвет, что
является нормой.
47
48.
В день визита пациента в ИЦ, он НЕдолжен принимать ЛП утром (так как на
визите пациент сдает ряд анализов
предусмотренных протоколом КИ).
Также ему могут отменить ЛП при
оценке эффективности на визитах 2 и 3.
ЛП необходимо приносить на каждый
визит,
для
оценки
комплаентности
разослепленным фармацевтом.
48
49. Выдача и первое заполнение Дневника пациента
4950.
Дневник выдает врач-исследователь. На каждомвизите нужно будет проверять правильность
заполнения (если допускаются ошибки, нужно внести
их в эИРК).
Дневник начинается с вечера дня 0, поэтому
заполнять правильнее будет так:
Если пациент пришел утром, выпил препарат под
наблюдением фармацевта, тогда дневник он начинает
заполнять с вечера день 0.
Если пациент пришел днем-вечером, тогда он не
заполняет день 0 в дневнике.
51. Данные, которые необходимо внести в дневник пациента
1. Рандомизационный код пациента(имеется на всех страницах дневника)
51
52.
2. Визит выдачи (2 цифры)3. Дата выдачи
4. Номер ИЦ (две цифры)
52
53.
5354. Оценка эффективности. Визит 1 (день 3)
5455.
На визите 1 будут проводиться следующие процедуры:- сбор жалоб, актуализация анамнеза, в том числе информации о сопутствующей терапии;
- физикальное обследование;
- оценка показателей жизненно важных функций (АД, ЧСС, ЧДД);
- термометрия;
- оценка степени дегидратации и тяжести состояния пациента;
- оценка эффективности антибактериальной терапии;
- оценка комплаентности терапии разослепленным фармацевтом (оценивается на
визитах 1-3 и вносятся данные в эИРК);
- оценка заполнения Дневника пациента;
- регистрация НЯ/СНЯ;
- оценка критериев исключения;
- если у пациента наблюдается эффективность терапии, он продолжает
принимать лекарственный препарат до визита 2.
56. Оценка эффективности антибактериальной терапии
5657.
Основной (первичный) параметр эффективности:- частота наступления клинического излечения на 5-й день от
начала антибактериальной терапии, определяемого как:
а) отсутствие стула либо полностью оформленный стул (тип 3 и 4
по Бристольской шкале) за последние 48 ч, при отсутствии
лихорадки (при этом могут оставаться другие кишечные
симптомы);
ИЛИ
б) отсутствие водянистого стула (тип 7 по Бристольской шкале)
или не более двух эпизодов не полностью оформленного стула
(тип 5 и 6 по Бристольской шкале) за последние 24 ч при
отсутствии лихорадки и каких-либо других кишечных симптомов
(за исключением незначительного газообразования или вздутия).
58.
Лекарственныйпрепарат
следует
отменить,
если
симптомы диареи усиливаются или сохраняются более 48 ч.
Следует назначить другую антибактериальную терапию в
соответствии
с
официальными
клиническими
рекомендациями.
Если на визите 1 наступает излечение, ЛП необходимо
продолжать принимать до визита 2!
58
59. Оценка эффективности. Визит 2 (день 5)
5960.
На визите 2 будут проводиться следующие процедуры:- сбор жалоб, актуализация анамнеза, в том числе
информации о сопутствующей терапии;
- физикальное обследование;
- оценка показателей жизненно важных функций (АД, ЧСС,
ЧДД);
- термометрия;
- оценка степени дегидратации и тяжести состояния пациента;
- оценка эффективности антибактериальной терапии;
- оценка заполнения Дневника пациента;
- регистрация НЯ/СНЯ;
- оценка критериев исключения.
61.
В случае завершения терапии на 5-й день:- общий анализ крови (определение содержания
эритроцитов, лейкоцитов, тромбоцитов, гемоглобина,
гематокрита, лейкоцитарной формулы, СОЭ);
- биохимический анализ крови (определение общего
белка, креатинина, глюкозы, общего билирубина, АЛТ,
АСТ, ЩФ);
- общий анализ мочи (определение цвета мочи, рН,
удельного веса, прозрачности, наличия белка, глюкозы,
билирубина,
уробилиногена,
кетоновых
тел,
эритроцитов, лейкоцитов, эпителия, цилиндров);
61
62.
-копрологическое исследование кала (копрограмма)*;
бактериологическое исследование кала*;
сбор ЛП и расчет количества оставшегося ЛП, оценка
комплаентности разослепленным фармацевтом;
возврат Дневника пациента;
регистрация ЭКГ в 12 отведениях;
тест на алкоголь в слюне;
тест для выявления наркотиков в моче;
В случае завершения терапии на 5-й день пациент не
должен приходить в исследовательский центр на визит 3
(день 7).
62
63. Оценка эффективности. Визит 3 (день 7) Аналогично визиту 2 (день 5)
6364. Контроль безопасности. Визит 4 (день 14 ± 2)
65.
Врач-исследователь осуществляет телефонный контакт спациентом. Если пациент недоступен для контакта, должны быть
предприняты адекватные действия по выяснению исхода
заболевания (выздоровление, госпитализация в медицинское
учреждение, развитие осложнений, смерть пациента).
В момент телефонного звонка врач-исследователь
осуществляет следующие процедуры:
- сбор жалоб, актуализация анамнеза, в том числе информации о
сопутствующей терапии;
- регистрация НЯ/СНЯ;
- регистрация исхода заболевания, включая повторные эпизоды
диареи.
66.
Если у пациента в ходе КИ будут выявленыНЯ/СНЯ, незавершенные на визите 4, то пациент
должен быть приглашен в исследовательский центр на
незапланированный визит. Объем обследований на
незапланированном визите определяется врачомисследователем. В любое время в ходе КИ по
причинам, связанным с безопасностью, могут быть
назначены один или несколько незапланированных
визитов.
Врач-исследователь должен предупредить пациента о
дате и времени незапланированного(ых) визита(ов).
66
67.
Должно регистрироваться и сообщатьсялюбое СНЯ, независимо от взаимосвязи с ЛП, с
момента принятия ЛП и до истечения 7–9 дней
после
последнего
визита
участника
(последующее
наблюдение
посредством
телефонного звонка).
Исследование для пациента считается
завершенным при отсутствии клинически
значимых
отклонений
по
результатам
проведенных обследований.
67
68. Визит досрочного завершения
6869.
Еслипациент
принимает
решение
досрочно
завершить КИ в любой момент, или если врач-
исследователь
досрочное
будет
считать
целесообразным
выведение
пациента
из
КИ
(кроме
исключения из КИ по причине неэффективности
рифаксимина),
то
пациент
будет
приглашен
в
исследовательский центр для прохождения процедур
визита досрочного завершения.
70.
Навизите
досрочного
завершения
должны
быть
проведены
следующие процедуры:
- общий анализ крови (определение содержания эритроцитов, лейкоцитов,
тромбоцитов, гемоглобина, гематокрита, лейкоцитарной формулы, СОЭ);
- биохимический анализ крови (определение общего белка, креатинина,
глюкозы, общего билирубина, АЛТ, АСТ, ЩФ);
- общий анализ мочи (определение цвета мочи, рН, удельного веса,
прозрачности,
наличия
белка,
глюкозы,
билирубина,
уробилиногена,
кетоновых тел, эритроцитов, лейкоцитов, эпителия, цилиндров);
70
71.
- сбор ЛП и расчет количества оставшегося ЛП, оценкакомплаентности разослепленным фармацевтом;
- копрологическое исследование кала (копрограмма)*;
- бактериологическое исследование кала*;
- возврат Дневника пациента;
- регистрация ЭКГ в 12 отведениях;
- тест на алкоголь в слюне;
- тест для выявления наркотиков в моче.
71
72. Завершение исследования
7273.
Завершение КИ предусматривает прохождение пациентами всех предусмотренныхпротоколом КИ процедур.
Исследовательский центр должен полностью завершить КИ и заполнить всю
требуемую документацию в полном соответствии с протоколом КИ.
Уведомление о завершении КИ должно быть направлено в Министерство
здравоохранения РФ в срок, не превышающий пяти рабочих дней со дня завершения
КИ.
74. Отбор образцов кала для анализа
7475.
При отсутствии на скрининге возможности отбора проб / неотборепроб для бактериологического исследования кала, копрограммы и
экспресс-тестов на вирусные инфекции в кале НЕ следует включать
пациента в КИ. При отсутствии возможности отбора проб / неотборе
проб на визите 2 / визите 3 будет оформлено отклонение от протокола
КИ,
пациенту
будет
назначен
дополнительный
визит.
На
дополнительном визите пациент должен будет передать врачуисследователю контейнер с калом для выполнения бактериологического
исследования и копрограммы.
76.
Сколько времени должно пройти от моментасбора кала до доставки в клинику?
Пациенту следует передать контейнер в клиническую
лабораторию не позднее 2 ч от момента сбора кала
76
77.
Индивидуальные данные, результаты обследований имедицинский анамнез указываются сначала в первичной
документации каждого пациента (история болезни), а затем
переносятся в эИРК не позднее 3–5 рабочих дней после
визита.
77
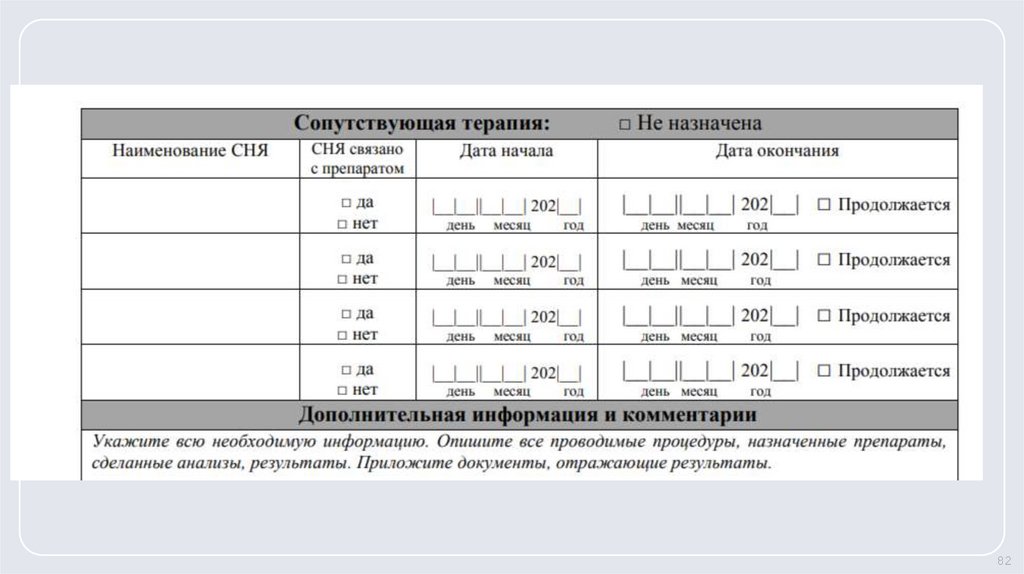
78. Форма СНЯ из протокола КИ
7879.
7980.
8081.
8182.
8283. Внесение данных в эИРК
8384.
1. Если в результатах лабораторных анализов у Вас нетединого значение (например: в ОАМ эпителий 1-3)
необходимо вносить в эИРК верхнее значение (в примере –
это значение 3).
2. Информацию о НЯ необходимо внести в эИРК в течение 3х
дней.
3. Если пациент заканчивает терапию на визите, то
необходимо ответить НЕТ на вопрос в конце визита, тогда
Вам открываются все формы анализов и тд.
84




















































































 Медицина
Медицина








