Похожие презентации:
Кровь: состав, функция. Особенности метаболизма в эритроцитах. Свертывание крови
1. Кровь: состав, функция. Особенности метаболизма в эритроцитах. Свертывание крови.
«Кровь как зеркало отражает многое изтого, что происходит в организме»
Н.А. Кассирский
Кровь: состав, функция.
Особенности метаболизма
в эритроцитах.
Свертывание крови.
Шамитова Елена Николаевна
2.
3. ОБЩАЯ ХАРАКТЕРИСТИКА КРОВИ
Кровь особый жид подвижной соединительной ткани,циркулирующей
в замкнутой системе кровеносных сосудов и
благодаря работе сердца находиться в состоянии непрерывного
движения. Она транспортирует различные химические вещества к
органам и тканям, и осуществляет интеграцию метаболических
процессов, протекающих в различных клетках. Кровь относится к
быстро обновляющимся тканям. Физиологическая регенерация
форменных элементов крови осуществляется за счёт разрушения
старых клеток и образования новых органами кроветворения. Главным
из них у человека и других млекопитающих является костный мозг.
Среднее количество крови в теле взрослого человека 6—8 % от общей
массы, а в теле ребёнка — 8—9 %. Т. е. средний объём крови у
взрослого человека составляет 5000—6000 мл.
На жидкую часть
крови(плазму) приходится в среднем 55% общего объема, оставшаяся
часть - форменные элементы (эритроциты, лейкоциты и тромбоциты).
4. Функции крови:
1. транспортная - одна из основных функций крови. Кровьтранспортирует кислород от лёгких к тканям и углекислый газ от
тканей к лёгким, также осуществляет перенос питательных веществ от
органов пищеварения к тканям; метаболитов, растворенных в воде, а
также гомонов из одного участка тела в другой.
2. выделительная — выносит из тканей конечные продукты обмена
веществ: мочевину, мочевую кислоту, билирубин, креатинин и др. к
органам выделения.
3. терморегуляторная — поддерживает постоянство температуры тела,
нагреваясь в органах с высоким обменом веществ – мышцах, печени,
кровь переносит тепло к другим органам и коже, через которую
происходит теплоотдача.
4. гуморальная — связывает между собой различные органы и системы,
перенося сигнальные вещества, которые в них образуются.
5. защитная — обеспечивается белыми клетками крови,
иммуноглобулинами и системой комплемента
6. гемостатическая — определяется соотношением свертывающей и
противосвертывающей систем. Эта функция предохраняет организм от
потери крови путем остановки кровотечения в результате свёртывания
крови.
5.
6.
Вязкость крови – сопротивление течению жидкости при взаимномперемещении частиц за счет внутреннего трения. Вязкость цельной
крови равна 5 Ед, плазмы крови – 1,8–2,5 Ед по отношению к
дистиллированной воде). Вязкость цельной крови, в основном, зависит
от количества эритроцитов,вязкость плазмы обусловлена белками,
особенно альбуминами. Повышение вязкости влечет за собой
возрастание сопротивления току крови, снижает линейную скорость
кровотока и увеличивает опасность тромбообразования.
Относительная плотность или удельный вес цельной крови равна
1,050–1,060; плазмы – 1,024–1,034.
Температура крови во многом зависит от интенсивности обмена веществ
того органа, от которого оттекает кровь, и колеблется в пределах 37–40
градусов . Предельные значения рН, совместимые с жизнью, составляют
6,8–8,0 (в коротком интервале времени). В норме рН для артериальной
крови равно 7,36–7,42, для венозной крови 7,26–7,36. Более кислая
реакция венозной крови связана с наличием угольной кислоты.
Отклонение рН в кислую сторону называется ацидозом, а в щелочную –
алкалозом.
7.
Осмотическое давление сила, которая определяет движениерастворителя через полупроницаемую мембрану из раствора
меньшей концентрации в раствор большей концентрации.
Осмотическое давление крови является одной из жестких констант и
составляет 7,3–8,0 атм. Осмотическое давление определяет
распределение воды между тканями и клетками. В норме
осмолярность плазмы и эритроцитов уравновешены, т.е. они
изотоничны.
Онкотическое давление – часть осмотического давления,
создаваемоебелками (в основном, альбуминами). Онкотическое
давление – важнейший фактор, удерживающий жидкость в
сосудистом русле, поскольку онкотическое давление в крови больше,
чем в тканях. Онкотическое давление крови равно 0,03–0,04
атмосфер или 25–30 мм рт. ст. Снижение онкотического давления
крови при гипопротеинемии или повышение онкотического
давления в тканях(например, при ожогах или воспалении) ведет к
появлению отеков.
8.
9. Состав
1. Плазма – раствор белков, электролитов,моносахаридов, азотсодержащих
соединений, липидов.
2. Форменные элементы:
• Эритроциты
• Тромбоциты
• Лейкоциты
10.
11. КЛЕТОЧНЫЕ ЭЛЕМЕНТЫ КРОВИ И ИХ МЕТАБОЛИЗМ
1. Эритроциты - самые многочисленные из форменныхэлементов (красные кровяные тельца). Они образуются в
костном мозге плоских костей из стволовых кроветворных
клеток. Стимуляторами эритропоэза являются ИЛ-3,
эритропоэтин. Скорость образования эритропоэтина в
мозговом слое почек зависит от парциального давления
кислорода. При недостатке кислорода скорость образования
гормона повышается и, соответственно, количество
эритроцитов тоже увеличивается. Хроническая почечная
недостаточность сопровождается снижением образования
эритропоэтина в почках, что приводит к развитию анемии.
В процессе дифференцировки эритробластов (содержит
ядро) и поступивших в кровоток незрелых клеток
(ретикулоцит) идет активный синтез белков, которые
сохраняются на протяжении всей жизни зрелого
эритроцита. После вытеснения ядра клетки утрачивают
большую часть своей метаболической активности, в том
числе и способность синтезировать белки. Зрелые клетки
имеют форму двояковогнутых дисков почти полностью
заполненного гемоглобином.
12. RBC (red blood cells — красные кровяные тельца)
абсолютное содержаниеэритроцитов (норма 4,3—5,15
10^{12} кл/л)
13.
HCT/RBC — средний объём эритроцитов.HGB/RBC — среднее содержание гемоглобина в
эритроците.
HGB/HCT — средняя концентрация гемоглобина в
эритроците.
RDW — Red cell Distribution Width — «ширина
распределения эритроцитов» так называемый
«анизоцитоз эритроцитов» — показатель
гетерогенности эритроцитов, рассчитывается как
коэффициент вариации среднего объёма
эритроцитов.
RDW-SD — относительная ширина распределения
эритроцитов по объёму, стандартное отклонение.
RDW-CV — относительная ширина распределения
эритроцитов по объёму, коэффициент вариации.
P-LCR — коэффициент больших тромбоцитов.
ESR (СОЭ) (скорость оседания эритроцитов) —
неспецифический индикатор патологического
состояния организма.
14. Эритроцитарные индексы
MCV — средний объём эритроцита в кубических микрометрах(мкм) или фемтолитрах (фл)
норма 80—95 фл
В старых анализах указывали: микроцитоз, нормоцитоз,
макроцитоз.
MCH — среднее содержание гемоглобина в отдельном
эритроците в абсолютных единицах
норма 27—31 пг
пропорциональное отношению «гемоглобин/количество
эритроцитов». Цветной показатель крови в старых анализах.
ЦП=MCH*0.03
MCHC — средняя концентрация гемоглобина в эритроцитарной
массе, а не в цельной крови (см. выше HGB)
норма 300—380 г/л.
Отражает степень насыщения эритроцита гемоглобином.
15.
В 1 мм3 крови человека в норме содержится 4,5—5,5 млн.эритроцитов (у мужчин 4,5—5 млн., у женщин 4—4,5 млн.).
Общая поверхность эритроцитов достигает 300 м2. Это в 200 раз
больше поверхности тела. Большая площадь поверхности
обеспечивает эффективность газообмена, эластичная клеточная
мембрана облегчает движение по узким капиллярам,
специальная ферментативная система защищает эти клетки от
активных форм кислорода. Эритроциты могут перемещаться как
по отдельности, так и группами наподобие уложенных в стопку
монет создавая концентрирующийся в центре сосуда поток.
Длительность циркуляции – 100-120 дней.
Важную роль в сохранении формы и способности к обратимой
деформации
эритроцитов
играют
липиды
и
белки
плазматической мембраны. Три из них - спектрин,
гликофорин, белок полосы 3 - составляют в сумме по весу более
6О% всех мембранных белков.
К N-концевой части белка, расположенной на наружной
поверхности
мембраны,
присоединено
около
20
олигосахаридных цепей. Олигосахариды гликофорина антигенные детерминанты системы групп крови АВО.
16.
Спектрин - периферический трансмембранный белок,нековалентно
связанный
с
цитоплазматической
поверхностью
липидного
бислоя мембраны. Он
представляет собой длинную, тонкую, гибкую фибриллу и
является основным белком цитоскелета эритроцитов.
Спектрин состоит из α- и β-полипептидных цепей,
имеющих доменное строение; α- и β-цепи димера
расположены антипараллельно, перекручены друг с
другом и нековалентно взаимодействуют во многих точках.
Спектрин может прикрепляться к мембране и с помощью
белка анкирина. Этот крупный белок соединяется с βцепью спектрина и цитоплазматическим доменом
интегрального белка мембраны - белка полосы 3. Каждый
димер спектрина состоит из двух антипараллельных,
нековалентносвязанных
между
собой
αи
βполипептидных цепей (А). Белок полосы 4.1 образует со
спетрином и актином "узловой комплекс", который
посредством
белка
полосы
4.1
связывается
с
цитоплазматическим доменом гликофорина.
17.
Анкирин соединяет спектрин с основным интегральнымбелком плазматической мембраны - белком полосы 3 (Б).
На
цитоплазматической
поверхности
мембраны
эритроцита имеется гибкая сетеобразная структура,
состоящая из белков и обеспечивающая пластичность
эритроцита при прохождении им через мелкие капилляры
(В).
Интегральный белок полосы 3 - белок-переносчик ионов С1и НСО3- через плазматическую мембрану эритроцитов по
механизму пассивного антипорта. Поступающий из тканей
в
эритроциты
СО2
под
действием
фермента
карбоангидразы превращается в слабую угольную кислоту,
которая распадается на Н+ и НСО3-. Образующиеся при
этом протоны присоединяются к гемоглобину, уменьшая
его сродство к О2, а бикарбонаты с помощью белка полосы
3 обмениваются на Cl- и выходят в плазму крови.
Н2О + СО2 → Н2СО3 → Н+ + НСО3- → обмен на Сl- .
18.
В лёгких увеличение парциального давления кислорода ивзаимодействие его с гемоглобином приводят к вытеснению
протонов из гемоглобина, обмену внутриклеточного Сl- на
НСО3- через белок полосы 3, образованию угольной кислоты и
её разрушению на СО2 и Н2О.
Мембранный
фермент
Nа+,
К+-АТФ-аза
обеспечивает
поддержание градиента концентраций Na+ и К+ по обе стороны
мембраны. При снижении активности Na+, К+-АТФ-азы
концентрация Na+ в клетке повышается, так как небольшие
ионы могут проходить через мембрану простой диффузией. Это
приводит к увеличению осмотического давления, увеличению
поступления воды в эритроцит и к его гибели в результате
разрушения клеточной мембраны - гемолизу.
Са2+-АТФ-аза - мембранный фермент, осуществляющий
выведение из эритроцитов ионов кальция и поддерживающий
градиент концентрации этого иона по обе стороны мембраны.
Белки аквопорины (Aquaporins (AQPs) транспортирует воду через
клеточные мембраны в ответ на осмотические градиенты
19. Белки цитоплазмы эритроцитов
Белки цитоплазмы эритроцитовОсновным белком эритроцитов, на долю которого приходится
около 98 % всей массы белков цитоплазмы, является гемоглобин.
Последний является гетеродимерным тетрамером, состоящим
из четырех полипептидных цепей, соединенных с четырьмя
молекулами гема. В свою очередь гем – это молекула
протопорфина IX, связанная с анионом железа.
Каждый
тетрамер
гемоглобина
может обратимо связывать и
транспортировать не более 4-х молекул кислорода. К числу
основных гемоглобинов (Hb) взрослого человека относится
гемоглобин А (от слова adultus – взрослый), на долю которого
приходится 96–98 % и в составе которого имеются две α- и две βцепи (α2β2).
20.
21.
22.
К числу нормальных гемоглобинов относится гемоглобинА2 , который содержится в крови взрослого человека в
количестве 1,5-3,5 % (символ HbA2 – α2 δ2). На долю
фетального гемоглобина (HbF – α2γ2) приходится 0,5–
1%. Смена гемоглобина F на гемоглобин А происходит
во время рождения ребенка, а к 4–6 месяцам жизни
уровень фетального гемоглобина составляет 1 %.
Главным регулятором сродства Hb к О2 является
промежуточный
продукт
гликолиза
–
2,3дифосфоглицериновая кислота (2-3ДФГ). Увеличение
образования 2,3ДФГ снижает сродство Hb к О2, что
приводит к сдвигу кривой диссоциации оксигемоглобина
вправо и к усиленному поступлению О2 в ткани. Сдвиг
кривой вправо возникает также при увеличении
температуры тела, возрастании уровня СО2 или на фоне
развития
метаболического
ацидоза.
Фетальный
гемоглобин слабо связывается с 2-3ДФГ и поэтому
характеризуется более высокой
кислородсвзывающей
способностью по сравнению с HbA.
23.
24.
25.
26.
27.
28. Транспорт газов эритроцитами
Реакциисвязывания
кислорода в лёгких и его
высвобождения в тканях
- химические реакции,
обеспечивающие перенос
(транспорт) кислорода с
кровью от лёгких к
тканям.
29.
Транспорт О2 обеспечивается в значительной мерегемоглобином, состоящим из белка глобина и гема. Ион железа
гема обратимо связывает одну молекулу О2. С одной молекулой
Hb максимально связываются 4 молекулы О2 с образованием
оксигемоглобина. Гем может подвергаться не только
оксигенации, но и истинному окислению, когда железо
становится из двухвалентного трехвалентным. Окисленный гем
носит название гематина, а молекула гемоглобина становится
метгемоглобином. В крови человека метгемоглобин находится в
незначительных количествах(менее3% общего Hb крови), его
уровень резко возрастает при отравлениях. Метгемоглобин не
способен отдавать кислород тканям.Основная форма транспорта
О2– в виде оксигемоглобина. Кислород транспортируется
артериальной кровью
не только в связи
с гемоглобином,
но и в растворенном
виде
30.
Реакция связывания кислорода гемоглобином называетсяоксигенацией гемоглобина, а реакция высвобождения
кислорода гемоглобином называется дезоксигенацией
гемоглобина. В результате оксигенации образуется
оксигемоглобин, а в результате реакции обратного
направления,
дезоксигенации,
образуется
восстановленный гемоглобин, или дезоксигемоглобин.
Реакции оксигенации / дезоксигенации можно записать
следующим образом:
Hb4 + O2 ↔ Hb4O2 (1).
Hb4O2 + O2 ↔ Hb4O4 (2).
Hb4O4 + O2 ↔ Hb4O6 (3).
Hb4O6 + O2 ↔ Hb4O8 (4).
31.
32.
В соответствии с кривой диссоциации оксигемоглобина насыщениеартериальной крови кислородом в среднем составляет 97%, в
венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт.ст., а в венозной – около
40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально
парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст..
Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст.,
содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным
образом химическими свойствами гемоглобина, а также рядом
других факторов – температурой тела, рН среды, р СО2
При понижении температуры тела наклон кривой диссоциации
оксигемоглобина возрастает, а при ее повышении – снижается, и
соответственно снижается сродство Hb к О2. При снижении рН, т.е.
при закислении среды, сродство гемоглобина к О2 уменьшается.
Увеличение напряжения в крови СО2 также сопровождается
снижением сродства Hb к О2 и уплощением кривой диссоциации
оксигемоглобина
33.
Согласно закону Фика, газообмен О2 между альвеолярным воздухом и кровью происходитблагодаря наличию концентрационного градиента О2 между этими средами. В альвеолах легких
парциальное давление О2 100 мм рт.ст., а в притекающей к легким венозной крови парциальное
напряжение О2 40 мм рт.ст. Давление газов в воде или в тканях организма обозначают термином
«напряжение газов» и обозначают символами Ро2, Рсo2.
Транспорт О2 начинается в капиллярах легких после его химического связывания с гемоглобином.
Гемоглобин (Нb) способен избирательно связывать О2 и образовывать оксигемоглобин (НbО2) в
зоне высокой концентрации О2 в легких и освобождать молекулярный О2 в области пониженного
содержания О2 в тканях. Гемоглобин переносит О2 от легких к тканям.
Зависимость степени оксигенации гемоглобина от парциального давления О2 в альвеолярном
воздухе графически представляется в виде кривой диссоциации оксигемоглобина. Плато кривой
диссоциации характерно для насыщенной О2 (сатурированной) артериальной крови, а крутая
нисходящая часть кривой — венозной, или десатурированной, крови в тканях.
Влияние рН на кривую диссоциации оксигемоглобина называется. Эффект Бора способствует
связыванию и обмену кислорода в легких. Повышение сродства гемоглобина к О2: сдвиг влево, угол
наклона кривой повышается: повышение рН крови, уменьшение температуры тканей, уменьшение
содержания 2,3-дифосфоглицерата, уменьшение напряжения СО2 в крови. Понижение сродства
гемоглобина к О2: сдвиг вправо, угол наклона кривой понижается): понижается рН крови, рост
температуры, рост 2,3-дифосфоглицерата, рост напряжения СО2 в крови
Кислородная ёмкость крови – количество О2, которое связывается кровью до полного насыщения
гемоглобина. Величину кислородной емкости крови определяет количество гемоглобина, 1 г
которого связывает 1,36—1,34 мл О2. Кровь человека содержит около 700—800 г гемоглобина и
может связать таким образом почти 1 л О2.
34. Условия связывания кислорода и условия отдачи принято изображать графически в виде кривой диссоциации оксигемоглобина.
35.
Напряжение двуокиси углерода в артериальной крови, поступающей вкапилляры микрогемациркуляторного русла тканей, составляет 40 мм
рт ст (5,3кПа). В клетках же, расположенных около этих капилляров,
напряжение двуокиси углерода значительно выше, так как она
непрерывно образуется как конечный продукт метаболизма. В связи с
этим, растворенная в цитоплазме клеток двуокись углерода,
диффундирует в направлении положительного градиента напряжения
через мембрану клеток в интерстициальную жидкость, а оттуда в кровь
капилляров.
36.
37. Транспорт углекислого газа кровью.
Углекислый газ является конечным продуктом клеточного метаболизма. Он образуетсяв тканях, диффундирует в кровь и переносится кровью к легким в 3
формах: растворенной в плазме, в составе бикарбонатов и в виде карбаминовых
соединений эритроцитов.
В венозной крови, притекающей к капиллярам легких, напряжение СО2 составляет в
среднем 46 мм рт.ст., а в альвеолярном воздухе парциальное давление
СО2 равно в среднем 40 мм рт.ст., что обеспечивает диффузию СО2 из плазмы
крови в альвеолы легких по концентрационному градиенту.
От парциального напряжения физически растворенного углекислого газа зависит
процесс связывания С02 кровью. Углекислота поступает в эритроцит, где
имеется фермент карбоангидраза, который может в 10 000 раз увеличить скорость
образования угольной кислоты. Пройдя через эритроцит, угольная
кислота превращается в бикарбонат и переносится к легким.
Эритроциты переносят в 3 раза больше С02, чем плазма. Белки плазмы
составляют 8 г на 100 см3 крови, гемоглобина же содержится в крови 15 г на 100
см3. Большая часть С02 транспортируется в организме в связанном состоянии в
виде гидрокарбонатов и карбаминовых соединений, что увеличивает время
обмена С02.
Кроме растворенного в плазме крови С02, в альвеолы легких диффундирует
С02, который высвобождается из карбаминовых соединений эритроцитов
благодаря реакции окисления гемоглобина в капиллярах легкого, а также из
гидрокарбонатов плазмы крови в результате их быстрой диссоциации с
помощью содержащегося в эритроцитах фермента карбоангидразы. Бикарбонаты
плазмы для освобождения С02 должны
сначала проникнуть в эритроциты, чтобы
подвергнуться действию карбоангидразы.
38. Транспорт углекислого газа кровью.
39. Утилизация кислорода тканями
Тканевое или клеточное дыхание включает три стадии. На 1 стадиипируват, аминокислоты и жирные кислоты окисляются до
двухуглеродных фрагментов ацетильных групп, входящих в состав
ацетилкофермента А. Последние на 2 этапе окисления включаются
в цикл лимонной кислоты, где происходит образование
высокоэнергетических атомов водорода и высвобождение СО2 –
конечного продукта окисления органических субстратов. На 3
стадии клеточного дыхания атомы водорода делятся на протоны
(Н+) и «высокоэнергетические» электроны, передающиеся по
дыхательной цепи на молекулярный О2 и восстанавливающие его
до НО2. Перенос электронов сопряжен с запасом энергии в форме
АТФ, т.е. с окислительным фосфорилированием. В организме
человека более 90% всего потребляемого кислорода
восстанавливается с участием цитохромоксидазы митохондрий, и
лишь около 10% кислорода метаболизируется в тканях с участием
оксигеназ: диоксигеназы и монооксигеназы.
40. Утилизация кислорода тканями
Скорость утилизации О2 в различных тканях различна. В среднемвзрослый человек потребляет 250 мл О2 в 1 мин. Максимальное
извлечение О2 из притекающей артериальной крови свойственно
миокарду. Кислород используется в клетках в окислительновосстановительных реакциях. Коэффициент утилизации О2 в тканях равен
отношению потребления О2 к интенсивности его доставки, широко
варьирует в различных органах и тканях. В условиях нормы
минимальную потребность в О2 проявляют почки и селезенка, а
максимальную потребность – кора головного мозга, миокард и
скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до
0,6, а в миокарде до 0,7. Обмен дыхательных газов в тканях происходит в
процессе свободной и облегченной диффузии. При этом О2 переносится
по градиенту напряжения газа из эритроцитов и плазмы крови в
окружающие ткани. Одновременно происходит диффузия СО2 из тканей в
кровь. Интенсивность диффузионного потока О2 и СО2 определяется
градиентом их напряжения между кровью и тканями, а также площадью
газообмена, плотностью капилляров, распределением кровотока в
микроциркуляторном русле.
41.
Обмен глюкозы в эритроцитах• Основной путь получения энергии – гликолиз, 90% глюкозы в
эритроцитах распадается в процессе анаэробного гликолиза. И
10% глюкозы окисляется в реакциях пентозофосфатного пути.
Глюкоза распадается в цитоплазме до двух молекул лактата,
которые удаляются из клетки в плазму крови и используется в
других клетках, прежде всего гепатоцитах. АТФ, образующийся в
анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и
поддержание самого гликолиза, требующего затраты АТФ в
гексокиназной и фосфофруктокиназной реакциях.
• Особенность анаэробного гликолиза в эритроцитах по сравнению
с другими клетками наличие обходного пути, по которому
молекула 1,3-бисфосфоглицерата в 2,3-бисфосфоглицерат.
Образующийся, только в эритроцитах 2,3-бисфосфоглицерат
служит важным аллостерическим регулятором связывания
кислорода
гемоглобином.
Реакция
образования
2,3дифосфоглицерата, отсутствующая в «классическом» гликолизе,
называется шунт Раппопорта.
42. Антиоксидантная защита
Антиоксидантная защита. Окисление железа гемоглобинаэритроцитов сопровождается образованием супероксидного
анион-радикала:
Главной функциональной группой глутатиона является
сульфгидрильная группа, водород которой
обеспечивает
нейтрализацию органических и неорганических окислителей,
действующих на мембрану эритроцита, и защищает липиды
мембраны от свободнорадикального окисления.
Восстановленный глутатион необходим для поддержания в
восстановленной форме SH-групп белков; препятствует
окислению гемоглобина; предотвращает перекисное окисление
липидов
мембран.
При
снижении
концентрации
восстановленного глутатиона эритроцит быстро «стареет».
43.
44.
1 - спонтанное окисление Fe2+ в теме гемоглобина источник супероксидного аниона в эритроцитах;2 - Супероксиддисмутаза превращает супероксидный анион
в пероксид водорода и воду: О2-+ О2- + 2Н+ → Н2О2 +
О2;
3 - пероксид водорода расщепляется каталазой: 2 Н2О2 → 2
Н2О + О2или глутатионпероксидазой: 2 GSH + Н2О2 →
GSSG +2 Н2О;
4 - Глутатионредуктаза восстанавливает окисленный
глутатион: GSSG + NADPH + Н+ → 2GSH + NADP+;
5 - NADPH, необходимый для восстановления глутатиона,
образуется на окислительном этапе пентозофосфатного
пути превращения глюкозы;
6 - NADH, необходимый для восстановления гемоглобина
метгемоглобинредуктазной системой, образуется в
глицеральдегидфосфатдегидрогеназной
реакции
гликолиза.
45.
46. Лейкоциты
Лейкоциты(белыекровяные
тельца)
в
отличие
от
эритроцитов отличаются друг
от друга как по строению, так и
по функциональному значению.
Все лимфоциты имеют единого
предшественника – стволовую
кроветворную
клетку
и
проходят начальные этапы
дифференцировки в костном
мозгу( 96 –144ч).
47. WBC (white blood cells — белые кровяные тельца)
Лейкоциты позвоночных животных и человека образуются вспециальных кроветворных органах: в период эмбрионального
развития такими органами являются желточный мешок, печень,
селезенка и костный мозг. Во взрослом организме лейкоциты
образуются в костном мозге, а лимфоциты, кроме того, в селезенке,
вилочковой железе и лимфатических узлах.
48.
Регуляцияпролиферации
и
дифференцировки
лейкоцитов
осуществляется: для лимфоидного ряда – это про-Т- и про-Влимфоциты, а для миелоидного ряда – это колониеобразующие клетки
эозинофильного и базофильного рядов (КОЕ-Эо, КОЕ-Б),
нейтрофильного ряда (КОЕ-Г), моноцитарного ряда (КОЕ-М), а также
эритроцитарного (КОЕ-Э) и мегакариоцитарного (КОЕ-Мег) рядов.
Усиление лейкопоэза возникает под влиянием провоспалительных
цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, а также под влиянием ряда медиаторов
воспаления, в частности лейкотриенов В4, С4, ФСК, вырабатываемого
клетками микроокружения стволовых клеток. Универсальными
стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются
гормоны адаптации: катехоламины, глюкокортикоиды, реализующие
свои эффекты на костный мозг через усиление образования КСФ и
интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин
В12, аскорбиновая кислота, фолиевая кислота, железо.
Подавление костно-мозгового кроветворения возможно под влиянием
ряда медиаторов воспаления, таких, как простагландины Е1, Е2, ИЛ-10,
ИЛ-13, ФНО-α, трансформирующий фактор роста бета (ТФР-β), а
также лактоферрина и кислого изоферритина.
49. Лейкоцитарные индексы
• LYM% (LY%) (lymphocyte) — относительное (%) содержание(норма 25—40 %) лимфоцитов.
• MXD% — относительное (%) содержание смеси (норма 5—10 %)
моноцитов, базофилов и эозинофилов.
• NEUT% (NE%) (neutrophils) — относительное (%) содержание
нейтрофилов.
• MON% (MO%) (monocyte) — относительное (%) содержание
моноцитов (норма 4—11 %).
• EO% — относительное (%) содержание эозинофилов.
• BA% — относительное (%) содержание базофилов.
• IMM% — относительное (%) содержание незрелых
гранулоцитов.
• ATL% — относительное (%) содержание атипичных лимфоцитов.
• GR% — относительное (%) содержание (норма 47—72 %)
гранулоцитов.
50. Лейкоцитарная формула (лейкограмма)
— процентное соотношение различныхвидов лейкоцитов, определяемое при
подсчёте их в окрашенном мазке крови
под микроскопом.
51.
Регуляция пролиферации и дифференцировки лейкоцитовосуществляется: неспецифической защиты макроорганизма.
Лейкоциты являются полноценными клетками с большим ядром,
митохондриями и высоким содержанием нуклеиновых кислот. В
лейкоцитах
активно
протекают
процессы
биосинтеза
нуклеиновых кислот и белков.
Основной путь получения энергии – аэробный гликолиз. АТФ
образуется также в реакциях β-окисления жирных кислот.
В лейкоцитах сосредоточен весь гликоген крови, который является
источником энергии при недостаточном её поступлении.
В лизосомах лейкоцитов локализована мощная система
протеолитических ферментов – протеазы, фосфатазы, эстеразы,
ДНК-азы, РНК-азы, что обеспечивает участие этих клеток в
защитных реакциях организма. В результате действия этих
ферментов
разрушаются
полимерные
молекулы
микроорганизмов и образуются мономеры (моносахариды,
аминокислоты, нуклеотиды), которые поступают в цитозоль и
могут использоваться клеткой.
Поглощение бактерий лейкоцитами в процессе фагоцитоза
сопровождаются резким увеличением потребления кислорода с
образованием супероксидного аниона и пероксида водорода,
которые оказывают бактерицидное действие. Это явление
называется «распираторным взрывом».
52. Тромбоциты
Тромбоциты(кровяные пластинки)- образуютсяиз цитоплазмы мегакариоцитов костного мозга и
не могут считаться полноценными клетками,
поскольку не содержат ядра. Имеют форму диска
диаметром около 3 мкм и толщиной около 0,5
мкм. Циркулируют в кровотоке в концентрации
200–400 тыс. клеток в 1 мкл крови. Живут
тромбоциты в кровотоке в среднем 5–9 дней, а
затем разрушаются в селезенке и печени. В
последние 20 лет было обнаружено их участие в
иммунном ответе, воспалении, регенерации
тканей,
ангиогенезе
(образовании
новых
кровеносных сосудов) и даже развитии опухолей.
Дальнейшее изучение тромбоцитов поможет
лучше понять протекание многих жизненно
важных процессов нашего организма, но в
первую очередь станет решающим шагом в
победе над тромбозом — основной причиной
смертности в развитых странах.
53. Цитоскелет и изменение формы тромбоцитов
Цитозольтромбоцита
пронизан
трехмерной
сетью
из
водонерастворимых белковых нитей
(филаментов), которая формирует
цитоскелет. Филаменты состоят из
полимеризованного белка актина и
обеспечивают
изменение
формы
тромбоцита при активации. Под
плазматической мембраной находится
мембранный скелет, связанный с
цитоплазматическими
«хвостами»
некоторых рецепторов. Состоит он из
коротких актиновых филаментов,
соединенных друг с другом с
помощью
специальных
белков.
Мембранный скелет не только
поддерживает
плазматическую
мембрану, регулируя контуры клетки,
и стабилизирует ее, предотвращая
фрагментацию, но и регулирует
распределение в плоскости мембраны
рецепторов, прикрепленных к нему.
54.
55.
Снаружи тромбоцит ограничен билипиднымслоем мембраны, многочисленные впячивания
которой (открытая канальцевая система) дают
запас поверхности для изменения формы.
Поддерживает ее и одновременно позволяет
сильно менять цитоскелет (каркас) клетки.
Внутри находятся эндоплазматический
ретикулум (хранилище ионов кальция,
необходимых для сигнализации и выполнения
тромбоцитом своих функций) и митохондрии
(органеллы, обеспечивающие дыхание).
В цитозоле присутствуют гранулы, содержащие
вещества, выплескивающиеся при активации
клетки (переходе в новое состояние) во внеклеточное пространство. В плотных
гранулах содержатся нуклеотиды (АТФ, АДФ, ГТФ, ГДФ), серотонин, ионы кальция
в высокой концентрации, в α-гранулах — различные белки (в том числе факторы
свертывания крови), а в лизосомах — некоторые ферменты (коллагеназа, эластаза и
др.). После активации тромбоцита на внешней поверхности его мембраны
появляется отрицательно заряженный липид — фосфатидилсерин. С ним с
помощью ионов кальция связываются некоторые факторы свертывания, формируя
специальные комплексы. Они во много раз ускоряют реакции, приводящие к
желированию плазмы крови у места повреждения (этот процесс называется
плазменным гемостазом).
56.
57.
58.
59.
60.
61.
62.
63.
64. Белки плазмы крови
При помощи различныхвидов электрофореза белков
плазмы можно выделить
альбуминовую
и
глобулиновую фракции. В
норме соотношение этих
фракций составляет 1,5 – 2,5.
Использование
метода
электрофореза на бумаге
позволяет
выявить
5
белковых фракций (в порядке
убывания
скорости
миграции): альбумины, α1-,
α2-, β- и γ-глобулины (см.
рисунок 1).
65.
Альбумины – белки с молекулярной массой около 70000 Да. Состоит из585 аминокислотных остатков. Молекула альбумина содержит много
дикарбоновых аминокислот, поэтому может удерживать в крови катионы
Na+, Са2+, Сu2+, Zn2+. Выполняют транспортную функцию:
осуществляют перенос свободных жирных кислот, желчных пигментов,
стероидных гормонов, ионов Са2+, многих лекарств. Альбумины также
служат богатым и быстро реализуемым резервом аминокислот.
Альбумины — основные белки плазмы (55—60% всех белков плазмы).
Концентрация альбумина в крови составляет 40-50 г/л. В сутки в печени
синтезируется около 12 г альбумина. Около 40% альбумина содержится в
крови и остальные 60% в межклеточной жидкости. Из-за относительно
небольшого размера молекул, высокой концентрации в плазме и
гидрофильных свойств белки альбуминовой группы играют важную роль
в поддержании онкотического давления. Альбумины выполняют
транспортную функцию, перенося холестерин, свободные жирные
кислоты, гормоны тироксин, трийодтиронин,
жёлчные пигменты.
Свободная сульфгидрильная (—SH) группа альбумина связывает тяжёлые
металлы, например соединения ртути, которые отлагаются в почках до
удаления из организма. Альбумины способны соединяться с некоторыми
лекарственными средствами — пенициллином, салицилатами, а также
связывать Mg, Mn. Альбумин из крови поступает в межклеточную
жидкость , из которой по лимфатической системе вновь возвращается в
кровь.
66.
• При недостатке альбумина, который должен удержать Nа+, другиекатионы и воду, вода уходит в межклеточное пространство, усиливая
отёки. Гипоальбуминемия может наблюдаться при заболевании
печени, при повышении проницаемости капилляров, при потерях
белка из-за обширных ожогов или злокачественных образований.
• Большая часть белков α и β-глобулиновых фракций связана с
углеводами (гликопротеиды) или с липидами (липопротеиды).
• Плазменные липопротеиды – это сложные комплексные соединения,
имеющие характерное строение: внутри липопротеидной частицы
находится жировая капля (ядро), содержащая неполярные липиды
(триглицериды, эстерефицированный холестерин). Жировая капля
окружена оболочкой, в состав которой входят фосфолипиды, белки,
которые называют апопротеинами и свободный холестерин.
Гидрофильные группы этих молекул обращены к водной фазе, а
гидрофобные части – к гидрофобному ядру липопротеина, в котором
находятся транспортируемые липиды. Физиологическая роль
липопротеидов заключается в доставке к тканям липидов, а также
стероидных гормонов и жирорастворимых витаминов.
67.
При электрофорезе все типы липопротеидов движутся кположительному полюсу, ближе к старту располагаются ХМ, а ЛПВП,
имеющие наибольшее количество белков и наименьший размер,
удаляются от старта дальше других частиц.
В плазме крови человека обнаружено несколько классов липопротеидов:
Липопротеиды высокой плотности (ЛПВП) или α-липопротеиды.–
богатые белками (50%) и фосфолипидами ( 27), постоянно находятся в
плазме крови здоровых людей в концентрации 1,25 – 4,25 г/л. ЛПВП
выполняют две основные функции: поставляют апопротеины другим
липопротеидам в крови и участвуют в удалении избытка холестерола
из клеток и других липопротеинов.
ЛПВП образуются в клетках печени и в небольшом количестве в тонком
кишечнике в виде предшественников ЛПВП.
Липопротеиды низкой плотности (ЛПНП) или β-липопротеиды –
являются самым богатым холестерином (ХС - 8%, эфиры холестерола 42%) классом. Основной аполипопротеин В-100. Концентрация их в
плазме крови здоровых людей составляет 3,0 - 4,5 г/л. Синтезируются
β-липопротеиды в плазме крови из ЛПОНП и ЛППП. Основная
функция это транспорт холестерола.
68.
Липопротеиды очень низкой плотности (ЛПОНП) или пре-βлипопротеиды – являются предшественниками ЛПНП.Плотность этих частиц 0,96-1,00г/мл., диаметр 21-100нМ.
Аполипопротеины ЛПОНП: В-100, С-11 и Е. Синтезируются в
клетках печени. Участвуют в транспорте липидов,
синтезируемых в печени.
Хиломикроны- синтезируются в клетках слизистой оболочке
кишечника. Большой размер ХМ не позволяет им проникать
через стенки капилляров, поэтому из клеток кишечника они
сначала попадают в лимфатическую систему и потом через
главный грудной проток вливаются в кровь вместе с лимфой.
Основные апопротеины в составе ХМ – белок апоВ-48, апоЕ и
С-Ι Ι.
69.
•Кислый α1-гликопротеин (орозомукоид) – содержит до 40%углеводов, изоэлектрическая точка его находится в кислой среде
(2,7). Функция этого белка до конца не установлена; известно,
что на ранних стадиях воспалительного процесса орозомукоид
способствует образованию коллагеновых волокон в очаге
воспаления (Я.Мусил, 1985).
•α1-Антитрипсин – ингибитор ряда протеаз (трипсина,
химотрипсина, калликреина, плазмина). Врождённое снижение
содержания α1-антитрипсина в крови может быть фактором
предрасположенности к бронхо-лёгочным заболеваниям, так как
эластические волокна лёгочной ткани особенно чувствительны к
действию протеолитических ферментов.
•Ретинолсвязывающий
белок
осуществляет
транспорт
жирорастворимого витамина А.
•Тироксинсвязывающий белок – связывает и транспортирует
иодсодержащие гормоны щитовидной железы.
•Транскортин – связывает и транспортирует глюкокортикоидные го
рмоны (кортизол, кортикостерон).
70.
α2-Глобулины:к фракции α2-глобулинов относятся некоторые белки,
участвующие в свёртывании крови, в том числе протромбин —
неактивный предшественник фермента тромбина, вызывающего
превращение фибриногена в фибрин.
•Гаптоглобины (25% α2-глобулинов) – образуют стабильный комплекс с
гемоглобином, появляющимся в плазме в результате внутрисосудистого
гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются
клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо
повторно используется для синтеза гемоглобина. Тем самым
предотвращается потеря железа организ
• Церулоплазмин – белок, содержащий ионы меди (одна молекула
церулоплазмина содержит 6-8 ионов Cu2+), которые придают ему
голубую окраску. Является транспортной формой ионов меди в
организме. Обладает оксидазной активностью: окисляет Fe2+ в Fe3+, что
обеспечивает связывание железа трансферрином. Способен окислять
ароматическиеамины, участвует в обмене адреналина, норадреналина,
серотонина.
71.
β-Глобулины:•Трансферрин – главный белок β-глобулиновой фракции, участвует в
связывании и транспорте трёхвалентного железа в различные ткани,
особенно в кроветворные. Трансферрин регулирует содержание Fe3+ в
крови, предотвращает избыточное накопление и потерю с мочой.
•Гемопексин – связывает гем и предотвращает его потерю почками.
Комплекс гем-гемопексин улавливается из крови печенью.
•С-реактивный белок (С-РБ) – белок, способный преципитировать (в
присутствии Са2+) С-полисахарид клеточной стенки пневмококка.
Биологическая роль его определяется способностью активировать
фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых
людей концентрация С-РБ в плазме ничтожно мала и стандартными
методами не определяется. При остром воспалительном процессе она
увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в
крови. Исследование С-РБ имеет преимущество перед другими
маркерами воспалительного процесса: определением СОЭ и подсчётом
числа лейкоцитов. Данный показатель более чувствителен, его
увеличение происходит раньше и после выздоровления быстрее
возвращается к норме.
72.
К γ-глобулинам относится белок криоглобулин, который отсутствует всыворотке крови здоровых людей и появляется при патологических
состояниях. Его можно обнаружить при миеломе, нефрозе, циррозе
печени, ревматизме, лимфосаркоме, лейкозах и других заболеваниях.
К числу белков плазмы, мигрирующих с γ-глобулинами, относятся
разнообразные антитела, в том числе против дифтерита, коклюша,
кори, скарлатины, полиомиелита. В фракцию γ-глобулинов входят
иммуноглобулины: IgG, IgM, IgA, IgD, IgE, которые играют огромную
роль в работе иммунной системы. Иммуноглобулины или антитела
вырабатываются В – лимфоцитами в ответ на попадание в организм
чужеродных структур, так называемых антигенами. Иммуноглобулины
практически имеют один план строения; они состоят из двух тяжёлых
Н и двух лёгких L цепей, соединенных тремя дисульфидными
мостиками.Основные функции антител – обнаружение и связывание
чужеродных антигенов, находящихся в организме вне его клеток. Это
происходит с помощью специфических антигенсвязывающих участков
разных клонов иммуноглобулинов. Кроме того, благодаря связыванию
антигена с антителом облегчается процесс разрушения чужеродных
веществ. Специфичность пути разрушения комплекса антиген –
антитело зависит от класса антител.
73.
Существует 5 классов тяжёлых цепей иммуноглобулинов,отличающихся по строению константных доменов: α, δ, ε, γ и µ.
В
соответствии
с
ними
различают
5
классов
иммуноглобулинов: A, D, E, G, M. Каждый класс
иммуноглобулинов имеет свой тип тяжелых цепей Н: IgG - γцепь, IgM –µ - цепь, IgA – α-цепь, IgD – σ-цепь, IgE –ε-цепь,
которые отличаются по аминокислотному составу. Каждый тип
иммуноглобулинов может специфически взаимодействовать с
определенным антигеном. При многих патологических
процессах содержание иммуноглобулинов в сыворотке крови
существенно изменяется. Так, при хроническом агрессивном
гепатите отмечается повышение IgG, при алкогольном циррозе –
IgA, концентрация IgE увеличивается при бронхиальной астме,
аскаридозе и некоторых других заболеваниях. Важно отметить,
что у детей которых наблюдается дефицит IgA, чаще
встречаются инфекционные заболевания.
• •Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют
собой антитела, вырабатываемые организмом в ответ на
введение чужеродных веществ с антигенной активностью.
74.
Минеральныекрови.
компоненты
плазмы
Минеральные вещества являются необходимыми компонентами
плазмы крови. Важнейшими катионами являются ионы натрия,
калия, кальция и магния. Им соответствуют анионы: хлориды,
бикарбонаты, фосфаты, сульфаты. Часть катионов в плазме
крови связаны с органическими анионами и белками. Сумма
всех катионов равна сумме анионов, так как плазма крови
электронейтральна.
Натрий – основной катион внеклеточной жидкости. Его
содержание в плазме крови 135 – 150 ммоль/л. Ионы натрия
участвуют
в
поддержании
осмотического
давления
внеклеточной жидкости. Гипернатриемия наблюдается при
гиперфункции
коры
надпочечников,
при
введении
гипертонического раствора хлорида натрия парентерально.
Гипонатриемия может быть обусловлена бессолевой диетой,
надпочечниковой недостаточностью, диабетическим ацидозом.
75.
Калий является основным внутриклеточным катионом. В плазмекрови он содержится в количестве 3,9 ммоль/л, а в эритроцитах
– 73,5 – 112 ммоль/л. Как и натрий, калий поддерживает
осмотический и кислотно-основный гомеостаз в клетке.
Гиперкалиемия отмечается при усиленном разрушении клеток
(гемолитическая анемия, синдром длительного раздавливания),
при нарушении выделения калия почками, при обезвоживании
организма. Гипокалиемия наблюдается при гиперфункции коры
надпочечников, при диабетическом ацидозе.
Кальций в плазме крови содержится в виде форм.
Выполняющих различные функции: связанный с белками (0,9
ммоль/л), ионизированный (1,25 ммоль/л) и неионизированный
(0,35 ммоль/л). Биологически активным является только
ионизированный кальций. Гиперкальциемия наблюдается при
гиперпаратиреозе, гипервитаминозе D, синдроме ИценкоКушинга, деструктивных процессах в костной ткани.
Гипокальциемия встречается при рахите, гипопаратиреозе,
заболеваниях почек.
76.
Хлориды содержатся в плазмекрови в количестве 95 – 110
ммоль/л, участвуют в поддержании
осмотического давления, кислотноосновного состояния внеклеточной
жидкости.
Гиперхлоремия
наблюдается
при
сердечной
недостаточности,
артериальной
гипертензии, гипохлоремия – при
рвоте, заболеваниях почек.
Фосфаты в плазме крови являются
компонентами буферной системы,
их концентрация составляет 0,8 –
1,45 ммоль/л. Гиперфосфатемия
наблюдается при заболеваниях
почек,
гипопаратиреозе,
гипервитаминозе
D.
Гипофосфатемия отмечена при
гиперпаратиреозе,
микседеме,
рахите.
77. Небелковые азотистые компоненты крови (остаточный азот).
К этой группе веществ относятся: мочевина, мочеваякислота, аминокислоты, креатин, креатинин, аммиак,
индикан, билирубин и другие соединения.
Содержание остаточного азота в плазме крови здоровых
людей - 15-25 ммоль/л. Повышение содержания
остаточного азота в крови называется азотемией. В
зависимости от причины, азотемия подразделяется на
ретенционную и продукционную.
Ретенционная азотемия возникает при нарушении выведения
продуктов азотистого обмена (в первую очередь мочевины)
с мочой и характерна для недостаточности функции почек.
В этом случае до 90% небелкового азота крови приходится
на азот мочевины вместо 50% в норме.
78.
Продукционная азотемия развивается при избыточномпоступлении азотистых веществ в кровь вследствие
усиленного распада тканевых белков (длительное голодание,
сахарный диабет, тяжёлые ранения и ожоги, инфекционные
заболевания).
Определение остаточного азота проводят в в безбелковом
фильтрате сыворотки крови. В результате минерализации
безбелкового
фильтрата
при
нагревании
с
концентрированной
Н2SO4
азот
всех
небелковых
соединений переходит в форму (NH4)2SO4. Ионы NH4+
определяют с помощью реактива Несслера.
•Мочевина - главный конечный продукт обмена белков в
организме
человека.
Образуется
в
результате
обезвреживания аммиака в печени, выводится из организма
почками. Поэтому содержание мочевины в крови снижается
при заболеваниях печени и возрастает при почечной
недостаточности.
79.
•Аминокислоты - поступают в кровь при всасывании изжелудочно-кишечного тракта или являются продуктами
распада тканевых белков. В крови здоровых людей среди
аминокислот преобладают аланин и глутамин, которые
наряду с участием в биосинтезе белков являются
транспортными формами аммиака.
•Мочевая кислота - конечный продукт катаболизма
пуриновых нуклеотидов. Содержание её в крови возрастает
при подагре (в результате усиленного образования) и при
нарушениях функции почек (из-за недостаточного
выведения).
•Креатин - синтезируется в почках и печени, в мышцах
превращается в креатинфосфат - источник энергии для
процессов мышечного сокращения. При заболеваниях
мышечной системы содержание креатина в крови
значительно возрастает.
80.
•Креатинин - конечный продукт азотистого обмена,образуется
в
результате
дефосфорилирования
креатинфосфата в мышцах, выводится из организма
почками. Содержание креатинина в крови снижается при
заболеваниях мышечной системы, повышается при
почечной недостаточности.
•Индикан - продукт обезвреживания индола, образуется в
печени, выводится почками. Содержание его в крови
снижается при заболеваниях печени, повышается - при
усилении процессов гниения белков в кишечнике, при
заболеваниях почек.
•Билирубин (прямой и непрямой) - продукты катаболизма
гемоглобина.
Содержание
билирубина
в
крови
увеличивается при желтухах: гемолитической (за счёт
непрямого билирубина), обтурационной (за счёт прямого
билирубина), паренхиматозной (за счёт обеих фракций).
81.
82.
83. Безазотистые органические компоненты крови.
• В эту группу веществ входят питательные вещества (углеводы,липиды) и продукты их метаболизма (органические кислоты).
Наибольшее значение в клинике имеет определение
содержания в крови глюкозы, холестерола, свободных жирных
кислот, кетоновых тел и молочной кислоты. Формулы этих
веществ представлены на рисунке 6.
• •Глюкоза - главный энергетический субстрат организма.
Содержание её у здоровых людей в крови натощак - 3,3 - 5,5
ммоль/л. Повышение содержания глюкозы в крови
(гипергликемия) наблюдается после приёма пищи, при
эмоциональном стрессе, у больных сахарным диабетом,
гипертиреозом, болезнью Иценко-Кушинга. Снижение
содержания глюкозы в крови (гипогликемия) наблюдается при
голодании, интенсивных физических нагрузках, остром
алкогольном отравлении, передозировке инсулина.
84.
•Холестерол - обязательный липидный компонент биологических мембран,предшественник стероидных гормонов, витамина D3, желчных кислот.
Содержание его в плазме крови здоровых людей - 3,9 - 6,5 ммоль/л. Повышение
содержания холестерола в крови (гиперхолестеролемия) наблюдается при
атеросклерозе, сахарном диабете, микседеме, желчно-каменной болезни.
Снижение уровня холестерола в крови (гипохолестеролемия) обнаруживается
при гипертиреозе, циррозе печени, заболеваниях кишечника, голодании, при
приёме желчегонных препаратов.
•Свободные жирные кислоты (СЖК) используются тканями и органами в качестве
энергетического материала. Содержание СЖК в крови повышается при
голодании, сахарном диабете, после введения адреналина и глюкокортикоидов;
снижается при гипотиреозе, после введения инсулина.
•Кетоновые тела. К кетоновым телам относятся ацетоацетат,β-гидроксибутират,
ацетон - продукты неполного окисления жирных кислот. Содержание кетоновых
тел в крови повышается (гиперкетонемия) при голодании, лихорадке, сахарном
диабете.
•Молочная кислота (лактат) - конечный продукт анаэробного окисления углеводов.
Содержание её в крови повышается при гипоксии (физические нагрузки,
заболевания лёгких, сердца, крови).
• Пировиноградная кислота (пируват) – промежуточный продукт катаболизма
углеводов и некоторых аминокислот. Наиболее резкое повышение содержания
пировиноградной кислоты в крови отмечается при мышечной работе и
недостаточности витамина В1.
85.
Рисунок. Безазотистые органические вещества плазмы крови.86. Ферменты плазмы крови.
Все ферменты, содержащиеся в плазме крови, можно разделитьна три группы:
1.секреторные ферменты - синтезируются в печени, выделяются в
кровь, где выполняют свою функцию (например, факторы
свёртывания крови);
2.экскреторные ферменты - синтезируются в печени, в норме
выделяются с желчью (например, щелочная фосфатаза), их
содержание и активность в плазме крови возрастает при
нарушении оттока желчи;
3.индикаторные ферменты - синтезируются в различных тканях и
попадают в кровь при разрушении клеток этих тканей. В разных
клетках преобладают различные ферменты, поэтому при
повреждении того или иного органа в крови появляются
характерные для него ферменты. Это может быть использовано
в диагностике заболеваний.
87.
88. Буферные системы крови.
Буферные системы организма состоят из слабыхкислот и их солей с сильными основаниями.
Каждая буферная система характеризуется
двумя показателями:
•рН буфера (зависит от соотношения
компонентов буфера);
•буферная ёмкость, то есть количество сильного
основания или кислоты, которое нужно
прибавить к буферному раствору для
изменения рН на единицу (зависит от
абсолютных концентраций компонентов
буфера).
Различают следующие буферные системы крови:
•бикарбонатная (H2CO3/NaHCO3);
•фосфатная (NaH2PO4/Na2HPO4);
•гемоглобиновая (дезоксигемоглобин в качестве
слабой кислоты/ калиевая соль
оксигемоглобина);
•белковая (действие её обусловлено
амфотерностью белков). Бикарбонатная и
тесно связанная с ней гемоглобиновая
буферные системы составляют в совокупности
более 80% буферной ёмкости крови.
89.
Дыхательная регуляция КОС осуществляется путёмизменения интенсивности внешнего дыхания. При
накоплении в крови СО2 и Н+ усиливается лёгочная
вентиляция, что приводит к нормализации газового
состава крови. Снижение концентрации углекислоты и Н+
вызывает уменьшение лёгочной вентиляции и
нормализацию данных показателей.
Почечная регуляция КОС осуществляется главным образом
за счёт трёх механизмов:
•реабсорбции бикарбонатов (в клетках почечных канальцев
из Н2О и СО2 образуется угольная кислота Н2СО3; она
диссоциирует, Н+ выделяется в мочу, НСО3—
реабсорбируетоя в кровь);
•реабсорбции Na+ из клубочкового фильтрата в обмен на Н+
(при этом Na2HPO4 в фильтрате переходит в NaH2PO4 и
увеличивается кислотность мочи);
•секреции NH4+ (при гидролизе глутамина в клетках
канальцев образуется NH3; он взаимодействует с H+,
образуются ионы NH4+, которые выводятся с мочой.
90. Лабораторные показатели КОС крови.
-рН - показатель водородных ионов плазмы крови. Интегральныйпоказатель,отражающий состояние буферных систем и
физиологические механизмы компенсации. Нормальный
диапазон - 7,35-7,45;
-рСО2 - показатель парциального напряжения СО2 в крови.
Отражает функцио-нальное состояние системы дыхания.
Нормальный диапазон - 40 ± 5 мм Hg;
-АВ (actual bicarbonate) - истинные бикарбонаты плазмы, то есть
содержание ионов НСО3" в крови, взятой у данного больного в
конкретных условиях. Нормальный диапазон АВ - 19-25
ммоль/л;
-SB (standart bicarbonate) - стандартные бикарбонаты плазмы
крови. Содер-жание бикарбоната у данного пациента,
определяемое в стандартных усло¬виях (рСО2 = 40 мм Hg, HbO2
= 100%, t° = 37 °С). Нормальный диапазон -20-26 ммоль/л
91.
-ВВ (buffer base) - буферные основания плазмы, то есть сумма всехосновных компонентов бикарбонатной, фосфатной, белковой,
гемоглобиновой систем. Нормальный диапазон ВВ - 44-52
ммоль/л;
-BE (base exsecc) - сдвиг буферных оснований, отражающий
изменения содер-жания буферных оснований крови по
сравнению с нормальным для данного больного NBB.
Нормальный диапазон - ±2,3 ммоль/л;
-NBB - сумма всех основных компонентов буферных систем крови
больного, но оцениваемая в стандартных условиях (рН = 7,38,
рСО2 = 40 мм Hg, t° = 37 °С).
BE = ВВ - NBB. Следовательно, BE показывает, какое количество
миллимолей НСО3~ следует добавить (или удалить), чтобы
значение рН стало 7,4 (при t° = 37 °С). Положительное значение
BE указывает на избыток оснований (или дефицит кислот), а
отрицательное - на дефицит оснований (или избыток кислот);
рН мочи - показатель водородных ионов мочи. Отражает
функциональное состояние почек, интенсивность процессов
ацидо- и аммониогенеза. Нормальный диапазон - 5,0-7,0.
92.
На практике при оценке кислотно-основного состояниянеобходимо учитывать, по крайней мере, три параметра:
результирующее значение рН, респираторный компонент рСО2 и метаболический компонент - концентрацию
бикарбоната [HCO3i в форме АВ или SB. Нормативы и
основные виды нарушений КОС представлены ниже.
Нормальные параметры КОС
рН = 7,35-7,45
рСО2 = 35-45 мм рт. ст.
SB = 20-26 ммоль/л
ВВ = 44-52 ммоль/л
BE = ±2,5 ммоль/л
Параметры КОС взаимосвязаны закономерностями,
выраженными уравнением Гендерсона-Гассельбаха,
определяющим развитие вариантов нарушений КОС.
93. Нарушения КОС крови.
Известны четыре главные формы нарушений кислотно-основного состояния:Ацидоз - форма нарушения кислотно-щелочного равновесия в организме,
характеризующаяся сдвигом отношений между анионами кислот и
катионами оснований в сторону увеличения анионов. (Снижение величины
рН крови ниже 6,8 несовместимо с жизнью).
Концентрация бикарбоната плазмы падает в результате действия следующих
механизмов:
-повышения концентрации ионов водорода за счет нелетучих кислот
(например, кетоацидоз, связанный с диабетом или алкоголизмом,
лактатацидоз);
-потери оснований (например, тяжелая диарея, синдром мальабсорбции);
-снижения экскреции кислот почками (например, острая и хроническая
почечная недостаточность). Снижение рН стимулирует дыхание. Организм
стремится как можно быстрее компенсировать падение рН, что проявляется
снижением уровня парциального давления углекислого газа в
артериальной крови, которое может уменьшиться на 10-15 мм рт. ст.
Наиболее важный ме-ханизм, с помощью которого организм избавляется от
кислот - экскреция кислот почками. Однако скорость накопления нелетучих
кислот может оказаться выше, чем способность буферных систем
организма к их нейтрализации, компенсированию дыханием или
выведению с мочой.
94.
•метаболический ацидоз - возникающий при нарушенияхобмена
веществ,
сопровождающихся
усиленным
образованием,
недостаточным
окислением
или
связыванием
нелетучих
кислот
(молочной,
пировиноградной, ацетоуксусной, (3-ок-симасляной и
др.)и первичного снижения концентрации бикарбоната в
плазме крови (уровень бикарбоната менее 24 ммоль/л и
рН менее 7,40). Возникает при сахарном диабете и
голодании (за счёт накопления кетоновых тел в крови), при
гипоксии (за счёт накопления лактата). При этом
нарушении снижается рСО2 и [НСО3-] крови,
увеличивается экскреция NH4+ с мочой;
•дыхательный ацидоз - возникает при бронхите,
пневмонии, бронхиальной астме (в результате задержки
углекислоты в крови). При этом нарушении повышается
рСО2 и [HCO3-] крови, увеличивается экскреция NH4+ с
мочой;
95.
Алкалоз - форма нарушения кислотно-щелочного равновесия(кислотно-ос-новного
состояния)
в
организме,
характеризующаяся сдвигом отношений между анионами
кислот и катионами оснований крови в сторону увеличения
катионов, рН крови при этом увеличивается (значение рН более
7,7 несовместимо с жизнью). Рассматривая причины
возникновения алкалоза и механизмы компенсации сдвигов
КОС, необходимо учитывать, что изменения концентрации Н+ в
жидкостях и тканях организма наступают при потере кислот и
накоплении оснований, если возмущающие факторы по своей
интенсивности
превосходят
пределы
возможностей
гомеостатических систем. Причем на характер изменений КОС и
его клинические проявления влияют длительность и
интенсивность возмущающего фактора.
По степени компенсации алкалоз разделяют на:
-компенсированный - рН = 7,40 ± 7,04;
-субкомпенсированный - рН = 7,45-7,49;
-декомпенсированный - рН > 7,50.
96.
•метаболический алкалоз - развивается при потере кислот,например, при неукротимой рвоте. При этом нарушении
повышается рСО2 и [HCO3-] крови, увеличивается
экскреция НСО3- с мочой, снижается кислотность мочи.
Патофизиологическое представление о метаболическом
алкалозе требует понимания того, что повышение
щелочности среды возможно только во внеклеточном
пространстве. Внутри клеток, напротив, развивается
ацидоз из-за активации процессов катаболизма и
перемещения внутрь клетки дополнительно ионов
водорода в обмен на калий. Это в большинстве случаев
обусловливает не только трудность лечения, но и
сложность
компенсации
возникшего
процесса
естественными физиологическими резервами.
97.
Лабораторные показатели метаболического алкалозаДанные анализа КОС и газов артериальной крови: рН, АВ, SB, BB
повышены; BE резко положительный; рСО2 умеренно повышен.
При тяжелом алкалозе рСО2 повышается в качестве
компенсаторного ответа (при отсутствии сопутствующего
легочного заболевания).
Обычно уровень калия плазмы низкий (<4 ммоль/л), как и
содержание хлоридов (С1 < 95 ммоль/л). Отмечается
гипомагниемия, гипернатриемия, гипокальциеми.
•дыхательный алкалоз - наблюдается при усиленной вентиляции
лёгких, например, у альпинистов на большой высоте. При этом
нарушении снижается рСО2 и [НСО3-] крови, уменьшается
кислотность мочи.
Лабораторные показатели респираторного алкалоза
Повышены рН крови и мочи, резко снижен рСО2, АВ, SB, ВВ
снижены,
BE
умеренно
отрицательный.
Отмечается
гипокальциемия, возможно появление признаков вторично
развивающегося метаболического ацидоза различной степени
выраженности.
Для лечения метаболического ацидоза используют введение
раствора бикарбоната натрия; для лечения метаболического
алкалоза - введение раствора глутаминовой кислоты.
98.
99.
100.
101. Характеристика системы свертывания крови
В свертывающую систему входят около 15 веществ(факторов) свертывания, содержащихся в плазме. По своей
природе они относятся к белкам — протеазам и
неферментным белкам. Факторы свертывания крови
вырабатываются организмом в неактивном состоянии.
Индекс «а» означает активную форму, а его отсутствие —
неактивный предшественник. Для давно открытых белков,
таких как фибрин и тромбин, используют и собственные
имена. Некоторые номера (III, IV, VI) по историческим
причинам не используются.
Международный комитет по гемостазу и тромбозу присвоил
арабскую нумерацию тромбоцитарным и римскую —
плазменным факторам (см. факторы тромбоцитов, табл.).
102. Характеристика системы свертывания крови
Главный «вход» в этот каскад находится в его средней части, на уровнефакторов IX и X: белок тканевый фактор (обозначен на схеме как TF)
связывает фактор VIIa, и получившийся ферментативный комплекс
активирует факторы IX и X. Результатом работы каскада является белок
фибрин, способный полимеризоваться и образовывать сгусток (гель).
Подавляющее большинство реакций активации — это реакции
протеолиза, т.е. частичного расщепления белка, увеличивающего его
активность. Почти
каждый фактор
свертывания обязательно
тем или иным образом
ингибируется: обратная
связь необходима для
стабильной работы
системы.
103. Характеристика системы свертывания крови
Инициация образования сгустка в ответ на повреждение тканиосуществляется по «внешнему» пути свертывания, а формирования
красного тромба в области замедленного кровотока или на аномальной
сосудистой стенке при отсутствии повреждения ткани – по
«внутреннему» пути свертывания. На этапе активации фактора X
происходит как бы объединение обоих путей и образуется конечный
путь свертывания крови.
В нормальных условиях тромбина в крови нет, он образуется из своего
активного зимогена – белка плазмы протромбина. Этот процесс
осуществляется протеолитическим ферментом, названным фактором Ха,
который также в обычных условиях отсутствует в крови; он образуется
при кровопотере из своего зимогена (фактора X). Фактор Ха превращает
протромбин в тромбин только в присутствии ионов Са2+ и других
факторов свертывания.
Таким образом, свертывание крови включает эффективно регулируемую
серию превращений неактивных зимогенов в активные ферменты, что в
итоге приводит к образованию тромбина и превращению фибриногена в
фибрин. Заметим, что «внутренний» путь свертывания крови –
медленный процесс, поскольку в нем участвует большое число факторов
свертывания
104. Характеристика системы свертывания крови
Принято считать, что фактор III, переходящий в плазму кровипри повреждении тканей, а также фактор 3 тромбоцитов
создают предпосылки для образования минимального
(затравочного) количества тромбина (из протромбина). Этого
минимального количества тромбина недостаточно для
быстрого превращения фибриногена в фибрин и,
следовательно, для свертывания крови. В то же время следы
образовавшегося тромбина катализируют превращение
проакцелерина и проконвертина в акцелерин (фактор Va) и
соответственно в конвертин (фактор VIIa).
В результате сложного взаимодействия перечисленных
факторов, а также ионов Са2+ происходит образование
активного фактора X (фактор Ха).
105.
106.
107. Свертывание крови является матричным процессом,т.к.активация гемокоагуляции осуществляется на матрице фосфолипопротеидах
Свертывание крови является матричным процессом,т.к.активациягемокоагуляцииосуществляется на матрице фосфолипопротеидах
разрушенных форменных элементов либо тканей
108.
В сосудах tr выталкиваются эритроцитами из основного потока идвижутся вдоль стенок, проводя своего рода мониторинг их состояния.
Одним из первых сигналов к активации тромбоцитов становится коллаген
— основной белок соединительной ткани, обнажающийся при
повреждении сосуда. Обнаружив коллаген, tr связываются с ним через
специальные рецепторы, одновременно активируясь и прочно
прикрепляясь к месту повреждения. Взаимодействие tr с коллагеном ведет
к запуску внутриклеточного сигнального каскада и появлению в цитозоле
вторичного мессенджера — инозитолтрифосфата (ИФ3). ИФЗ служит
сигналом к выходу ионов кальция из
внутриклеточных хранилищ. А
повышение его внутриклеточной
концентрации может приводить к
разнообразным ответам tr:
выплескиванию содержимого
гранул (секреции), изменению
формы, прикреплению к стенке сосуда
(адгезии), скреплению с другими
тромбоцитами (агрегации), появлению
прокоагулянтной активности.
109.
После того, как кровеносная система уже распознала повреждение сосуда, в кровипоявляются еще три природных активатора тромбоцита — тромбин, АДФ и тромбоксан A2.
Белок тромбин образуется из предшественника, протромбина, в плазме крови, но массово —
уже на мембранах активированных тромбоцитов. При секреции их плотных гранул
выбрасывается большое количество АДФ и меньше АДФ высвобождается из поврежденных
клеток эндотелия, выстилающего внутреннюю поверхность сосудов. Из арахидоновой
кислоты, находящейся в мембранах активированных тромбоцитов,
синтезируется тромбоксан А2. Связывание этих
трех активаторов со своими рецепторами на мембране
тромбоцита приводит, как и в случае с коллагеном, к
появлению ИФ3 в цитозоле и повышению в нем
концентрации кальция.Таким образом, все три растворимых активатора
и коллаген действуют по одному пути, однако
вызывают разные тромбоцитарные ответы.
Например, тромбоксан А2 провоцирует выброс
плотных гранул, а АДФ — нет. Активация отдельно
коллагеном или тромбином вызывает все перечисленные ответы одновременно, а совместно — приводит к
появлению группы прокоагулянтных тромбоцитов и
синтезу тромбина на их мембранах.
110.
Чтобы случайная активация не превращала тромбоцит в настоящую «бомбу», несущуюся вкровотоке и запускающую всю систему свертывания, в организме неповрежденные клетки
эндотелия постоянно выделяют простациклин и оксид азота, которые блокируют активацию
клеток, препятствуя повышению в них концентрации кальция
Чтобы залатать неисправный сосуд и предотвратить кровопотерю,
тромбоцитам нужно прикрепиться к месту «аварии» (адгезия) и
друг к другу (агрегация). Первые обнаружившие повреждение
клетки прикрепляются к нему и формируют нижний
слой тромба. К ним прилепляются новые тромбоциты из потока,
и постепенно образуется тромбоцитарный агрегат. Но между
клетками в нем остаются промежутки, через которые может просачиваться плазма крови,
поэтому она желируется вблизи места повреждения в результате реакций между факторами
свертывания. Образующийся гель заполняет промежутки между тромбоцитами и полностью
останавливает вытекание крови из раны. Адгезия и агрегация в норме ведут к перекрыванию
места «аварии» и предотвращению кровопотери, а при патологических условиях, вызывают
формирование тромбов, мешающих нормальному кровотоку в здоровых сосудах. Их
тромбирование является причиной многих сердечно-сосудистых заболеваний, в том числе
инфарктов и инсультов.
111.
Адгезия происходит за счет связывания специальных рецепторов, гликопротеинов (ГП) VI иIb и интегрина αIIbβ3 (или ГП IIbIIIa), на мембране тромбоцита с определенными белками на
поверхности поврежденного сосуда. Агрегация же происходит за счет гликопротеинов Ib и
IIbIIIa и представляет собой образование связи между двумя
рецепторами посредством растворенного в плазме крови лиганда.
Гликопротеинам Ib и VI для связывания лигандов не требуется
дополнительных условий, в отличие от ГП IIbIIIa, который
приобретает такую способность только благодаря своим
конформационным изменениям, происходящим после активации
тромбоцита. Фибриноген и фактор Виллебранда, основные
лиганды интегрина αIIbβ3, обладают симметричной структурой и поэтому взаимодействуют
одновременно с двумя рецепторами на соседних активированных тромбоцитах, формируя
между ними скрепляющие «мостики». Рассмотрим приближенную последовательность
событий, происходящих с тромбоцитами при нарушении целостности сосуда. Повреждение
эндотелия приводит к выставлению в кровоток коллагена, на который из плазмы крови тут же
садятся молекулы фактора Виллебранда. Тромбоциты, приносимые к месту травмы,
связываются с ними, а затем с коллагеном через рецепторы ГП Ib и ГП VI соответственно.
Это запускает сигнальные процессы, приводящие к активации интегринов αIIbβ3 и к началу
формирования тромба. По мере того как клетки склеиваются друг с другом за счет
интегринов αIIbβ3, они секретируют тромбоксан А2 и АДФ, которые активируют интегрины
αIIbβ3 на проносящихся в потоке тромбоцитах, вовлекая их в растущий тромб.
112.
113. Коагуляционный гемостаз
1 стадия- образуется протромбиназа, во 2 стадии из плазменногофактора протромбина под действием протромбиназы образуется
тромбин – это ключевой этап коагуляции. 3 стадия – образование
из фибриногена под действием тромбина фибрина.
Тромбоциты высвобождают фибриноген в дополнение к уже
присутствующему в плазме в норме. Фибрин образует плотную
фиброзную прокладку, к которой прикрепляется всё больше
тромбоцитов и других клеток крови.
114.
115.
116.
117. Тромбин: структура и функции
Тромбин состоит из двух полипептидных цепей: A и B (36 и 259аминокислотных остатков соответственно), соединенных одной
дисульфидной связью. Тромбин - трипсиноподобная сериновая
протеиназа,катализирующий гидролиз пептидных связей,
образованных остатками аргинина и лизина.
118. Тромбин: структура и функции
Ряд существенных отличий определяет уникальность свойств тромбина:1). Наличие двух анион-связывающих экзо-участков, один из которых расположен
вблизи каталитического участка активного центра и ответственен за "узнавание"
фибриногена . Со вторым участком связываются гепарин и другие полисахариды,
а также такие отрицательно заряженные соединения, как гирудин и клеточные
мембраны. Внутри этого участка и вблизи него расположены фрагменты,
подверженные триптическому гидролизу и аутолизу. Альфа-тромбин
превращается в бета-форму с потерей способности свертывать фибриноген, бетатромбин превращается в гамма, эпсилон, дзета-формы.
2). Аполярный участок связывания, расположеннный вблизи каталитического
активного центра тромбина. Его наличие определяет преимущественное
расщепление тромбином субстратов, содержащих аргининовые и лизиновые
пептидные связи, непосредственно соединенные с остатком пролина или с
другими аполярными остатками.
3). Над каталитическим участком активного центра располагается фрагмент с
уникальной аминокислотной последовательностью Tyr-Pro-Pro-Trp, которая
обеспечивает хемотаксические свойства тромбина в отношении лейкоцитов .
4). Аминокислотная последовательность Arg-Gly-Asp обеспечивает связывание
фермента с клеточными рецепторами.
119.
под влиянием фермента тромбина от фибриногена отщепляются 2пептида А и 2 пептида В (мол. масса пептида А – 2000, а пептида В – 2400).
Установлено, что тромбин разрывает пептидную связь аргинин–лизин.
120.
121.
Фибриноген напоминает стержень длиной 50 нм и толщиной 5нм (рис. а). Активация позволяет его молекулам склеиваться в
фибриновую нить (рис б), а затем в волокно, способное
ветвиться и образовывать трехмерную сеть (рис. в).
122.
Сгусток крови, или фибриновый гель — прикреплённая к повреждённойповерхности сосудов трёхмерная сеть фибриновых волокон, в которой
находятся клетки крови, кровяные пластинки и сыворотка крови. В течение
десятков минут после образования сгустка происходит его ретракция
(сжатие), в результате которой из фибринового геля удаляется его жидкая
часть (сыворотка), т.е. сгусток крови становится плотным тромбом. Ретракция
кровяного сгустка предупреждает полную закупорку сосудов, создавая
возможность восстановления кровотока.
Судьба тромба. Тромб первоначально выступает в просвет сосуда, но позже
он сокращается (ретракция тромба) и уплотняется. По мере заживления
стенки сосуда тромб удаляется при помощи плазмина. Этот процесс
называется фибринолиз. Тромб может раствориться в течение нескольких
дней после образования. При фибринолизе — ферментативном
расщеплении волокон фибрина — образуются растворимые пептиды
123.
124. Плазмин образуется из плазминогена, синтезируемого в печени, который активируется факторами, представленными на схеме.
Дополнительно из гранул тромбоцитов выделяются ферменты,разрушающие тромб. Стенка сосуда восстанавливается благодаря пролиферации ГМК и
фибробластов, накоплению нового соединительнотканного матрикса, восстановлению эндотелия.
125. фибринолиз включает 3 фазы: 1 фаза – выделение активатора плазминогена из поврежденных тканей или активация плазменного
фибринолиз включает 3 фазы:1 фаза – выделение активатора плазминогенаиз поврежденных тканей или активация
плазменного активатора плазминогена(например, активация фактора Хагемана).
2 фаза – превращение плазминогенав плазмин под действием активатора
плазминогена.
3 фаза – разрушение фибрина под действием плазмина. Кроме факторов, активирующих
фибринолиз, существуют вещества, которые его ограничивают. Мощный ингибитор
фибринолиза – α2-антиплазмин (один из глобулинов плазмы), который связывает
плазмин, трипсин, урокиназу, t-PА и способен нейтрализовать до 2/3 всего плазмина.
Возможность регуляцииактивности фибринолитическойсистемы позволяет
предупредить нежелательные последствия фибринолиза (излишний лизис тромба).
126. Жидкое состояние крови поддерживается несколькими механизмами: 1)гладкая поверхность эндотелия сосудов; 2)отрицательный заряд
стенки сосудов и форменных элементов крови, за счет чегоони взаимно отталкиваются;
3)синтез эндотелием сосудов одного из простагландинов простациклина, который
является мощным ингибитором адгезии и агрегации тромбоцитов. Синтез
простациклина усиливается при стрессе, под влиянием брадикинина, тромбина.
Снижение или утрата продукции простациклина участком эндотелия может быть
одной из причин агрегации тромбоцитов и приводить к образованию тромба;
4)способность эндотелия синтезировать и фиксировать АТ III, мощнейший
антикоагулянт, кофактора гепарина;
5)в эндотелиальных клетках образуется оксид азота, который участвует в регуляции
сосудистого тонуса, расслабляя гладкомышечные клетки сосудов, угнетает адгезию
и агрегацию тромбоцитов. Его эффект усиливается взаимодействием с
простациклином;
127. Жидкое состояние крови поддерживается несколькими механизмами: 6)гепариноподобные соединения эндотелия усиливают активность
антитромбина III;7)наличие эктоэнзимов, синтезируемых эндотелием (например, АДФ-расщепляет АДФ
тромбоцитов, что угнетает агрегацию кровяных пластинок);
8)нормальное содержание тромбоцитов, выполняющих трофическую роль для эндотелия
сосудов;
9)клетки ретикулоэндотелиальной системы поглощают тромбин плазмы крови;
10) на стенке сосудов имеется тонкий слой растворимого фибрина, который адсорбирует
спонтанно активированные факторы свертывания, особенно тромбин;
11)наличие фибринолитического звена системы гемостаза;
12)постоянное присутствие в крови некоторого количества противосвертывающих веществ,
получивших название «естественные антикоагулянты».
Первичные антикоагулянты всегда присутствуют в циркуляции, предотвращая спонтанное
внутрисосудистое тромбообразование. Вторичные антикоагулянты образуются в
результате протеолитического расщепления факторов свертывания крови в процессе
формирования и растворения фибринового сгустка. Антикоагулянты по действию условно
делятся на три группы:1)обладающие антитромбопластическим и антипротромбиназным
свойством (антитромбопластины); 2) связывающие тромбин (антитромбины);
3) предупреждающие переход фибриногена в фибрин (ингибиторы самосборки фибрина).
128.
129.
130.
131.
132.
133.
134.
135.
136.
137.
Фактор I — фибриноген — гликопротеин с молекулярной массойоколо 340000 дальтон, состоящий из 2946 последовательных
аминокислот, и представляет собой димер, в каждой единице
которого содержатся три полипептидные цепи, соединенные
дисульфидными мостиками.
Фактор I в том виде, в каком он вырабатывается
паренхиматозными клетками печени и поступает в кровь,
называется фибриногеном А, в отличие от фибриногена В,
который осаждается из плазмы витамином К (производным b нафтохинона). Под действием тромбина фибриноген
превращается в нерастворимый в крови фибриллярный белок —
фибрин, основное вещество (субстрат) тромба (сгустка).
В результате увеличения концентрации фибриногена в крови
резко повышаются СОЭ, вязкость крови, но не усиливается
гемокоагуляция. Уменьшением количества фибриногена А ниже
1 г/л иногда обусловлены кровотечения только из-за недостатка
фибриногена (гипофибриногенемия).
Гипо- и афибриногенемия (полное отсутствие фибриногена в
крови) бывают врожденными и приобретенными.
138.
Встречается и дисфибриногенемия — состояние, когда поддействием тромбина фибриноген крови не превращается в
фибрин вследствие функциональной неполноценности
молекулы фибриногена. Приобретенные гипо- и
афибриногенемии особенно часто выявляют акушеры и хирурги
у больных с развивающимся острым ДВС-синдромом, реже
возникновение фибриногенопении связано с тяжелым
нарушением функции печени.
Фибриноген А не осаждается b -нафтолом, 50 % раствором
этанола и протамином в небольших концентрациях.
Фибриноген под влиянием тромбина превращается в фибрин по
типу протеолитического дробления молекулы фибриногена.
Вначале тромбин отщепляет от молекулы фибриногена 2
пептида А, образуя дез-А-мономеры фибрина (неполноценные
мономеры фибрина). Затем отщепляются 2 пептида В и
возникают дез-АВ-мономеры, или полные мономеры фибрина.
Фибринопептиды А иногда появляются в циркулирующей крови,
что свидетельствует либо о ранних этапах развития ДВС, либо о
латентно протекающем внутрисосудистом свертывании крови в
нормальных условиях.
139.
Оставшаяся молекула фибриногена — фибрин-мономер. Этамолекула приобретает способность соединяться с себе
подобными и образовывать фибрин-полимер, который
представляет гель (или сгусток). Сборка мономеров
фибрина проходит этапы формирования димеров, из
которых при продольном и поперечном сшивании
образуются полимеры фибрина — протофибриллы, а
затем нити фибрина. Тромб из такого фибрина легко
растворяется фибринолизином и потому не может
обеспечить полноценный гемостаз. Это нередко бывает
причиной кровоточивости и плохого заживления ран.
Подобный фибрин называется растворимым (фибрин S,
soluble). Полноценным, то есть устойчивым к
фибринолизину, он может стать под действием фибриназы
(фактоpa XIIIa). Образовавшийся фибрин называется
нерастворимым фибрином (фибрин I, insoluble).
140.
Фактор II— протромбин — относится к эуглобулинам. Поддействием протромбиназы образуются a-, b- и g -тромбины. a тромбин обладает сильной свертывающей активностью в
отношении фибриногена, но быстро нейтрализуется
антитромбином III. b -тромбин резистентен по отношению к
гепарину и AT III. g-тромбин не имеет свертывающей активности,
но ему присуще эстеразное и фибринолитическое действие (Р.
Machowich et al., 1976).
Фактор II cинтезируется в печени при участии витамина К. Если
нарушается функция печени, концентрация протромбина в
крови снижается. Уровень протромбина, или его функция,
снижается при эндо- или экзогенной недостаточности витамина
К, когда синтезируется неполноценный протромбин (белки
PIVKA).
Скорость свертывания крови нарушается лишь при уменьшении
концентрации протромбина ниже 40 %.
Повышенный уровень фактора II способствует развитию
тромбозов. Как правило, гиперпротромбинемия остается
фактором риска, если появляется активная протромбиназа,
снижаются активность антитромбина III и гепарина, а также
угнетен фибринолиз.
Существенной особенностью факторов протромбинового
комплекса является зависимость их активности от участия в их
синтезе витамина К (рис.1).
141.
142.
При его участии вырабатываемые в печени факторы имеют гаммакарбоксигруппировки, которые осуществляют реакцию с отрицательнымигруппами тромбопластина через кальциевые мостики. Такая реконфигурация
неактивного фактора обеспечивает ему раскрытие собственного активного центра
и таким образом происходит превращение их в активную форму.
143.
144.
Фактор III — тканевый тромбопластин (неактивная тканеваяпротромбиназа, апопротеин С—термостабильный
липопротеид). Разрушается при 75 °С. Его много в легких, тканях
мозга, сердца, кишечника, матки, в эндотелии. Он, в основном,
участвует в локальном гемостазе. При контакте с плазменными
факторами (VIIa, IV) способен активировать фактор Х (это
внешний путь формирования протромбиназы). Из форменных
элементов тканевый тромбопластин могут синтезировать только
моноциты (3. С. Баркаган, 1986).
Фактор IV — ионы кальция — имеет первостепенное значение
для активации протромбиназы и превращения протромбина в
тромбин. Ускоряет фибриноген-фибриновую реакцию. Ионы
кальция необходимы для взаимодействия факторов
свертывания с фосфолипидной поверхностью клеток. У
здоровых людей фактор IV определяется в концентрации 0,8—
1,75 ммоль/л.
Кальций способен связывать гепарин, благодаря чему
свертывание крови ускоряется. Без кальция нарушается
агрегация тромбоцитов и ретракция кровяного сгустка. Ионы
кальция ингибируют фибринолиз.
145.
Фактор V — проакселерин, лабильный фактор, или Асглобулин,— образуется в печени, но, в отличие от другихпеченочных факторов протромбинового комплекса (II, VII, IX и X),
его синтез не зависит от витамина К. Термолабилен, не
адсорбируется сернокислым барием. В хранящейся цитратной
плазме фактор V разрушается при +4 °С за 2 нед, при 37 °С — за
48 ч. В оксалатной плазме интенсивность этого процесса
удваивается. Проакцелерин плохо сохраняется в
консервированной крови. Он необходим для образования
внутренней (кровяной) протромбиназы, при этом заметно
активирует фактор X, и для превращения протромбина в
тромбин, когда в комплекс включаются фактор Ха, Са2+и
фосфолипид. Во время свертывания крови фактор потребляется,
как и фактор II, поэтому в сыворотке не обнаруживается. В
случаях дефицита фактора V в различной степени нарушаются
внешний и внутренний пути образования протромбиназы. В
коагулограмме это, прежде всего, выражается удлинением
протромбинового времени (снижением протромбинового
индекса), нарушением теста генерации тромбопластина, каолинкефалинового и аутокоагуляционного тестов. Тромбиновое
время остается в пределах нормы. После добавления ВаSO4плазмы здорового человека, содержащей фактор V, эти
изменения корригируются и названные выше тесты
нормализуются.
146.
Фактор VI — акселерин, или сывороточный Асглобулин,—активная форма фактора V. В связи с темчто отдельным фактором признается только
неактивная, профакторная, форма коагулянта,
акселерин исключен из употребления и номенклатуры
факторов свертывания.
147.
Фактор VII — проконвертин, или конвертин,—синтезируется впечени при участии витамина К. Долго остается в
стабилизированной крови, хорошо переносит нагревание,
поэтому называется стабильным фактором. Хорошо
адсорбируется сернокислым барием, гидроокисью алюминия,
задерживается асбестовыми фильтрами Зейца. Факторы ХII, Ха,
калликреин могут превращать фактор VII в VIIa. В основном
способствуют образованию тканевой протромбиназы и
превращению протромбина в тромбин. Фактор VII в
циркулирующей крови активирует фактор X. Это действие
усиливается после активации проконвертина тканевым
тромбопластином. У больных с поражением печени и у
подвергаемых лечению антикоагулянтами непрямого действия
активность фактора VII снижается. Врожденным недостатком
фактора VII обусловлено развитие геморрагического диатеза
(болезни Александера). Фактор VII, подобно факторам ХПа, XI, X,
IX, Па и калликреину, является сериновой протеазой с аргининэстеразной активностью
148.
Фактор VIII — антигемофильный глобулин А, или плазменныйтромбопластический фактор А,— относится к сложным
гликопротеидам. Место его синтеза точно не установлено.
Доказан синтез фактора VIII в печени, селезенке, клетках
эндотелия, лейкоцитах, почках. Антигемофильный глобулин А
быстро инактивируется при 20° и 37 °С. Он стабилен несколько
часов при +4 °С и несколько недель при —20 °С. Быстро исчезает
из консервированной крови. Фактор VIII дольше активен в
присутствии цитрата натрия при рН 6,2—6,9, но быстро теряет
активность в среде с ЭДТА. Он не адсорбируется на сульфате
бария и гидроокиси алюминия. Этим пользуются для отделения
фактора VIII от факторов II, VII, IX и X.
В крови этот фактор циркулирует в виде комплекса из трех
субъединиц, обозначаемых VIIIK(коагулирующая единица), VIIIАГ (основной антигенный маркер) и VIII-фВ (фактор
Виллебранда, связанный с VIII-АГ). VIII-фВ регулирует синтез
коагулянтной части антигемофильного глобулина—VIIIK.
При свертывании крови фактор VIII остается в неактивном
состоянии








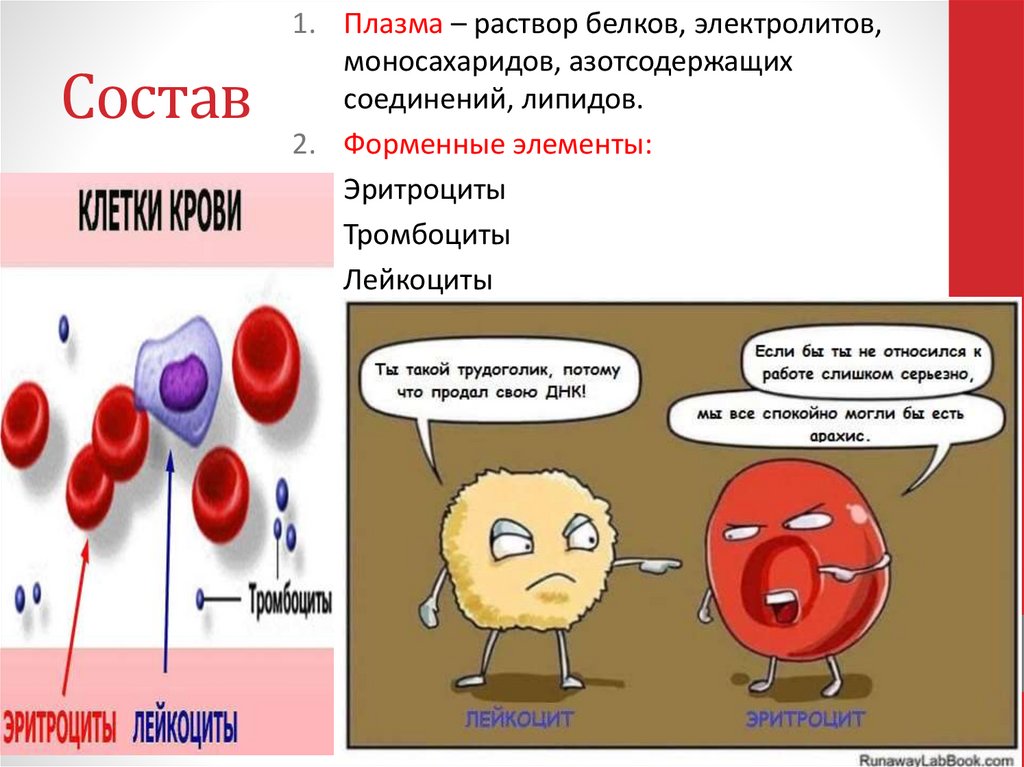
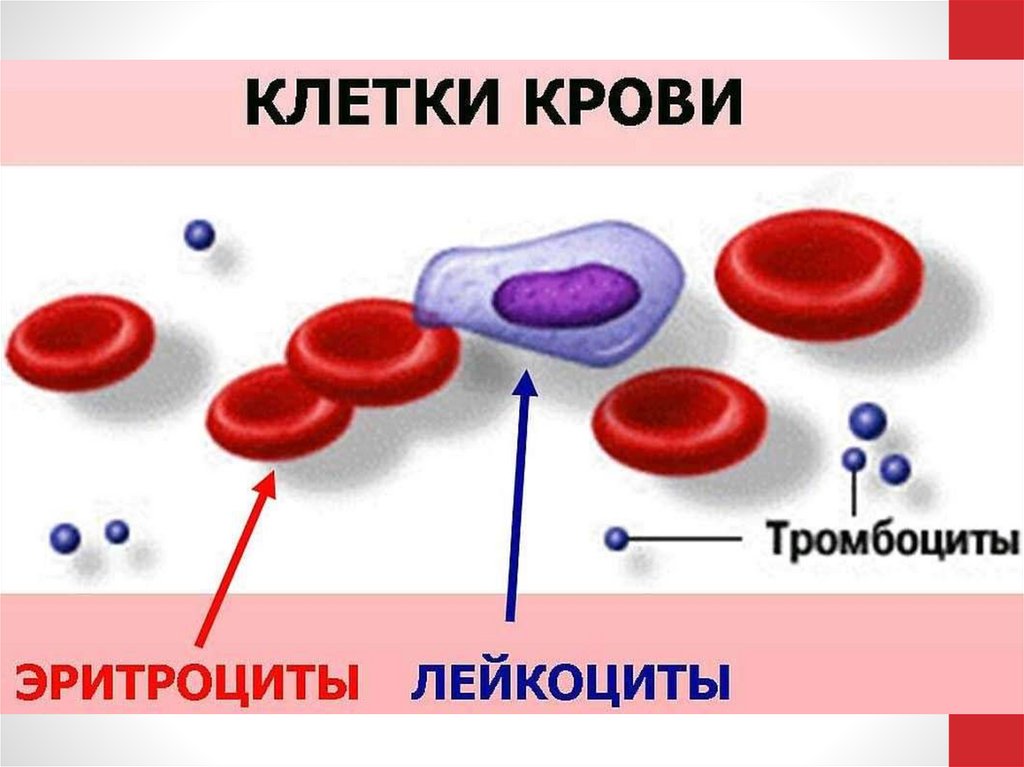










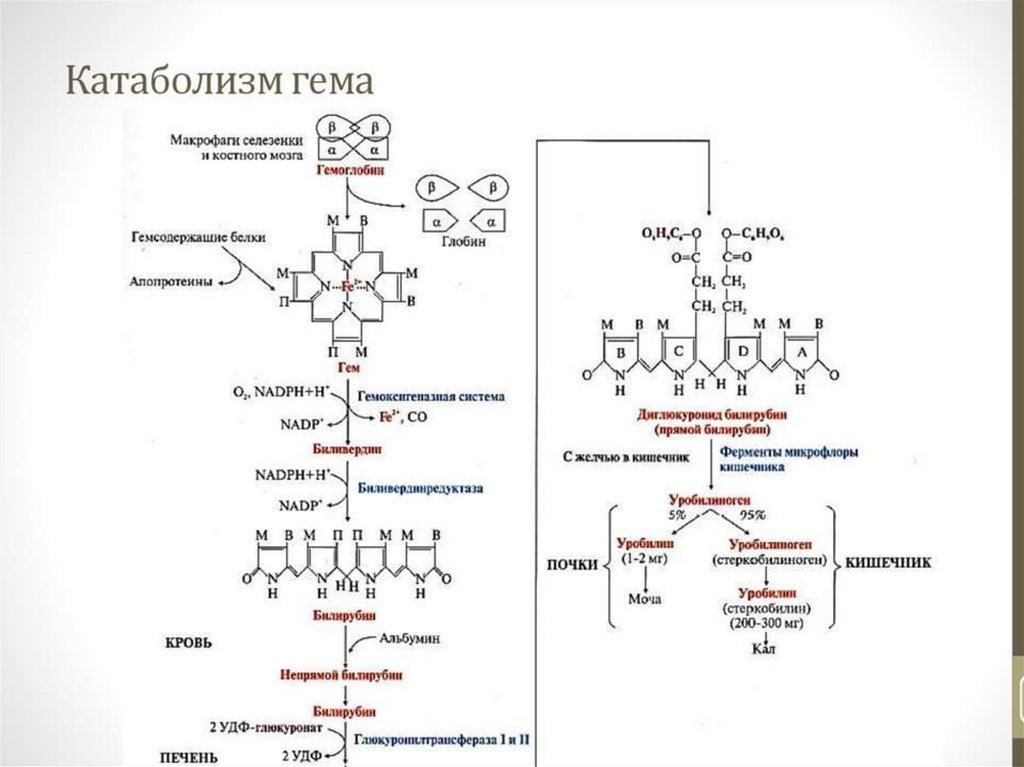








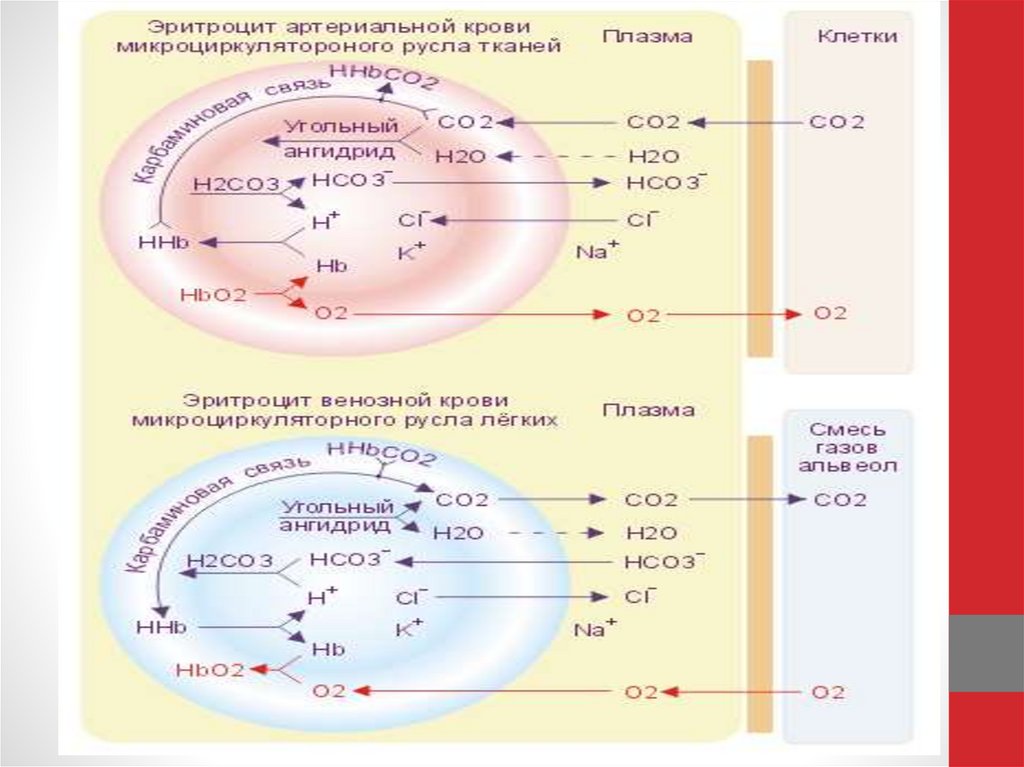


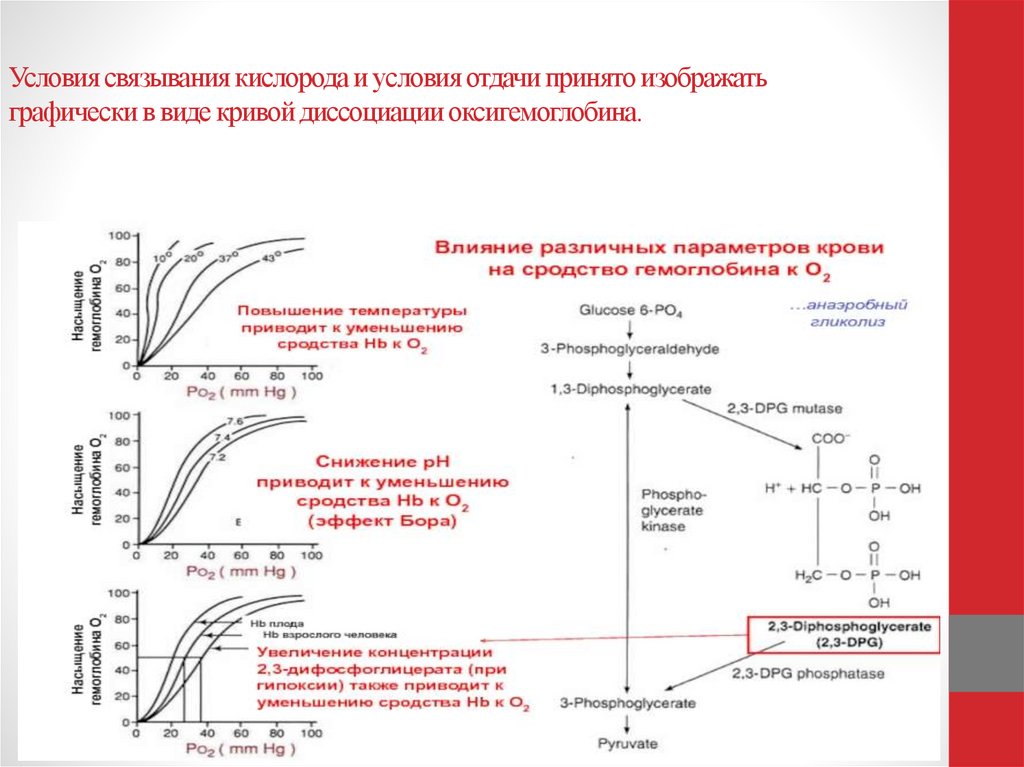
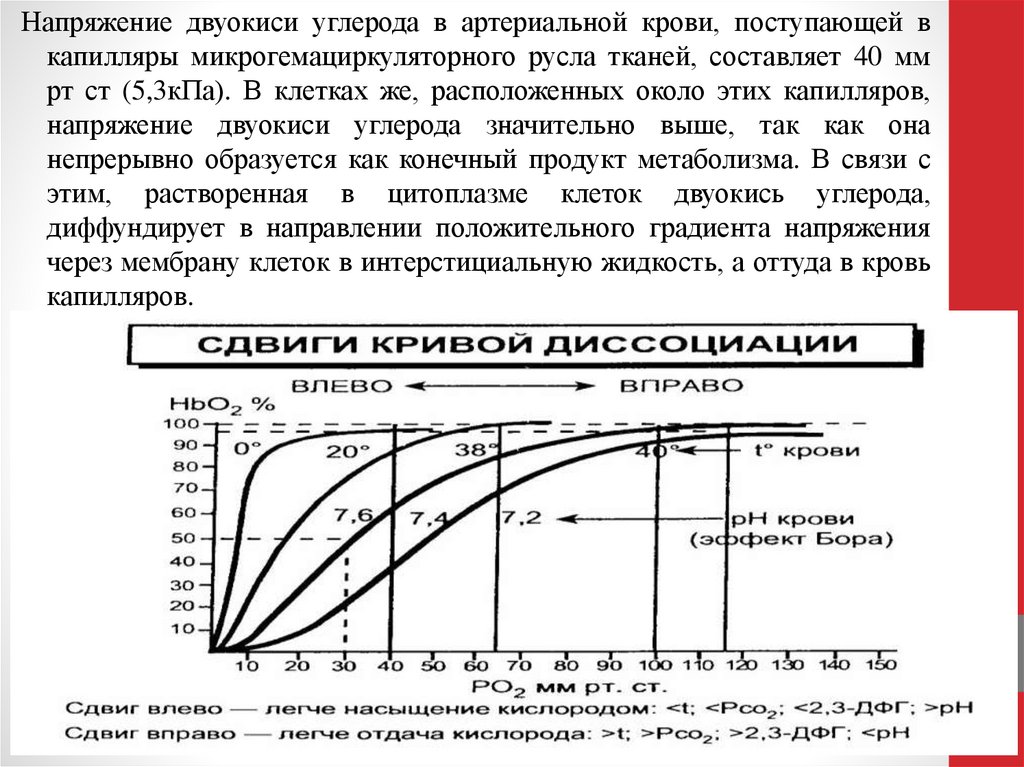
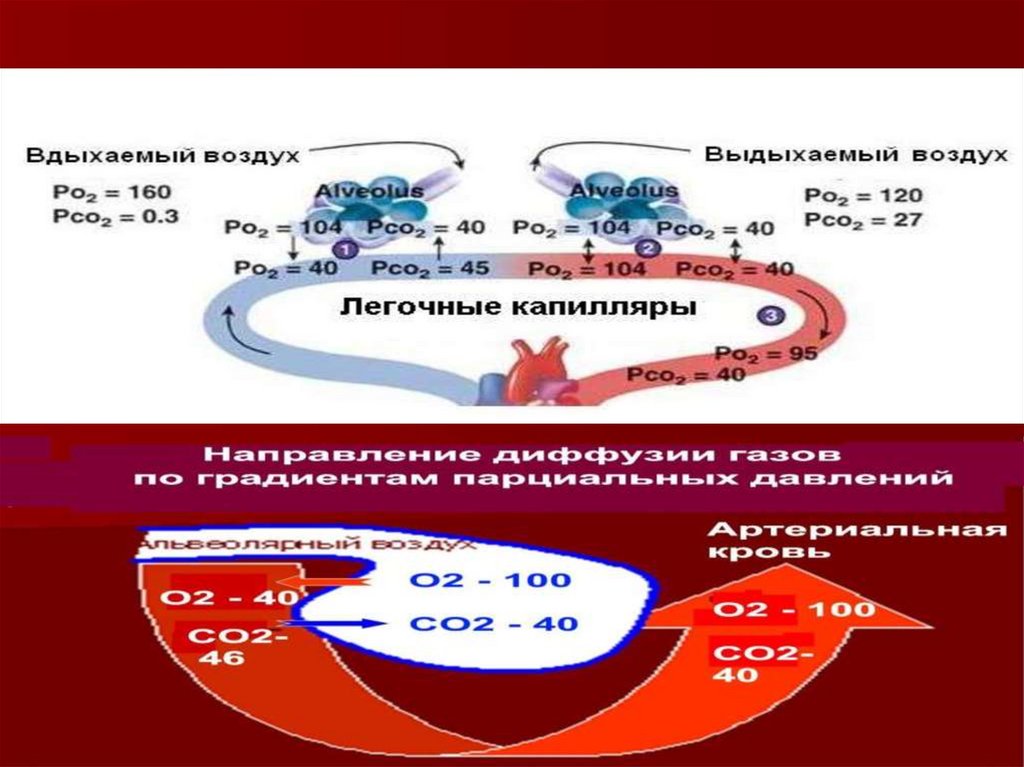

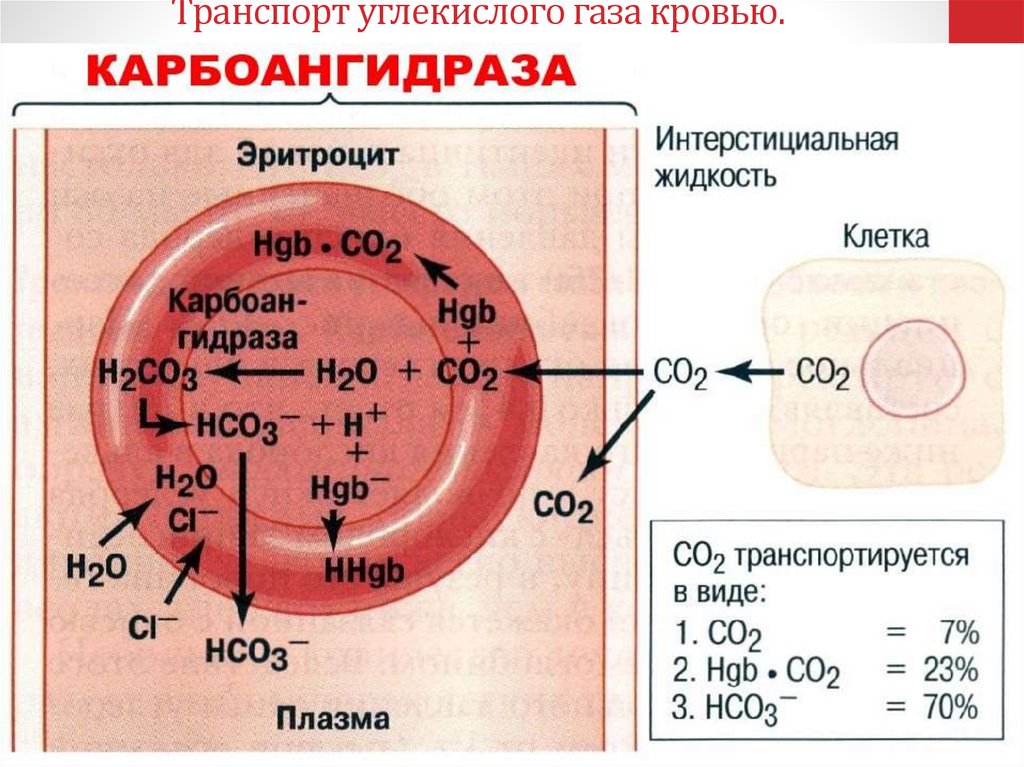











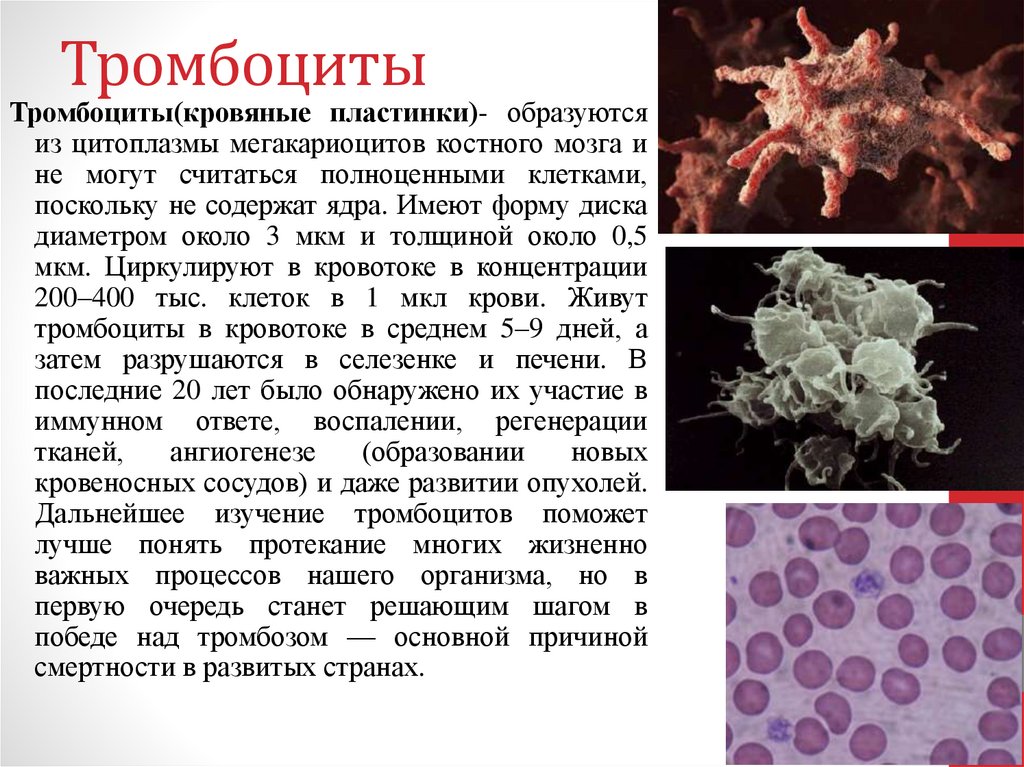
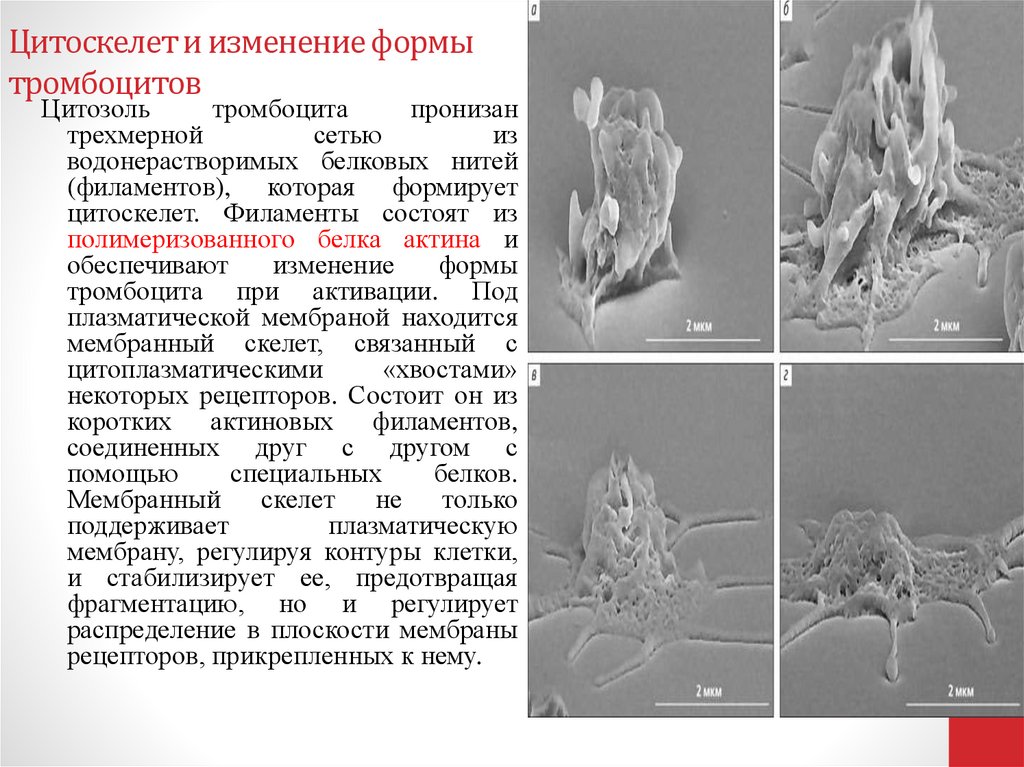







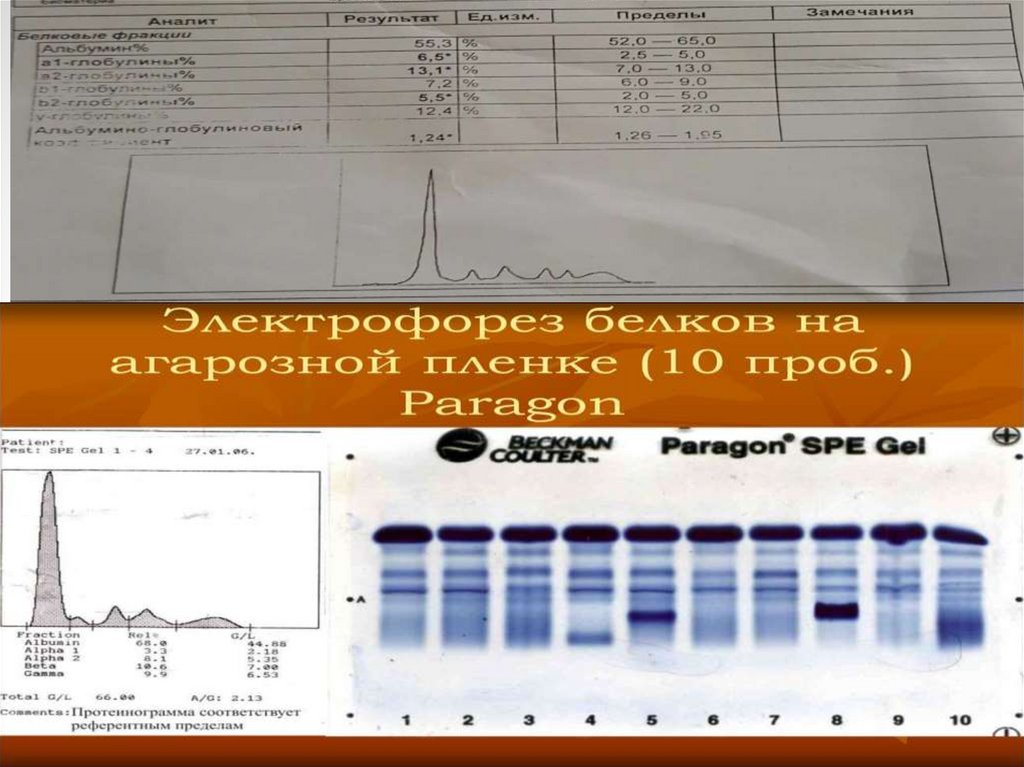


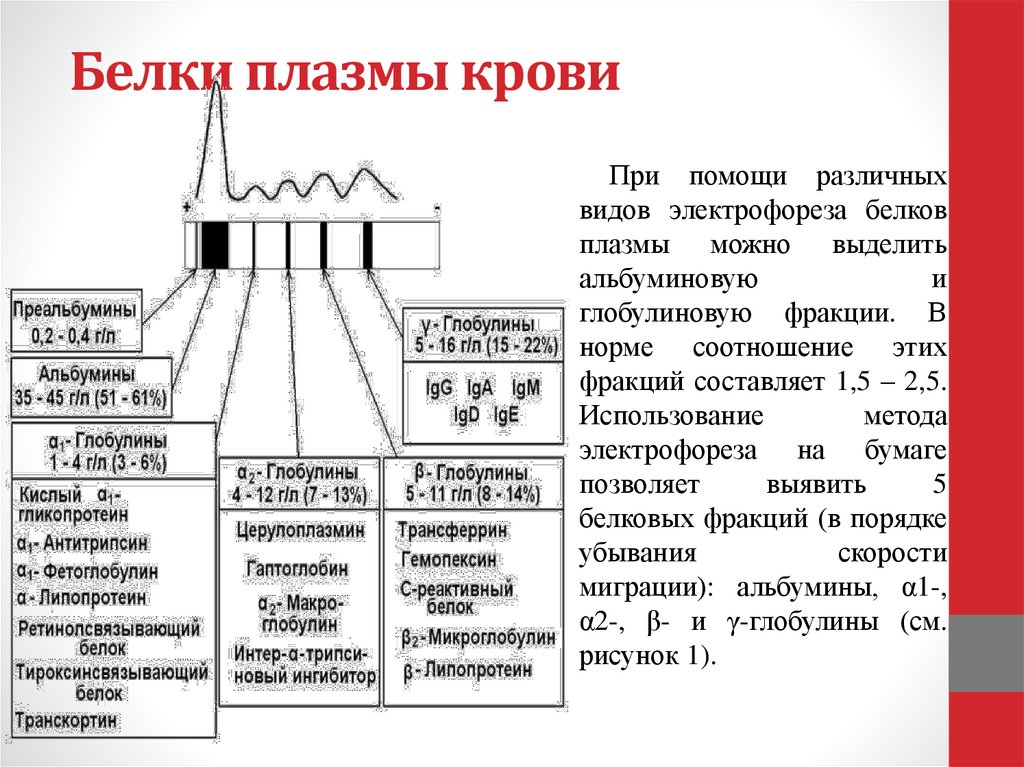



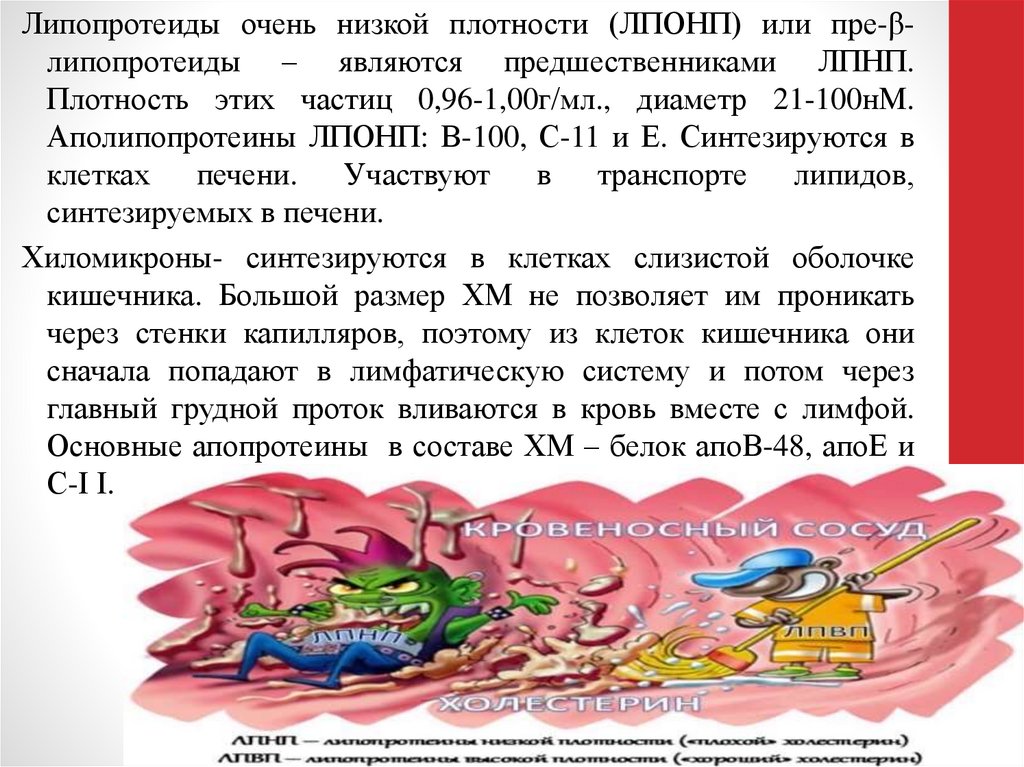
















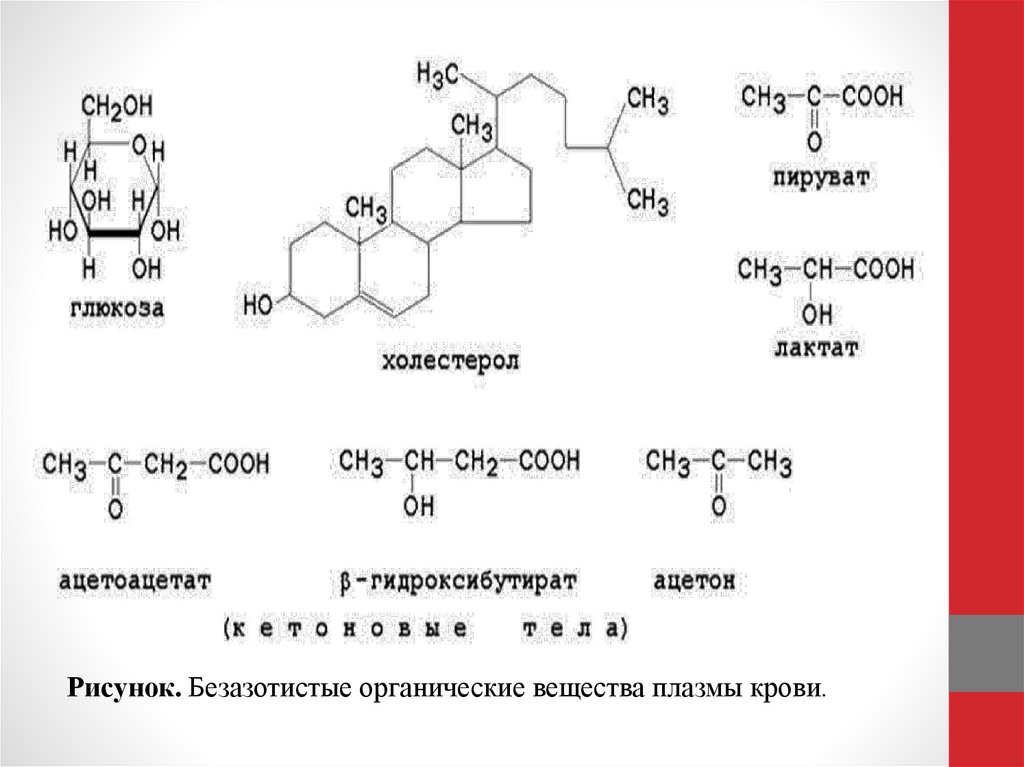













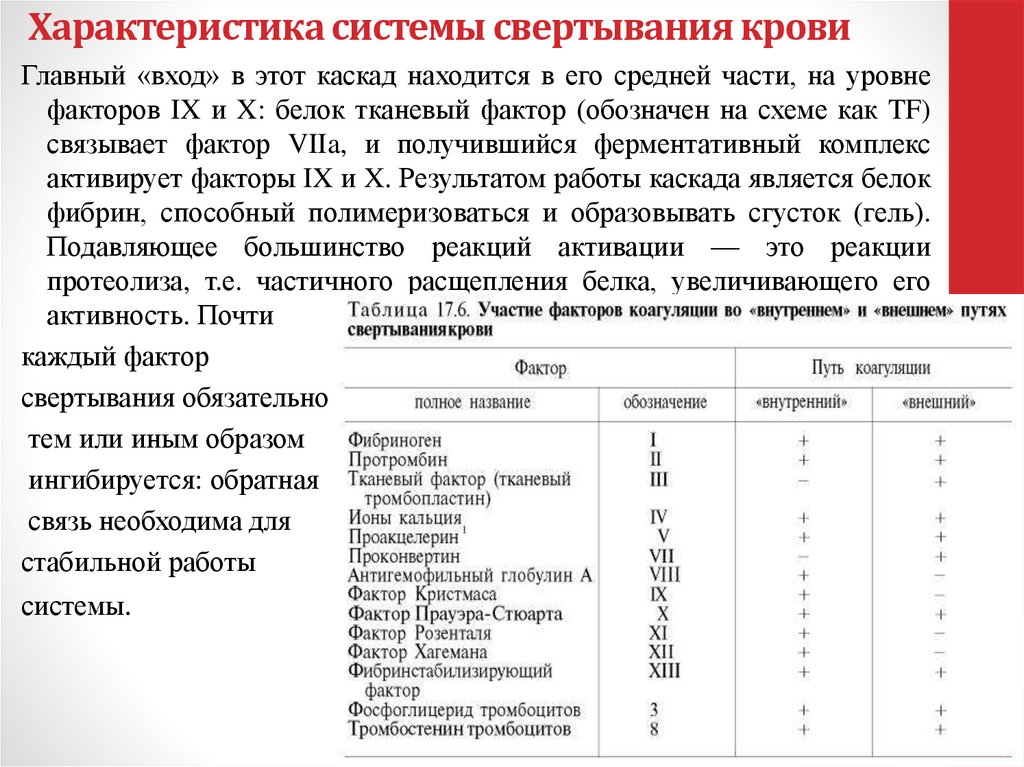









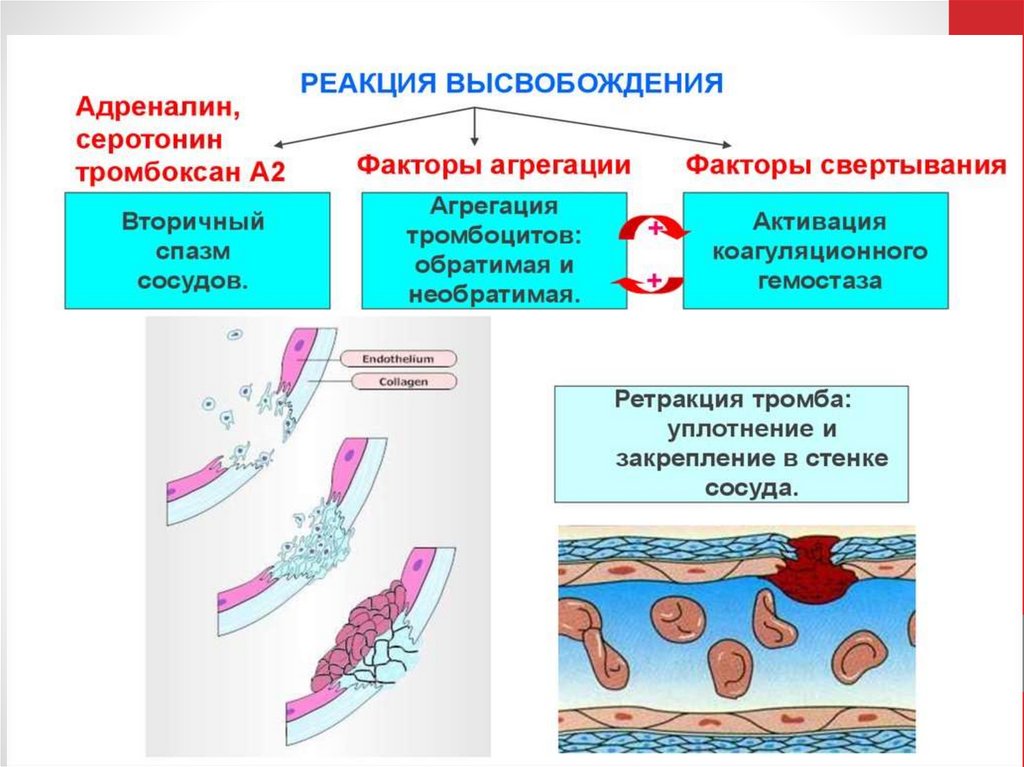






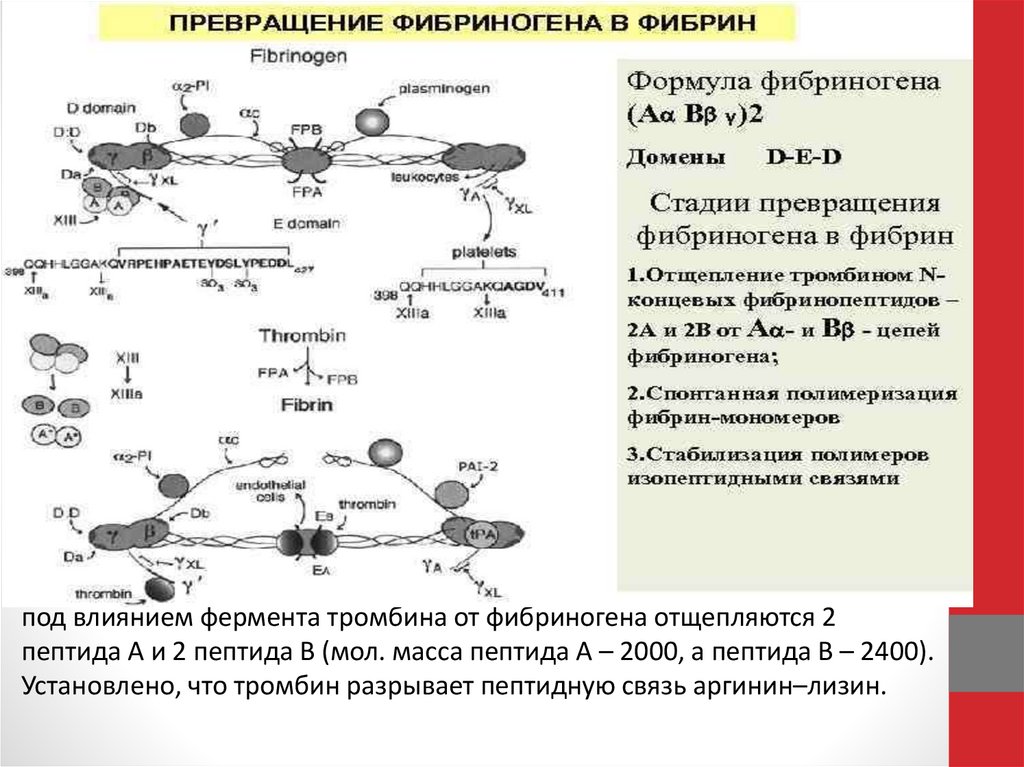
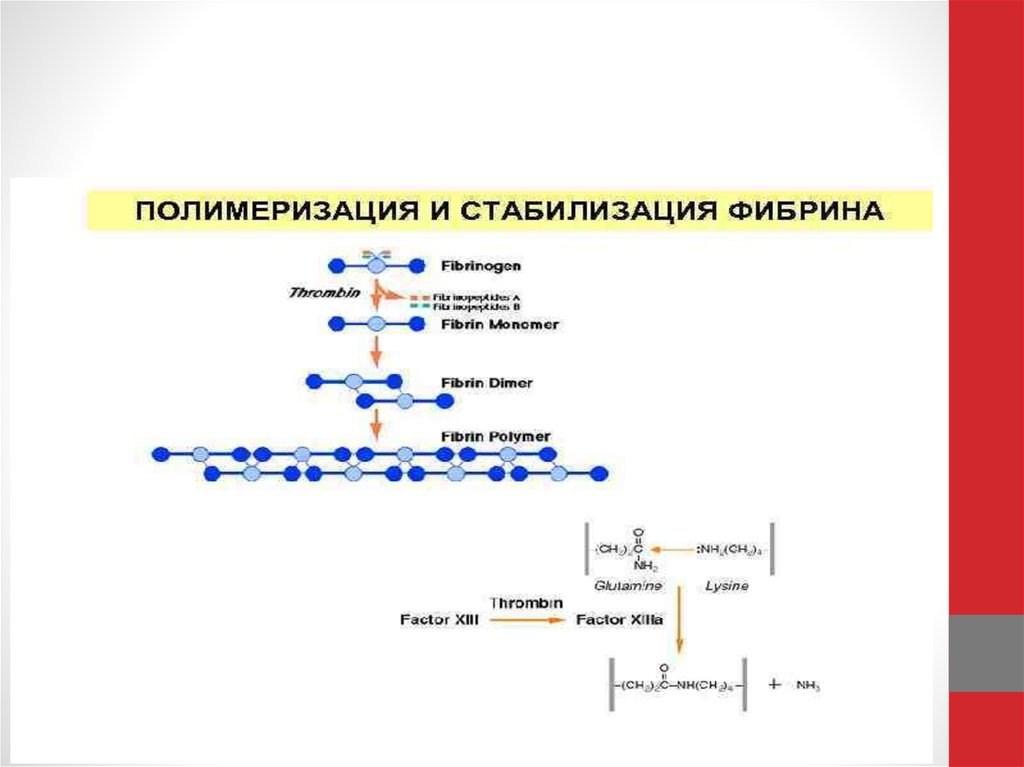











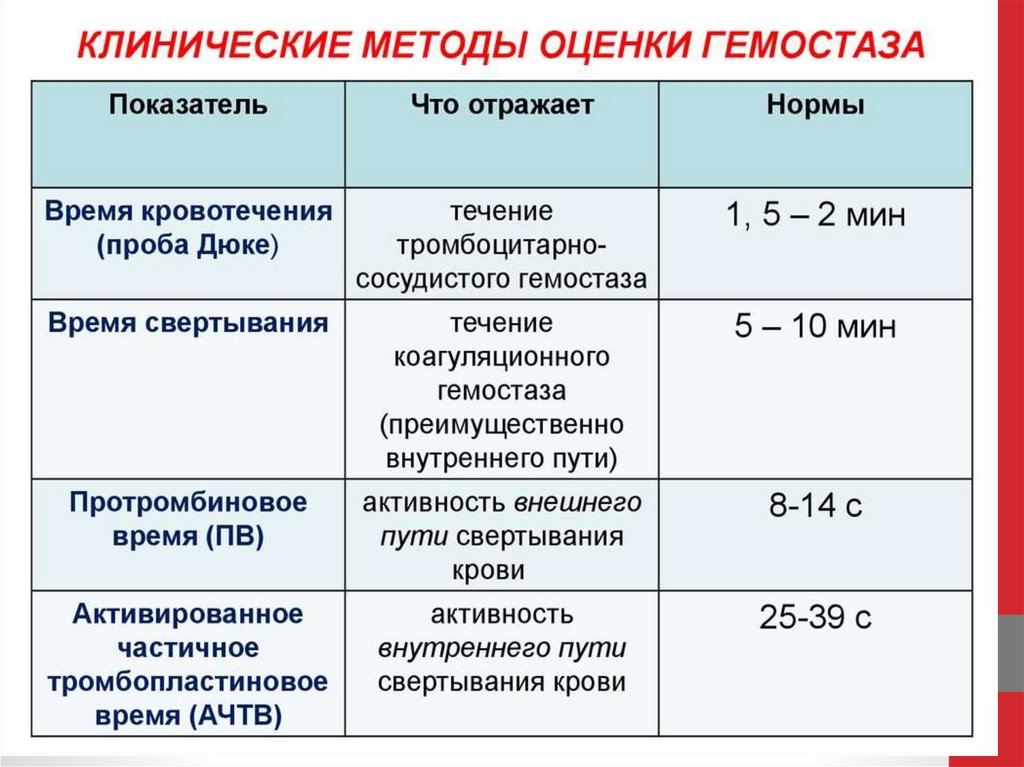



















 Медицина
Медицина








