Похожие презентации:
Растворы. Образование растворов
1. Литература
под. Редакцией Ершова Ю.А.Общая химия. Биофизическая химия. Химия
биогенных
процессов.
:
учебник
для
медицинских вузов
Зайцев О.С. Общая химия. Состояние веществ
и химические реакции. : Учебное пособие для
вузов.
А.Н.Аверцева и др. Общая и биоорганическая
химия: учебник для студентов мед. вузов
обучающихся по спец. "Стоматология"
АСАДЕМА Ли др.: Биоорганическая
(Электронный ресурс): учебник
химия
2.
РАСТВОРЫ3. Образование растворов
Смешивание двух веществ можетсопровождаться:
1. Химическим взаимодействием;
2. Образованием механических смесей,
которые легко разделяются на исходные
компоненты;
3. Образованием растворов (промежут. сост.
между 1 и 2)
4.
Раствор = растворитель + растворенное веществоРаствор – термодинамически устойчивая однородная
система из двух или более компонентов, относительные
количества которых могут изменяться в широких
пределах.
Растворитель – компонент раствора который в чистом
виде существует в таком же агрегатном состоянии, что
и раствор.
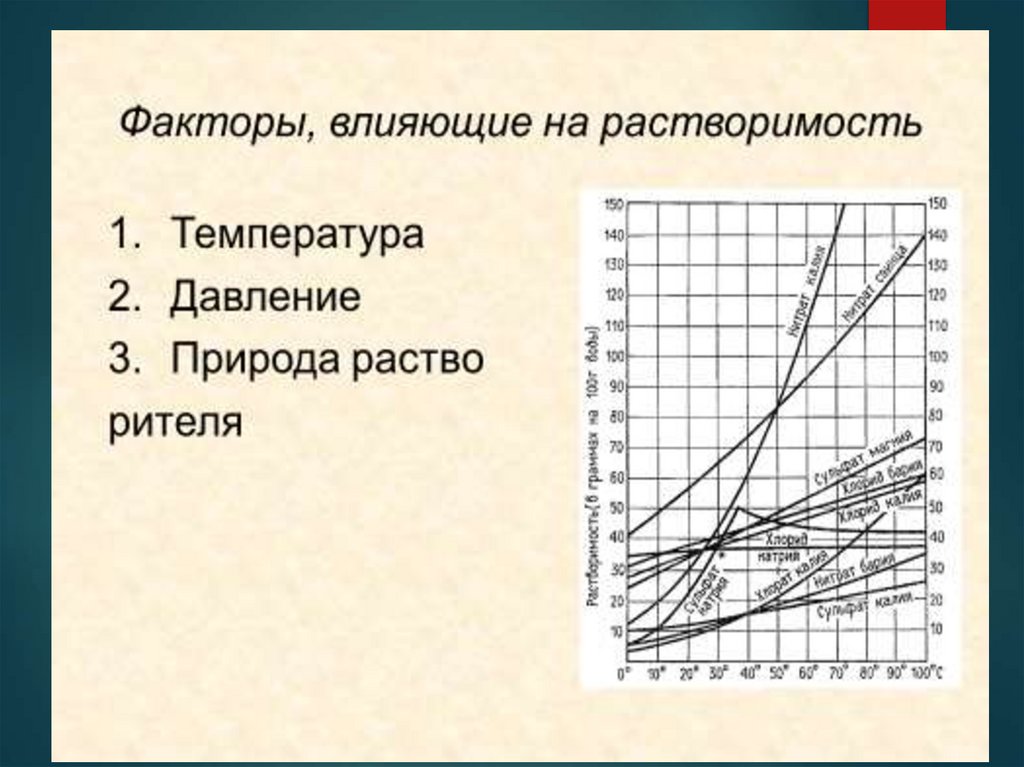
5. Классификация растворов
1. По агрегатному состоянию (твёрдые, жидкие,газообразные)
2. По состоянию равновесия (насыщенные, не
насыщенные, пересыщенные)
3. По концентрации (разбавленные,
концентрированные)
4. По типу растворителя (водные, спиртовые,
аммиачные, бензольные)
5. По электропроводности (электролиты, не
электролиты, промежуточные)
6.
Ненасыщенным называется такой раствор, в которомпри
данной
температуре
находится
меньше
растворяемого вещества, чем в его насыщенном
растворе.
Пересыщенным называется такой раствор, в котором
при данной температуре находится в растворенном
состоянии больше растворенного вещества, чем в его
насыщенном растворе при тех же условиях.
7.
Установлено,что
лучше
«подобное
растворяется в подобном». Т.е. вещества
состоящие из полярных молекул и с ионным
типом связи, лучше растворяются в полярных
растворителях (вода, спирты, жидкий аммиак),
а не полярные вещества – в неполярных
растворителях (бензол, сероуглерод).
8.
9. Значение растворов в жизнедеятельности организмов
Важнейшие биологические жидкости - кровь, лимфа моча,слюна, пот являются растворами солей, белков, углеводов,
липидов в воде. Слюны вырабатывается до 2 л в сутки.
Усвоение пищи связано с переходом питательных веществ в
растворенное состояние.
Биохимические реакции в живых организмах протекают в
растворах.
Биожидкости участвуют в транспорте: - кислорода, питательных
веществ (жиров, аминокислот), - лекарственных препаратов к
органам и тканям, - выведении из организма метаболитов:
мочевины, билирубина, углекислого газа.
Плазма крови является средой для клеток - лимфоцитов,
эритроцитов, тромбоцитов.
10.
11.
12.
13.
14.
15.
16.
17. Основные функции воды в организме
Обеспечение процессов всасывания имеханического передвижения питательных
веществ.
Поддержание оптимального осмотического
давления в крови и тканях.
Обеспечение функционирования белков,
нуклеиновых кислот, полисахаридов.
Участие в процессах биосинтеза,
ферментативного катализа, гидролиза.
Поддержание температуры тела.
18.
Истинные растворы – гомогенные системы, вкоторых структурной единицей растворенного
вещества являются ионы или молекулы. Водные
растворы. Содержание воды в организме от
массы
человека:
Эмбрион
(97%),
Новорожденный (77%), Взрослый (18-55 лет):
54% - Ж, 61% - М
19.
По механизму образования твердые растворы можноподразделить
на
следующие
основные
типы:
замещения, внедрения и вычитания. Сплавы и металлы
являются
важнейшими
конструкционными
материалами для изготовления зубных протезов, шин,
аппаратов
и
имплантатов.
Для
изготовления
медицинского инструментария применяют различные
металлы и сплавы. Иглы для наложения искусственного
пневмоторакса изготавливают из платины, проволочные
скобки для различных сшивающих аппаратов – из
тантала, некоторые глазные инструменты – из серебра.
Чугун
применяют
для
изготовления
оснований
операционных
столов,
зубоврачебных
кресел,
бормашин и пр.
20.
Из нержавеющей стали изготавливают хирургическиеножи, скальпели и пр. В стоматологии применяют
следующие сплавы на основе золота:
Сплав золота, меди, серебра – для изготовления
коронок и мостовидных протезов, плакировки для
фарфоровых зубов и базисных съемных протезов.
Золотые сплавы с примесью платины применяются для
изготовления каркасов бюгельных протезов, вкладок,
полукоронок и кламмеров в съемных пластиночных
протезах.
21.
Взависимости
от
сродства
к
подразделяют
воде
функциональные
группы
на:
гидрофильные
(«любящие
воду»)
и
гиброфобные
(«боящиеся
воды»).
К
гидрофильным относятся ионы и полярные
группы: гидроксильная – OH; амино – NH2 ;
карбоксильная – COOH и др. К гидрофобным
относятся неполярные группы: углеводородные
радикалы.
22.
23.
24.
25.
26.
27.
28.
29.
30. Законы Генри, Дальтона, Сеченова, их физиологическая значимость, применение в медицинской практике
31.
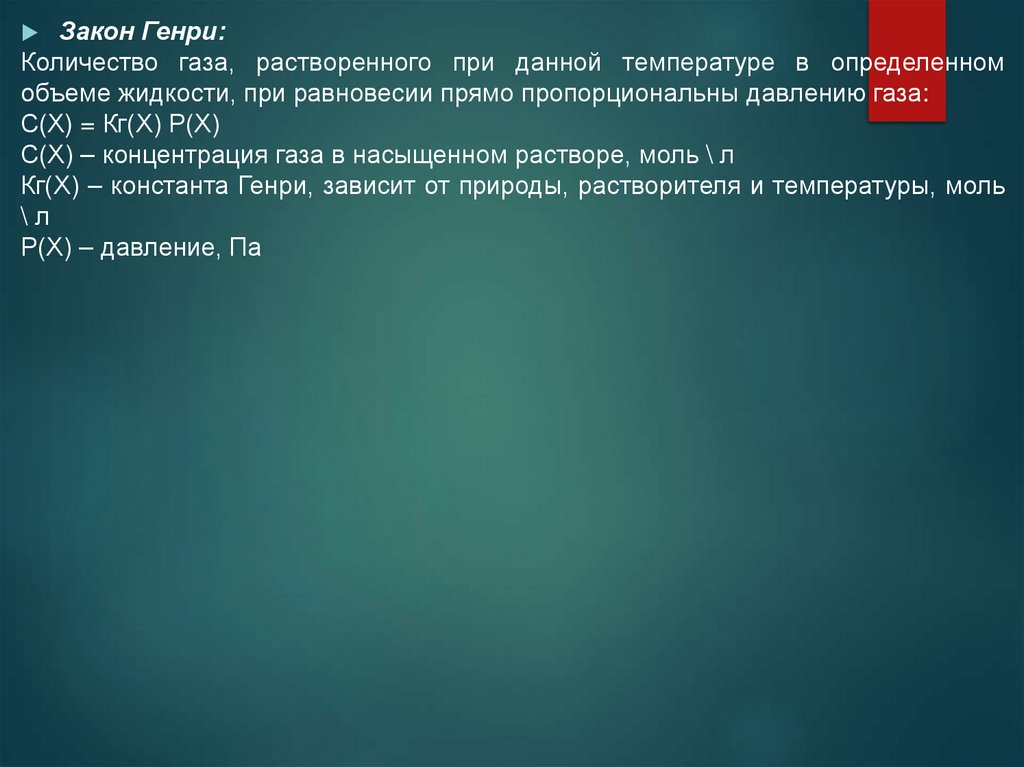
Закон Генри:Количество газа, растворенного при данной температуре в определенном
объеме жидкости, при равновесии прямо пропорциональны давлению газа:
С(Х) = Кг(Х) Р(Х)
С(Х) – концентрация газа в насыщенном растворе, моль \ л
Кг(Х) – константа Генри, зависит от природы, растворителя и температуры, моль
\л
Р(Х) – давление, Па
32.
Закон Дальтона:Растворимость каждого из компонентов газовой смеси
при
постоянной
температуре
пропорциональна
парциальному давлению компонента над жидкостью и
не зависит от общего давления смеси.
Pi = Pобщ χ(Xi)
Pi – парциальное давление компонента Xi
Pобщ – общее давление газовой смеси
χ(Xi) – молярная доля i-того компонента
33.
Знание законов Генри и Дальтона позволяетправильно анализировать газообмен в организме,
происходящий в основном в легких. Поступление
газов из воздуха в кровь и наоборот подчиняется
закону Генри.
34.
Закон Сеченова:Растворимость газов в жидкостях в присутствии электролитов
понижается, происходит высаливание газов.
С(Х) = С0(Х) е-Кс Сэ
С(Х) – растворимость газа Х в присутствии электролита
С0(Х) – растворимость газа Х в чистом растворителе
Сэ – концентрация электролита
Кс – константа Сеченова (зависит от природы газа, электролита,
температуры)
































 Химия
Химия








