Похожие презентации:
Лекция 1. Химическая термодинамика. I закон. Закон Гесса
1.
Лекция 1.Химическая термодинамика. I закон.
Закон Гесса
1
2.
Химическая термодинамика изучаетизменения энергии в результате
процессов в материальных системах
и возможности протекания этих
процессов, в том числе и в организме
человека.
2
3.
Основные понятияТермодинамическая система (тд/с)
это совокупность материальных объектов
отделенных от окружающей среды реальной
или воображаемой границей.
Выделение тд/с из окружающей среды
относительно. Например: аудитория,
человек, орган в организме, клетка…
3
4.
В организме выделяют различные системыи соответственно различные специалисты ими
занимаются, если это
.
1) сердечно-сосудистая системакардиолог
2) ухо-горло-носоторинолоринголог
3) пищеварительная система- гастроэнтеролог
Система может состоять из более простых
систем:
Организм – органы – ткани - клетки...
наиболее
сложность уменьшается
сложная
4
5.
РАЗЛИЧАЮТ СИСТЕМЫгомогенныеоднородные, когда
между составными
частями системы нет
границ раздела.
1. физ. раствор 0.9%NaCl в воде
2. плазма крови:
белки, гормоны,
витамины в воде
гетерогенныенеоднородные, когда между
составными частями
системы есть границы
раздела
1. лед в воде
2. эритроциты,
тромбоциты, лейкоциты в
плазме крови
3. человек в целом: все
биопроцессы идут на
границе раздела фаз.
5
6.
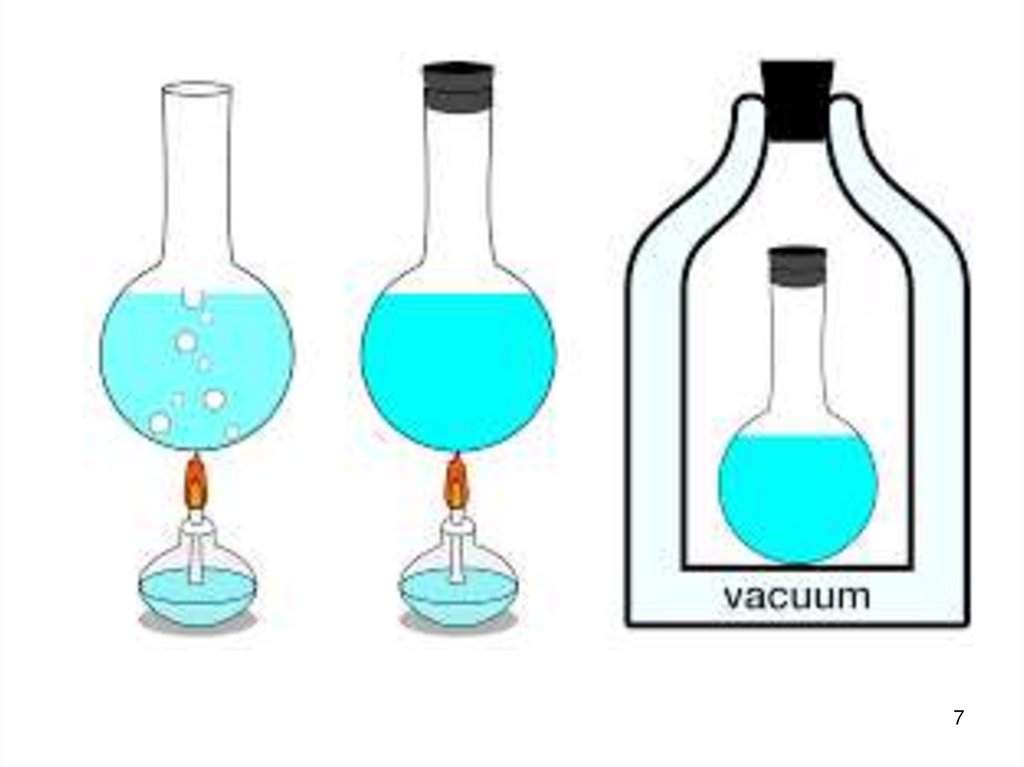
Различают :1. Изолированные системы : ∆m=0
∆E=0
Не обмениваются с окружающей средой ни массой
ни энергией. В природе не существуют. Человек
создаёт их искусственно (термос).
2. Закрытые системы:
∆m=0
∆E≠ 0
Не обмениваются массой, но обмениваются
энергией. Например: раствор в закрытой колбе
(в конце концов колба приобретает температуру
окружающей среды).
3. Открытые системы:
∆m ≠ 0 ∆E≠ 0
Обмениваются как массой так и энергией.
Например: любой живой организм; раствор в
открытой колбе
6
7.
78.
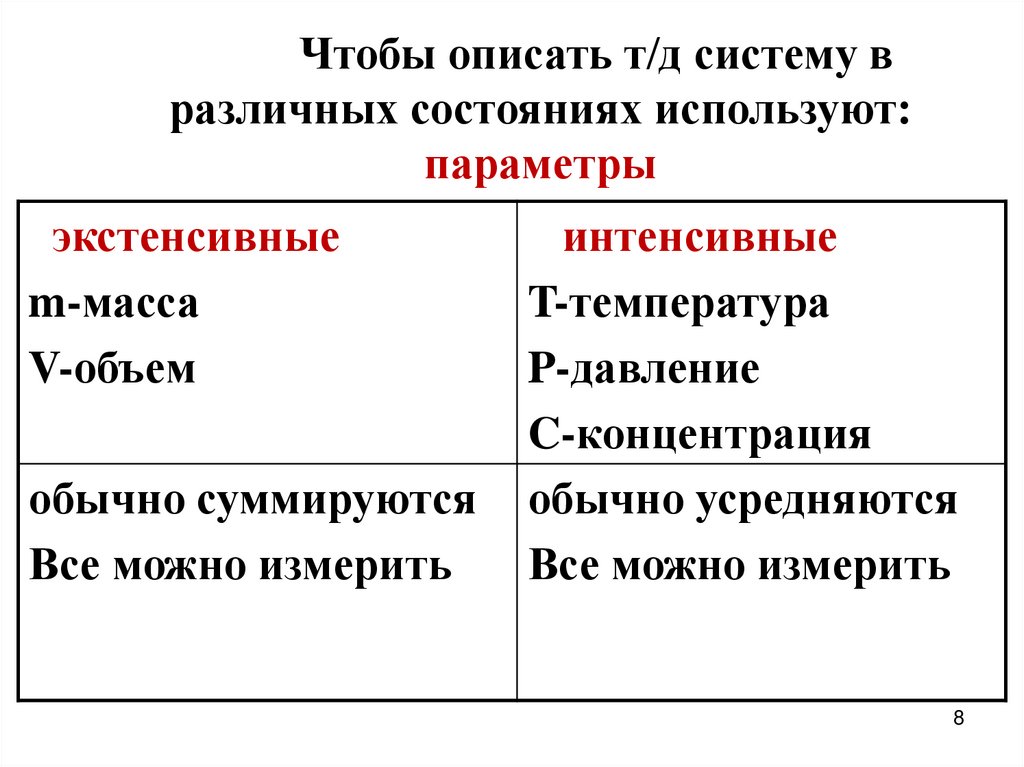
Чтобы описать т/д систему вразличных состояниях используют:
параметры
экстенсивные
m-масса
V-объем
обычно суммируются
Все можно измерить
интенсивные
T-температура
P-давление
C-концентрация
обычно усредняются
Все можно измерить
8
9.
Функции состоянияЗависят от параметров состояния и в целом
от состояния системы
E - внутренняя энергия
H- энтальпия
G -энергия Гиббса
S –энтропия
Их можно только рассчитать зная
параметры системы.
Они зависят только от начального и
конечного состояния процесса и не зависят
от пути процесса.
9
10.
Любое изменение параметров состояния системыозначает, что в системе идет термодинамический
процесс, который может быть
т/д процесс
Изохорный
если V = const
Изотермический
если T = const
Изобарный
если P = const
∆T = 0
∆P = 0
∆V= 0
если V и T постоянные то
изохорно-изотерм-кий
процесс
вне живого
если P и Tпостоянные то
изобарно-изотерм-кий
процесс
в живых системах
10
11.
Человек этооткрытая,
гетерогенная,
саморегулирующаяся и
самовоспроизводящаяся
система.
За 40 лет жизни человек потребляет в
среднем 40 тонн воды, 6 тонн пищи и
приблизительно 12млн литров кислорода.
11
12.
Когда человек здоров , то его температураt = 36,6°C, а давление P = 120/80.
На приеме врач первым делом измеряет
у взрослого человека температуру и давление,
а у ребенка рост и вес.
Любое изменение этих величин говорит о
заболевании, о нарушении гомеостаза.
К тому что мы уже знаем, о человеке
добавим, что в нем идут изобарно- изотерми12
ческие процессы.
13.
Состояние системыэто совокупность её физико-химических
свойств. Оно может быть :
начальное → переходное → конечное
13
14.
Конечное состояние может быть:1. равновесное, когда параметры системы
не изменяются со временем, и в системе
отсутствуют потоки вещества и энергии т.е.
∆m = 0 и ∆E = 0
Оно характерно для изолированных систем.
В природе такие не существуют.
2. стационарное состояние, когда
параметры системы также не изменяются,
но в системе имеются потоки вещества и
энергии. Оно характерно для закрытых и
14
открытых систем.
15.
Стационарное состояниеможет быть
в закрытых
системах
∆m=0
в открытых
системах
∆m≠0 и ∆E ≠0
Вне живого
Человек ,
животные,
растения
15
16.
В живых системах постоянно идетобмен веществ: мы дышим, потеем и т.д.
Если этой возможности нет, то
наступает стресс, а в результате возможно и
смерть. Организм первым долгом пытается
выйти из стрессового состояния - очень
вредного, т.к. в состоянии стресса человек
теряет большое количество энергии, а те
системы, которые отвечают за состояние
гомеостаза
плохо
выполняют
свои
функции…
16
17.
Первое начало (ЗАКОН) термодинамикиЭто закон сохранения и превращения
энергии. Он формулируется так:
энергия не создается из ничего и не исчезает
бесследно, а превращается из одного вида в
другой в строго эквивалентных
количествах.
Невозможно создать двигатель, который
совершал бы работу без затраты энергии
(т.н. перпетум мобиле – вечный двигатель).
17
18.
В этом законе фигурируют три величины:1. E - внутренняя энергия, это общий запас
энергии системы, слагающийся из
кинетической энергии движения
составляющих ее частиц (молекул , атомов,
электронов) и потенциальной энергии их
взаимодействия.
Это функция состояния. Абсолютную её
величину измерить невозможно, но можно
рассчитать её изменение.
18
19.
2. Q - теплота - это неупорядоченная формапередачи энергии, осуществляемая в
результате физических процессов, например
при движении и взаимодействии молекул
(без образования химической связи).
Любой вид энергии переходит в теплоту,
а теплота рассеивается в окружающую среду.
Например: химическая энергия→ в тепловую;
электрическая → в химическую (электролиз) →
в тепловую…
19
20.
3. W - работа - упорядоченная формапередачи энергии.
При этом работа может быть:
a) механической - перемещение тела в
пространстве ;
б) электрической- изменение электрических
потенциалов на клеточных мембранах;
в) химической – если идут анаболические и
катаболические процессы.
20
21.
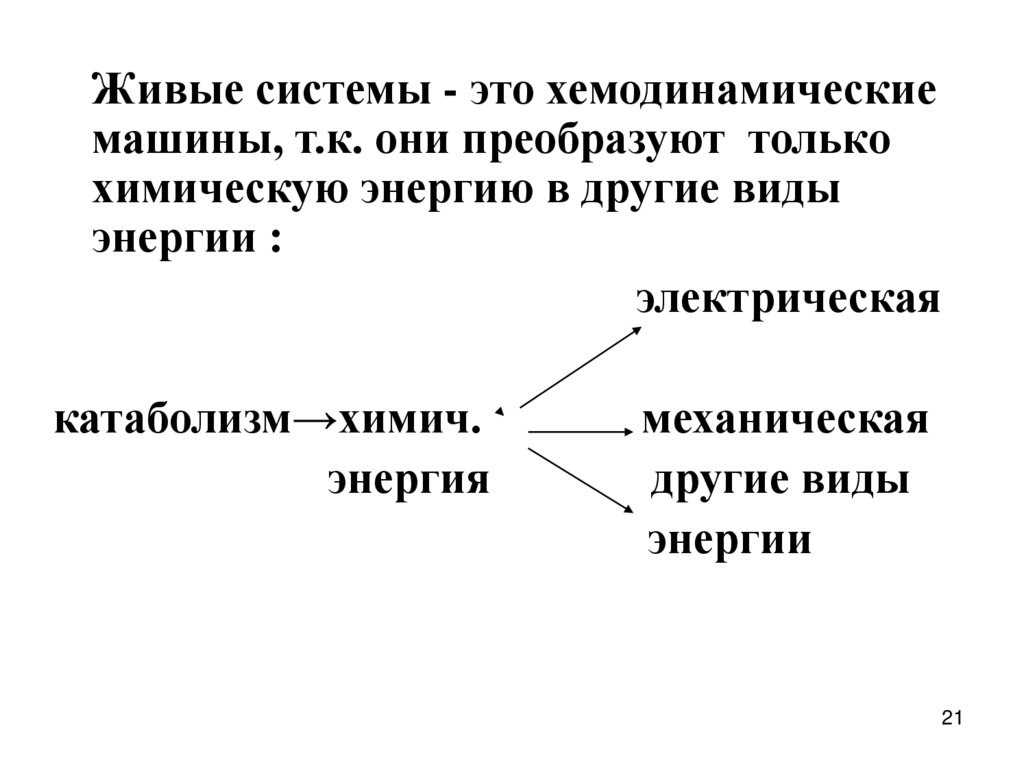
Живые системы - это хемодинамическиемашины, т.к. они преобразуют только
химическую энергию в другие виды
энергии :
электрическая
катаболизм→химич.
энергия
механическая
другие виды
энергии
21
22. Связь между тремя этими величинами (E, Q, W) отражает формула ∆E = Q - W
Изменение внутренней энергии системыравно теплоте подведенной к системе минус
работа, совершаемая системой против
внешних сил
22
23. Отсюда
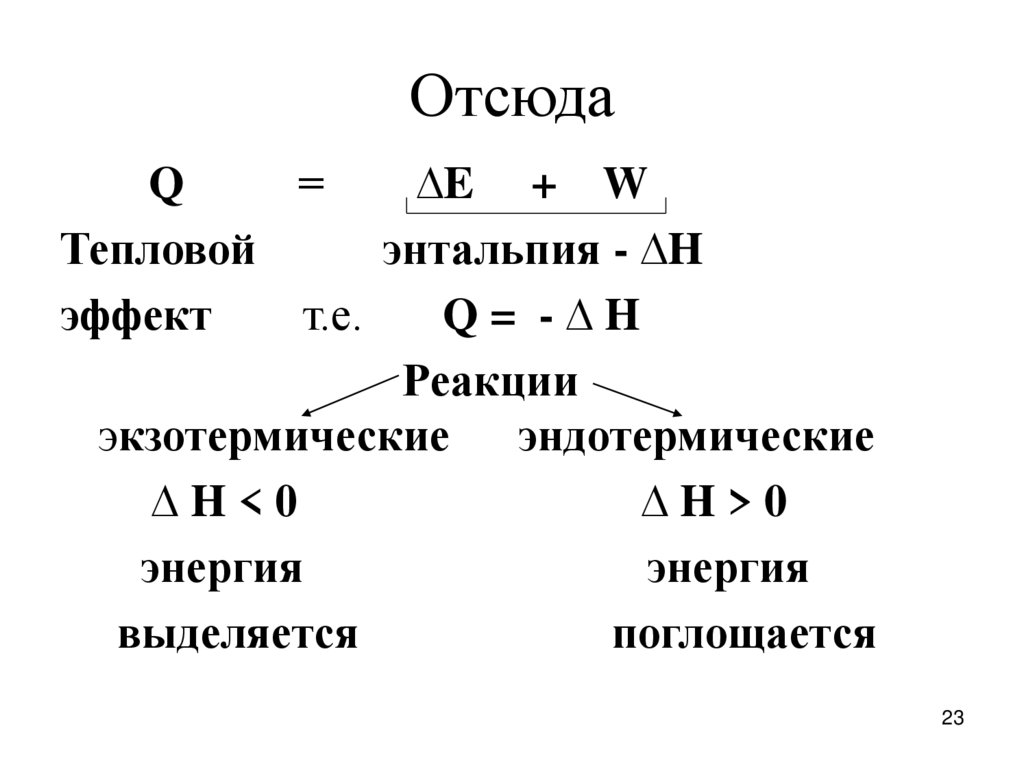
Q=
∆E + W
Тепловой
энтальпия - ∆H
эффект
т.е.
Q= -∆H
Реакции
экзотермические эндотермические
∆H<0
∆H>0
энергия
энергия
выделяется
поглощается
23
24.
Первый закон термодинамики гласит:Изменение внутренней энергии системы происходит за счет
работы и теплоты, переданной системе.
Формулу первого закона термодинамики в большинстве источников
записывают так:
ΔU = A + Q
, где ΔU — изменение внутренней энергии.
А — работа
Q – теплота
Данная формулировка для многих не совсем понятна, поэтому
давайте рассмотрим более простой для восприятия вариант первого
закона термодинамики.
По сути, тот же самый закон можно записать:
Q = ΔU + A
24
25.
Сам закон в данном случае будет гласить:Если мы подводим к телу теплоту, то она может
тратиться на изменение его внутренней
энергии(нагрев) и на совершение работы данным
телом(за счет изменения его объема).
Эта самая простая формулировка для восприятия
Чтобы стало еще понятнее, рассмотрим данный закон на простом
примере.
У нас есть обычная пустая банка, закрытая пластиковой крышкой.
Если мы подведем к банке тепло, то она начнет нагреваться. В тоже
время воздух находящийся в ней при нагревании начнет расширяться
и откроет крышку, совершив при этом работу. Таким образом, то
тепло, которое мы подвели к банке, потратиться на изменение её
внутренней энергии (банка и воздух в ней нагреются) и совершение
работы (откроется крышка).
Как видите, понять первый закон термодинамики достаточно
несложно. Если основной физический смысл в том, что энергия не
берется из ниоткуда и не исчезает в никуда. Именно поэтому не
существует и не может существовать вечного двигателя. Такого
двигателя, который смог совершать работу постоянно, не черпая при 25
этом энергию извне.
26.
2627.
2728.
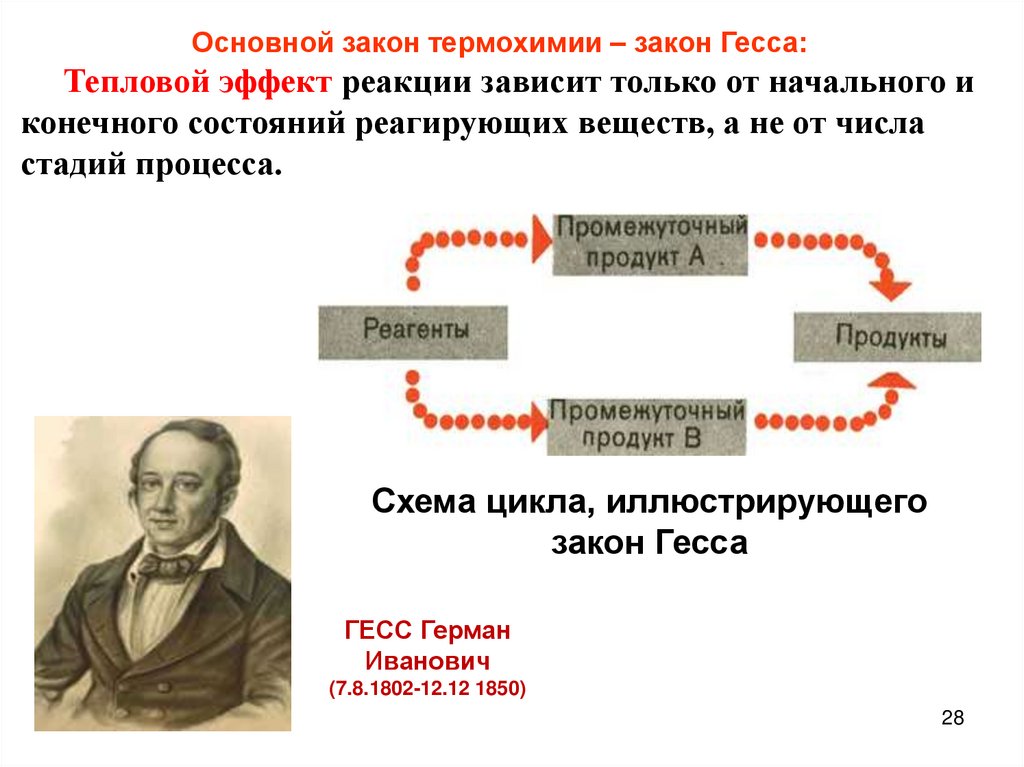
Основной закон термохимии – закон Гесса:Тепловой эффект реакции зависит только от начального и
конечного состояний реагирующих веществ, а не от числа
стадий процесса.
Схема цикла, иллюстрирующего
закон Гесса
ГЕСС Герман
Иванович
(7.8.1802-12.12 1850)
28
29.
Тепловые эффекты реакций в термохимии рассчитываютиспользуя
29
























 Химия
Химия








