Похожие презентации:
Взаимодействие электромагнитных волн с веществом. Закономерности поглощения света биологическими системами
1.
Карагандинский медицинский университетВзаимодействие электромагнитных волн с веществом.
Закономерности поглощения света биологическими
системами.
Кафедра информатики и биостатистики
Ассистент профессор Коршуков И.В.
2.
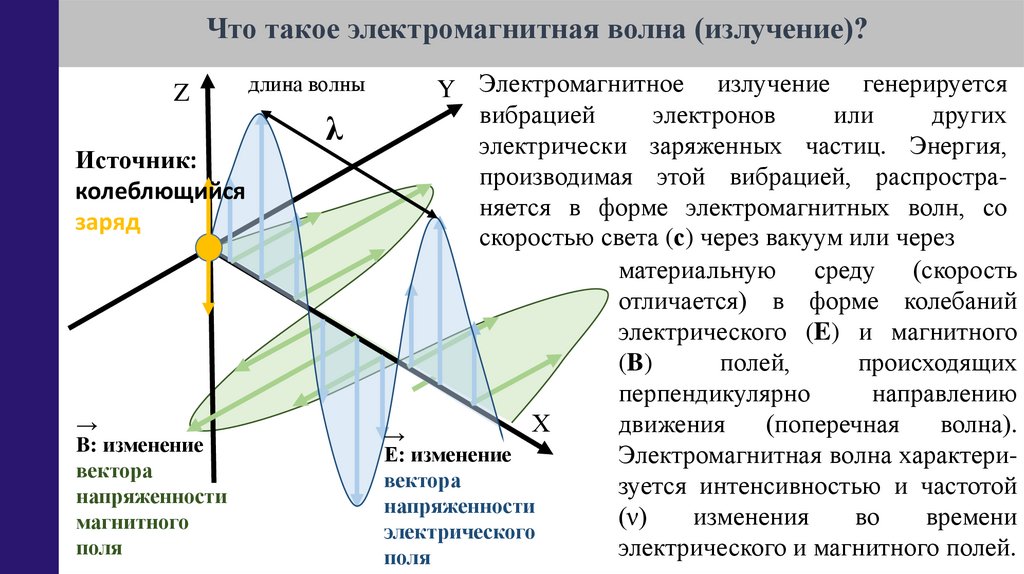
Что такое электромагнитная волна (излучение)?Z
Источник:
колеблющийся
заряд
→
B: изменение
вектора
напряженности
магнитного
поля
длина волны
λ
Y Электромагнитное излучение генерируется
вибрацией
электронов
или
других
электрически заряженных частиц. Энергия,
производимая этой вибрацией, распространяется в форме электромагнитных волн, со
скоростью света (с) через вакуум или через
материальную среду (скорость
отличается) в форме колебаний
электрического (E) и магнитного
(B)
полей,
происходящих
перпендикулярно
направлению
Х
движения
(поперечная
волна).
→
Е: изменение
Электромагнитная волна характеривектора
зуется интенсивностью и частотой
напряженности
(ν)
изменения
во
времени
электрического
электрического и магнитного полей.
поля
3.
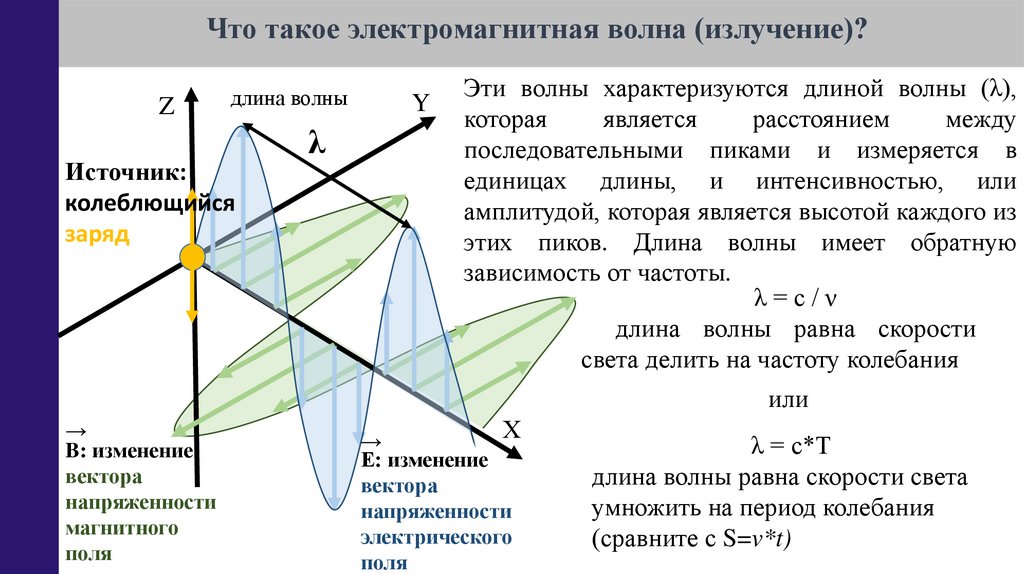
Что такое электромагнитная волна (излучение)?Z
длина волны
Источник:
колеблющийся
заряд
λ
Y
Эти волны характеризуются длиной волны (λ),
которая
является
расстоянием
между
последовательными пиками и измеряется в
единицах длины, и интенсивностью, или
амплитудой, которая является высотой каждого из
этих пиков. Длина волны имеет обратную
зависимость от частоты.
λ=с/ν
длина волны равна скорости
света делить на частоту колебания
или
→
B: изменение
вектора
напряженности
магнитного
поля
Х
→
Е: изменение
вектора
напряженности
электрического
поля
λ = с*Т
длина волны равна скорости света
умножить на период колебания
(сравните с S=v*t)
4.
Что такое электромагнитная волна (излучение)?В квантовой физике существует понятие корпускулярно-волнового дуализма:
электромагнитное излучение это:
• распространяющееся возмущение электромагнитного поля (волновая природа)
и
• поток дискретных частиц - фотонов (квантов энергии) (корпускулярная природа).
Фотоны - это пакеты энергии E=h*ν (уравнение Планка-Эйнштейна), которые
движутся со скоростью света. Фотоны с одинаковой энергией h*ν все одинаковы, и
значение их плотности соответствует интенсивности излучения. Электромагнитное
излучение взаимодействует с заряженными частицами в атомах, молекулах и более
крупных объектах материи. Эти явления, а также способы создания и наблюдения
электромагнитного излучения, и его технологические применения зависят от его
частоты ν.
5.
Некоторые характеристики и свойства электромагнитных волнОбщие свойства
Электромагнитные волны относятся множеству волн с общими свойствами,
называемого электромагнитным спектром. Все электромагнитные волны:
• являются поперечными волнами;
• могут распространяться в вакууме;
• движутся в вакууме с одинаковой скоростью (скоростью света, 300 000 000 м/с.)
Как и все волны, электромагнитные волны:
• переносят энергию из одного места в другое;
• могут отражаться;
• могут преломляться.
Различия
Каждый тип волны в электромагнитном спектре
имеет различную:
• длину волны (частоту)
Характеристики волн:
Частота ν (обратна периоду
Т)
Фаза θ
Ориентация плоскости в
которой осуществляются
колебания
Длина волны λ
Энергия кванта Е
6.
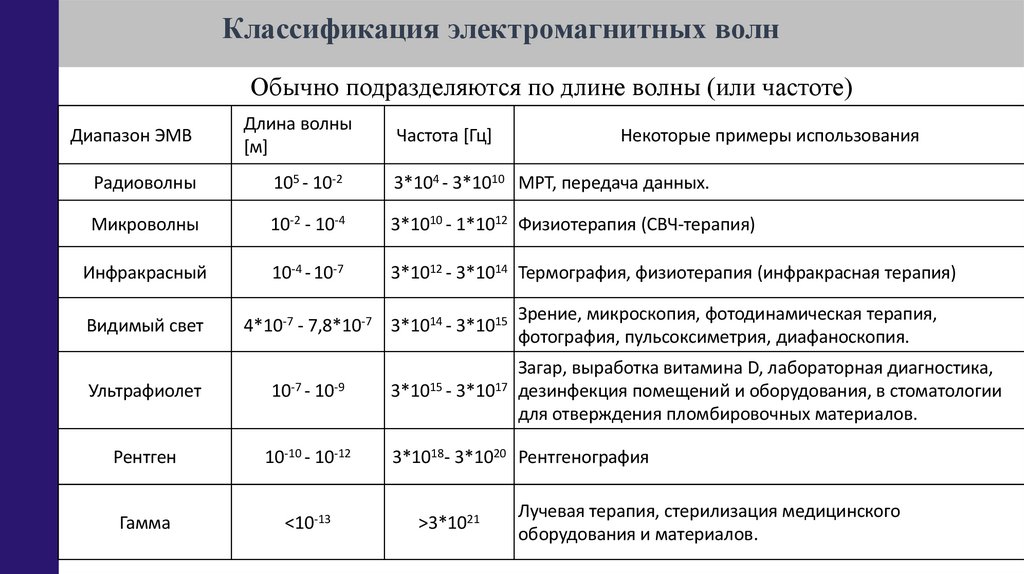
Классификация электромагнитных волнОбычно подразделяются по длине волны (или частоте)
Диапазон ЭМВ
Длина волны
[м]
Радиоволны
105 - 10-2
3*104 - 3*1010 МРТ, передача данных.
Микроволны
10-2 - 10-4
3*1010 - 1*1012 Физиотерапия (СВЧ-терапия)
Инфракрасный
10-4 - 10-7
3*1012 - 3*1014 Термография, физиотерапия (инфракрасная терапия)
Видимый свет
Частота [Гц]
4*10-7 - 7,8*10-7 3*1014 - 3*1015
Некоторые примеры использования
Зрение, микроскопия, фотодинамическая терапия,
фотография, пульсоксиметрия, диафаноскопия.
Ультрафиолет
10-7 - 10-9
Загар, выработка витамина D, лабораторная диагностика,
3*1015 - 3*1017 дезинфекция помещений и оборудования, в стоматологии
для отверждения пломбировочных материалов.
Рентген
10-10 - 10-12
3*1018- 3*1020 Рентгенография
Гамма
<10-13
>3*1021
Лучевая терапия, стерилизация медицинского
оборудования и материалов.
7.
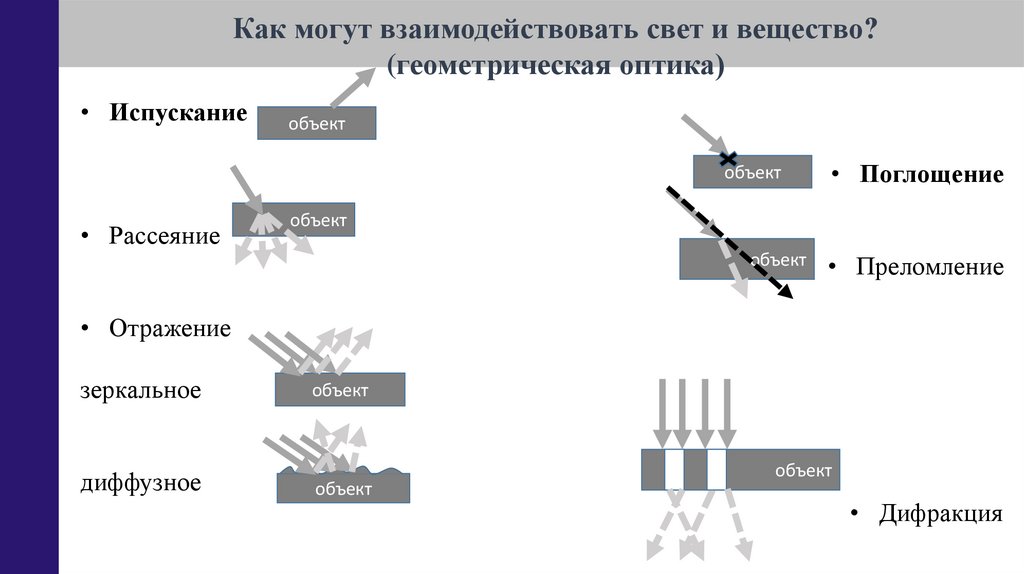
Как могут взаимодействовать свет и вещество?(геометрическая оптика)
• Испускание
объект
объект
• Рассеяние
• Поглощение
объект
объект
• Преломление
• Отражение
зеркальное
диффузное
объект
объект
объект
• Дифракция
8.
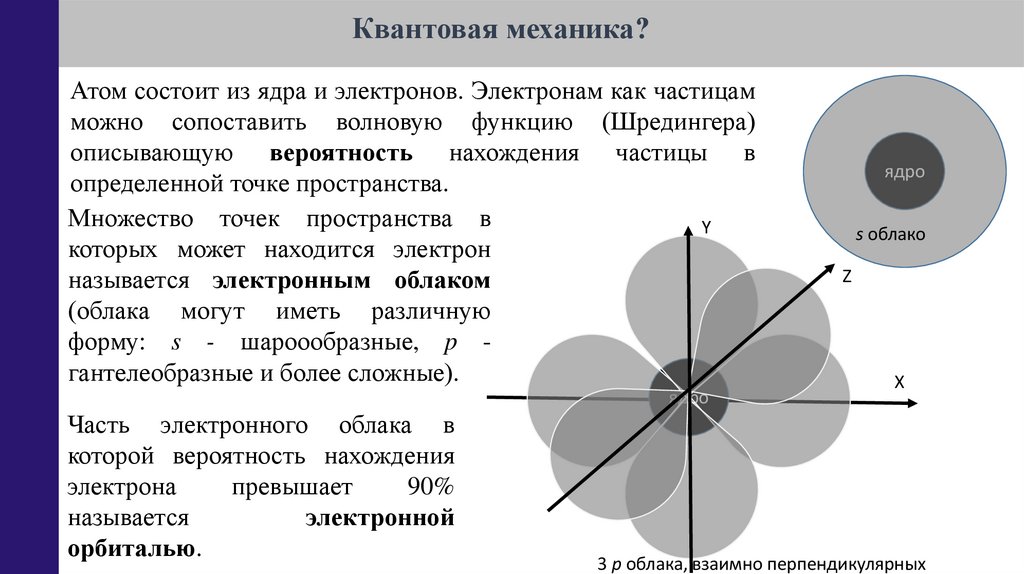
Квантовая механика?Атом состоит из ядра и электронов. Электронам как частицам
можно сопоставить волновую функцию (Шредингера)
описывающую вероятность нахождения частицы в
определенной точке пространства.
Множество точек пространства в
Y
которых может находится электрон
называется электронным облаком
(облака могут иметь различную
форму: s - шароообразные, p гантелеобразные и более сложные).
ядро
Часть электронного облака в
которой вероятность нахождения
электрона
превышает
90%
называется
электронной
орбиталью.
ядро
s облако
Z
Х
3 p облака, взаимно перпендикулярных
9.
Квантовая механика?Положение каждого электрона в атоме характеризуется набором квантовых
чисел:
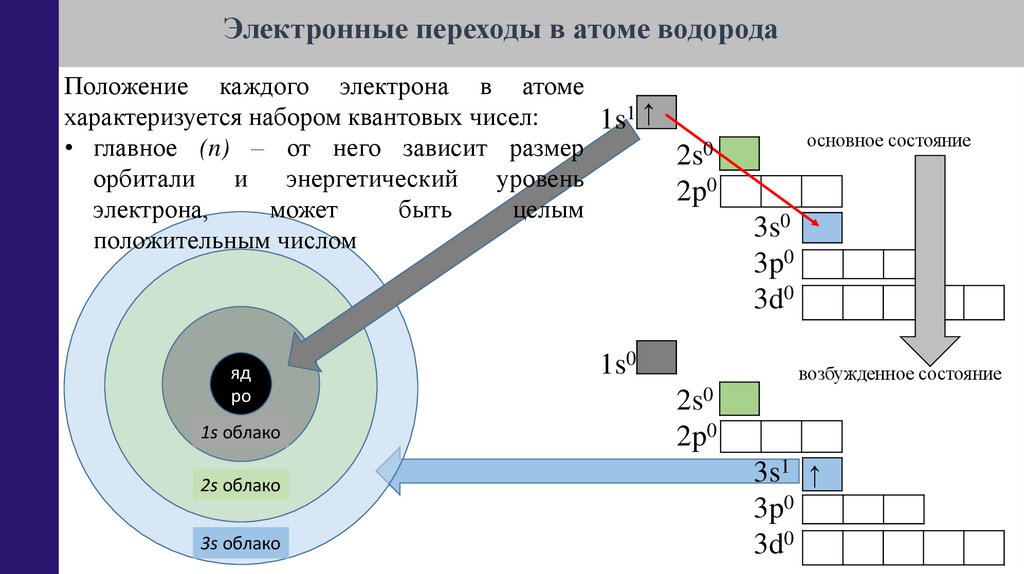
• главное (n) – от него зависит размер орбитали и энергетический уровень
электрона, может быть целым положительным числом
• орбитальное (l) – определяет форму орбитали (s, p, d, f), зависит от главного
и принимает значения от 0 до (n-1)
• магнитное (m) – пространственная ориентация орбитали в пространстве,
зависит от орбитального и принимает целые значения от - l до + l, включая
0, количество орбиталей на подуровне: 2 l +1.
• спиновое (s) – собственный момент вращения электрона, принимает
значения –½ либо +½.
Для каждого электрона набор этих чисел уникален.
10.
Квантовая механика?Заполнение электронных орбиталей выполняется в соответствии с
• правилом Клечковского (принцип ауфбау): от низких к высоким значениям энергии
• принципом исключения Паули: не может быть двух электронов с одинаковым
набором квантовых чисел
• правилом Хунда: в пределах одного подуровня электроны сначала заполняют
каждую орбиталь по одному (при этом имея максимальный суммарный спин),
только после заполнения всех вакантных мест формируются пары.
Максимальное число электронов на энергетическом уровне (электронной оболочке)
определяется по формуле 2n², где n это номер уровня (главное квантовое число).
Например водород H имеет только один электрон, значит сначала заполняется первый
слой (электронный уровень) и может содержать один подуровень в котором есть лишь
одна s орбиталь: 1s1 ↑
Гелий He имеет два электрона, оба на первом уровне, в составе s орбитали, но
обязательно с антипараллельными спинами: 1s2 ↑↓
Электроны расположенные на внешних оболочках атомов могут взаимодействовать
формируя химические связи (т.е. электронные пары от разных атомов).
11.
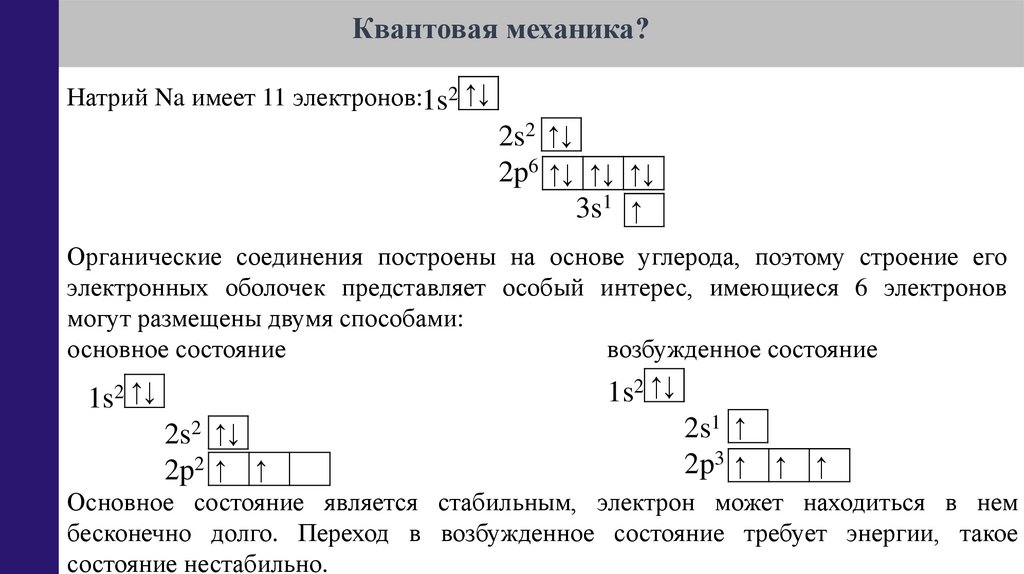
Квантовая механика?Натрий Na имеет 11 электронов:1s2 ↑↓
2s2 ↑↓
2p6 ↑↓ ↑↓ ↑↓
3s1 ↑
Органические соединения построены на основе углерода, поэтому строение его
электронных оболочек представляет особый интерес, имеющиеся 6 электронов
могут размещены двумя способами:
основное состояние
возбужденное состояние
2 ↑↓
1s2 ↑↓
1s
2s2 ↑↓
2p2 ↑ ↑
2s1 ↑
2p3 ↑ ↑ ↑
Основное состояние является стабильным, электрон может находиться в нем
бесконечно долго. Переход в возбужденное состояние требует энергии, такое
состояние нестабильно.
12.
А почему квантовая?В квантовой физике существует понятие корпускулярно-волнового дуализма:
электромагнитное излучение это:
• распространяющееся возмущение электромагнитного поля (волновая природа)
и
• поток дискретных частиц - фотонов (квантов энергии) (корпускулярная природа).
Фотоны - это пакеты энергии E=h*ν (уравнение Планка-Эйнштейна), которые
движутся со скоростью света.
Квант: минимальная неделимая порция некоторой физической величины (энергии).
Обладает свойствами: неделимость (нельзя получить половинку кванта) и
дискретностью (принимает одно из фиксированных значений).
Фотон – квант света (электромагнитного излучения).
Его энергия прямо пропорциональна частоте электромагнитного колебания.
При излучении: создается электромагнитная волна (или частица – фотон), которая
уносит из вещества порцию энергии (квант энергии).
При поглощении: электромагнитная волна приносит квант энергии в атом или
молекулу.
13.
Электронные переходыПоложение каждого электрона в атоме характеризуется набором квантовых чисел.
Для каждого электрона набор этих чисел уникален.
Набор квантовых чисел определяет запас энергии электрона.
При излучении создается электромагнитная волна (фотон), которая уносит из
вещества порцию энергии (квант энергии).
Общий запас энергии для электрона в основном состоянии минимален и не может
быть снижен: излучение кванта невозможно, но возможно поглощение кванта.
Квант обладает свойствами: неделимость (нельзя получить половинку кванта) и
дискретностью (принимает одно из фиксированных значений).
При поглощении: электромагнитная волна передает квант энергии электрону (в
составе атома или молекулы), который переходит в возбужденное (нестабильное)
состояние (обладает избытком энергии).
14.
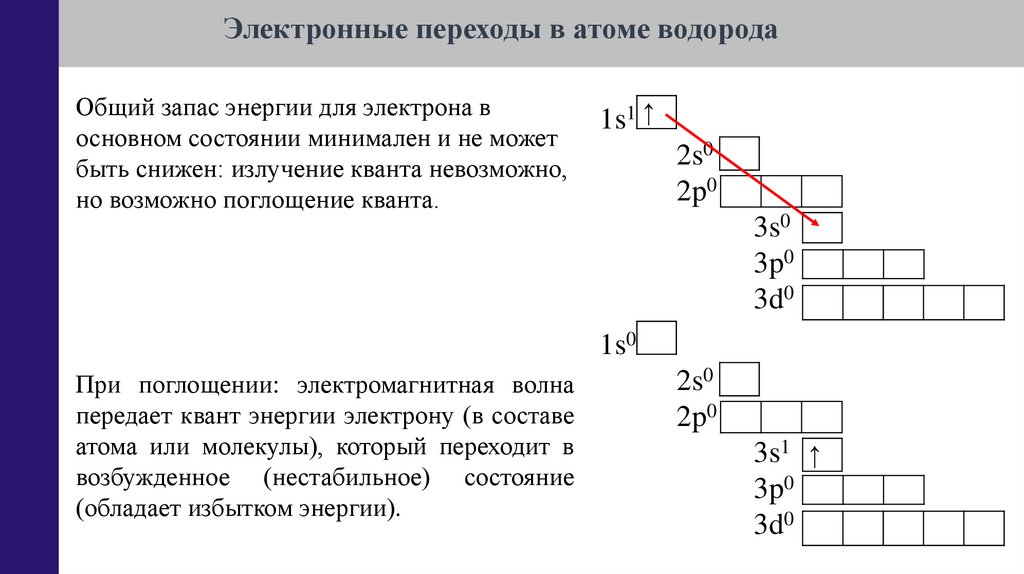
Электронные переходы в атоме водородаОбщий запас энергии для электрона в
основном состоянии минимален и не может
быть снижен: излучение кванта невозможно,
но возможно поглощение кванта.
1s1 ↑
2s0
2p0
3s0
3p0
3d0
1s0
При поглощении: электромагнитная волна
передает квант энергии электрону (в составе
атома или молекулы), который переходит в
возбужденное (нестабильное) состояние
(обладает избытком энергии).
2s0
2p0
3s1 ↑
3p0
3d0
15.
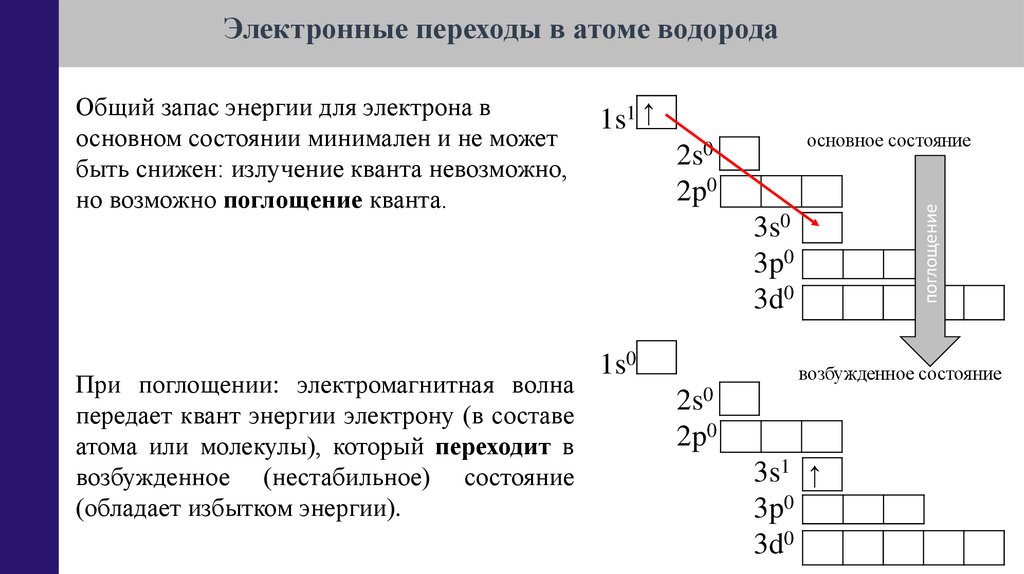
Электронные переходы в атоме водорода1s1 ↑
основное состояние
2s0
2p0
поглощение
Общий запас энергии для электрона в
основном состоянии минимален и не может
быть снижен: излучение кванта невозможно,
но возможно поглощение кванта.
3s0
3p0
3d0
При поглощении: электромагнитная волна
передает квант энергии электрону (в составе
атома или молекулы), который переходит в
возбужденное (нестабильное) состояние
(обладает избытком энергии).
1s0
возбужденное состояние
2s0
2p0
3s1 ↑
3p0
3d0
16.
Электронные переходы в атоме водородаПоложение каждого электрона в атоме
характеризуется набором квантовых чисел:
1s1 ↑
• главное (n) – от него зависит размер
2s0
орбитали
и энергетический уровень
2p0
электрона,
может
быть
целым
положительным числом
яд
ро
1s облако
2s облако
3s облако
1s0
основное состояние
3s0
3p0
3d0
возбужденное состояние
2s0
2p0
3s1 ↑
3p0
3d0
17.
Электронныепереходы в атоме водорода
Е
Е1
Е0
ядро
1s облако
2s облако
3s облако
поглощение
Е2
испускание
(энергия)
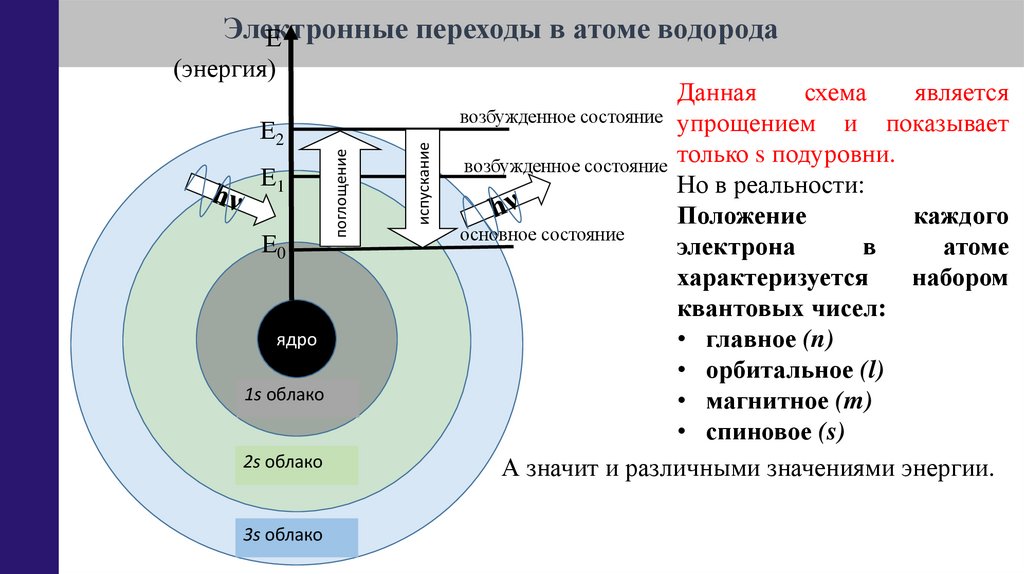
Данная
схема
является
возбужденное состояние упрощением и показывает
только s подуровни.
возбужденное состояние
Но в реальности:
Положение
каждого
основное состояние
электрона
в
атоме
характеризуется
набором
квантовых чисел:
• главное (n)
• орбитальное (l)
• магнитное (m)
• спиновое (s)
А значит и различными значениями энергии.
18.
Энергетические диаграммы электронных переходов в атомеводорода
Е0
испускание
поглощение
испускание
поглощение
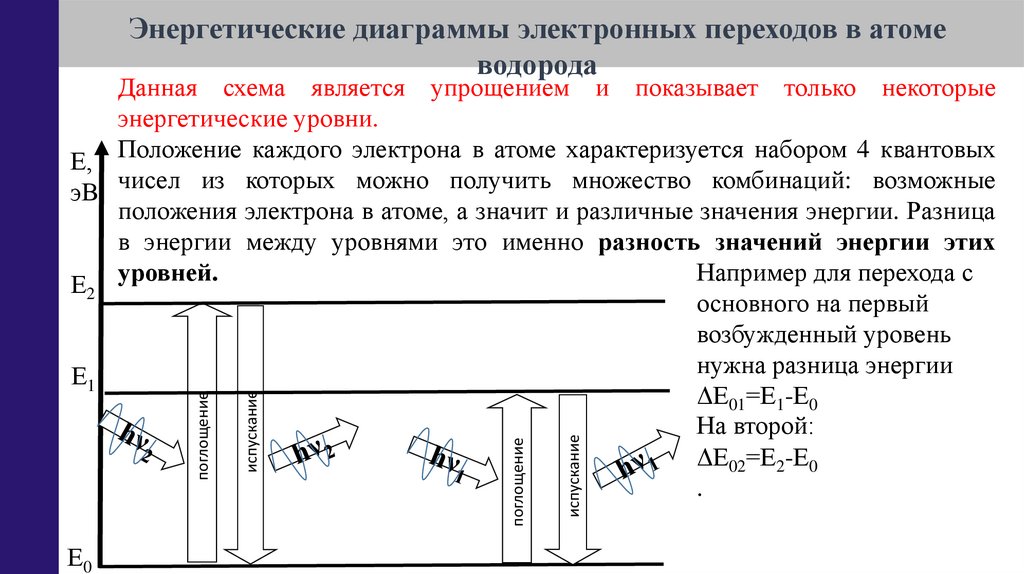
Данная схема является упрощением и показывает только некоторые
энергетические уровни.
Е, Положение каждого электрона в атоме характеризуется набором 4 квантовых
эВ чисел из которых можно получить множество комбинаций: возможные
положения электрона в атоме, а значит и различные значения энергии. Разница
в энергии между уровнями это именно разность значений энергии этих
Например для перехода с
Е2 уровней.
основного на первый
возбужденный уровень
нужна разница энергии
Е1
ΔЕ01=Е1-Е0
На второй:
ΔЕ02=Е2-Е0
.
19.
Энергетические диаграммы электронных переходов в атомеводорода
испускание
поглощение
испускание
поглощение
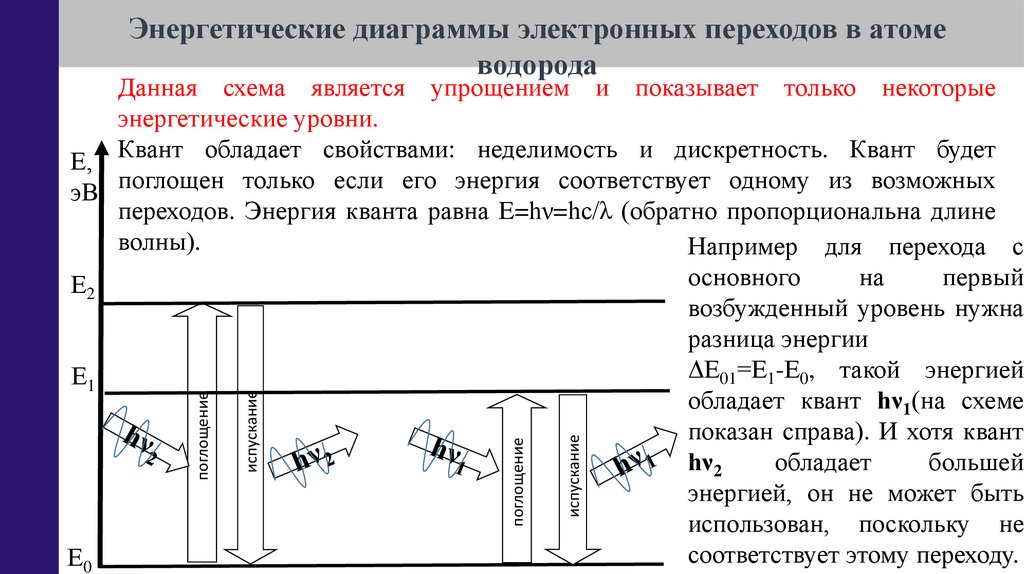
Данная схема является упрощением и показывает только некоторые
энергетические уровни.
Е, Квант обладает свойствами: неделимость и дискретность. Квант будет
эВ поглощен только если его энергия соответствует одному из возможных
переходов. Энергия кванта равна E=hν=hс/λ (обратно пропорциональна длине
волны).
Например для перехода с
основного
на
первый
Е2
возбужденный уровень нужна
разница энергии
ΔЕ01=Е1-Е0, такой энергией
Е1
обладает квант hν1(на схеме
показан справа). И хотя квант
hν2
обладает
большей
энергией, он не может быть
использован, поскольку не
соответствует этому переходу.
Е0
20.
Что такое испускание (излучение) ЭМВ??Процесс, посредством которого материя высвобождает энергию в форме
электромагнитного излучения. Это происходит, когда энергия внутри атомов, молекул
или частиц материала высвобождается после события возбуждения, вызывая
излучение электромагнитных волн в различных областях спектра,
Спонтанное излучение: когда атом, ион или молекула переходит из более высокого
энергетического состояния в более низкое (например, когда возбужденный электрон
падает на более низкую орбиталь), он спонтанно испускает фотон.
Вынужденное излучение: когда фотон определенной энергии взаимодействует с
возбужденным атомом или молекулой, он может вызвать высвобождение другого
фотона с той же фазой, направлением и энергией. Этот процесс является основой
работы лазера (усиление света путем вынужденного излучения).
Тепловое излучение: когда материал нагревается, его частицы вибрируют и
колеблются, испуская излучение. Количество и длина волны излучения зависят от
температуры. Например, объект, раскаленный докрасна или добела из-за тепла,
является обычным примером теплового излучения.
Длина волны и частота испускаемых электромагнитных волн зависят от разницы
21.
Что такое поглощение??процесс, посредством которого вещество (например, газы, жидкости или твердые
тела) получает энергию от электромагнитных волн (ЭМВ), проходящих через него
или взаимодействующих с ним.
Во время этого процесса энергия ЭМВ передается атомам, молекулам или частицам
внутри вещества, вызывая различные изменения, такие как:
Электронные переходы: электроны в веществе могут поглощать энергию и
переходить на более высокие энергетические уровни.
Колебательные и вращательные переходы: в молекулах поглощение энергии может
приводить к колебаниям или вращениям связей между атомами.
Тепловое возбуждение: поглощенная энергия также может увеличивать
кинетическую энергию частиц, повышая температуру материала.
Количество и способ поглощения зависят от частоты (или длины волны)
электромагнитной волны и свойств материала. Различные материалы поглощают
электромагнитные волны на разных частотах
22.
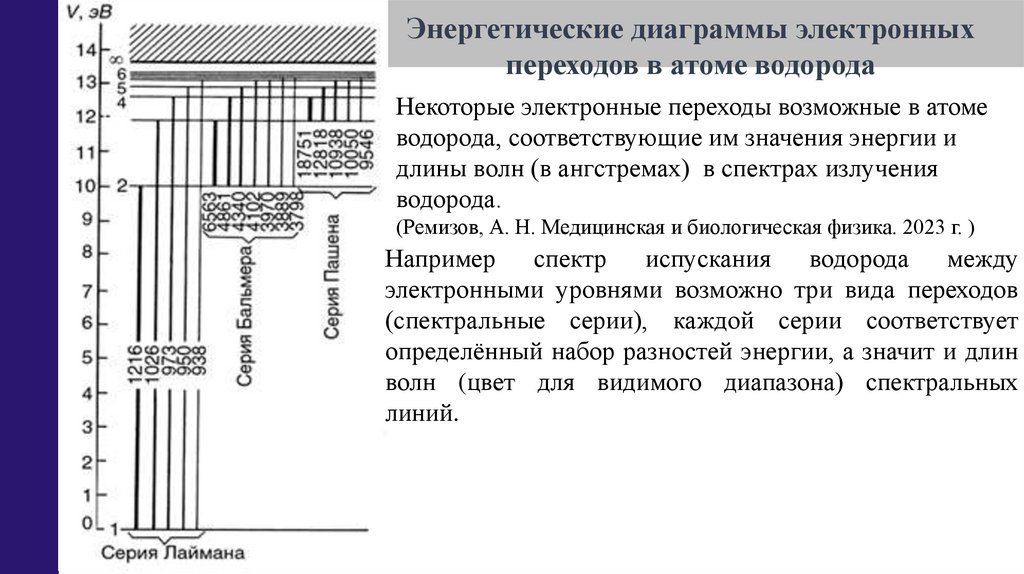
Энергетические диаграммы электронныхпереходов в атоме водорода
Некоторые электронные переходы возможные в атоме
водорода, соответствующие им значения энергии и
длины волн (в ангстремах) в спектрах излучения
водорода.
(Ремизов, А. Н. Медицинская и биологическая физика. 2023 г. )
Например спектр испускания водорода между
электронными уровнями возможно три вида переходов
(спектральные серии), каждой серии соответствует
определённый набор разностей энергии, а значит и длин
волн (цвет для видимого диапазона) спектральных
линий.
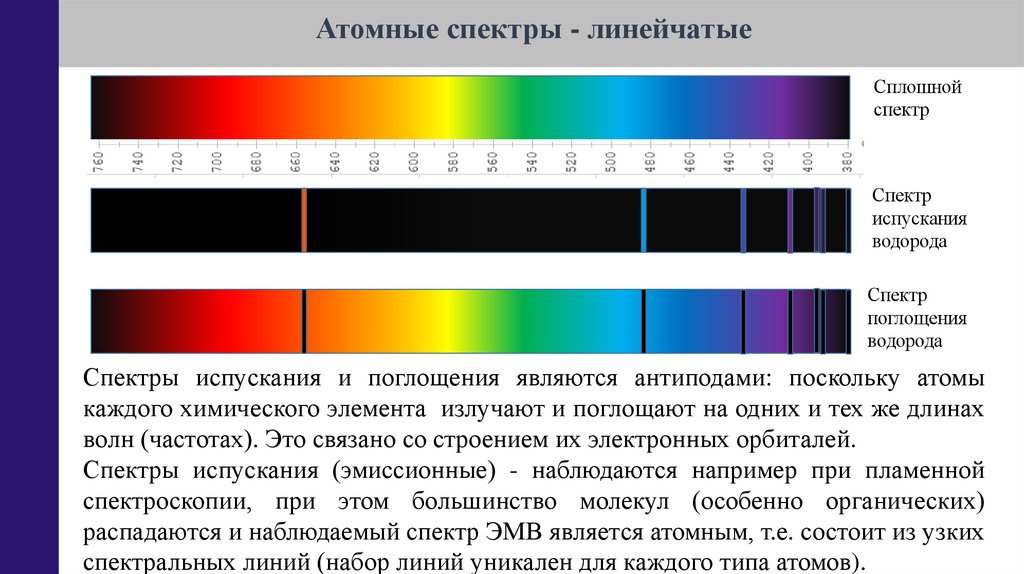
23.
Атомные спектры - линейчатыеСплошной
спектр
Спектр
испускания
водорода
Спектр
поглощения
водорода
Спектры испускания и поглощения являются антиподами: поскольку атомы
каждого химического элемента излучают и поглощают на одних и тех же длинах
волн (частотах). Это связано со строением их электронных орбиталей.
Спектры испускания (эмиссионные) - наблюдаются например при пламенной
спектроскопии, при этом большинство молекул (особенно органических)
распадаются и наблюдаемый спектр ЭМВ является атомным, т.е. состоит из узких
спектральных линий (набор линий уникален для каждого типа атомов).
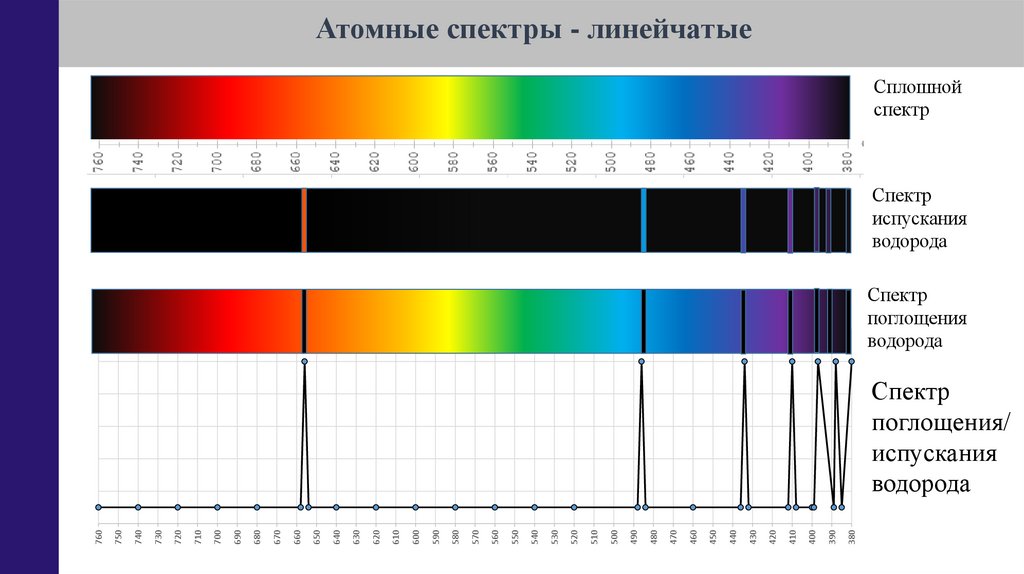
24.
Атомные спектры - линейчатыеСплошной
спектр
Спектр
испускания
водорода
Спектр
поглощения
водорода
380
390
400
410
420
430
440
450
460
470
480
490
500
510
520
530
540
550
560
570
580
590
600
610
620
630
640
650
660
670
680
690
700
710
720
730
740
750
760
Спектр
поглощения/
испускания
водорода
25.
Молекулярные спектрыМолекулярные спектры более сложные (чем
атомные) и не являются простой комбинацией
атомных спектров атомов составляющих
молекулу.
Молекулярные спектры испускания (особенно
органических молекул – нестабильных при
нагревании)
получить
практически
не
получится.
Молекулярные спектры поглощения - замеры
коэффициента поглощения данного вещества в
зависимости от длины волны. Представляются
в виде графика.
(Эйдельман, Е. Д. Физика с элементами биофизики.
2023г.)
26.
Спектральный анализ?По механизму получения спектра:
Эмиссионный (испускание) – подходит для простых, термостабильных веществ
Абсорбционнный (поглощение) – подходит для сложных органических молекул
По целям:
Количественный – по измеренной величине поглощения (при данной длине
волны) и известному спектру (для исследуемого вещества) поглощения
определить концентрацию вещества в растворе (закон Бугера-Ламберта-Бера)
Качественный – по измеренным величины поглощения (на всех длинах волн),
составить кривую (профиль) и сравнить ее с уже известными веществами для
идентификации неизвестного вещества в образце
27.
ФотобиологияФотобиология - наука, изучающая закономерности и механизмы действия света на
биологические системы различного уровня организации.
Фотомедицина как раздел фотобиологии не только рассматривает
фотобиологические процессы, протекающие в организме человека, но и
обеспечивает
формирование
теоретической
и
методической
основы
физиотерапевтических методов оптического воздействия и диагностического
инструментария.
Квантовая биофизика изучает электронную структуру биологически важных
молекул, электронные переходы в этих молекулах и пути превращения энергии
возбужденного состояния молекул в энергию продуктов.
28.
Фотобиологические процессыФотобиологическими называют процессы, начинающиеся с поглощения света
биологическим соединением и заканчивающиеся определенной физиологической реакцией
организма. Фотохимические и фотофизические процессы являются ключевыми в
жизнедеятельности биосистем. Подавляющее большинство фотобиологических реакций
относятся к эндергоническим, т.е. фотопродукты обладают большим запасом внутренней
энергии, чем исходные вещества. По биологическому результату эти процессы могут быть
разделены на две группы.
1. Физиологические - образующиеся фотопродукты необходимы для нормального
функционирования биосистемы, являются одним из звеньев обмена веществ и энергии.
Различают:
• энергетические (фотосинтез) - обеспечивают аккумулирование солнечной энергии;
• информационные (зрение, фототаксисы) - фотопродукты инициируют специализированные
механизмы, и организм получает информацию о состоянии внешней среды;
• фотобиосинтетические - фотохимические стадии синтеза некоторых органических
соединений (витамин D).
2. Деструктивно-модифицирующие - под действием света происходит повреждение
биомолекул и поражение клеток или организма (эритема, помутнение хрусталика и т.д.).
(по Есауленко, И. Э. Медицинская физика. Курс лекций. 2021)
29.
Стадии фотобиологических процессовСтадии фотобиологических процессов:
1) поглощение кванта света;
2) внутримолекулярные процессы превращения энергии;
3) межмолекулярный перенос энергии возбужденного состояния;
4) первичный фотохимический процесс;
5) темновые превращения первичных фотохимических продуктов
и образование стабильных соединений;
6) биохимические реакции с участием фотопродуктов;
7) общефизиологический ответ на действие света.
(по Есауленко, И. Э. Медицинская физика. Курс лекций. 2021)
30.
Хромофоры и ауксохромыХромофоры это части молекулы, «несущие» ей цвет.
Это некоторая группа или группы атомов внутри молекулы. При соединении атомов
в молекулу они соединяются химическими связями, которые являются
обобществленными электронными парами. Энергия перехода новых (молекулярных)
энергетических уровней будет равна энергии лишь некоторых квантов (например
видимого или ультрафиолетового излучения) что позволяет поглощать ЭМВ с
соответствующей длиной волны, что визуально воспринимается как «цвет».
Неподходящие ЭМВ будут отражаться или пропускаться.
Ауксохром это вспомогательная функциональная группа. Не поглощает ЭМВ, но
меняет конфигурацию электронных уровней в хромофорной группе, а значит и
определенные длины волн на которых хромофор способен поглощать ЭМВ
(батохромный сдвиг), либо усиливает поглощение (гиперхромный эффект), что
воспринимается как изменение цвета.
Типичные ауксохромы содержат: гидроксильную группу (-ОН), аминогруппа (-NH2),
карбоксильную группу (-COOH).
31.
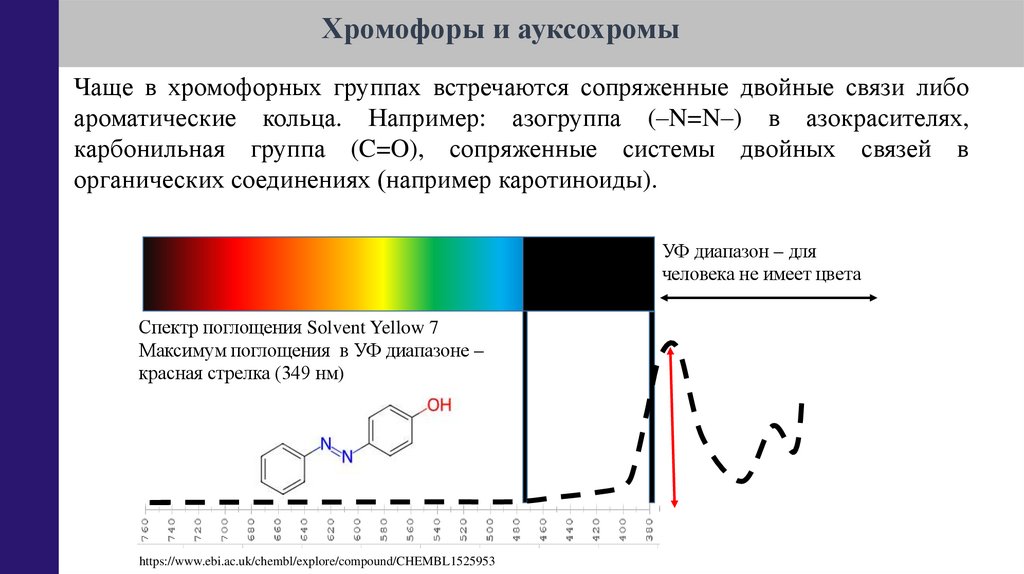
Хромофоры и ауксохромыЧаще в хромофорных группах встречаются сопряженные двойные связи либо
ароматические кольца. Например: азогруппа (–N=N–) в азокрасителях,
карбонильная группа (C=O), сопряженные системы двойных связей в
органических соединениях (например каротиноиды).
УФ диапазон – для
человека не имеет цвета
Спектр поглощения Solvent Yellow 7
Максимум поглощения в УФ диапазоне –
красная стрелка (349 нм)
https://www.ebi.ac.uk/chembl/explore/compound/CHEMBL1525953
32.
Хромофоры биологически важных молекулЗависимость фотобиологического эффекта от длины волны действующего света
называется спектром фотобиологического действия.
1. λ≈190 нм - пептидные связи белковой молекулы (интенсивность полосы
увеличивается при нарушении пространственной организации молекулы);
2 . λ≈255-280 нм - серосодержащие аминокислоты (цистин, цистеин, метионин);
3 . λ≈260 нм - пуриновые и пиримидиновые основания нуклеотидов;
4 . λ≈280 нм - ароматические аминокислоты (триптофан, фенилаланин, тирозин);
5 . λ≈412 нм (полоса Соре) - порфиринсодержащие соединения (гемоглобин);
6 . λ≈500 нм - комплекс ретиналя и опсина (зрительный пигмент родопсин).
(по Есауленко, И. Э. Медицинская физика. Курс лекций. 2021)
Обратите внимание что большая часть хромофоров биологически важных
молекул поглощает в УФ части спектра, и следовательно не видна глазом.
33.
Фотодинамическая терапия (ФДТ)Вещества повышающие чувствительность клеток и тканей к ЭМВ называются
фотосенсибилизаторами. Могут как сами поглощать ЭМВ и изменяться для
реализации эффекта (1 тип), либо после поглощения передавать полученную
энергию молекулярному кислороду, переводя его в одну из активных форм
кислорода (2 тип). Без поглощения ЭМВ никакие эффекты фотосенсибилизатора
не наступают.
Например могут использоваться для терапии некоторых видов опухолей:
сначала фотосенсибилизатор добавляется в опухолевую ткань, а после
накопления в опухолевых клетках активируется ЭМВ с соответствующей длиной
волны. Запускается фотохимическая реакция ведущая к гибели только клеток на
которые было направлено излучение.
Похожим образом можно уничтожать бактериальные клетки, даже устойчивые
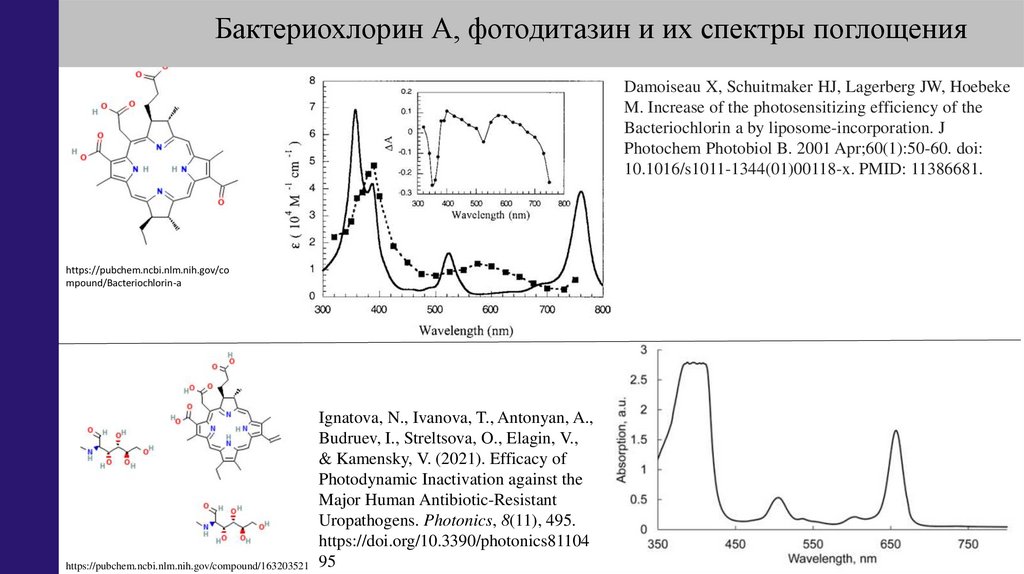
к антибиотикам, используются например бактериохлорин А, фотодитазин.
Однако этот метод работает лишь для поверхностно расположенных объектов.
34.
Бактериохлорин А, фотодитазин и их спектры поглощенияDamoiseau X, Schuitmaker HJ, Lagerberg JW, Hoebeke
M. Increase of the photosensitizing efficiency of the
Bacteriochlorin a by liposome-incorporation. J
Photochem Photobiol B. 2001 Apr;60(1):50-60. doi:
10.1016/s1011-1344(01)00118-x. PMID: 11386681.
https://pubchem.ncbi.nlm.nih.gov/co
mpound/Bacteriochlorin-a
Ignatova, N., Ivanova, T., Antonyan, A.,
Budruev, I., Streltsova, O., Elagin, V.,
& Kamensky, V. (2021). Efficacy of
Photodynamic Inactivation against the
Major Human Antibiotic-Resistant
Uropathogens. Photonics, 8(11), 495.
https://doi.org/10.3390/photonics81104
https://pubchem.ncbi.nlm.nih.gov/compound/163203521 95
35.
Лазерное излучениеВ лазерах для подачи энергии может использоваться входящее излучение с энергией
кванта - hν (оптическая накачка).
Е, эВ
Этап 2: Затем последующие
кванты hν вызывают
индуцированное излучение, hν
т.е. каждый квант вызывает
переход одного электрона на
основной уровень и
испускание еще одного,
точно такого же кванта.
индуцированное излучение
Этап 1: при поглощении
квантов hν число электронов
на возбужденном уровне Е1 hν
растет – создается инверсная
заселенность, т.е. на более
высоком энергетическом
уровне находится множество
электронов, хотя должно быть
Е0 крайне мало.
поглощение
Е1
hν
hν
36.
Свойства лазерного излучения. Применение ВИЛИСвойства лазерного излучения:
• Монохроматичность (у всех квантов одинаковая частота/энергия)
• Когерентность (у всех квантов одинаковая фаза колебания)
• Низкая расходимость излучения (узость пучка)
• Высокая степень поляризации
Высоко Интенсивное Лазерное Излучение (ВИЛИ)
при поглощении хромофорами в тканях тела приводит к нагреву и:
Фотоабляции (испарение)
Фотокоагуляции (сворачивание белков)
Эти явления используются для разрезания и соединения тканей, отбеливания
кожи и зубов.
37.
Что может происходить с энергией после поглощения?Переход в тепловую энергию (нагрев лазером – и например фотоабляция)
Тратится на изменение химической структуры поглотившей молекулы
(фотобиологические процессы, фотодинамическая терапия)
Повторное излучение (но уже кванта с меньшей энергией, а значит и частотой –
например поглощен УФ квант, а испущен – видимый свет, это закон Стокса)
После поглощения кванта энергии молекула находится в возбужденном
состоянии (нестабильно), из которого перейдет в основное состояние, а избыток
энергии может быть испущен в виде кванта энергии (т.е. создана ЭМВ). Такой
переход называется излучательным, а явление – люминесценция.
Свечение вещества не связано с нагревом, поэтому люминесценцию раньше
называли «холодным светом».
Люминофорами называются вещества способные к люминесценции (т.е.
молекулы имеют подходящую структуру энергетических уровней).
38.
ЛюминесценцияЛюминесценцию классифицируют по типу возбуждения, т.е. как доставляется
избыток энергии в молекулу:
фотолюминесценция (свечение вещества после поглощения ЭМВ видимого и
близких к нему диапазонов);
радиолюминесценция (после поглощения радиоактивного: α-, β-, γ-излучения);
рентгенолюминесценция (после поглощения рентгеновских лучей);
катодолюминесценция (после ударов разогнанных электронов);
электролюминесценция (при прохождении электрического тока либо помещении в
электрическое поле);
триболюминесценция (после деформации);
хемилюминесценция (при химических реакциях);
биолюминесценция (при протекании некоторых процессов в живой системе).
39.
Правило Вудворда-Хофмана - возможные переходы междуэнергетическими уровнями
Принцип сохранения орбитальной симметрии это правило Вудворда-Хофмана
(задает ограничения на протекания реакций).
Флуоресценция включает переходы между синглетными состояниями
(электронные спины спарены). Эти переходы обычно разрешены и происходят
быстро (в течение наносекунд).
Фосфоресценция включает переходы из синглетного состояния в триплетное
состояние (электронные спины не спарены), которые часто запрещены
правилами Вудворда-Хоффмана и как следствие могут происходить гораздо
медленнее (от миллисекунд до минут или дольше).
40.
Молекулярные спектрыМолекулярные спектры более сложные (чем
атомные) и не являются простой комбинацией
атомных спектров атомов составляющих
молекулу.
Молекулярные спектры испускания (особенно
органических молекул – нестабильных при
нагревании)
получить
практически
не
получится.
Молекулярные спектры поглощения - замеры
коэффициента поглощения данного вещества в
зависимости от длины волны. Представляются
в виде графика.
(Эйдельман, Е. Д. Физика с элементами биофизики.
2023г.)
41.
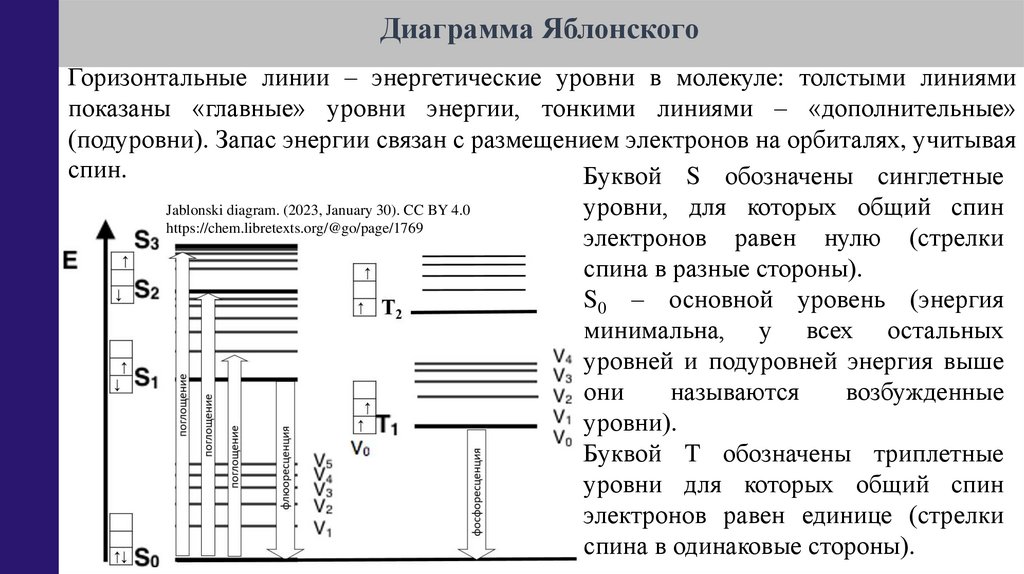
Диаграмма ЯблонскогоГоризонтальные линии – энергетические уровни в молекуле: толстыми линиями
показаны «главные» уровни энергии, тонкими линиями – «дополнительные»
(подуровни). Запас энергии связан с размещением электронов на орбиталях, учитывая
спин.
Буквой S обозначены синглетные
уровни, для которых общий спин
Jablonski diagram. (2023, January 30). CC BY 4.0
https://chem.libretexts.org/@go/page/1769
электронов равен нулю (стрелки
спина в разные стороны).
S0 – основной уровень (энергия
минимальна, у всех остальных
уровней и подуровней энергия выше
они
называются
возбужденные
уровни).
Буквой T обозначены триплетные
уровни для которых общий спин
электронов равен единице (стрелки
спина в одинаковые стороны).
42.
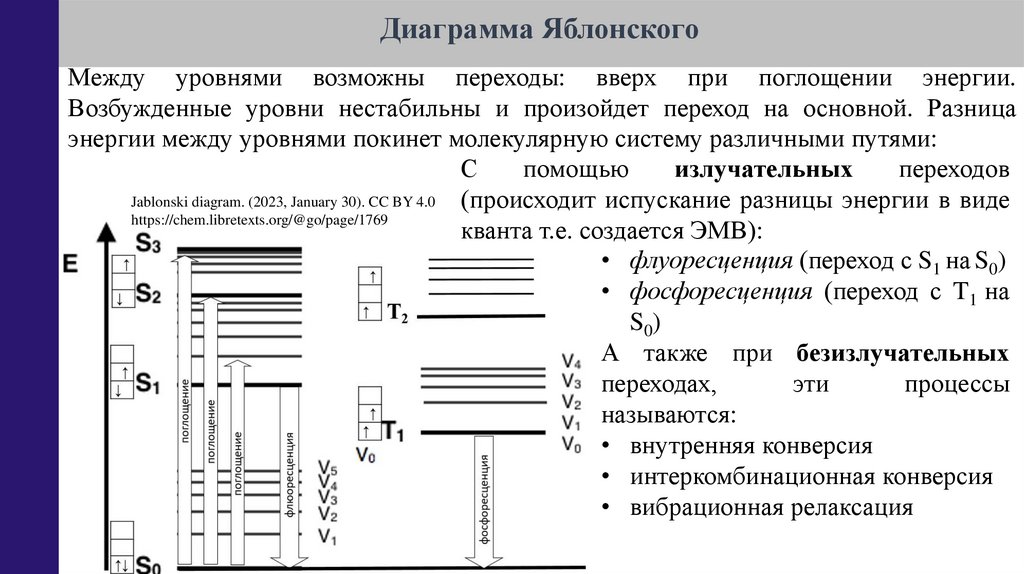
Диаграмма ЯблонскогоМежду уровнями возможны переходы: вверх при поглощении энергии.
Возбужденные уровни нестабильны и произойдет переход на основной. Разница
энергии между уровнями покинет молекулярную систему различными путями:
С
помощью
излучательных
переходов
Jablonski diagram. (2023, January 30). CC BY 4.0
(происходит испускание разницы энергии в виде
https://chem.libretexts.org/@go/page/1769
кванта т.е. создается ЭМВ):
• флуоресценция (переход с S1 на S0)
• фосфоресценция (переход с T1 на
S0)
А также при безизлучательных
переходах,
эти
процессы
называются:
• внутренняя конверсия
• интеркомбинационная конверсия
• вибрационная релаксация
43.
Диаграмма ЯблонскогоМожно заметить что энергия испускаемая при флуоресценции меньше чем энергии
было поглощено, а поскольку энергия кванта обратно пропорциональна длине
волны E=hс/λ, то длина волны испускаемого кванта будет больше (закон Стокса).
Jablonski diagram. (2023, January 30). CC BY 4.0
https://chem.libretexts.org/@go/page/1769
Вне зависимости от длины волны
поглощенного кванта излучение
происходит только с нижних
уровней, причем длительность
нахождения на нижнем триплетном
уровне
значительно
больше
(фософресценция
происходит
гораздо дольше).
44.
Нижний синглетный уровеньЗа счет внутренней конверсии электроны всегда оказываются на низшем
колебательном подуровне первого синглетного возбужденного состояния (S1).
Спины электронов не изменяются (антипараллельны), время жизни молекул в таком
состоянии составляет 10-8-10-9 с. Далее с определенной вероятностью могут
реализовываться следующие пути превращения энергии состояния S1:
1. В тепло: S1 → S0 (внутренняя конверсия).
2 . Испускание кванта флюоресценции: S1 → S0+hνфл.
3 . Фотохимическая реакция: S1 → продукт.
4 . Передача энергии возбуждения другой молекуле.
5 . Обращение спина электрона и переход молекулы в триплетное возбужденное
состояние: S1 → Т1 (интеркомбинационная конверсия).
45.
Нижний триплетный уровеньСпины электронов в состоянии Т1 и S0 одинаковы, поэтому переход в основное
состояние запрещен и время жизни молекулы в Т1 значительно больше - 10-4-10 с.
Из триплетного состояния возможны следующие пути реализации энергии:
• безызлучательный переход с обращением спина электрона: Т1 → S0;
• испускание кванта фосфоресценции: Т1 → S0+hν;
• фотохимическая реакция: Т1 → продукт;
• передача энергии возбуждения другой молекуле.
46.
Закон СтоксаЗакон Стокса - спектр люминесценции сдвинут в длинноволновую область
относительно спектра поглощения того же вещества, поскольку средняя энергия
квантов люминесценции ниже средней энергии поглощенных квантов. Излучение
кванта люминесценции всегда происходит с нижнего колебательного подуровня
нижнего возбужденного состояния (S1 или T1) независимо от того, на каком
уровне находился электрон после возбуждения молекулы. Переход электрона на
нижний подуровень происходит за счет рассеивания части энергии в виде тепла
(q), поэтому квант люминесценции hνлюм имеет меньшую энергию и большую
длину волны, чем кванты возбуждающего света hνвозб.
hνвозб = hνлюм + q,
ν=c/λ,
λлюм > λвозб
47.
Правило КашиПравило Каши - форма спектра люминесценции не зависит от длины волны
возбуждения люминесценции, а определяется природой вещества. Спектр
фотолюминесценции по форме совпадает со спектрами других типов
люминесценции данного вида молекул, т. е. не зависит от способа возбуждения
молекулы.
Для фотолюминесценции вводится понятие квантового выхода (η) - отношение
числа излученных квантов (Nлюм) к числу поглощенных (Nвозб):
η= Nлюм/ Nвозб
Квантовый выход может принимать значения от 0 до 1, он отражает вероятность
протекания люминесценции относительно иных путей дезактивации
возбужденного состояния.
48.
закон ВавиловаСогласно закону Вавилова, квантовый выход фотолюминесценции постоянен в
широкой области длин волн возбуждающего света, следовательно, определяется
природой вещества.
Так, квантовый выход флуоресценции
триптофана ≈0,17 (в составе белков от 0,02 до 0,4);
тирозина ≈0,2;
фенилаланина ≈0,04;
дезоксирибонуклеиновой кислоты ≈10-4.
При этом необходимо учитывать, что при определенных условиях внешней среды
может увеличиться вероятность безызлучательных переходов, что приводит к
тушению люминесценции (повышение температуры, увеличение концентрации
люминофора, наличие примесей).
49.
Применение люминесценцииЯвление люминесценции нашло широкое применение в медицине и биологии:
1. Люминесцентные микроскопы применяются в гистологических, цитологических
исследованиях.
2. Иммунный анализ при помощи флуоресцентных меток, присоединенных к
антигену или антителу.
3. Исследование проницаемости гематоэнцефалического и гистогематического
барьеров по флуоресценции флуоресцеина.
4. В исследованиях энергетического состояния вещества, пространственной
структуры молекул, процессах миграции энергии.
5. Стимулированная хемилюминесценция клеток в присутствии люминола является
важным показателем функционального состояния фагоцитов, их способности к
генерации активных форм кислорода.
6. Для химического анализа веществ, обнаружения примесей (правило Каши).
7. При создании экранов электронных приборов (катодолюминесценция),
люминесцентных источников света с высоким коэффициентом полезного действия.
50.
Литература для подготовкиОсновная литература:
Ремизов, А. Н. Медицинская и биологическая физика : учебник/А. Н. Ремизов. - 4-е изд. , испр. и
перераб. - Москва : ГЭОТАР-Медиа, 2023.
• Глава 28. «Волновые свойства частиц. Элементы квантовой механики». Параграфы: 28.5-28.9
• Глава 29. «Излучение и поглощение энергии атомами и молекулами»
• Глава 22. «Лазеры. Радиоспектроскопия». Параграф: 30.1
• Параграф 32.4. «Биофизические основы действия ионизирующих излучений на организм»
https://www.studentlibrary.ru/book/ISBN9785970474983.html
51.
Литература для подготовкиДополнительно:
Есауленко, И. Э. Медицинская физика. Курс лекций : учебное пособие / Есауленко И. Э. , Дорохов
Е. В. [и др. ]. - Москва : ГЭОТАР-Медиа, 2021
• Лекция 6. ОСНОВЫ ФОТОБИОЛОГИИ
https://www.studentlibrary.ru/book/ISBN9785970460641.html
Эйдельман, Е. Д. Физика с элементами биофизики : учебник / Е. Д. Эйдельман. - 2-е изд., перераб. и
доп. - Москва : ГЭОТАР-Медиа, 2023.
Глава 14. «Оптика». Параграфы: 14.1, 14.1.1, 14.1.2, 14.1.3, 14.1.5
Глава 15. «Тепловое излучение. Понятие о квантах». Параграфы: 15.1, 15.2, 15.5, 15.6
Глава 16. «Спектры атомов и молекул». Параграфы: 16.1, 16.2, 16.3, 16.5, 16.6, 16.7
Глава 17. «Физические основы спектрального анализа». Параграфы: 17.4, 17.5.1 - 17.5.4,
https://www.studentlibrary.ru/book/ISBN9785970469071.html
«Флуоресцентные репортеры и их молекулярные репортажи». Пучков Е. и др.
https://biomolecula.ru/articles/fluorestsentnye-reportery-i-ikh-molekuliarnye-reportazhi
Jablonski diagram. (2023, January 30). https://chem.libretexts.org/@go/page/1769
































 Физика
Физика








