Похожие презентации:
Kimyoviy muvozanat termodinamikasi. Massalar ta’siri qonuni
1. Toshkent davlat tibbiyot universitati Termiz filiali Tibbiy va biologik kimyo kafedrasi Farmatsiya yo’nalishi
FIZIK VA KOLLOID KIMYO FANIMavzu:Kimyoviy muvozanat termodinamikasi. Massalar ta’siri qonuni. Muvozanat
konstantasi. Kimyoviy realsiyalarning izoterma tenglamasi. Fazali muvozanat. Fazali
muvozanat termodinamikasi. Bir va ikki komponentli sistemalar.
2. Mavzu: Mavzu:Kimyoviy muvozanat termodinamikasi. Massalar ta’siri qonuni. Muvozanat konstantasi. Kimyoviy realsiyalarning
izoterma tenglamasi. Fazali muvozanat. Fazali muvozanattermodinamikasi.
Bir va ikki komponentli sistemalar.
Reja:
Massalar ta’siri qonuni. Muvozanat konstantasi. Kimyoviy
reaksiyalarning izoterma reaksuyalari. Gomogen va geterogen
reaksiyalar uchun massalar ta’siri qonuni.
Kimyoviy muvozanat konstantasi vauni ifodalash usullari.
Kimyoviy muvozanatni siljitish. Le-Shatele prinsipi.
Kimyoviy muvozanat konstantasini termodinamik kattaliklar
jadvalidan foydalanib hisoblash.
Fazali muvozanat termodinamikasi. Bir va ikki komponentli
sistemelar. Gibssning fazalar qoidasi.
3. Sistemaning barcha termodinamik parametrlarini o‘zaro bog‘lab turuvchi birgina umumiy differensial tenglamadan kelib chiqadigan
natijalar tahlilitermodinamikaning matematik apparati yordamida amalga oshiriladi. Bu
tenglama Gibbsning fundamental tenglamasi deb ataladi. Ammo, ushbu
umumiy tenglamani yozish uchun, avvalambor, tajribada o‘lchab
bo‘lmaydigan ikkita juda ham muhim kattalik – “energiya” va “entropiya”
tushunchalarini kiritishimiz shart. Buni termodinamikaning birinchi va
ikkinchi qonunlari yordamida amalga oshirishimiz mumkin. Nazariyani tuzish
uchun termodinamikaning qonunlaridan tashqari, qo‘shimcha isbotlarsiz,
apriori
ravishda
qabul
qilinadigan
qator
farazlardan
foydalaniladi. Avvalambor, sistemaning termodinamik muvozanati haqidagi
postulat kiritiladi.
4.
Ushbu postulat bo‘yicha sistemaning tashqi parametrlari vaqto‘tishi bilan o‘zgarmasa, muvozanat o‘z-o‘zidan buzilmaydigan
holatga keladi. Ushbu holat statsionar (vaqtga bog‘liq
bo‘lmagan, lekin nomuvozanat) holat deyiladi. Klassik
termodinamika faqat muvozanat holatidagi sistemalarni
o‘rganadi. Statsionar sistemalarning nomuvozanat (qaytmas)
jarayonlar termodinamikasi usullarida ifodalanadi. Ikkinchi
postulat haroratning mavjudligi yoki termik muvozanat haqidagi
postulat bo‘lib, yuqorida ta’kidlaganimizdek, u
termodinamikaning nolinchi qonuni ham deyiladi. Termik
muvozanatda bo‘lgan sistemalar o‘zaro issiqlik almashmaydilar
va sistemaning umumlashgan kuchlari o‘zaro teng bo‘ladi.
Ushbu postulat bo‘yicha haroratni issiqlik almashinish jarayonlari
uchun umumlashgan kuch sifatida kiritishimiz mumkin. Nihoyat,
o‘rganilayotgan sistemaning barcha xossalari tashqi parametrlar,
harorat va sistema tarkibining bir qiymatli funksiyasidir
5.
6.
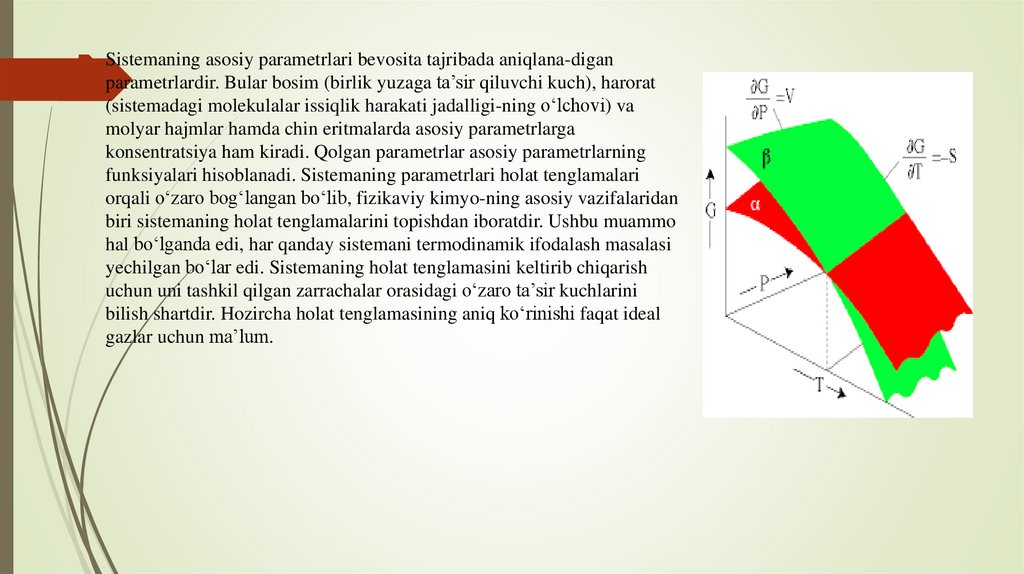
Sistemaning asosiy parametrlari bevosita tajribada aniqlana-diganparametrlardir. Bular bosim (birlik yuzaga ta’sir qiluvchi kuch), harorat
(sistemadagi molekulalar issiqlik harakati jadalligi-ning o‘lchovi) va
molyar hajmlar hamda chin eritmalarda asosiy parametrlarga
konsentratsiya ham kiradi. Qolgan parametrlar asosiy parametrlarning
funksiyalari hisoblanadi. Sistemaning parametrlari holat tenglamalari
orqali o‘zaro bog‘langan bo‘lib, fizikaviy kimyo-ning asosiy vazifalaridan
biri sistemaning holat tenglamalarini topishdan iboratdir. Ushbu muammo
hal bo‘lganda edi, har qanday sistemani termodinamik ifodalash masalasi
yechilgan bo‘lar edi. Sistemaning holat tenglamasini keltirib chiqarish
uchun uni tashkil qilgan zarrachalar orasidagi o‘zaro ta’sir kuchlarini
bilish shartdir. Hozircha holat tenglamasining aniq ko‘rinishi faqat ideal
gazlar uchun ma’lum.
7.
Agar holat tenglamasi ma’lum bo‘lsa, indivi-dual moddaningxossalarini ifodalash uchun ikkita parametrning qiymatlarini bilish
kifoya qiladi, uchinchisini holat tenglamasidan hisoblasa bo‘ladi.
Sistemaning parametrlari sistema ushbu holatga qanday yo‘l bilan
kelganiga bog‘liq bo‘lmaganligi sababli, ushbu kattaliklarning
cheksiz kichik o‘zgarishi dz to‘liq differensialdir (qolgan ikkita
parametrning cheksiz kichik o‘zgarishlari bo‘yicha). Ushbu
xususiyat termodinamikaga to‘liq differensiallar xossalariga
asoslangan matematik apparatni beradi. To‘liq differensiallarning
keyingi muhokamalarda keng ishlatiladigan ayrim xossalarini ko‘rib
chiqamiz
8.
9.
10.
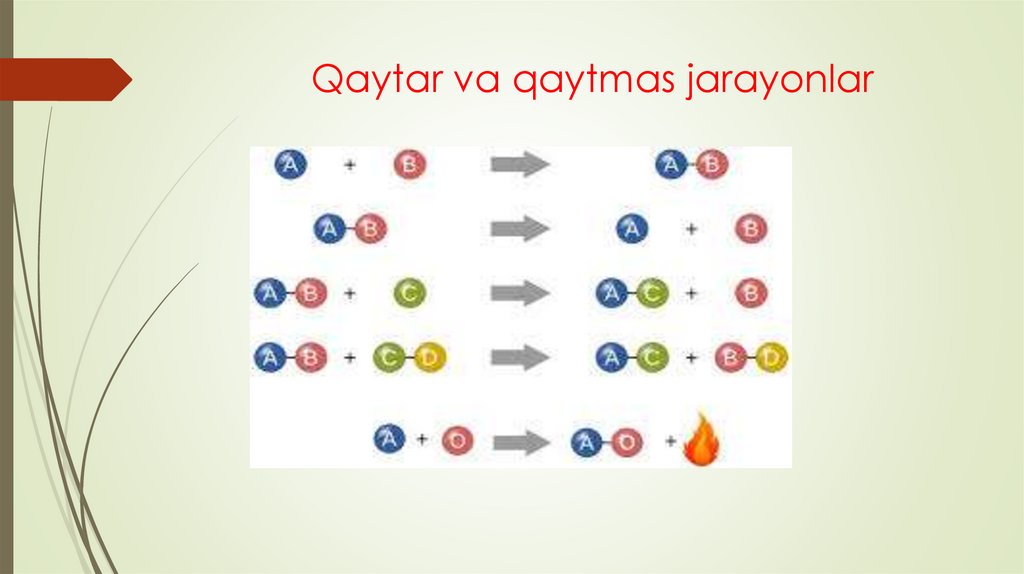
Qaytmas jarayonlar (fizikada) — muvozanat buzilgandasistemada oʻz-oʻzidan faqat bitta yoʻnalish boʻyicha sodir
boʻladigan fizik jarayonlar. Diffuziya, issiqlik oʻtkazuvchanlik,
gazning muayyan hajm boʻyicha kengayishi va boshqalar
hodisalar Qaytmas jarayonlarga misol boʻladi. Hamma
Qaytmas jarayonlar ketmaket muvozanatsiz holatlarning
uzluksiz qatoridan iborat. Sistemalarda Qaytmas jarayonlar
sodir boʻlgan boʻlsa, uni tashqi muhitda hech qanday
oʻzgarish yuzaga keltirmasdan boshlangʻich holatiga
qaytarish mumkin emas. Umuman, tabiatda sodir boʻladigan
hamma real jarayonlar Qaytmas jarayonlardan iborat. Berk
sistemalarda shunday Qaytmas jarayonlar sodir boʻlishi
mumkinki, natijada sistema entropiyasi faqat ortib boradi.
11. Qaytar va qaytmas jarayonlar
12.
13. KIMYOVIY REAKSIYALAR KINETEKASI
Kimyoviy reaksiyalarni tekshirishda ikki masala muhimahamiyatga ega:
1. Reaksivaning muvozanat qaror topgandagi unumi; ya’ni
kimyoviy reaksiyaning yo‘nalishi haqida va uni qanchalik chuqur
borishi haqida termodinamika jarayonlari o`rgatadi;
2. Reaksiva tezligi; ya’ni jarayon qancha vaqt davom etishini;
tezlikka ta’sir etuvchi omillarni esa kimyoviy kinetika o‘rgatadi.
Kimyoviy kinetika kimyoviy reaksiya tezligini, tezlikni turli
omillarga bog‘liqligini, reaksiyani kechish yo‘lini o‘rgatadi.
Ya’ni, reaksiyaga kirishuvchi reagentlar holati va ularni
konsentratsiyasini, qo‘shimcha moddalar ta’sirini, reaksiya sodir
bo‘layotgan idish o‘lchami va shaklini, harorat va turli nurlar
ta’sirini kimyoviy reaksiya tezligiga ta’sirini o‘rgatadi.
14.
Kimyoviy kinetikani bilish kimyoviy qurilmalar yasash, sanoatjarayonlarini jadallashtirish va avtomatlashtirishda zarur. Reaksiya
tezligini oshirish va reaksiyaga halal beradigan qo‘shimcha
reaksiyalarning tezligini kamaytirish sanoatning ishlab chiqarish
unumini oshirishga, xomashyodan to‘laroq foydalanishga, kam vaqt
ichida ko‘p mahsulot ishlab chiqarishga imkon beradi. Turli
dorilarni ta’sir kuchi ham ko‘p jihatdan organizmda sodir
bo‘ladigan biologik jarayonlar tezligiga bog‘liq.
Kimyoviy kinetika ikki bo`limdan iborat:
1) formal kinetika - reaksiya tezliklari va ularning matematik
ifodalarini beradi.
2) molekulyar kinetika - kimyoviy reaksiyalaming mexanizmini
o‘rganadi.
15.
16.
Kimyoviy reaksiya tezligi turlicha bo`lshi mumkin. Masalan,portlash reaksiyasi sekundning milliondan bir ulushi mobaynida
sodir bo`lsa, atmosferada temirning zanglashi oylar davomida,
yer ostida qazilma boyliklaming hosil bo‘lishi esa ko`p yillar
mobaynida davom etadi.
Kimyoviy
reaksiyalar xuddi darsliklarda tenglama tarzida
ko‘rsatilganidek, kamdan - kam bir bosqichda sodir bo‘ladi.
Kimyoviy reaksiya yozilganda, odatda, dastlabki va oxirgi holat
ko‘rsatiladi, xolos, ya’ni bu kimyoviy reaksiyaning matematik
balansining ramziy ifodasidir. Aslida, reaksiyalar bir qancha
oraliq bosqichlar orqali, ya’ni bir qator elementar jarayonlar
orqali kechadi. Bu jarayonlarni aniqlash oraliq mahsulotlarni
bilish murakkabligi tufayli qiyindir.
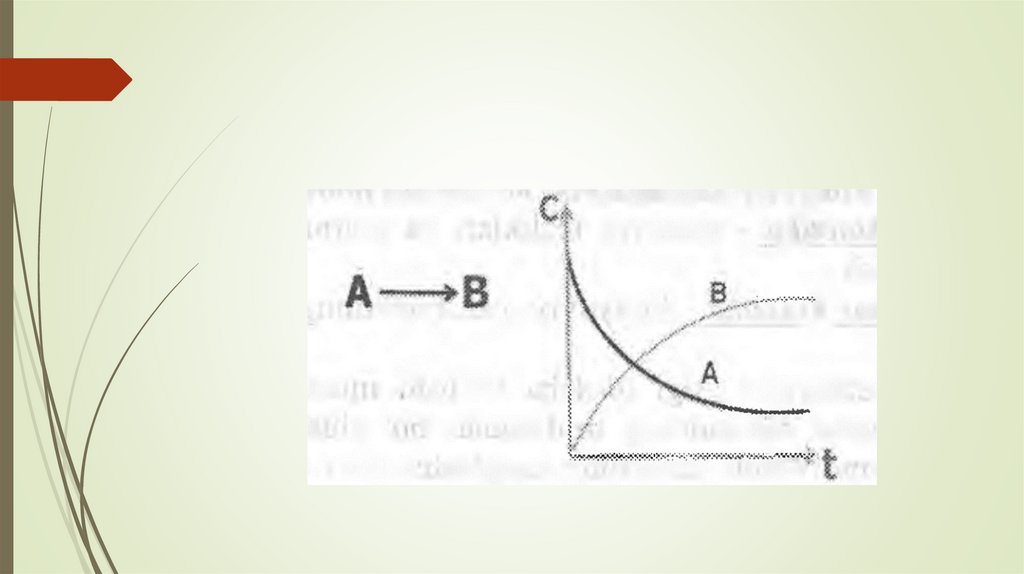
17. Kimyoviy reaksiya tezligi deb, vaqt va hajm birligi ichida reaksiyaga kirishuvchi moddalar konsentratsiyasining o`zgarishiga
aytiladi.bu yerda, v - reaksiyaning kuzatilgan tezligi, C konsentratsiya; t- vaqt. Kimyoviy reaksiya tezligi
vaqt funksiyasi bo‘lib, vaqt o‘tishi bilan uzluksiz
o‘zgarib boradi, ya’ni reagentlar (A) miqdori vaqt
oralig‘ida kamavib borsa. (B)-mahsulot esa ortib
boradi. Natijada reaksiya tezligi ham har xil vaqtda
turlicha bo‘ladi. Bu o‘zgarishlarning grafik ko‘rinishi.
18.
19.
Moddalar ekvivalent miqdorda reaksiyaga kirishgani uchun reaksiyatezligini reaksiyaga kirishuvchi moddalardan yoki reaksiya natijasida hosil
bo‘layotgan mahsulotlardan birortasining konsentratsiyasini vaqtga qarab
o‘zgarishi bilan ifodalash mumkin. Odatda qaysi moddaning miqdorini
aniq o‘lchash (analiz qilish) oson bo‘lsa, reaksiya tezligi ayni shu modda
konsentratsiyasining o‘zgarishi bilan o‘lchanadi.
Reaksiya tezligi (v) hamma vaqt musbat ishorali bo‘ladi. Shu
sababli, agar reaksiyaning tezligi dastlabki moddalardan
birortasining konsentratsiyasini o‘zgarishi orqali o‘lchansa dC/dt
oldiga manfiy (-), reaksiya mahsulotlaridan birining konsentratsiyasi
o‘zgarishi bilan o‘lchanganda esa musbat (+) ishora qo‘yiladi.
20.
Shunday qilib: agar moddaning konsentratsiyasi t1 dan t2 ga qadar o‘tganma’lum yaqt oralig‘ida AC = C2 - C1 ga qadar o‘zgarsa, unda reaksiyaning
o‘rtacha tezligi ∆t vaqt oralig‘ida quyidagiga teng bo'ladi:
Modda konsentratsiyasining cheksiz qisqa vaqt
ichida o‘zgarishi reaksiyaning haqiqiy tezligi deyiladi.
21.
Reaksiya tezligi moddalarning tabiatiga, haroratga,katalizatorga, konsentratsiya va boshqa omillarga bog‘liq.
Reaksiya tezligi bilan modda konsentratsiyasi orasidagi
bog‘lanish massalar ta’siri qonuni bilan ifoda etiladi. Bu qonunga 1867 yilda Guldberg va
Vaagelar ta’rif berishgan:
O`zgarmas haroratdagi kimyoviy reaksiya tezligi reaksiyaga
kirishayotgan moddalar konsentratsiyalari ko‘paytmasiga
to`g`ri proporsional.
Massalar ta’siri qonuniga muvofiq quyidagi reaksiya borayotgan bo‘lsa:
reaksiyaning tezligi quyidagicha qayd etiladi:
22.
Bu yerda, k - proporsionallik koeffitsiyenti bo‘lib, tezlik konstantasi debataladi va bu reaksiyaga kirishuvchi moddalar konsentratsiyalari 1 ga
teng bo`lgan vaqtdagi tezlik. Agar reaksiyaga kirishuvchi moddalar har
birining konsentratsiyalari birga teng bo‘lsa;
Tezlik konstantasining qiymati - reaksiyaga kirishuvchi
moddalarning tabiatiga, haroratga va katalizatorga,
erituvchining tabiatiga, pH bog‘ liq bolib, reaksiyaga
kirishuvchi moddalarning konsentratsiyasiga (yoki
partsial bosimga) bog‘liq emas. proporsionallik
koeffitsiyenti k ning qiymati turli reaksiyalar tezligini
solishtirish imkonini beradi.
23. REAKSIYA TARTIBI
Kimyoviy reaksiyalarning kinetik jihatdan sinflarga ajratilishini (klassifikatsiyasini) dastlabVant-Goff taklif qildi. Vant- Goff klassifikatsiyasida reaksiyaning normal borishiga halal
beruvchi va uni murakkablashtiruvchi ta’sirlar (reaksiya vaqtida
chiqadigan issiqlik, avtokataliz, idish devorlarining ta`siri va
boshqalar) hisobga olinmagan. Kimyoviy reaksiyalar kinetik jihatdan molekulyarligi va
tartibi bilan xarakterlanadi.
Kimyoviy reaksiya molekulyarligi deganda 1 ta elementar aktda to`qnashgan
molekulalar soni tushuniladi. Molekulyarligi
bo‘yicha:
- monomolekulyar;
- bimolekulyar;
- uchmolekulyar reaksiyalar uchraydi.
24.
Monomolekulyar reaksiyalarni sxematik ravishda quyidagicha ifodalash mumkin; A - yokiA – B + C. Bu xildagi reaksiyalarga ba`zi ajralish reaksiyalari, molekulalar ichida atomlarning
qayta gruppalanishi, izomerlanish reaksiyalari misol bo`la oladi:
va gaz fazada boradigan J2=2J reaksiyalari monomolekulyar
reaksiyalar jumlasidandir. Monomolekulyar reaksiyalarning tezligi:
25. KIMYOVIY REAKSIYA TEZLIGIGA HARORATNING TA`SIRI.
Reaksiya borayotganda harorat ko`tarilgan sari reaksiyaningtezligi orta boradi va reaksiyaning tezlik konstantasi o`zgaradi
hamda haroratning ta’siri sezilarli bo`ladi. Ko‘pchilik reaksiyalarda harorat
har 10°C ga ko‘tarilganda reaksiya tezligi 2-4 marta ortadi (Vant-Goff
qoidasi). Haroratning reaksiyaga ta’siri miqdoriy jihatdan Vant-GoffArrenius tenglamasi bilan ifodalanadi. Vant-Goffning izobarik tenglamasiga
ko‘ra:
bo`ladi. Bu yerda: K - muvozanat konstantasi; ∆H - issiqlik
effekti; R - gazlarning universal doimiysi.
26.
bo`lganligidan issiqlik effekti (∆H) ni E ga teng deb qabul qilsak:hosil bo`ladi, bunda c - integrallash konstantasi.
Agar c=lnk, qabul qilinsa, u holda
tenglama integrallanganda:
27.
k0 - eksponenta oldidagi son bo`lib, uning fizik ma`nosireaksiyaning aktivlanish energiyasi nolga teng bo`lgandagi tezlik konstantasini
qiymatini ifodalaydi. e - natural logarifm asosi. Tezlik konstantasini haroratga
bog`liqligini ifodalaydigan
tenglama Arremus-Vant Goff
qonunining matematik
ifodasi hisoblanadi.
Agar reaksiyaning tezlik konstantalari qiymatlari T1 va T2
haroratlarda topilgan bo`lsa, unda reaksiyaning aktivlanish
energiyasini hisoblab topish mumkin.
28.
tenglamani T1 dan T2 gacha integrallasak:E - aktivlanish energiyasi kimyoviy reaksiya sodir
bolishi
uchun zarur bo`lgan eng kichik qo`shimcha
energiyadir.
29.
Barcha kimyoviy reaksiyalarni ikkiga qaytar va qaytmas reaksiyalarga bo’lish mumkin. Faqat biryo’nalishda boradigan reaksiyalar qaytmas reaksiyalar deyiladi. Reaksiya natijasida ko’p
miqdorda issiqlik ajralib chiqsa, gaz modda, cho’kma yoki oz dissotsilanadigan moddalar hosil
bo’lsa, bunday reaksiyalar amalda qaytmas bo’ladi:
CH4 + 2O2 = CO2 + 2H2O + Q
Mg + 2HCl = MgCl2 + H2
AgNO3 + NaCl = AgCl + NaNO3
NaOH + HNO3 = NaNO3 + H2O
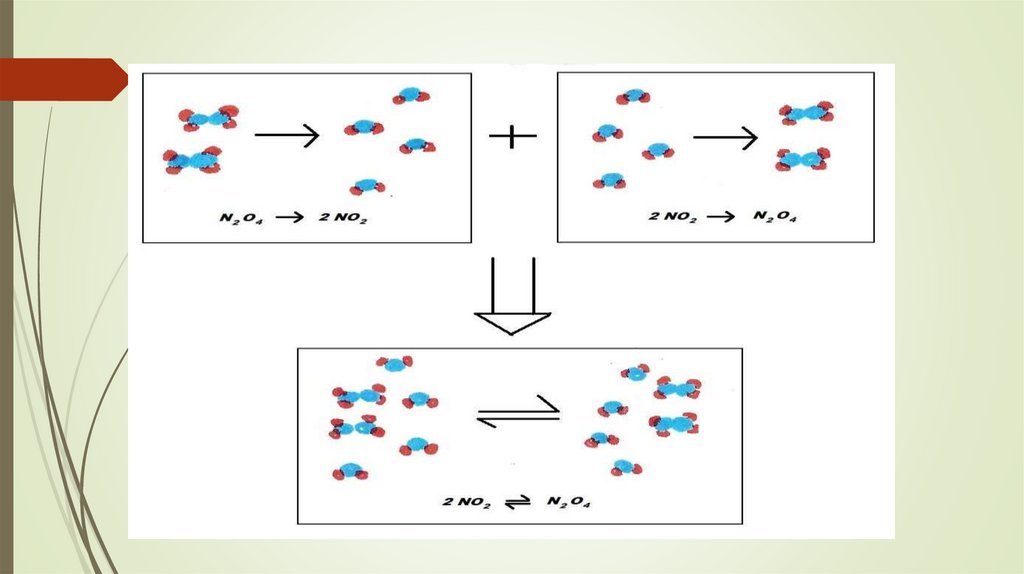
Bir vaqtning o’zida ikki qarama-qarshi yo’nalishda boradigan reaksiyalar qaytar reaksiyalar
deyiladi. Misol:
N2 + 3H2
«
2NH3
30.
Reaksiya boshlangan paytda to’g’ri reaksiyaning tezligi katta, teskari reaksiyaning tezligi kichik bo’ladi. Vaqt o’tishibilan to’g’ri reaksiyaning tezligi kamayib teskari reaksiyaning tezligi ortib boradi. Ma’lum vaqtdan so’ng har ikkala
reaksiya tezliklari tezlashadi.
aA + bB « cC + dD
reaksiya uchun tezlikning o’zgarishi grafigi
V1=k1[A]a*[B]b
V2=k2[C]c*[D]d
[C]c*[D]d
K=-----------
[A]a*[B]b
V1=V2
To’g’ri va teskari reaksiyalar tezliklari tenglashgan holat kimyoviy muvozanat deyiladi. Moddalarning muvozanat
vaqtidagi kontsentrasiyalari muvozanat kontsentrasiyasi deyiladi. Yuqoridagi ammiak hosil bo’lishi reaksiyasi
uchun to’g’ri va teskari reaktsiyalar
N2 + H2 « 2NH3
V1=k1[N2]1*[H2]3;
V2=k2[NH3]2
[NH3]2
K= --------------
[N2]1*[H2]
K=k1/k2
K - muvozanat konstantasi.
Muvozanat holatida reaksiya mahsulotlari kontsentrasiyalari ko’paytmasining
dastlabki moddalar kontsentratsiyalari ko’paytmasiga nisbati doimiy son bo’lib, muvozanat konstantasi deyiladi.
31.
Muvozanat konstantasi moddalarning tabiatiga, haroratga bog’liq bo’lib,kontsentratsiyaga, bosimga va katalizatorga bo’liq emas.
Geterogen reaksiyalarda qattiq moddalar kontsentrasiyasi muvozanat
konstantasi ifodasiga kirmaydi.
3Fe (k) +4H2O (g) = Fe3O4(k) +4H 2(g)
[H2]4
K
= --------
[H2O]4
Kimyoviy reaksiyalarning muvozanat konstantasi asosida izobarik
izotermik potensial hisoblanishi mumkin.
D Go= - RT ln K
Ko’rinib turibdiki , D Go qiymati kichik bo’lishi uchun K katta qiymatga ega
bo’lishi kerak.Demak, muvozanat jarayonida mahsolotlarning muvozanat
konsentrasiyalari ko’p bo’lsa izobar izotermik potensial kichik qiymatga ega
bo’ladi. D Go ning musbat qiymatlariga muvozanat holatining dastlabki
moddalarning konsentrasiyalari yuqori bo’lgan holati mos keladi.
Le-Shatele printsipi. Muvozanatda turgan sistemaga biror bir ta’sir
ko’rsatilsa, muvozanat buziladi va ma’lum vaqtdan so’ng yangi muvozanat
qaror topadi. Bu jarayon muvozanatning siljishi deyiladi.
32.
33. Kimyoviy reaksiyalarning mexanizmi
Kimyoviy reaksiyalarning mexanizmiTa’sirlashuvchi moddalarning tabiatiga va sharoitga ko’ra kimyoviy
reaksiyalarda atomlar,molekulalar,radikallar va ionlar ishtirok etadi.
Erkin radikallar molekulalarning parchalanishidan hosil bo’lgan qismlardan iborat
bo’ladi. Masalan, *OH( H2Omolekulasining qismi), *NH2 ( NH3 molekulasining qismi), *HS
(H2S dan hosil bo’lgan), Erkin radikallarga erkin atomlar ham kiradi.
Erkin ragikallarning reaksion qobiliyati juda yuqori , lekin ular ishtirok etadigan
reaksiyalarning aktivlanish energiyasi kichik(O-40 kJ/mol).
Erkin radikallar hosil bo’lishi qizdirish, yoritish, yadroviy nurlanish,mexanik ta’sirlar hamda
elektr razryadlari ta’siri natijasida yuzaga keladi.
Ionlar ishtirokida ketadigan reaksiyalarning aktivlanish energiyasi 0-80 kJ/mol ni tashkil
etadi.
Molekulalar ishtirokida ketadigan reaksiyalarning faollanish energiyasi juda yuqori
bo’ladi.Masalan, HJ hosil bo’lish reaksiyasining aktivlanish energiyasi 150 kj/mol ga teng.
34. Le Shatelye prinsipi
Har qanday muvozanat holatidagi sistemaga tashqi omillar (reaksiyada qatnashuvchi moddalarkonsentratsiyasi, gazlar uchun tashqi bosim, temperatura) ta’siri natijasida muvozanat o ‘zgarishi kuzatiladi.
Muvozanatning o‘zgarishini 1884-yilda Le Shatelye ta’rifladi:
Muvozanat holatda turgan sistemaga biror tashqi ta’sir o‘tkazilsa (temperatura , bosim yoki m oddalardan
birining konsentratsiyasi о‘zgartirilsa), muvozanat shu ta’sirni kamaytiruvchi reaksiya tomon siljiydi.
Sistema temperaturasi ko‘tarilganda muvozanat endotermik jarayon tomoniga, bosim orttirilganda hajmi
kamroq bo’lgan moddalar hosil bo‘ladigan reaksiya tomon siljiydi.
Le Shatelye prinsipiga asoslangan holda kimyoviy jarayonlarni boshqarish imkoniyatiga ega bo‘lamiz. Misol
uchun o‘ng tomonga boradigan ekzotermik (teskari tomonga esa endotermik) jarayonni olamiz:
N2+ 3H2 = 2NH3, ΔH°298 = -92 kJ
Xulosa
35.
36.
Temperatura orttirilganda muvozanat chap tomonga siljiydi, ya’niammiakning parchalanishiga olib keladigan reaksiya tezligi
ortadi. Temperatura pasayganda (sistema sovitilganda)
muvozanat ammiak sintezi (o‘ng tomon) ortadigan tomon siljiydi.
Xulosa qilib aytganda, temperatura ortganda muvozanat
endotermik reaksiya tomon, temperatura pasaytirilganda
ekzotermik jarayon tomon siljiydi.
Bosim o‘zgarishi bu sistema muvozanatiga ta’sir
ko‘rsatadi. Yopiq idishda o’zgarmas temperaturada
mahsulotlar kam hajm egallaydi, boshla- ng‘ich
moddalar esa ko‘proq hajm egallaydi.
Demak, reaksiya to’g‘ri tomonga borishi natijasida
sistemada bosim kamayadi, reaksiya teskari tomonga
borganda esa bosim ortadi. Reaksion hajmni siqilganda
muvozanat o‘ng tomonga siljiydi va aks holda, bosim
kamaytirilganda muvozanat chap tomonga siljiydi.
37.
Konsentratsiya o’zgarishining muvozanatga ta ’sirini ham Le Shatelyeprinsipi tushuntiradi. Agar boshlang‘ich moddalardan birining
konsentratsiyasi orttirilsa, shu modda ishtirokida o‘ng tomonga boradigan reaksiya tezligi ortadi, ya’ni qo‘shilgan modda konsentratsiyasini
kamaytirishga olib keladigan reaksiya tezligi teskari tomonga
boradigannikiga qaraganda kattaroq bo‘ladi, muvozanat o ‘ng tom
onga siljiydi.
Yuqorida ko‘rib o ‘tilgan omillarning muvozanatga ta’siri natijalaridan
amaliy xulosalar qilish mumkin. Bizning misolimizda ammiak unumini
orttirish uchun reaksiyani mumkin qadar past temperaturada va
boshlang‘ich moddalardan birining konsentratsiyasi tenglamadagi
stexiometrik nisbatlarga nisbatan kattaroq bo‘lgan sharoitda olib borish
yaxshi natijaga olib keladi. Lekin, H2 va N2 aralashmasining
temperaturasi kamaygan sari reaksiya tezligi ortavermaydi, past
temperaturada zarrachalar harakat tezligi kamayadi, aktiv zarrachalar
soni kamayadi, reaksiya tezligi ham kamayib ketadi. Shu sababli
temperaturani ma’lum darajagacha kamaytiriladi.
38.
Farmatsiyadagi ahamiyatiFarmatsiyada «mos kelmaslik» termini juda ko‗p ishlatiladi. Mos kelmaslik
deganda o‗zining dastlabki xossalarini ( fizik, kimyoviy, farmakodinamik)
o‗zgarishi va sifatini yomonlashishiga olib keladigan jarayon tushuniladi.
Holat diagrammalaridan foydalanib fizikaviy nomutanosiblikni(bu eftektik
nuqtada kuzatiladi) - kukunlarning nam tortib qolishi, emulsiyalarning
qavatlanishi; kimyoviy mos kelmaslik – moddalarning kimyoviy birikmalar
hosil qilishining oldini olish mumkin. Ba‘zi hollarda holat diagrammalari
dori shakllarini tayyorlashda qo‗llaniladi. Masalan: suppozitoriylar (
shamchalar) uchun asos tayyorlashda. Diagrammalar shamchalarning
ratsional tarkibini topib olishga yordam beradi. Bu asoslar 35-360C da
eriydigan va 320C dan pastda yumshamaydigan bo‗lishi kerak. Shu yo‗l
bilan 40% salomas va 60% metilsteriat; 80% parafin va 20% metilsteriat
tarkibli asoslar olingan. Dorivor moddalarning biologik ta‘sirini oshirishda
qo‗llaniladi. Yomon eriydigan dorivor moddalarning biologik ta‘siri
ularning dispersligini oshirish bilan ya‘ni, zarrachalarining o‗lchamini
kichraytirish bilan yaxshilanadi.
39.
Buning uchun yomon eriydigan dori moddani fiziologik inertyaxshi eriydigan modda bilan aralashtiriladi va termik tahlil usuli
orqali eftektik aralashma tarkibi topiladi. Bu aralashma tarkibiga
to’g’ri keladigan tarkib bo‗yicha aralashma tayyorlab,
suyuqlantiriladi va sovutiladi. Kristallanganda juda mayda
kristallar hosil bo‗ladi va ularning biologik ta‘siri kuchayadi. Shu
yo‗l bilan tiozolning biologik ta‘siri kuchaytirilgan. Uning fizologik
inert modda – mochevina bilan effektiv aralashmasi
tayyorlangan. Undan tashqari parchalanmay suyuqlanadigan
qattiq dori moddalar aralashmalarining tarkibini analiz qilishga
imkon
beradi.



































 Химия
Химия








