Похожие презентации:
Белки. Строение и функции белков. Аминокислоты
1. Лекция
Белки. Строение и функциибелков. Аминокислоты
2. Белки
Белки — это неразветвленные (линейные)гетерополимеры,
мономерами
(то
есть
структурными
единицами)
которых
являются аминокислоты.
Входящие в состав белков аминокислоты
имеют сходное, но не совсем одинаковое
строение:
3.
Аминокислоты— органические соединения, в
молекуле
которых
одновременно
содержатся карбоксильные (СООН) и аминные
(NH2) группы.
Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O) и азот (N).
Известны около 500 встречающихся в природе
аминокислот (хотя только 20 используются в
генетическом коде).
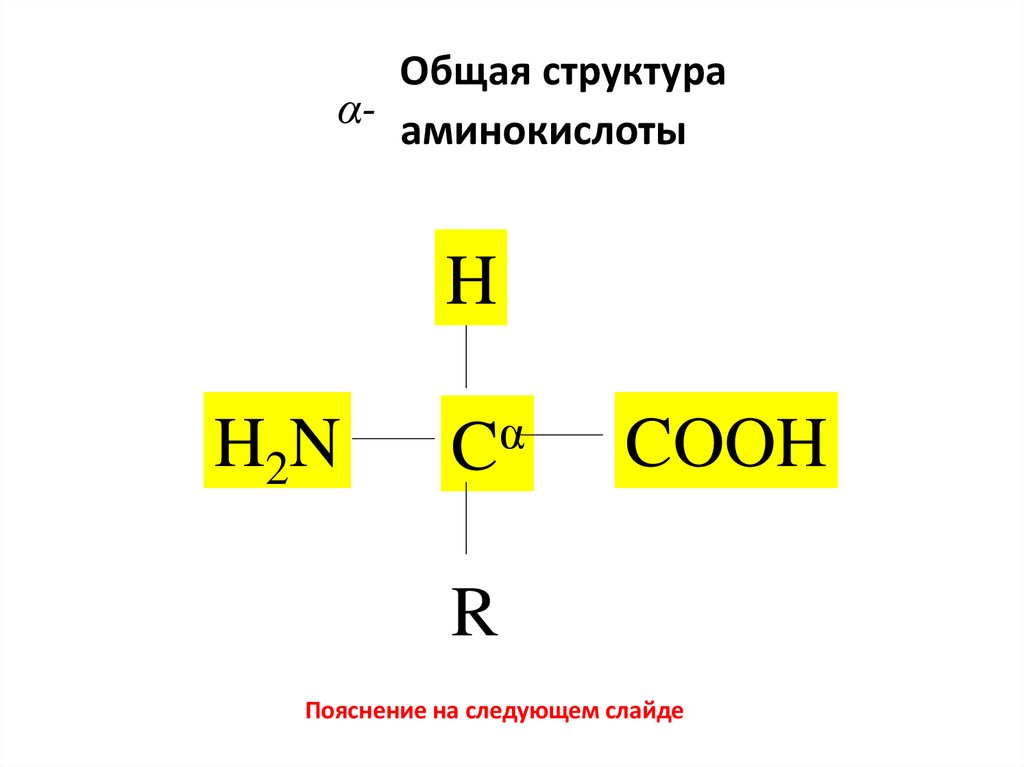
4. Общая структура α- аминокислоты
HH2N
α
C
COOH
R
Пояснение на следующем слайде
5.
Структура аминокислотыКак видно из формулы, молекула аминокислоты состоит из
двух частей. Та часть, которая на рисунке находится на желтом
фоне – предыдущий слайд (то есть все, кроме радикала — R),
одинакова у всех аминокислот, входящих в состав белков.
Эта общая часть содержит аминогруппу (–NH2)
и карбоксильную группу (–COOH), присоединенные к одному
и тому же атому углерода.
Такие аминокислоты, в которых аминогруппа присоединена
к тому же атому углерода (α-атому, согласно номенклатуре
карбоновых кислот), что и карбоксильная группа, называются αаминокислотами.
Та часть молекулы аминокислоты, которая изображена в
формуле в виде буквы R, называется боковым радикалом.
Боковой радикал у различных аминокислот имеет разную
структуру.
6.
В белках аминокислоты соединяются друг с другом посредствомковалентной амидной связи, которая называется пептидной:
(-СО-NH-),
R-CH-COOH
|
+
NH2
H2N-CH-COOH
|
----
R`
R-CH-CO--NH-CH-COOH
|
|
NH2
Кроме пептидной в молекуле белка присутствуют следующие:
1. Ковалентная связь:
дисульфидная
--S--S-2. Не ковалентные связи:
водородная
( -- СО.....NH2--) (--ОН.... ООС--)
ионная
-COO-...+NH3-неполярная связь
(-- R .... R--)
R`
7.
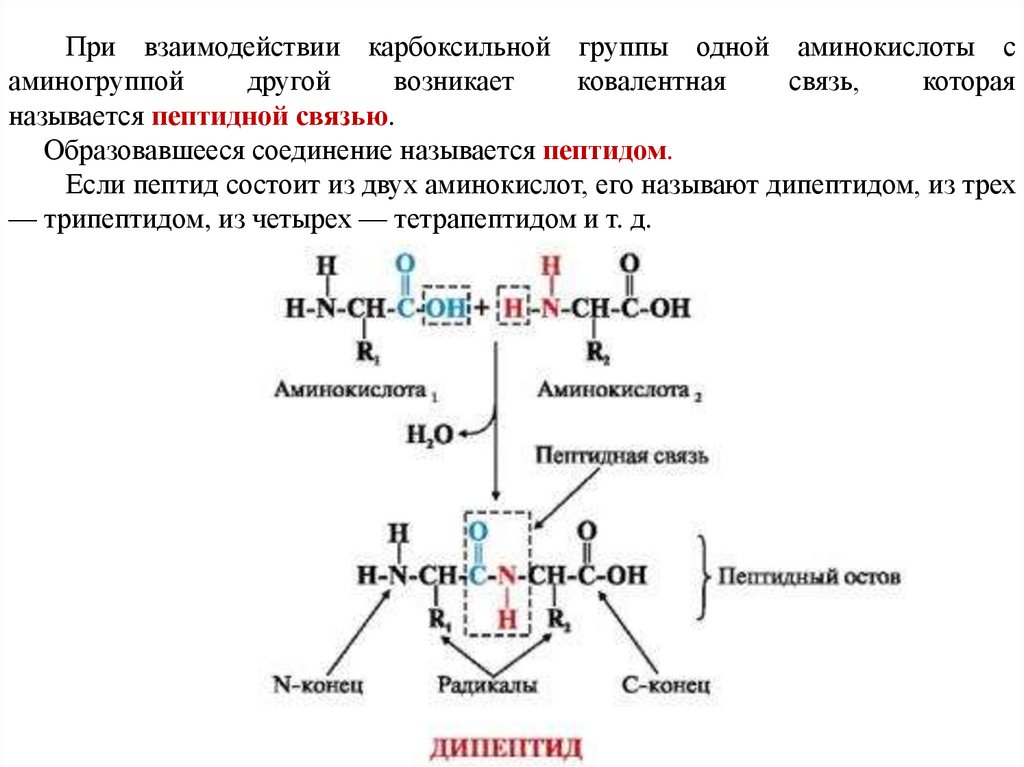
При взаимодействии карбоксильной группы одной аминокислоты саминогруппой
другой
возникает
ковалентная
связь,
которая
называется пептидной связью.
Образовавшееся соединение называется пептидом.
Если пептид состоит из двух аминокислот, его называют дипептидом, из трех
— трипептидом, из четырех — тетрапептидом и т. д.
8.
Классификация аминокислотПо функциональным группам
1)Алифатические:
*Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин
, лейцин
*Оксимоноаминокарбоновые: серин, треонин
*Моноаминодикарбоновые аспарагин, глутамин
* Диаминомонокарбоновые: лизин, аргинин
* Серосодержащие: цистеин, метионин
2)Ароматические: фенилаланин, тирозин, триптофан,
3)Гетероциклические: триптофан, гистидин
4)Иминокислоты: пролин
9.
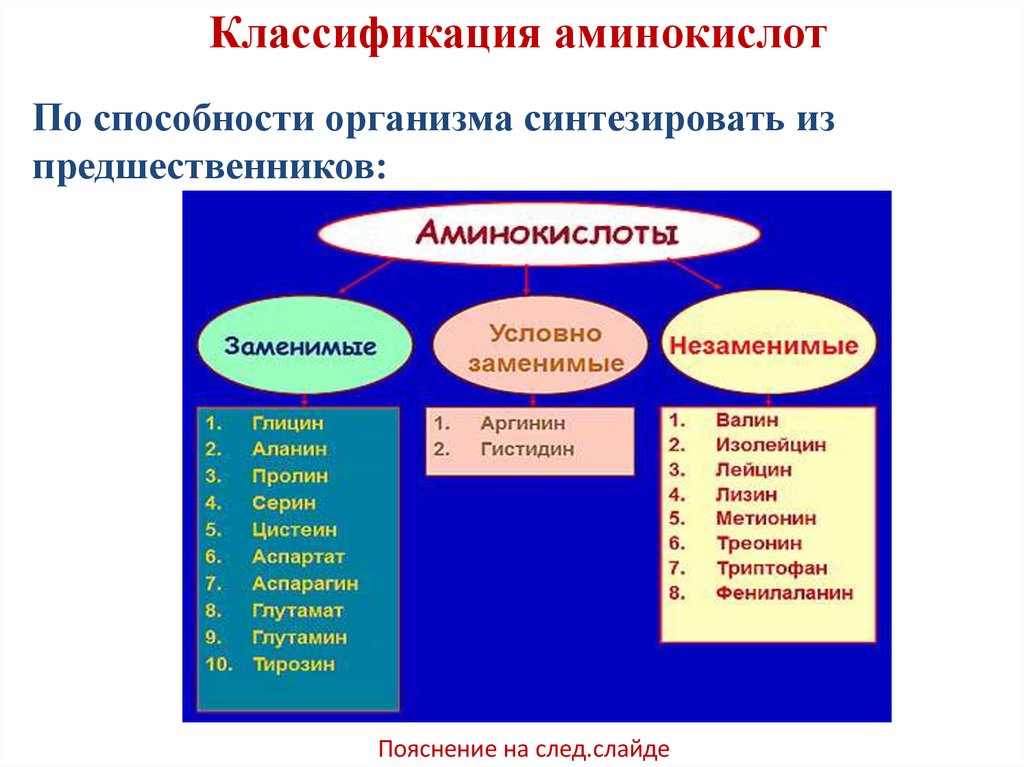
Классификация аминокислотПо способности организма синтезировать из
предшественников:
Пояснение на след.слайде
10.
Незаменимыеаминокислоты
—
необходимые аминокислоты, которые не могут быть
синтезированы в том или ином организме
(необходимо
поступление
незаменимых
аминокислот в организм с пищей)
Заменимые аминокислоты это те, которые
организм может синтезировать самостоятельно или
получить с продуктами питания.
В отдельную группу выделяют условнозаменимые аминокислоты – аргинин и гистидин
их
синтез
осуществляется
при
наличии
незаменимых
аминокислот.
При
недостатке
предшественников эти аминокислоты могут стать
незаменимыми.
11.
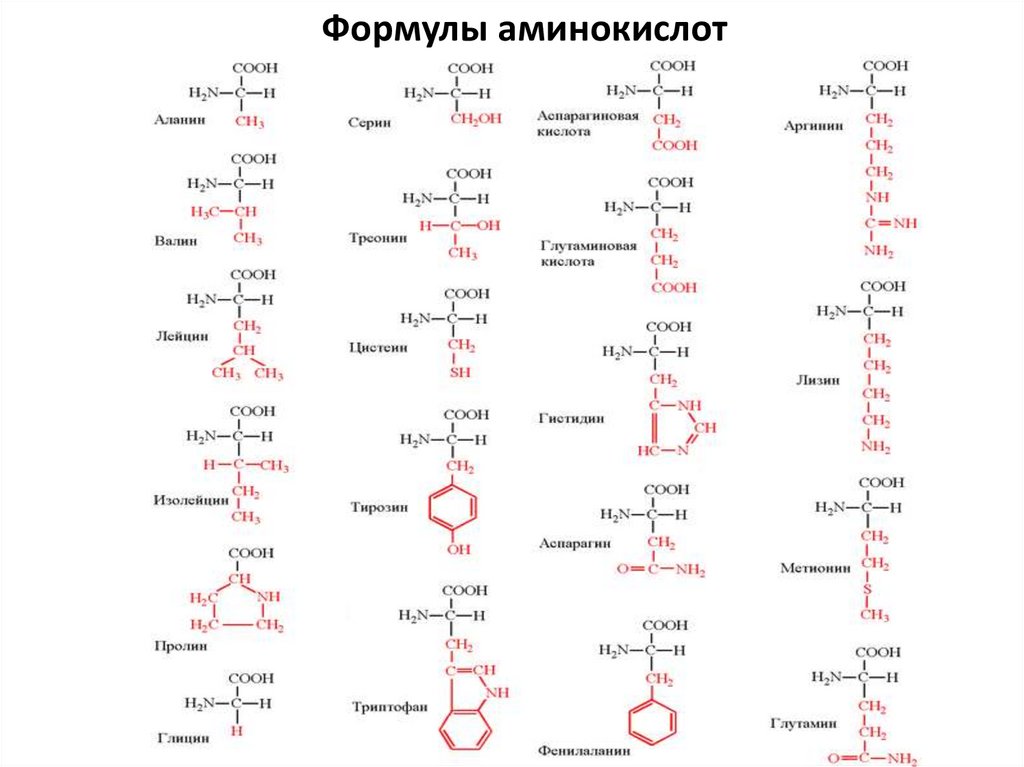
Формулы аминокислот12.
Аббревиатура аминокислот (для общей информации)13.
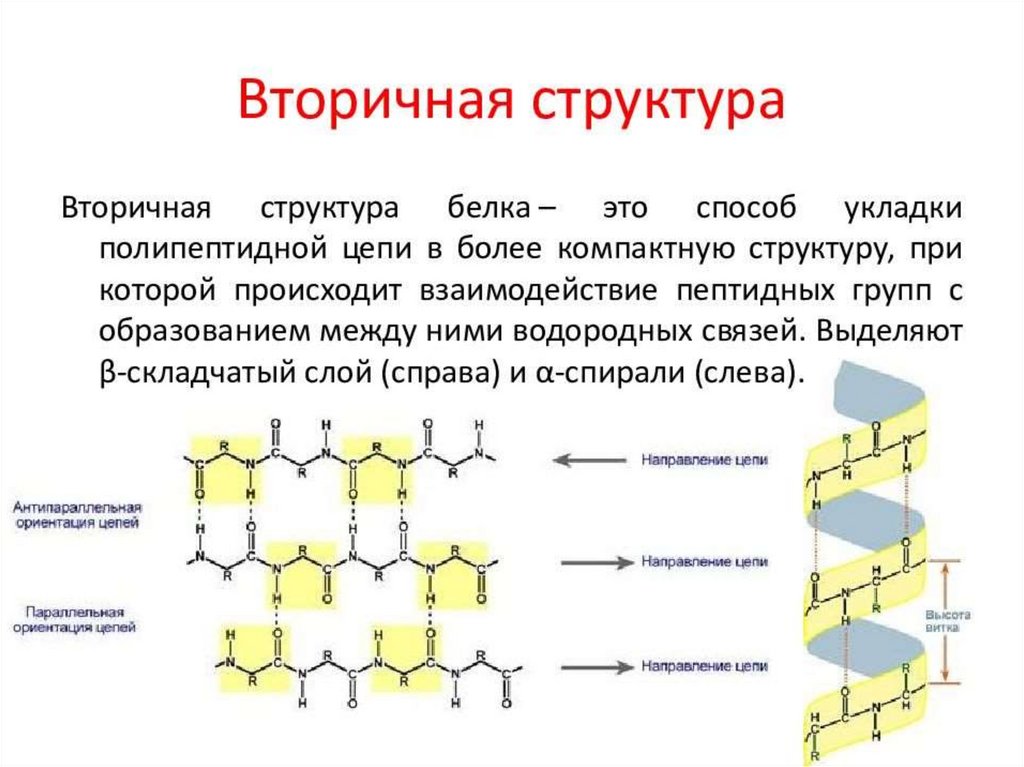
БЕЛКИ14. Первичная структура Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом
пептиднымисвязями в полипептидной цепи.
NH2-Val-His-Leu-Thr-Pro-Glu-Glu-
Lys-Ser-Ala-Val-Thr-Ala-Leu-TrpGly-Lys-Val-Asn-Val-Asp-Glu-ValGly-Gly-Glu-…..
Первичная структура фрагмента бета-субъединицы
гемоглобина
15.
16.
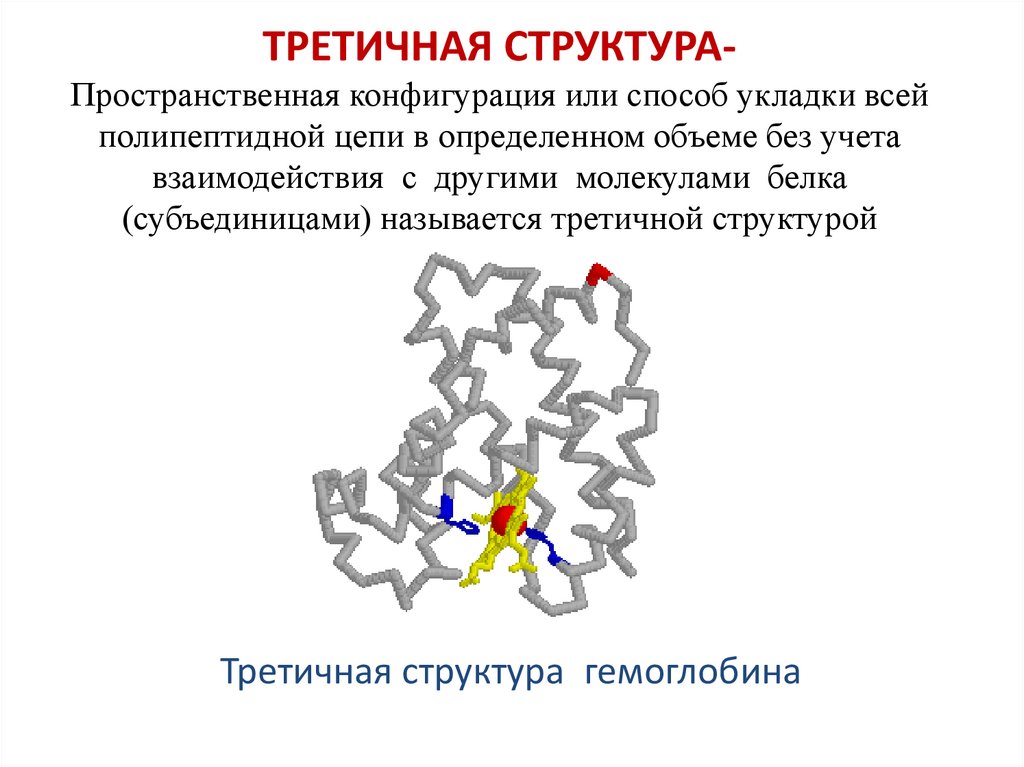
ТРЕТИЧНАЯ СТРУКТУРАПространственная конфигурация или способ укладки всейполипептидной цепи в определенном объеме без учета
взаимодействия с другими молекулами белка
(субъединицами) называется третичной структурой
Третичная структура гемоглобина
17.
Четвертичная структура белка18. Классификация белков. Простые белки
• 1.Протамины и гистоны - это обширная группа белковщелочного характера, поскольку в составе в большом
количестве присутствуют диамино-монокарбоновые кислоты
(лиз, арг, гис).
• Гистоны принимают участие в формировании хромосом и
являются регуляторами функций генов оперона.
• 2.Проламины и глютелины являются растительными
белками, проявляют свойства энзимов и являются резервными
белками семян растений.
• 3.Протеиноиды или склеропротеины это не растворимые в
воде белки опорных тканей. Они почти не подвергаются
действию пищеварительных энзимов в желудочно-кишечном
тракте и поэтому не пригодны в пищу человеку.
• К этой группе относится белок коллаген и эластин
соединительной ткани, кератин волос, ногтей, перьев.
• 4.Альбумины и
глобулины
- наиболее
широко
распространенная группа простых белков.
• К ним относятся белки молока, сыворотки крови, яичный белок,
белки мышц и др.
19. Сложные белки
• 1.Фосфопротеиды состоят из простого белка и простетической группыпредставленной радикалом фосфорной кислоты,
присоединенной к
апопротеину через ОН- группу серина эфирной связью. К фосфопротеидам
относится казениноген молока, ововителин и фосвитин яичного желтка,
овальбумин, пепсин, фосфорилазы и др. белки.
• 2.Хромопротеиды , простетическая группа представлена различными
окрашенными соединениями. К хромопротеидам относятся флавопротеиды,
простетическая группа которых представлена производными рибофлавина,
родопсин - светочувствительный белок сетчатки, простетическая группа
которого - ретиналь (вит А).
• 3.Нуклеопротеиды - простетическая группа представлена нуклеиновыми
кислотами.
• Различают два типа нуклеопротеидов:
• дезоксирибонуклеопротеиды, простетическая группа которых представлена
ДНК и
• рибонуклеопротеиды, простетическая группа которых представлена РНК
20.
• 4.Липопротеиды (протеолипиды) представляют комплексы белков ижироподобными соединениями, структура которых крайне неустойчива.
• 5.Глюкопротеиды различают две разновидности:
• - гликопротеиды и
• - мукопротеиды (протеогликаны).
• - Гликопротеиды это белки, простетическая группа которых представлена
в основном нейтральными мукополисахаридами (сиаловыми кислотами). К
ним относятся некоторые гормоны, ферменты и белки плазмы крови (ФСГ,
ГТГ, холинэстераза, протромбин, фибриноген,
иммуноглобулины,
группоспецифические белки крови и др.).
-Протеогликаны (гликопротеиды) представлены муцинами и мукоидами.
К муцинам относятся муцин слюны и муцины слизистой желудочнокишечного тракта. Простетическая группы у этих белков представлена
гиалуроновой кислотой. Мукоиды образуют в воде очень вязкий раствор и
встречаются в основном веществе соединительной ткани, в выделениях
слизистых оболочек, в синовиальных жидкостях, в стекловидном теле глаза,
в яичном белке.
• К мукоидам относятся овомукоиды, остеомукоиды, хондромукоиды,
гиаломукоиды. Простетическая группа этих белков образована
хондроитинсульфатами.
• Мукоид - гепаринфибринолизин содержит мукополисахарид - гепарин.
21.
• 6. Металлопротеиды - белки, в состав которых входятметаллы.
• К этой группе относится трансферрин, ферритин - содержащие
железо, церулоплазмин - содержащий медь и другие белки.
22. По биологическим функциям все белки можно объединить в следующие группы
1.Транспортные белки: гемоглобин, трансферрин,альбумины сыворотки крови, церрулоплазмин,
альфа
и
бета-липопротеиды,
белки
трансмембранного транспорта.
• 2.Резервные (трофические) белки: казеин молока,
овальбумин яиц.
• 3.Структурные белки: коллаген, эластин,
кератин, гликопротеиды, мукоиды соединительной
ткани, липопротеиды мембран, белки нуклеосом,
рибосом и другие белки формирующие остов
клетки, ткани и органов.
• 4.Сократительные белки: актин, миозин,
тропонин, тромиозин мышечной ткани.
23.
• 5.Белки-регуляторыфизиологических
функций клеток и метаболизма: белковые
гормоны (тропные гормоны гипофиза,
вазопрессин,
окситоцин,
паратгормон,
тиреокальцитонин, инсулин, глюкогон),
белки активаторы
и
ингибиторы
ферментов и других белков.
• 6.Защитные белки - иммуноглобулины.
• 7.Рецепторные белки:
мембранные,
цитоплазматические, ядерные.
• 8.Белки - биокатализаторы (ферменты).
24. Физико-химические свойства белков
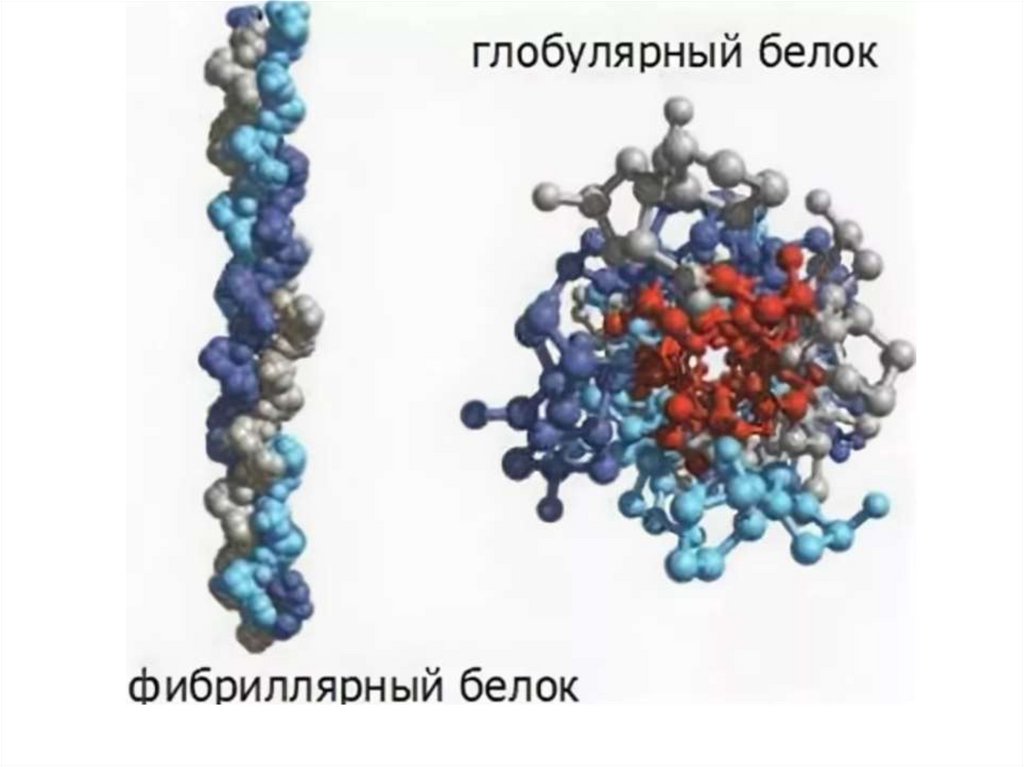
• Белковая молекула любого типа в нативном состоянииобладает характерной для нее пространственной структурой конформацией. В зависимости от конформации белки можно
разделить на два основных типа: фибриллярные и глобулярные.
• Фибриллярные белки - это устойчивые, нерастворимые в воде и
разбавленных солевых растворах вещества. Фибриллярные
белки - это главные структурные элементы соединительной
ткани.
• У глобулярных белков - них полипептидные цепи плотно
свернуты в компактные сферические или
глобулярные
структуры. Они хорошо растворимы в воде. К глобулярным
белкам относятся почти все ферменты, антитела, некоторые
гормоны, сывороточный альбумин и гемоглобин.
• Некоторые белки принадлежат к промежуточному типу. К ним
относится миозин, фибриноген - фибрин белки системы
свертывания крови
25.
26. Осаждение белков из растворов
• При добавлении к раствору белка любых воду отнимающихсредств (спирт, ацетон и др.), или соединений уменьшающих
заряд на белковой молекуле (нейтральные соли),
• или вызывающих денатурацию белковой молекулы (соли
тяжелых металлов, концентрированные щелочи и кислоты,
алкалоидные реактивы, нагревание до 60-80 градусов,
облучение и др.), наблюдается дегидратация белковых
молекул и их выпадение в осадок.
• В зависимости от типа осаждающего фактора и глубины,
происходящих при этом изменений в структуре белковой
молекуле различают
• обратимое и необратимое осаждение белков из растворов.
27. Обратимое осаждение (высаливание)
Обратимое осаждение (высаливание)
Обратимое осаждение можно вызвать ацетоном, спиртом или
растворами нейтральных солей (NaCl, MgSO4 KCl (NH4)2SO4
Na2SO4 и др.) щелочных и щелочноземельных металлов.
При высаливании (обратимое осаждение белков растворами
нейтральных солей), как при любом виде обратимого
осаждения, белок не теряет своих биологических свойств.
После удаления солей путем диализа или гель фильтрацией,
белки вновь растворяясь, проявляют типичные им
биологические свойства.
Обратимое осаждение можно использовать для выделения белков
с сохраненными биологическими свойствами.
Обратимое осаждение белков имеет место и в клетке, где
это явление лежит в основе механизма регуляции
активности и временного выключения функции какой-либо
белковой молекулы.
28. Необратимое осаждение
• Необратимоеосаждение,
вызывается
физическими
факторами
:
нагревание,
облучение,
чередование
замораживания и оттаивания
• и химическими факторами: действие щелочей, кислот, солей
тяжелых металлов, алкалоидные реактивы и др.),
• Необратимое осаждение
приводит не только к потере
гидратной оболочки,
но и к изменению структурной
организации белковой молекулы на уровне третичной
структуры, т.е. вызывает денатурацию.
• Такое изменение в структуре молекулы белка необратимо.
• При непродолжительном действии денатурирующего
фактора или при быстром его устранении возможна
ренатурация
восстановление
исходной
(нативной)
конформации белковой молекулы и его свойств.
• Явление ренатурации используется для получения чистых
ферментов и других белков методами низкотемпературной
лиофилизации.
29.
• Для количественного определения белковчаще всего используются
• 1 - реакция с нингидрином или
• 2- биуретовая реакция.
• В настоящее время в качестве метода
количественного определения белка
используется спектрофотометрический
метод.
• Количество белка можно определять и путем
регистрации степени проявления биологических
свойств белка.
• Этим способом определяют количество
иммуноглобулинов, ферментов и прочих белков.
30.
Контрольные вопросы1.Понятие аминокислот. Структура аминокислот
2.Пептидная связь
3. Классификация аминокислот по функциональным
группам
4. Заменимые, условно-заменимые и незаменимые
аминокислоты
5. Первичная, вторичная, третичная ,четвертичная
структура белка
6.Простые белки : классификация
7.Сложные белки :классификация
8. Классификация белков по биологическим функциям
9.Осаждение белков: обратимое и необратимое
10. Методы количественного определения белков.























 Химия
Химия








