Похожие презентации:
Аминокислоты и белки
1. Аминокислоты и белки
Строение, свойстваСпирали встречаются во многих областях: в
архитектуре, в макромолекулах белков,
нуклеиновых кислот и даже в полисахаридах
(Loretto Chapel, Santa Fe, NM/© Sarbo )
1
2. Аминокислоты
Аминокисло́ ты (аминокарбо́ новые кисло́ ты)— органические соединения, в молекуле
которых одновременно содержатся
карбоксильные и аминные группы.
H2N
CH COOH
R
2
3. Аминокислоты
Аминокислоты могут рассматриваться какпроизводные карбоновых кислот, в которых
один или несколько атомов водорода
заменены на аминные группы.
H2N
CH COOH
R
3
4. Протеиногенные аминокислоты
В процессе биосинтеза белка вполипептидную цепь включаются 20
протеиногенных, или стандартных αаминокислот, кодируемых генетическим
кодом.
В последнее время к протеиногенным
аминокислотам иногда причисляют
трансляционно включаемые селеноцистеин
(Sec, U) и пирролизин (Pyl, O). Это так
называемые 21-я и 22-я аминокислоты.
4
5.
КлассификацияПо радикалу
Неполярные: глицин, аланин, валин, изолейцин,
лейцин, пролин, метионин, фенилаланин, триптофан,
Полярные незаряженные (заряды
скомпенсированы) при pH=7: серин, треонин,
цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно при pH=7:
аспарагиновая кислота, глутаминовая кислота
Полярные заряженные положительно при pH=7:
лизин, аргинин, гистидин
5
6.
КлассификацияПо функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин,
валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат,
за счёт второй карбоксильной группы несут в
растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин,
глутамин
6
7.
КлассификацияПо функциональным группам
Диаминомонокарбоновые: лизин, аргинин, несут в
растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин,
триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
7
8.
СокращениеСтруктурная
формула
(pI)
Глицин
gly
H2NCH2COOH
5.97
Аланин
ala
CH3CHCOOH
6.02
Название
NH2
Валин
val
Лейцин
leu
Пролин
pro
Фенилаланин
phe
(CH3)2CHCHCOOH
5.97
NH2
(CH3)2CHCH2CHCOOH 5.98
NH2
NH
6.10
COOH
C6H5CH2CHCOOH
5.88
NH2
Триптофан
try
C6H5CH2CHCOOH
NH2
5.88
8
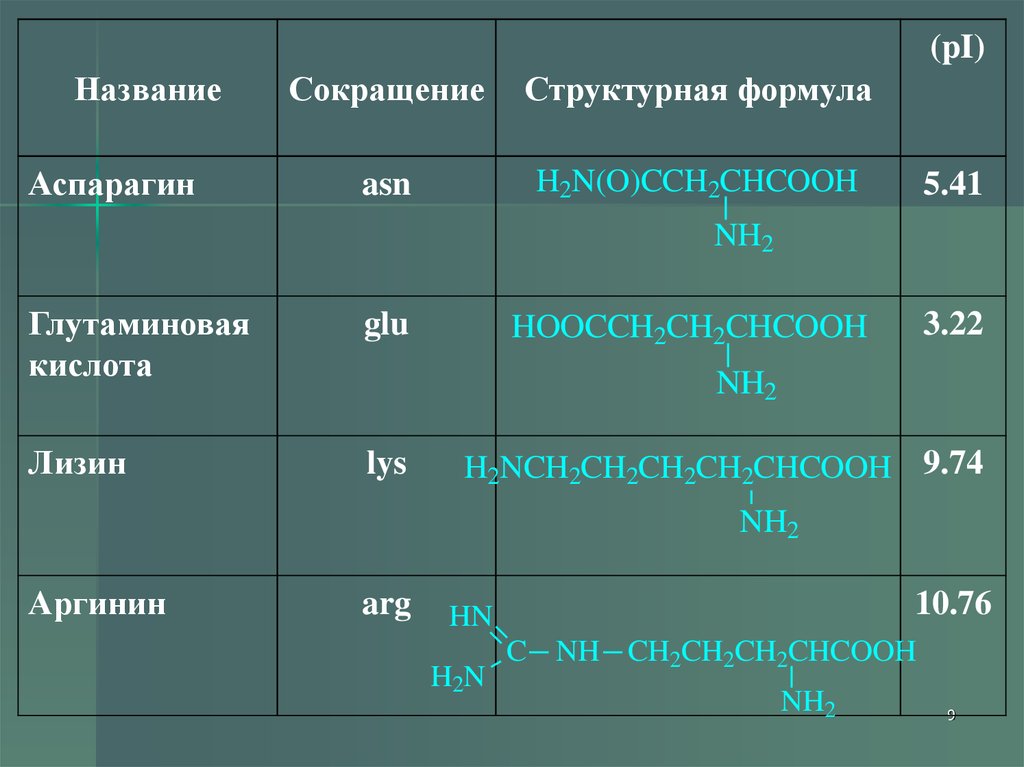
9.
(pI)Название
Аспарагин
Сокращение
Структурная формула
asn
H2N(O)CCH2CHCOOH
5.41
NH2
Глутаминовая
кислота
glu
Лизин
lys
3.22
HOOCCH2CH2CHCOOH
NH2
H2NCH2CH2CH2CH2CHCOOH 9.74
NH2
Аргинин
arg
10.76
HN
H2N
C NH CH2CH2CH2CHCOOH
NH2
9
10.
НазваниеГистидин
Сокращение
Структурная формула
his
(pI)
7.58
N
NH2
NH
Тирозин
CH2CHCOOH
tyr
5.65
HO
CH2CHCOOH
NH2
Цистеин
cySH
HSCH2CHCOOH
5.02
NH2
10
11. Незаменимые аминокислоты
Незаменимыми называютсяаминокислоты, которые не могут
быть синтезированы организмом из
веществ, поступающих с пищей, в
количествах, достаточных для того,
чтобы удовлетворить
физиологические потребности
организма.
11
12. Незаменимые аминокислоты
Следующие аминокислоты принятосчитать незаменимыми для организма
человека:
Лизин, Метионин, Фенилаланин,
Триптофан, Треонин, Лейцин, Валин
Изолейцин, Аргинин и Гистидин.
12
13.
Для запоминания десяти незаменимыхаминокислот существует
мнемоническое правило:
Лиза Метнула Фен в Трибуну, Трезвый
Лейтенант Валялся в Изоляторе с
Аргентинским Гитаристом.
13
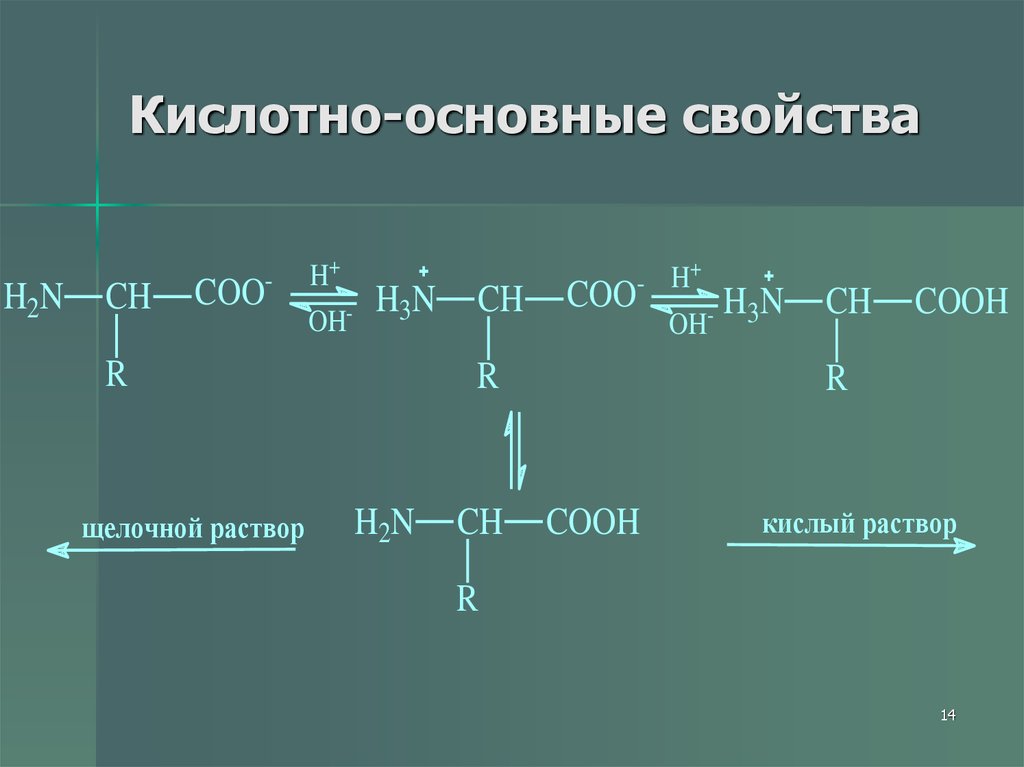
14. Кислотно-основные свойства
H 2NCH
COO
-
H+
OH
-
H 3N
R
щелочной раствор
CH
COO
+
- H
R
H2N
CH
OH-
H 3N
CH
COOH
R
COOH
кислый раствор
R
14
15. Кислотно-основные свойства
H2NCHCOOHR
не ионная форма;
идеализированная
аминокислота
-
H3NCHCOO
R
цвиттер-ион;
аминокислота в
твердом состоянии
15
16. Изоэлектрическая точка (рI)
Изоэлектрической точкойназывается такое значение pH,
имеющее определенное значение
для каждой аминокислоты, при
котором содержание диполярного
иона (цвиттер-иона) максимально
16
17. Способы получения аминокислот Аминирование -галогензамещенных кислот
Способы получения аминокислотАминирование -галогензамещенных кислот
RCH2COOH + Br2
PBr3
1) NH3 (изб.)
RCHCOOH 2) разб. кисл.
Br
RCHCOOH
NH2
17
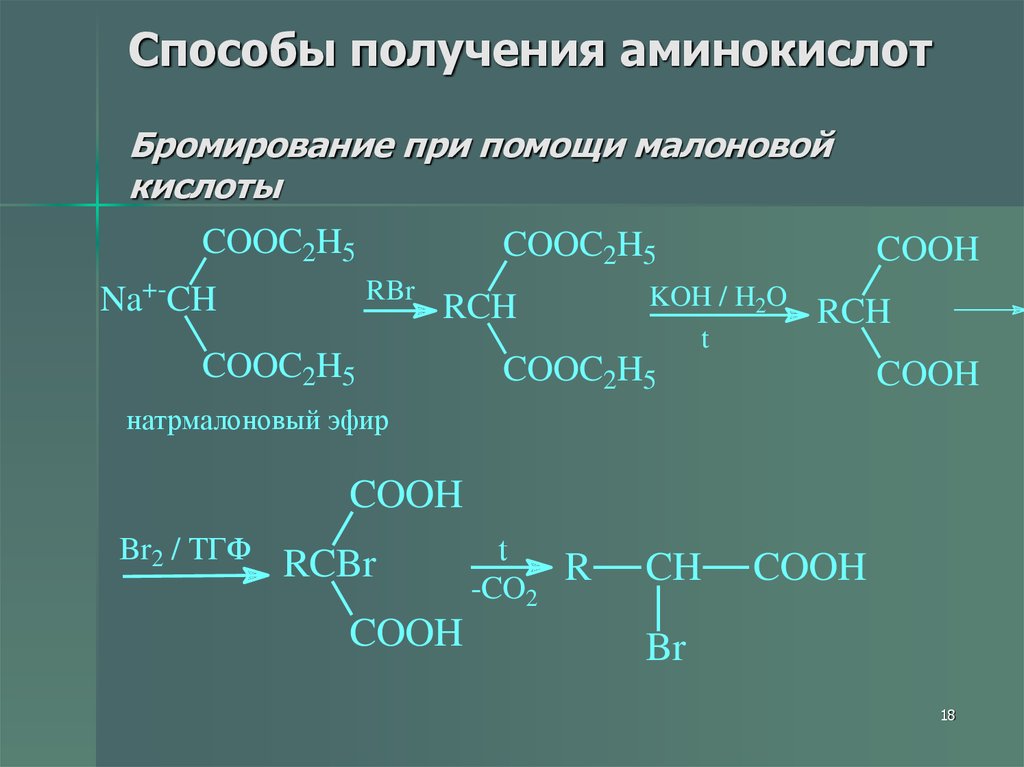
18. Способы получения аминокислот Бромирование при помощи малоновой кислоты
COOC2H5Na+-CH
COOC2H5
RBr
KOH / H2O
t
RCH
COOC2H5
COOH
RCH
COOC2H5
COOH
натрмалоновый эфир
COOH
Br2 / ТГФ
RCBr
COOH
t
-CO2
R
CH
COOH
Br
18
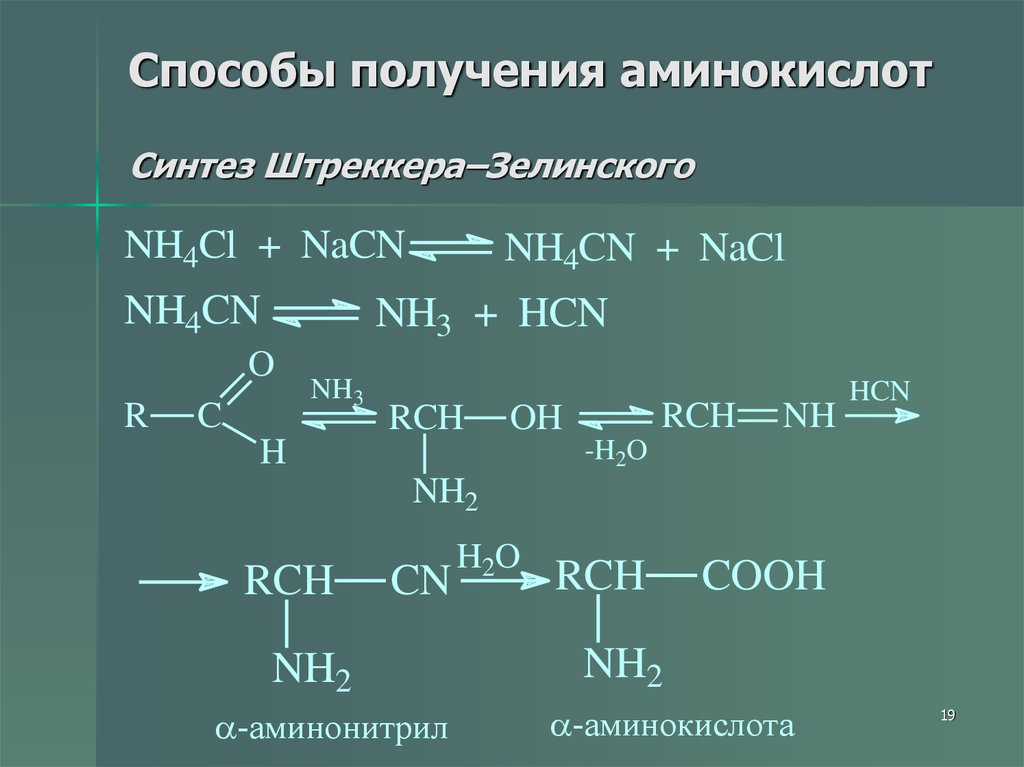
19. Способы получения аминокислот Синтез Штреккера–Зелинского
NH4Cl + NaCNNH4CN
NH3 + HCN
O
R
NH4CN + NaCl
C
NH3
RCH
RCH
OH
H
NH
HCN
-H2O
NH2
RCH
CN
NH2
-аминонитрил
H2O
RCH
COOH
NH2
-аминокислота
19
20. Способы получения аминокислот
Алкилирование N-замещенныхаминомалоновых эфиров
Аминирование эфиров -галогензамещенных кислот (с помощью
фталимида калия)
20
21. Способы получения аминокислот Биологический способ получения аминокислот
Корм сдобавкой
рацемической
смеси
-аминокислот
Оптически
чистый изомер
-аминокислоты
Отходы с
оптически
активным
изомером
-аминокислоты
Очистка
21
22. Химические свойства аминокислот Реакции аминогруппы
CH3CHCOOH + [HNO2]NH2
аланин
CH3CHCOOH + N2 + H2O
OH
молочная
кислота
Метод Ван-Слайка
22
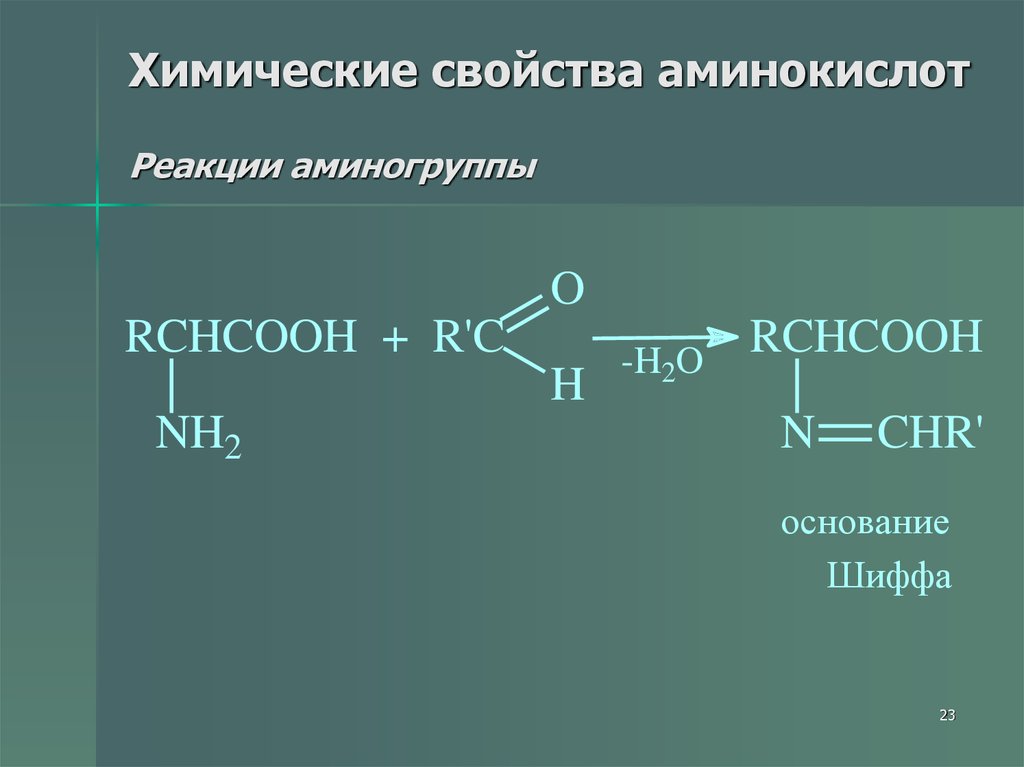
23. Химические свойства аминокислот Реакции аминогруппы
ORCHCOOH + R'C
H
NH2
RCHCOOH
-H2O
N
CHR'
основание
Шиффа
23
24. Химические свойства аминокислот Реакции карбоксильной группы
HClCH3CHCOOH + CH3OH -H O CH3CHCOOCH3
2
NH3+ClNH2
аланин
гидрохлорид
метилового эфира
аланина
-NH4Cl NH3
CH3CHCOOCH3
NH2
метиловый эфир
аланина
24
25. Химические свойства аминокислот Реакции карбоксильной группы
HOCH2CHCOOHNH2
серин
HOOCCHCH2CH2COOH
NH2
HOCH2CH2NH2 + CO2
коламин
H2NCH2CH2CH2COOH + CO2
4-аминобутановая кислота
глутаминовая кислота
25
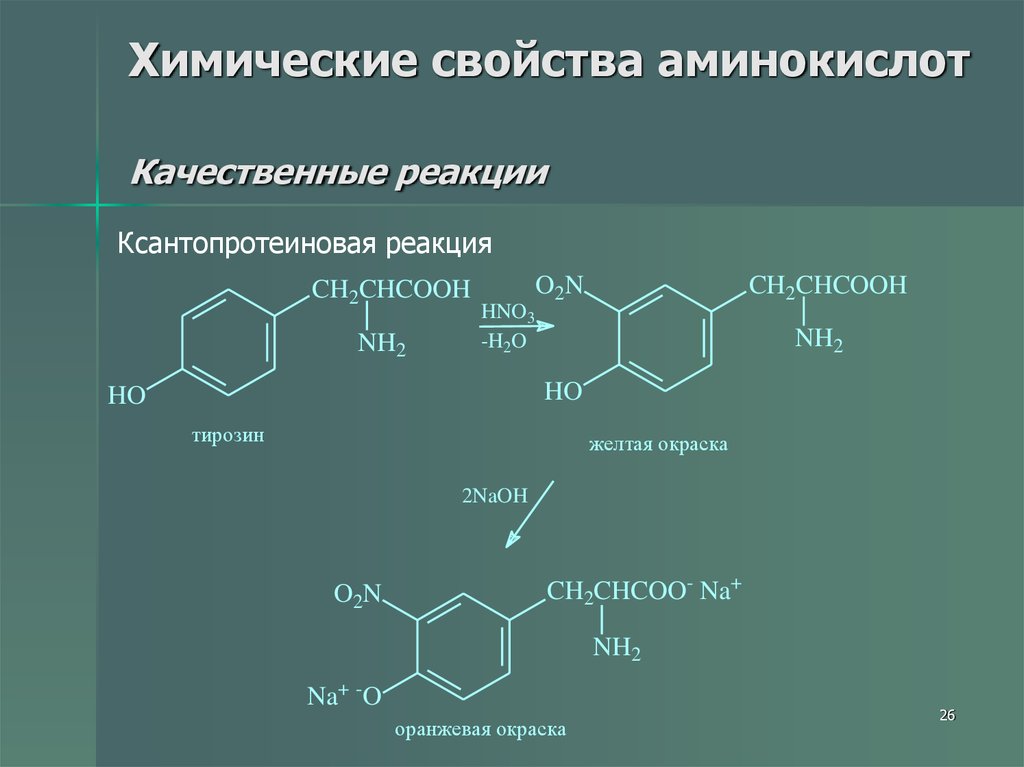
26. Химические свойства аминокислот Качественные реакции
Ксантопротеиновая реакцияCH2CHCOOH
NH2
HNO3
-H2O
O2 N
CH2CHCOOH
NH2
HO
HO
тирозин
желтая окраска
2NaOH
O2 N
CH2CHCOO- Na+
NH2
Na+ -O
оранжевая окраска
26
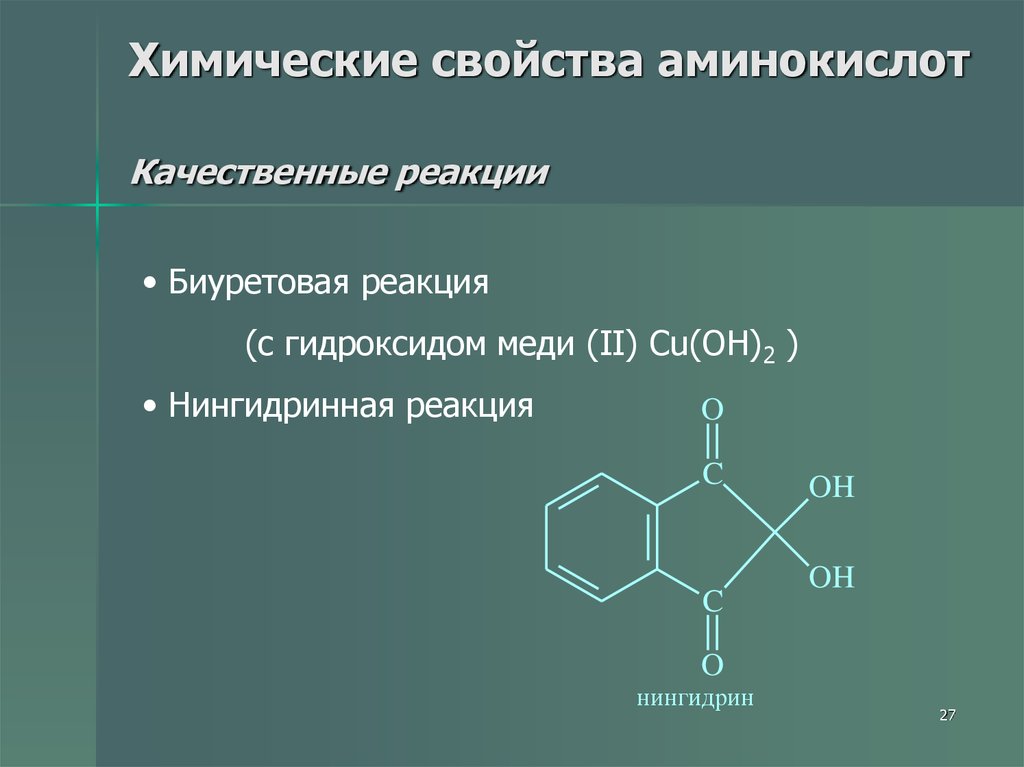
27. Химические свойства аминокислот Качественные реакции
• Биуретовая реакция(с гидроксидом меди (II) Cu(OH)2 )
• Нингидринная реакция
O
C
C
OH
OH
O
нингидрин
27
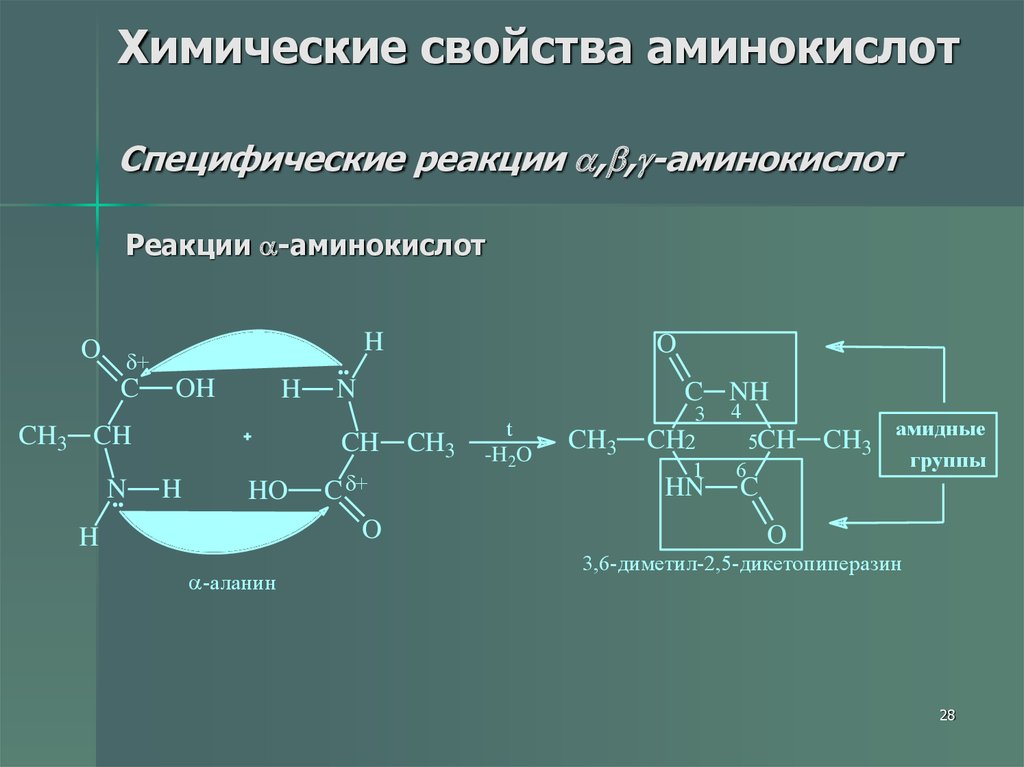
28. Химические свойства аминокислот Специфические реакции ,,-аминокислот
Химические свойства аминокислотСпецифические реакции , , -аминокислот
Реакции -аминокислот
H
O +
C OH
H
CH3 CH
N
N
CH CH3
H
HO
H
-аланин
O
C +
O
C NH
t
-H2O
CH3
3
CH2
1
HN
4
5CH
6
CH3 амидные
группы
C
O
3,6-диметил-2,5-дикетопиперазин
28
29. Химические свойства аминокислот Специфические реакции ,,-аминокислот
Химические свойства аминокислотСпецифические реакции , , -аминокислот
Реакции -аминокислот
CH2
CH
NH2
H
-аланин
COOH
t
-NH3
CH2
CH
COOH
акриловая кислота
29
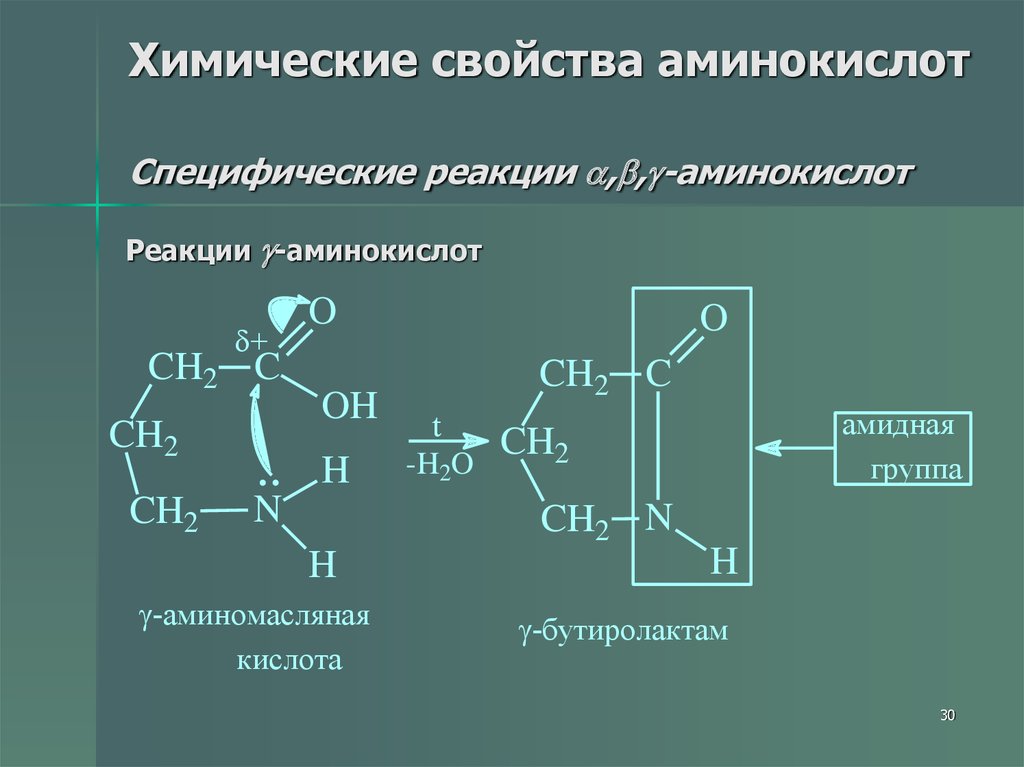
30. Химические свойства аминокислот Специфические реакции ,,-аминокислот
Химические свойства аминокислотСпецифические реакции , , -аминокислот
Реакции -аминокислот
+
CH2 C
CH2
CH2
O
OH
H
N
O
CH2 C
t
-H2O
амидная
группа
CH2
CH2 N
H
-аминомасляная
кислота
H
-бутиролактам
30
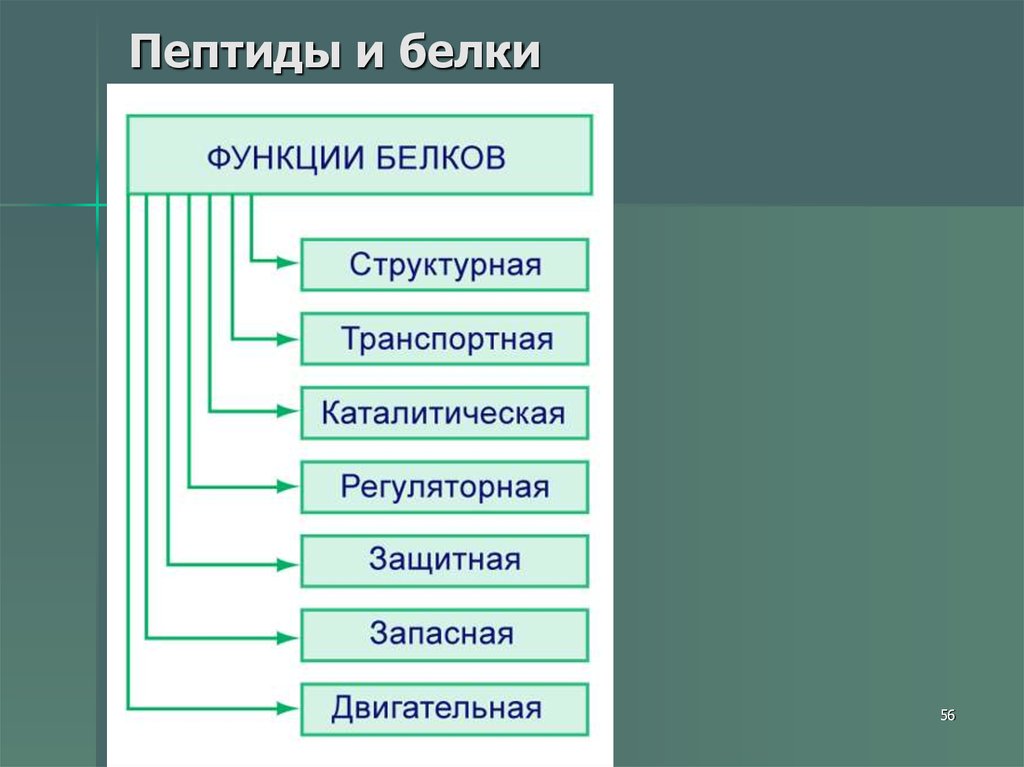
31. Пептиды и белки
Пептиды — соединения,построенные из нескольких
остатков -аминокислот,
связанных амидной (пептидной)
связью.
O
Ñ NH
31
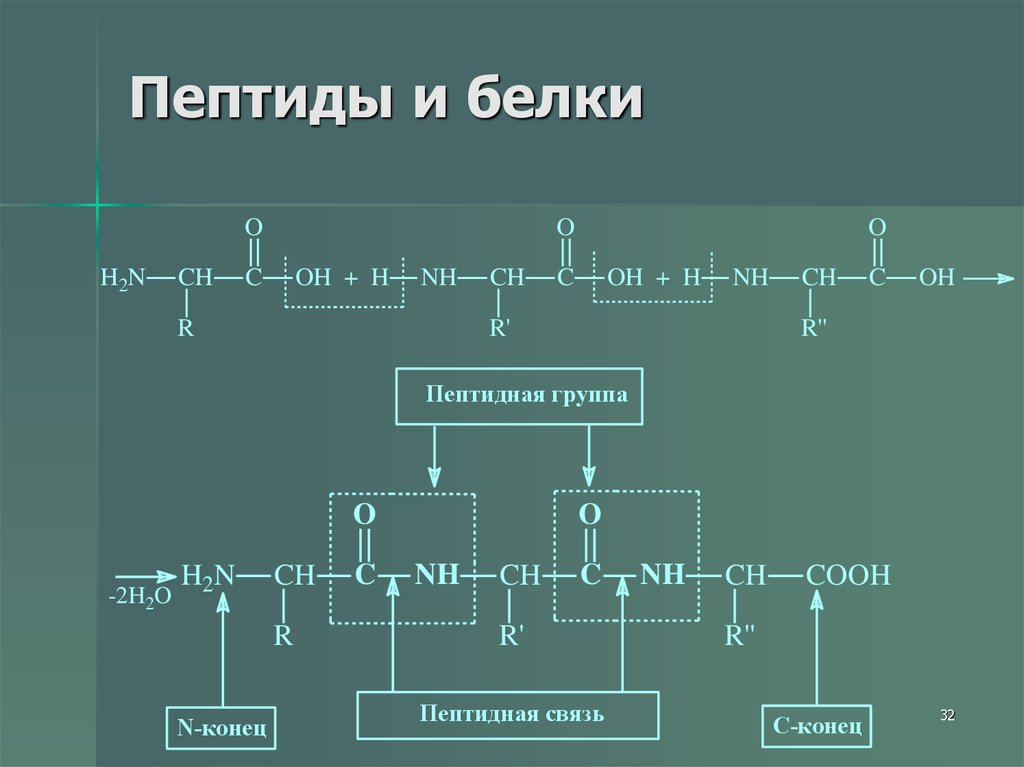
32. Пептиды и белки
OH2N
CH
O
C
OH + H
NH
R
CH
O
C
OH + H
NH
R'
CH
C
OH
R''
Пептидная группа
O
-2H2O
H 2N
CH
R
N-конец
C
O
NH
CH
C
R'
Пептидная связь
NH
CH
COOH
R''
C-конец
32
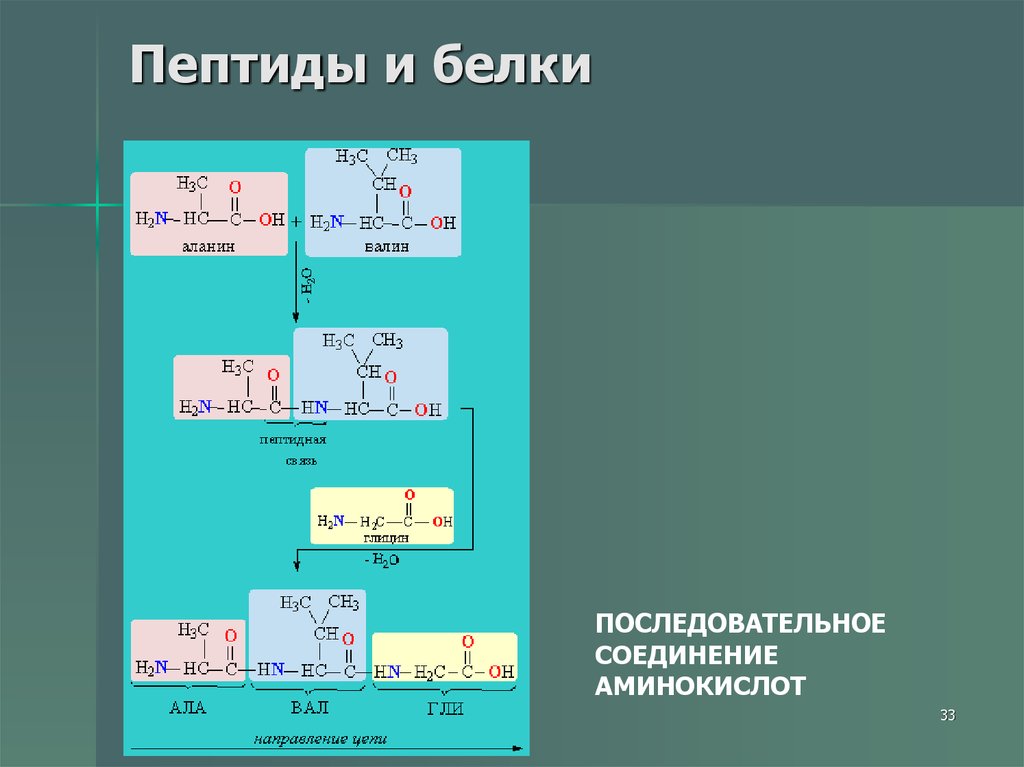
33. Пептиды и белки
ПОСЛЕДОВАТЕЛЬНОЕСОЕДИНЕНИЕ
АМИНОКИСЛОТ
33
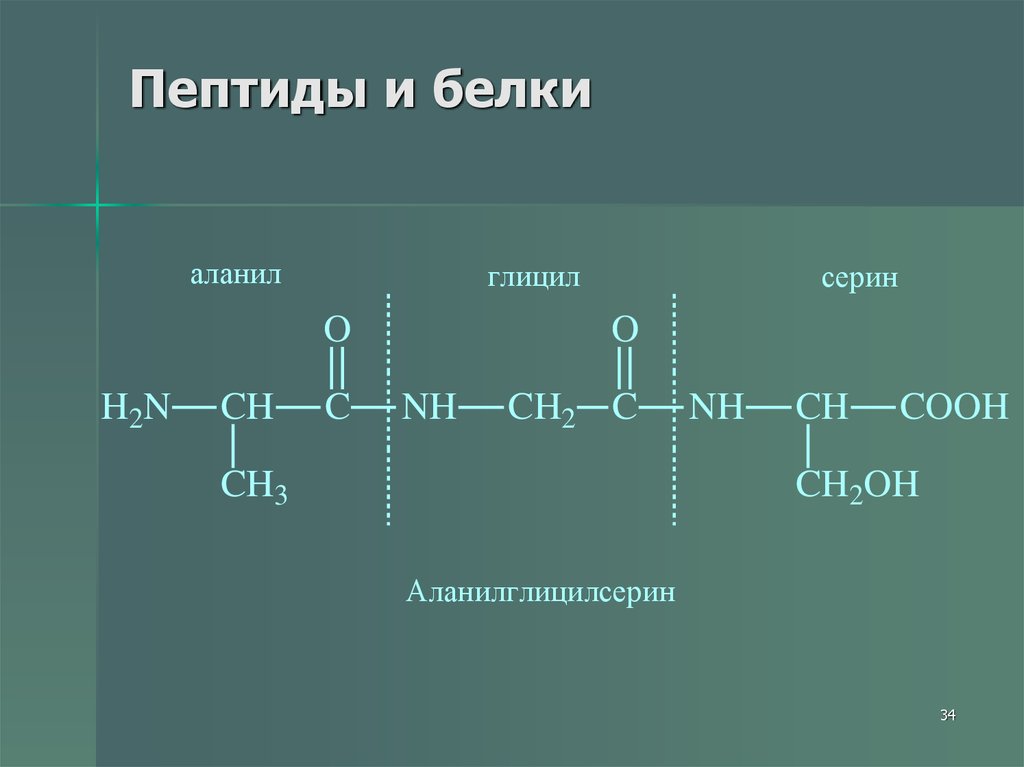
34. Пептиды и белки
аланилглицил
O
O
H2N
CH
C
серин
NH
CH2 C
NH
CH
COOH
CH2OH
CH3
Аланилглицилсерин
34
35. Пептиды и белки
Первичная структура белка инсулина.35
36. Пептиды и белки Структура белков
Первичная структура пептидов ибелков — это последовательность
аминокислотных остатков в
полипептидной цепи.
36
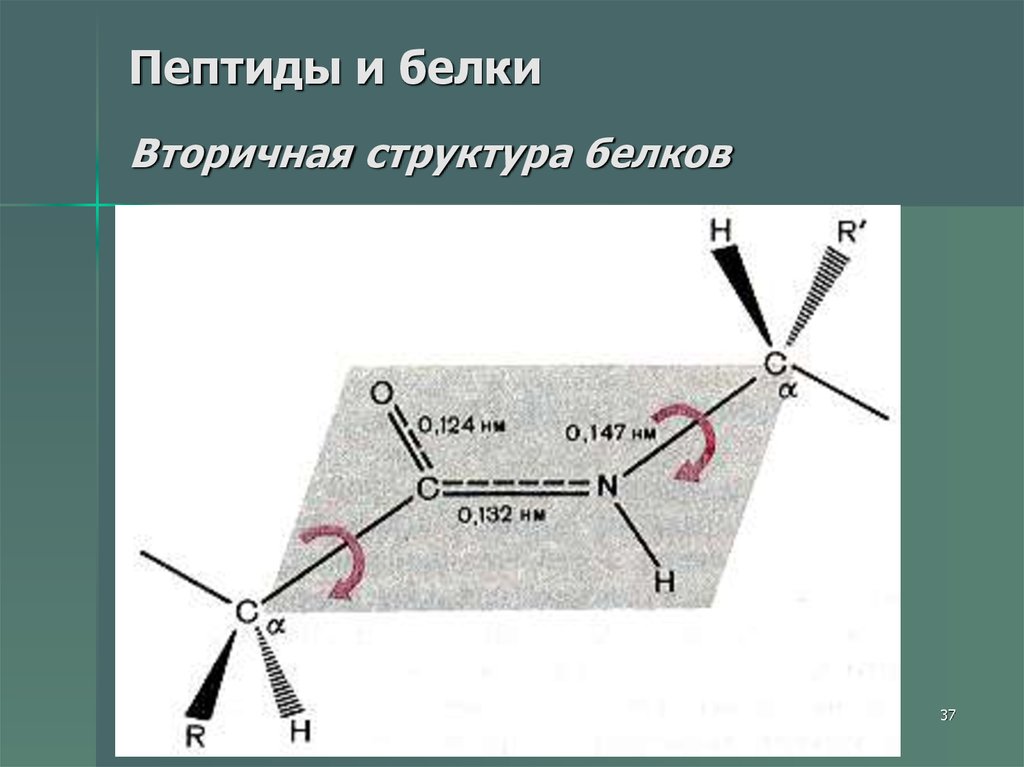
37. Пептиды и белки Вторичная структура белков
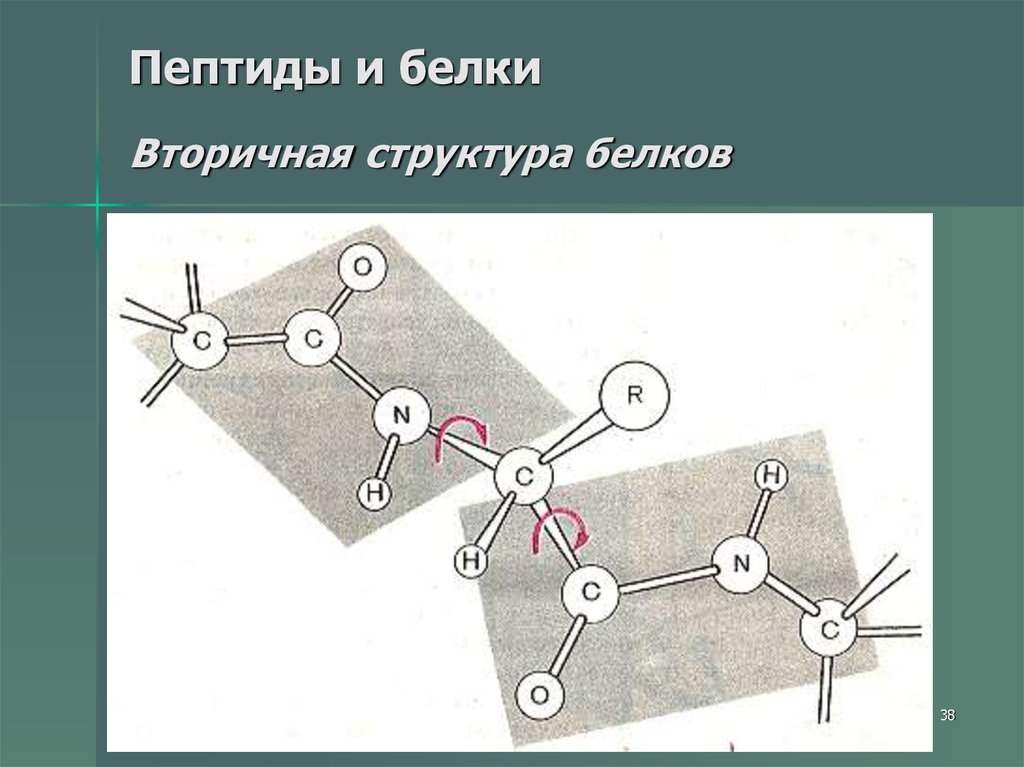
3738. Пептиды и белки Вторичная структура белков
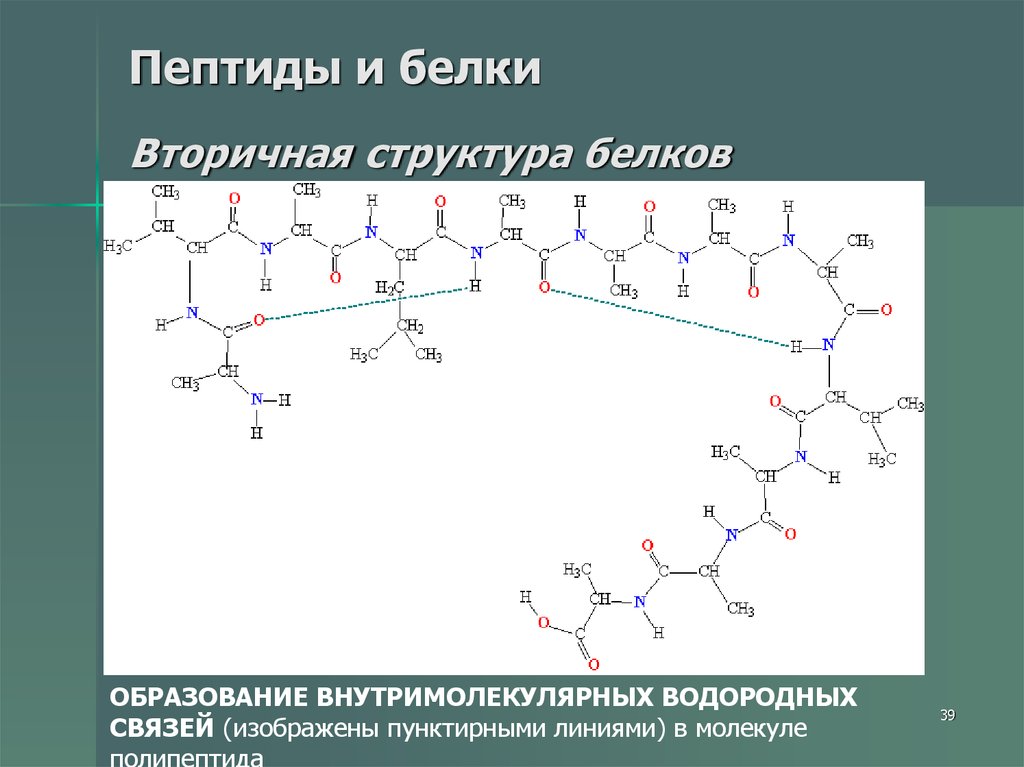
3839. Пептиды и белки Вторичная структура белков
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ ВОДОРОДНЫХСВЯЗЕЙ (изображены пунктирными линиями) в молекуле
полипептида
39
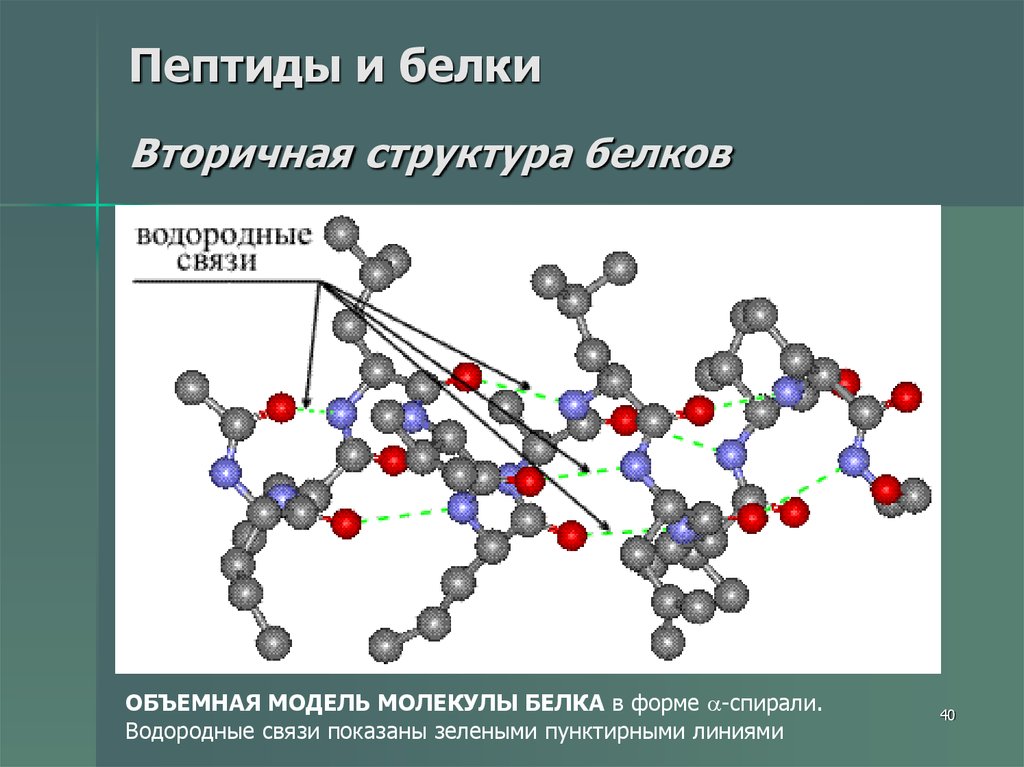
40. Пептиды и белки Вторичная структура белков
ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме -спирали.Водородные связи показаны зелеными пунктирными линиями
40
41. Пептиды и белки Вторичная структура белков
-спиральмолекулы белка
41
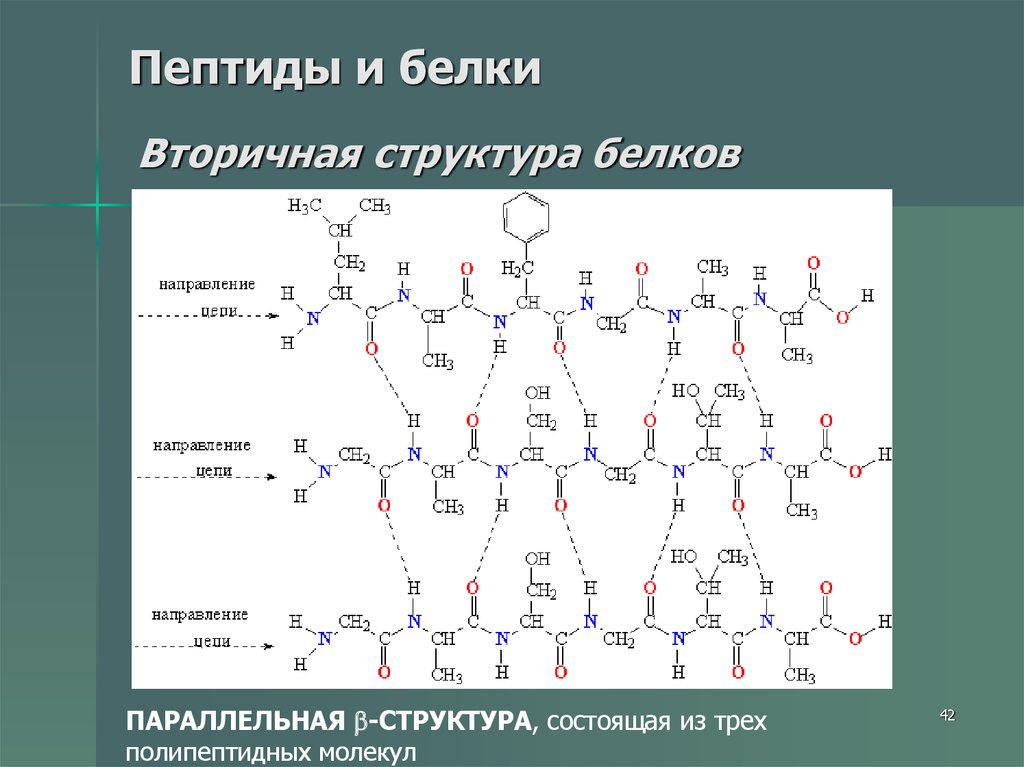
42. Пептиды и белки Вторичная структура белков
ПАРАЛЛЕЛЬНАЯ -СТРУКТУРА, состоящая из трехполипептидных молекул
42
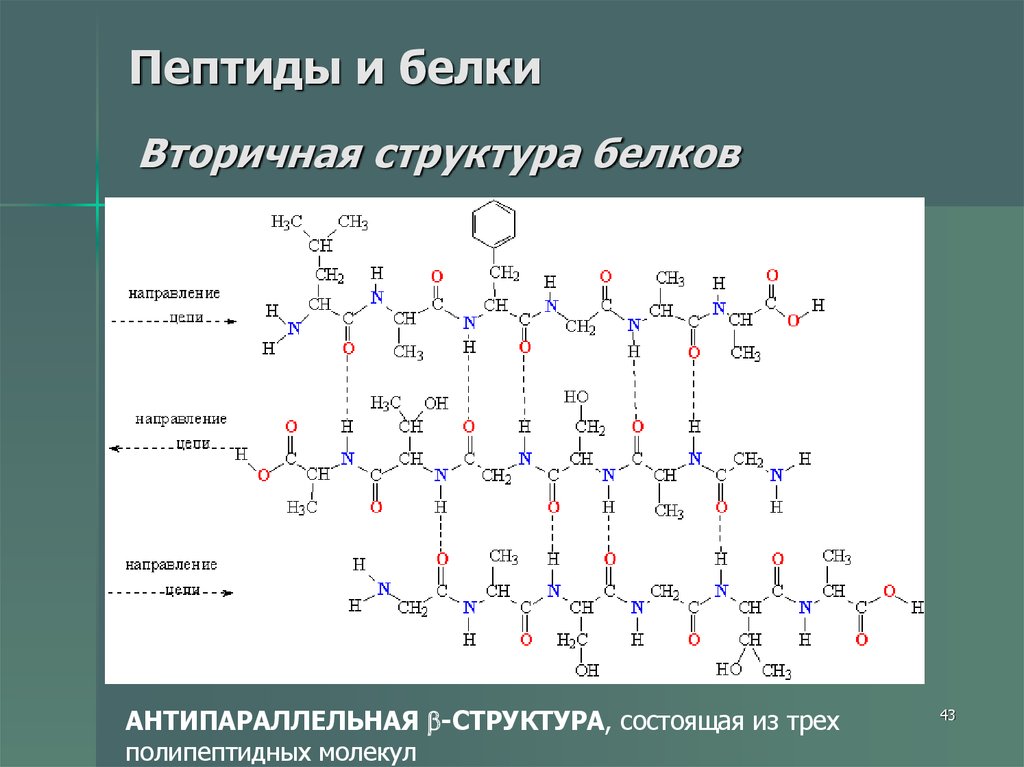
43. Пептиды и белки Вторичная структура белков
АНТИПАРАЛЛЕЛЬНАЯ -СТРУКТУРА, состоящая из трехполипептидных молекул
43
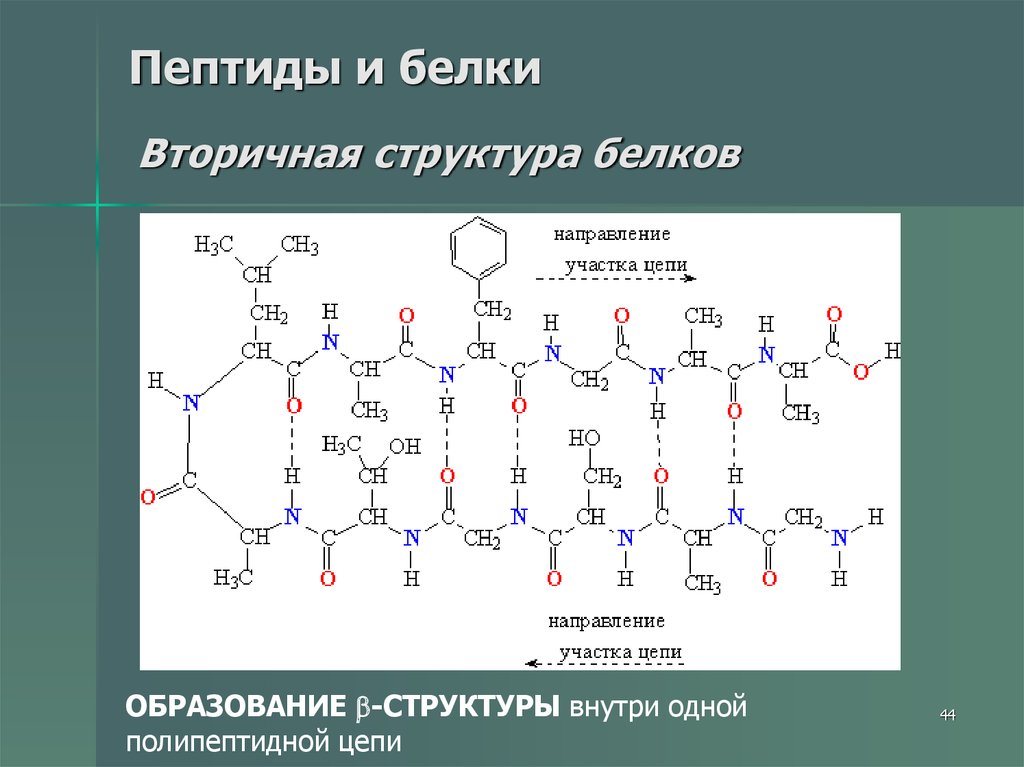
44. Пептиды и белки Вторичная структура белков
ОБРАЗОВАНИЕ -СТРУКТУРЫ внутри однойполипептидной цепи
44
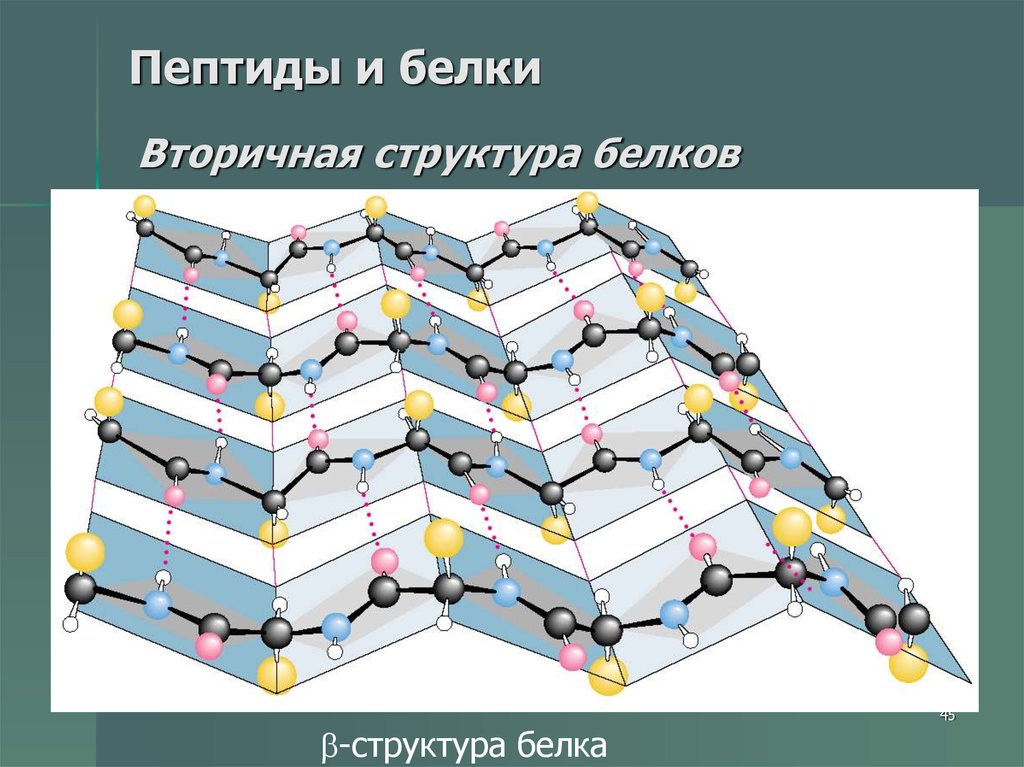
45. Пептиды и белки Вторичная структура белков
-структура белка45
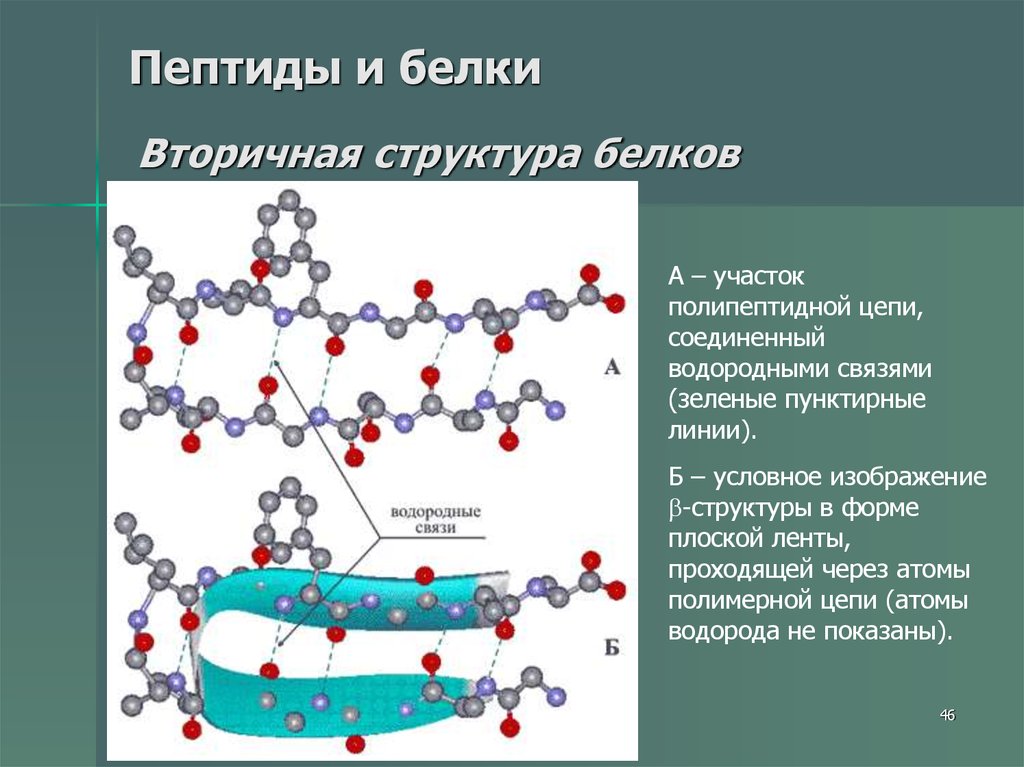
46. Пептиды и белки Вторичная структура белков
А – участокполипептидной цепи,
соединенный
водородными связями
(зеленые пунктирные
линии).
Б – условное изображение
-структуры в форме
плоской ленты,
проходящей через атомы
полимерной цепи (атомы
водорода не показаны).
46
47. Пептиды и белки Вторичная структура белков
Вторичная структура белка — этоболее высокий уровень структурной
организации, в котором закрепление
конформации происходит за счет
водородных связей между пептидными
группами.
47
48. Пептиды и белки Третичная структура белков
РАЗЛИЧНЫЕ ВАРИАНТЫИЗОБРАЖЕНИЯ СТРУКТУРЫ
БЕЛКА КРАМБИНА.
А– структурная формула в
пространственном
изображении.
Б – структура в виде объемной
модели.
В – третичная структура
молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение
третичной структуры.
Е – третичная структура с
дисульфидными мостиками.
48
49. Пептиды и белки Ионные взаимодействия
остаток лизинаNH
CH
пептидная связь
CO
(CH2)4NH3+
ионное взаимодействие
-
OOCCH
CO
CH
NH
остаток
аспаргиновой кислоты
49
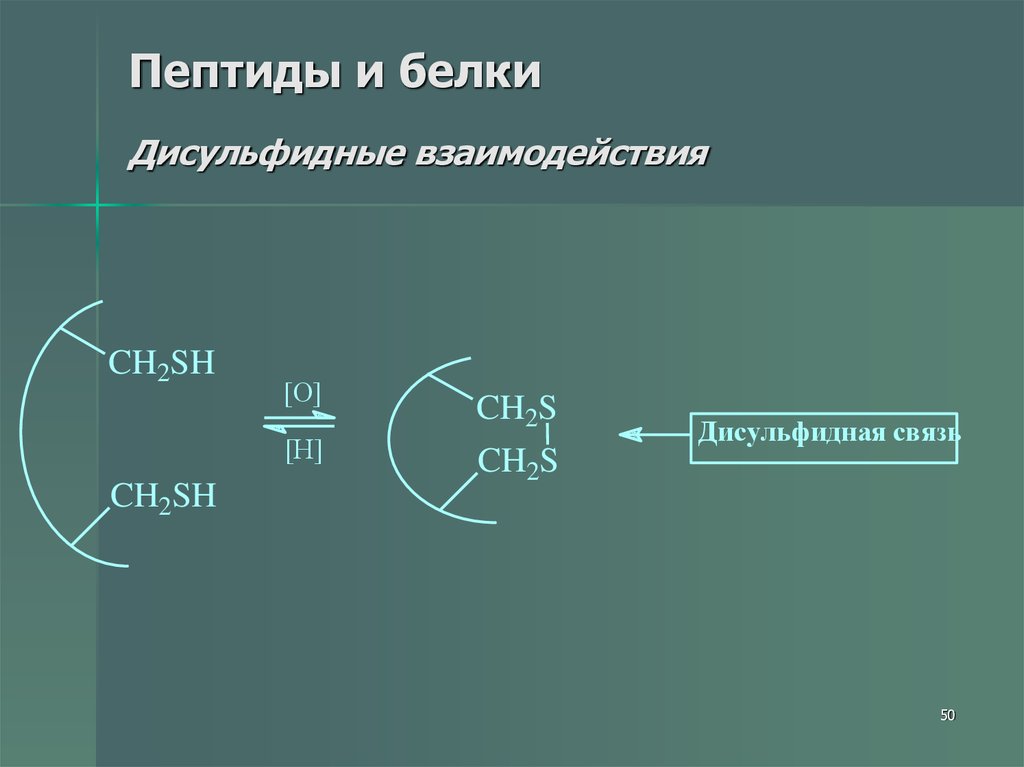
50. Пептиды и белки Дисульфидные взаимодействия
CH2SH[O]
[H]
CH2SH
CH2S
Дисульфидная связь
CH2S
50
51. Пептиды и белки Глобулярные белки
ГЛОБУЛЯРНАЯСТРУКТУРА
АЛЬБУМИНА (белок
куриного яйца). В
структуре помимо
дисульфидных мостиков
присутствуют свободные
сульфгидридные HSгруппы цистеина, которые
в процессе разложения
белка легко образуют
сероводород – источник
запаха тухлых яиц.
Дисульфидные мостики
намного более устойчивы
и при разложении белка
сероводород не образуют
51
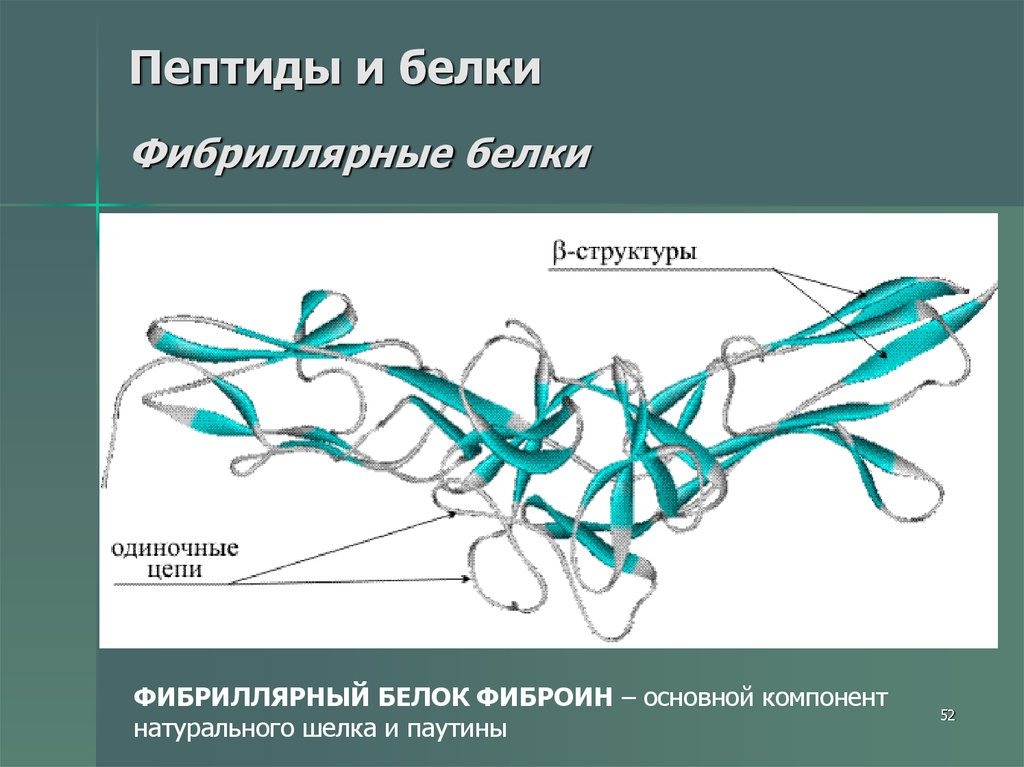
52. Пептиды и белки Фибриллярные белки
ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН – основной компонентнатурального шелка и паутины
52
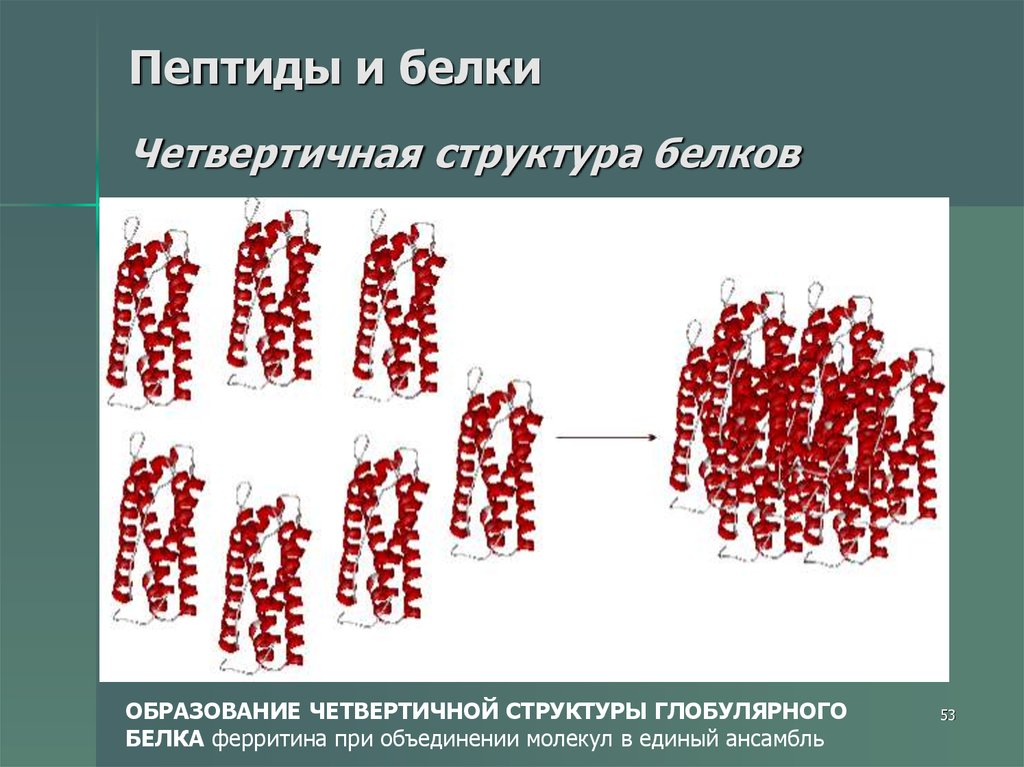
53. Пептиды и белки Четвертичная структура белков
ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГОБЕЛКА ферритина при объединении молекул в единый ансамбль
53
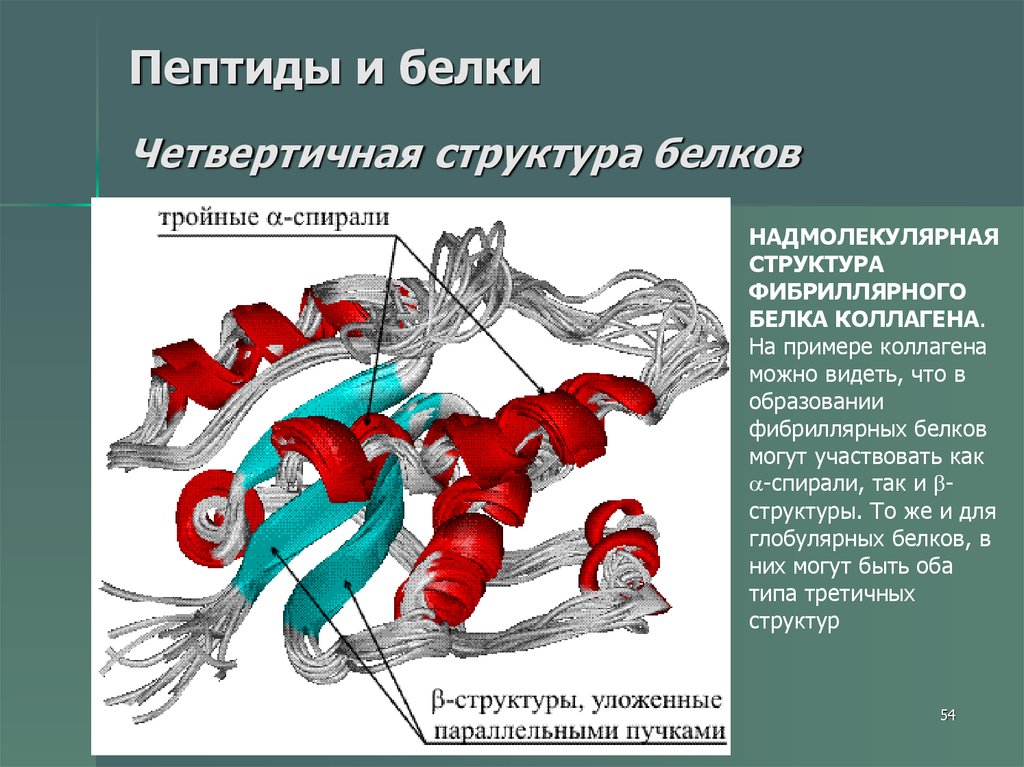
54. Пептиды и белки Четвертичная структура белков
НАДМОЛЕКУЛЯРНАЯСТРУКТУРА
ФИБРИЛЛЯРНОГО
БЕЛКА КОЛЛАГЕНА.
На примере коллагена
можно видеть, что в
образовании
фибриллярных белков
могут участвовать как
-спирали, так и структуры. То же и для
глобулярных белков, в
них могут быть оба
типа третичных
структур
54
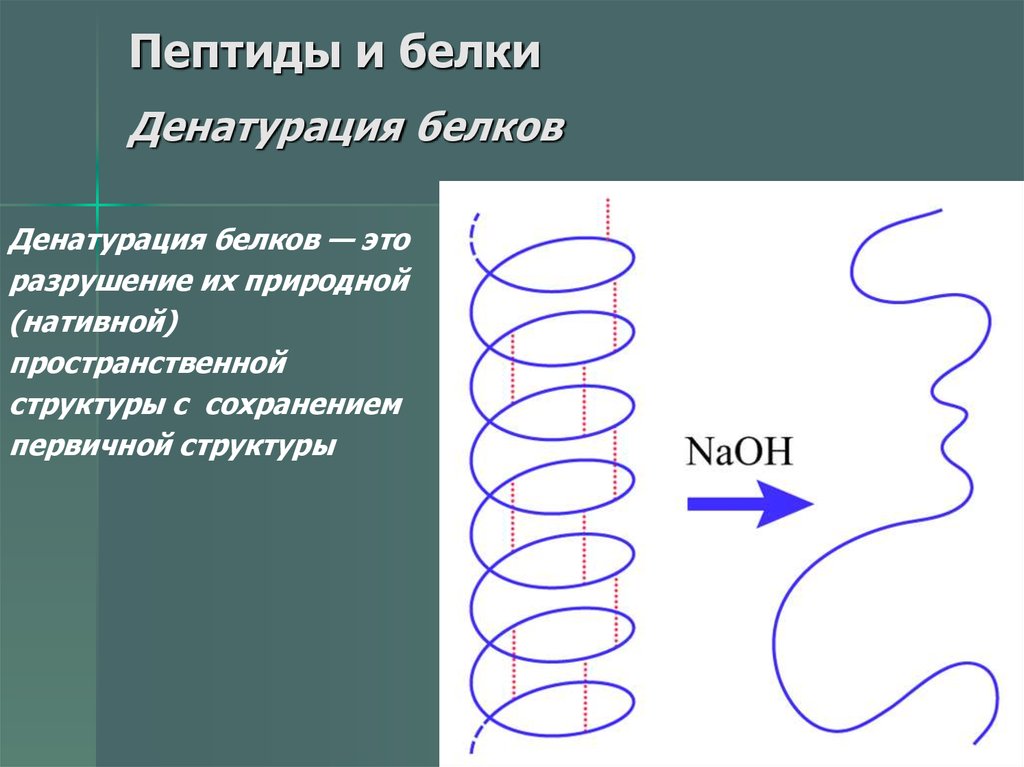
55. Пептиды и белки Денатурация белков
Денатурация белков — эторазрушение их природной
(нативной)
пространственной
структуры с сохранением
первичной структуры
55




























 Химия
Химия