Похожие презентации:
Лекция №2. Оксиды, кислоты, основания, соли
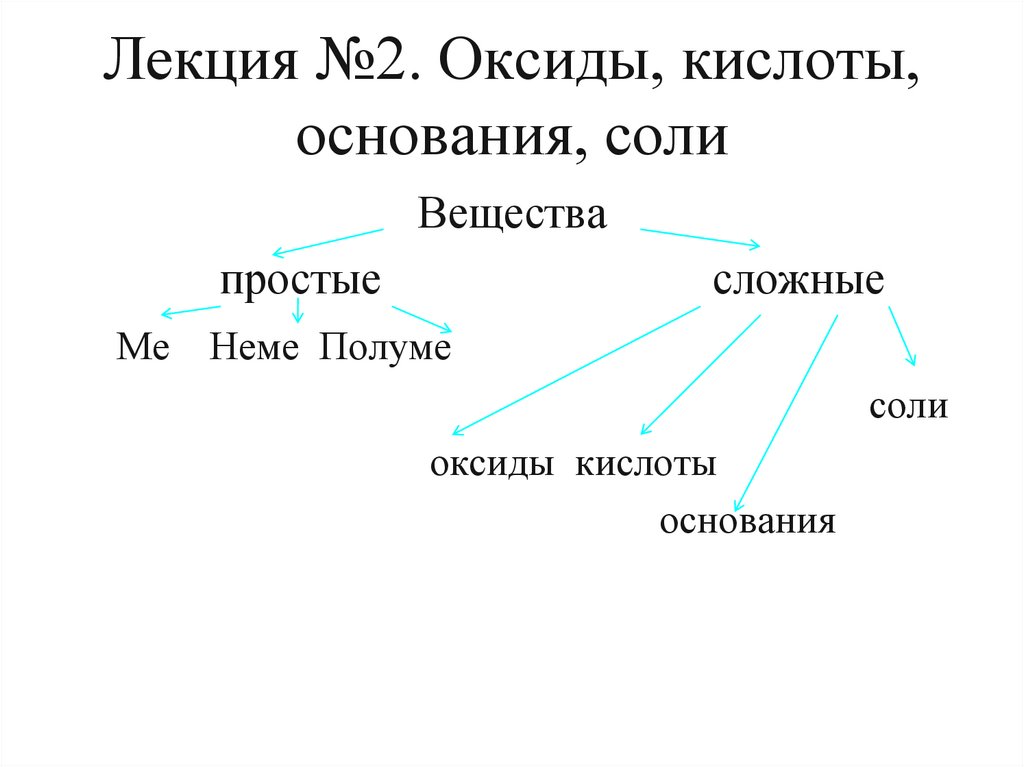
1. Лекция №2. Оксиды, кислоты, основания, соли
Веществапростые
Ме
сложные
Неме Полуме
соли
оксиды кислоты
основания
2. 1. Способы получения оксидов
1.1. Горение простых веществС+O2 = CO2
1.2. Горение сложных веществ
CH4 + 2O2 = CO2 + 2H2O
1.3.Разложение солей и нерастворимых
оснований
CaCO3 = CaO + CO2
2Al(OH)3 = Al2O3 + 3H2O
3. 2. Химические свойства основных оксидов
2.1. С водой - только растворимые основанияNa2O + H2O = 2NaOH
2.2. С кислотами
CuO + H2SO4 = CuSO4 + H2O
2.3. Друг с другом
SO3 + CaO = CaSO4
4. 3. Химические свойства кислотных оксидов
3.1. С водой - только растворимые кислотыSO3 + H2O = H2SO4
3.2. С основаниями
Ca(OH)2 + SO2 = CaSO3 + H2O
3.3. Друг с другом
SO2 + CaO = CaSO3
5. 4. Способы получения кислот
4.1. Оксид Неме + Н2О (кроме кремниевойкислот)
N2O5 + H2O = 2HNO3
4.2. Неме + Н2
Cl2+ H2 = 2HCl
4.3. Соль + кислота
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl
6. 5. Химические свойства кислот
5.1. ИндикаторЛакмус + кислота = красный цвет,
кислая среда
5.2. С металлами – см. ряд напряжений
металлов
Zn + 2HCl = ZnCl2 + H2 ↑
5.3. С основными оксидами
MgO + 2HNO3 = Mg(NO3)2 + H2O
7.
8. Ряд напряжения металлов
9.
5.4. С основаниямиNaOH + HCl = NaCl + H2O
5.5. С солями – если выделяется газ или
осадок
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
CaCO3 +2HCl = CaCl2 + CO2 ↑ + H2O
10. 6. Способы получения щелочей
6.1. Me + H2O2Na + 2H2O = 2NaOH + H2 ↑
6.2. MeO + H2O
K2O + H2O = 2KOH
11. 7. Способы получения нерастворимых оснований
Щелочь + сольFeSO4 + 2NaOH = Fe(OH)2↓ +Na2SO4
12. 8. Химические свойства щелочей
8.1. ИндикаторФенолфталеин + щелочь = малиновый цвет =
щелочная среда
13.
8.2. С кислотами- нейтрализация3KOH + H3PO4 = K3PO4 + 3H2O
8.3. С кислотными оксидами
N2O3 + 2NaOH = 2NaNO2 + H2O
8.4. С солями – осадок
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
14. 9. Химические свойства нерастворимых в воде оснований
9.1. С кислотамиAl(OH)3↓ + 3HCl = AlCl3 + 3H2O
9.2. Pазложение при нагревании
Cu(OH)2 = CuO + H2O
15. 10. Способы получения солей – 10 способов
10.1. Ме + Неме2Na + Cl2 = 2NaCl
10.2. Ме + Соль, смотри ряд напряжений металлов
Fe + CuSO4 = Cu + FeSO4
Cu + FeSO4 =нет
16. 11. Химические свойства солей
11.1. С металламиZn + PbCl2 = ZnCl2 + Pb
11.2. С кислотами – газ или осадок
Na2SO3 + 2HCl = 2NaCl + SO2 ↑ + H2O
11.3. Разложение при нагревании
CaCO3 = CaO + CO2
11.4. С щелочами
ZnCl2 + 2LiOH = Zn(OH)2↓ + 2LiCl







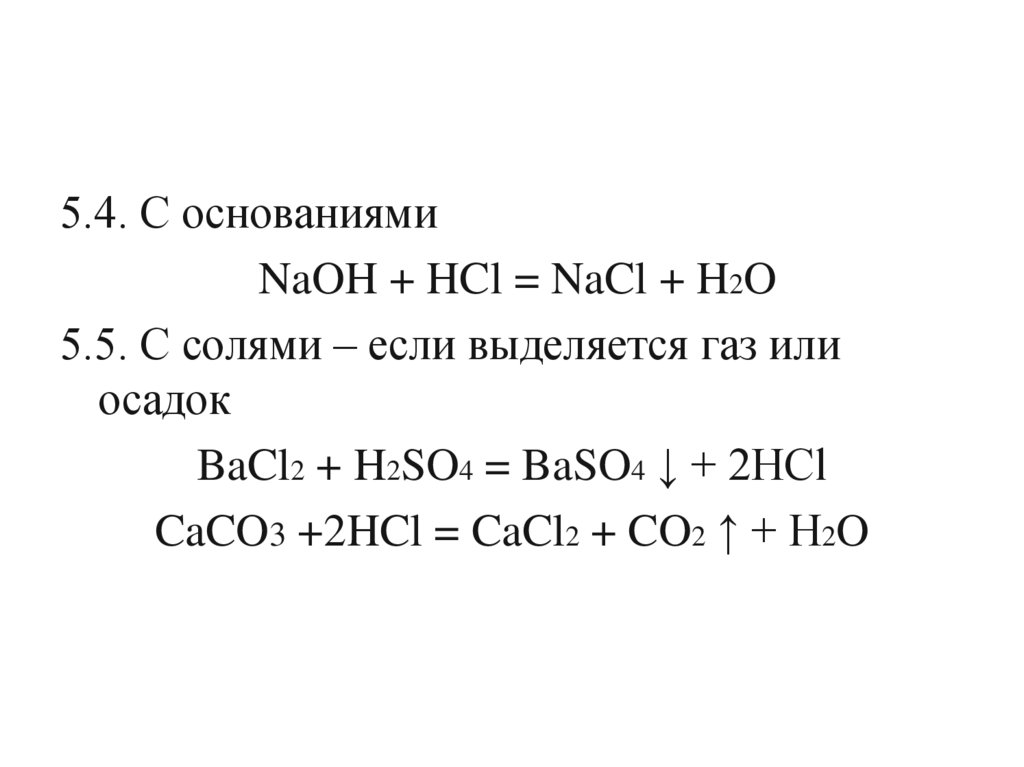







 Химия
Химия








