Похожие презентации:
Строение атома и молекулы с позиции квантовой механики
1.
Строение атома имолекулы с позиции
квантовой механики
2.
Квантовая механика – раздел естественнофизических наук, предназначенный дляизучения квантовых микрообъектов
Микрообъекты для химика – это молекулы и
атомы
3.
Основные принципы КМ1. С точки зрения КМ любой объект может находиться в
строго определенных стационарных состояниях,
переход между которыми осуществляется скачком.
2. Причем в каком состоянии находится объект
определяется вероятностью.
4.
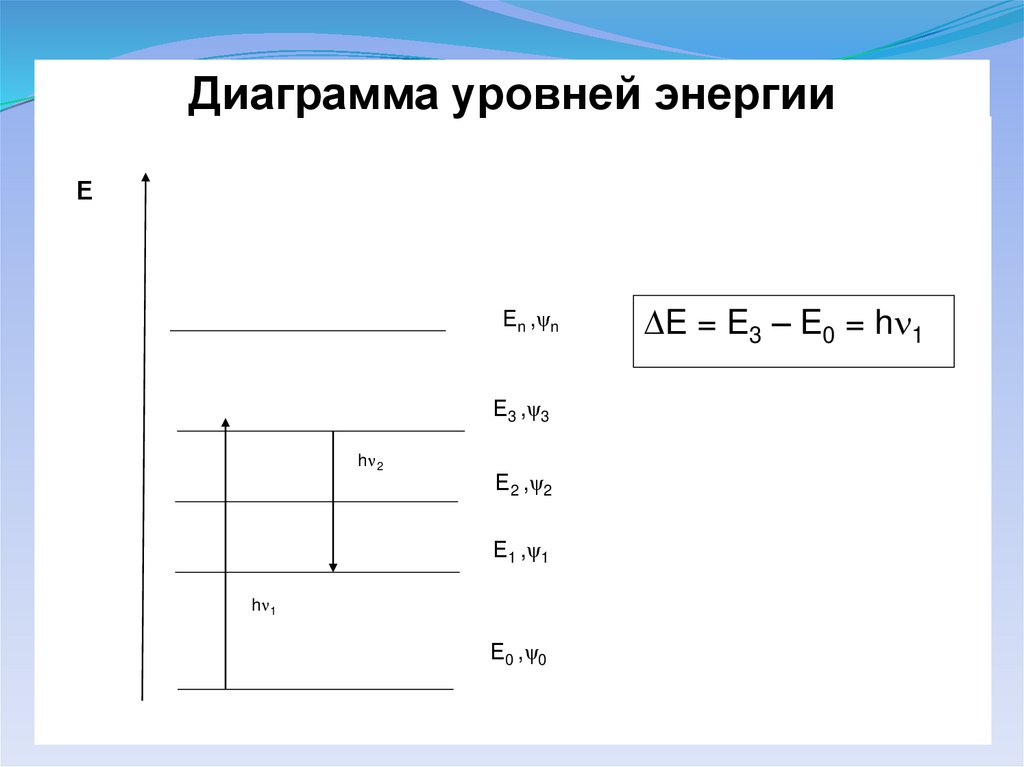
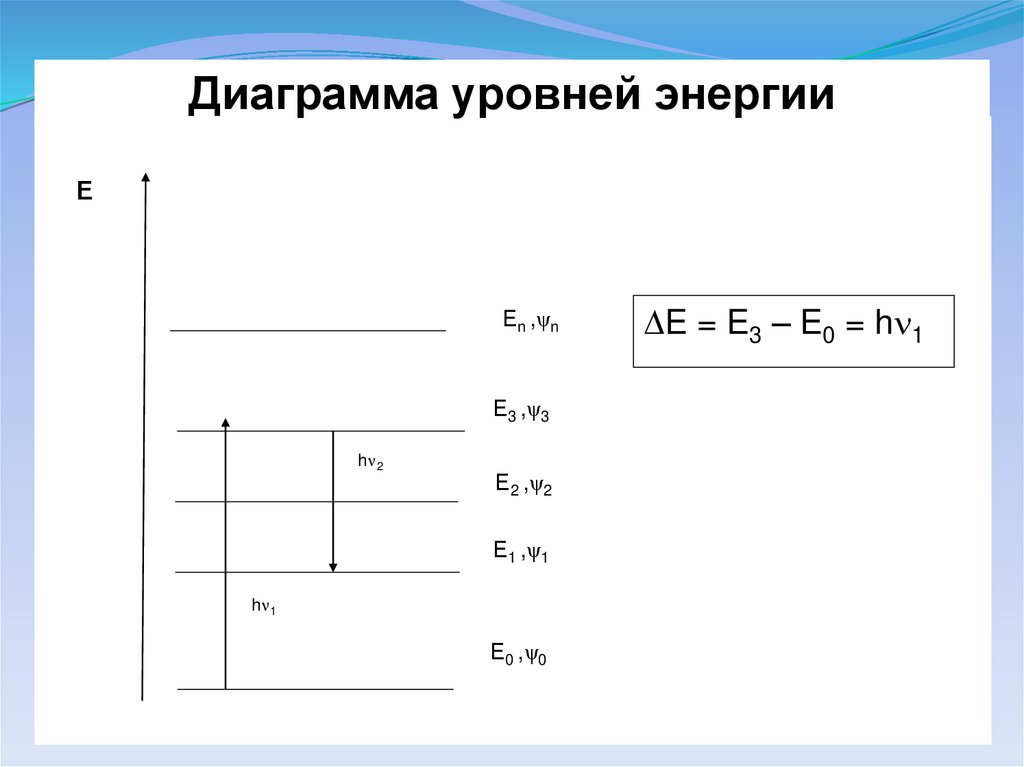
Диаграмма уровней энергииЕ
Еn ,ψn
Е3 ,ψ3
h 2
Е2 ,ψ2
Е1 ,ψ1
h 1
Е0 ,ψ0
E = E3 – E0 = h 1
5.
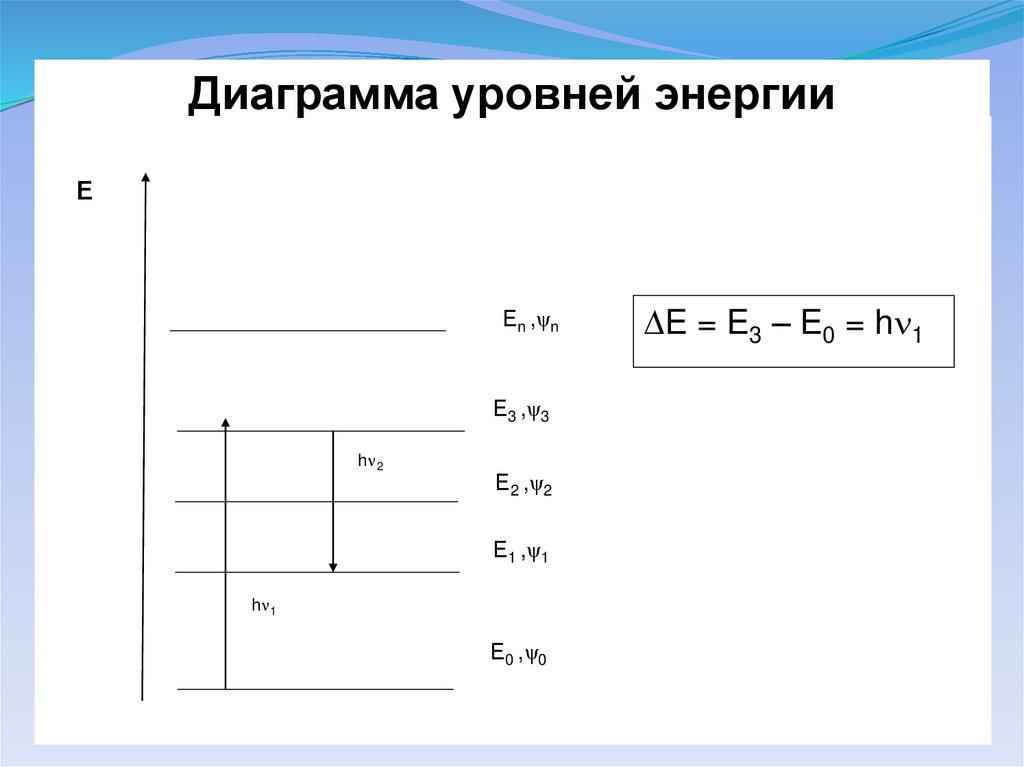
Диаграмма уровней энергииЕ
Еn ,ψn
Е3 ,ψ3
h 2
Е2 ,ψ2
Е1 ,ψ1
h 1
Е0 ,ψ0
E = E3 – E0 = h 1
6.
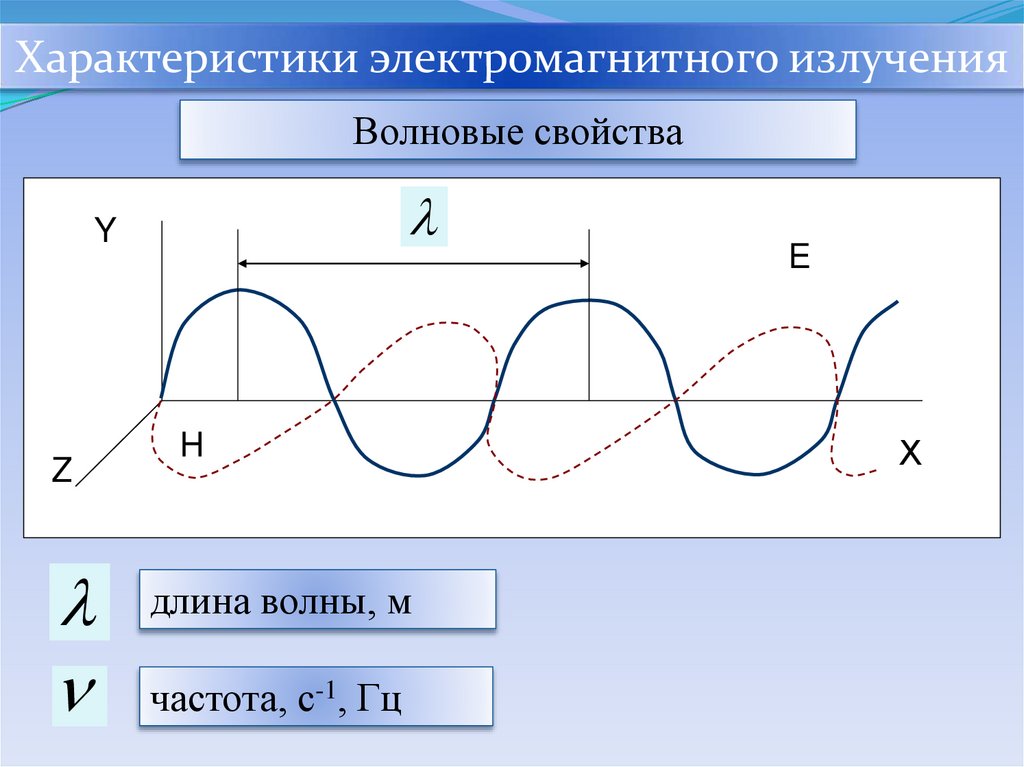
Характеристики электромагнитного излученияВолновые свойства
Y
Z
H
длина волны, м
частота, с-1, Гц
E
Х
7.
Электромагнитное излучение и егохарактеристики
Электромагнитное поле, создаваемое электрическими и
магнитными силами, является одним из видов материи.
Электромагнитное излучение способно проявлять двойственную
природу, т.е. в определенных условиях проявляет волновые
свойства, а в других условиях – корпускулярные (т.е. свойства
частиц).
Волновые свойства:
Преломление
Дифракция
Интерференция и т.п.
Корпускулярные свойства:
Поглощение или
испускание фотонов
(квантов света)
8.
9.
Характеристики электромагнитного излученияВолновые характеристики
Частота (ν) — число колебаний в единицу времени. Для
измерения частоты используют единицу системы СИ —
герц (1 Гц = 1 с–1) или кратные единицы — мегагерц (1 МГц =
1·106 Гц), гигагерц (1 ГГц = 1·109 Гц)
Длина волны (λ) — расстояние, проходимое
электромагнитной волной за время одного полного
колебания. Для измерения длины волны используют
единицу системы СИ — метр (м) или подходящие для
данного диапазона кратные единицы: нанометр (1 нм = 1·10–9
м), микрометр (1 мкм = 1·10–6 м) и др. Внесистемная единица
–– ангстрем (1 Ǻ= 1·10–10 м = 0,1 нм) в настоящее время не
рекомендуется к применению, но, тем не менее, часто
используется.
10.
Волновое число~– число волн в 1 см
Волновое число чаще всего измеряют в обратных
сантиметрах (см–1), в зарубежной литературе эту величину
обозначают как кайзер (К). Для измерения малых разностей
волновых чисел соответственно употребляется милликайзер
(1 мК = 10–3 см–1).
Связь между волновой и корпускулярной природой света
описывается уравнением Планка:
Е h
hc
где ΔЕ — изменение энергии
элементарной системы в
результате поглощения или
испускания фотона с энергией
hν (h — постоянная Планка) h =
6,6262·10–34 Дж·с.
11.
Диаграмма уровней энергииЕ
Еn ,ψn
Е3 ,ψ3
h 2
Е2 ,ψ2
Е1 ,ψ1
h 1
Е0 ,ψ0
E = E3 – E0 = h 1
12.
РЕЗОНАНС – это явление, когда частота внешнеговоздействия совпадает с частотой собственных
процессов. При этом внешнее воздействие и
объект взаимодействуют, обмениваются энергией.
13.
Н̂ ЕДискретный набор - 1, 2 , 3 , 4 ...
Значения энергий - Е 1, Е 2, Е 3, Е 4…
Р (x, y, z) = (x, y, z) 2 dV
14.
Н̂ ЕДискретный набор - 1, 2 , 3 , 4 ...
Значения энергий - Е 1, Е 2, Е 3, Е 4…
Р (x, y, z) = (x, y, z) 2 dV
15.
Н̂ ЕДискретный набор - 1, 2 , 3 , 4 ...
Значения энергий - Е 1, Е 2, Е 3, Е 4…
Р (x, y, z) = (x, y, z) 2 dV
16.
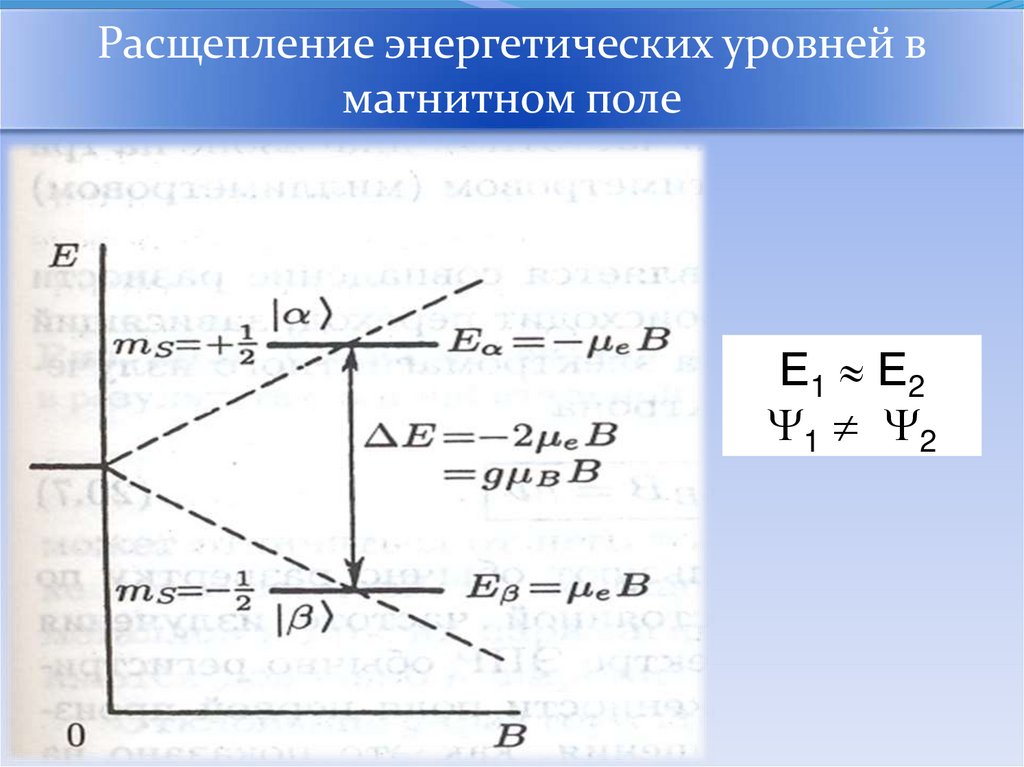
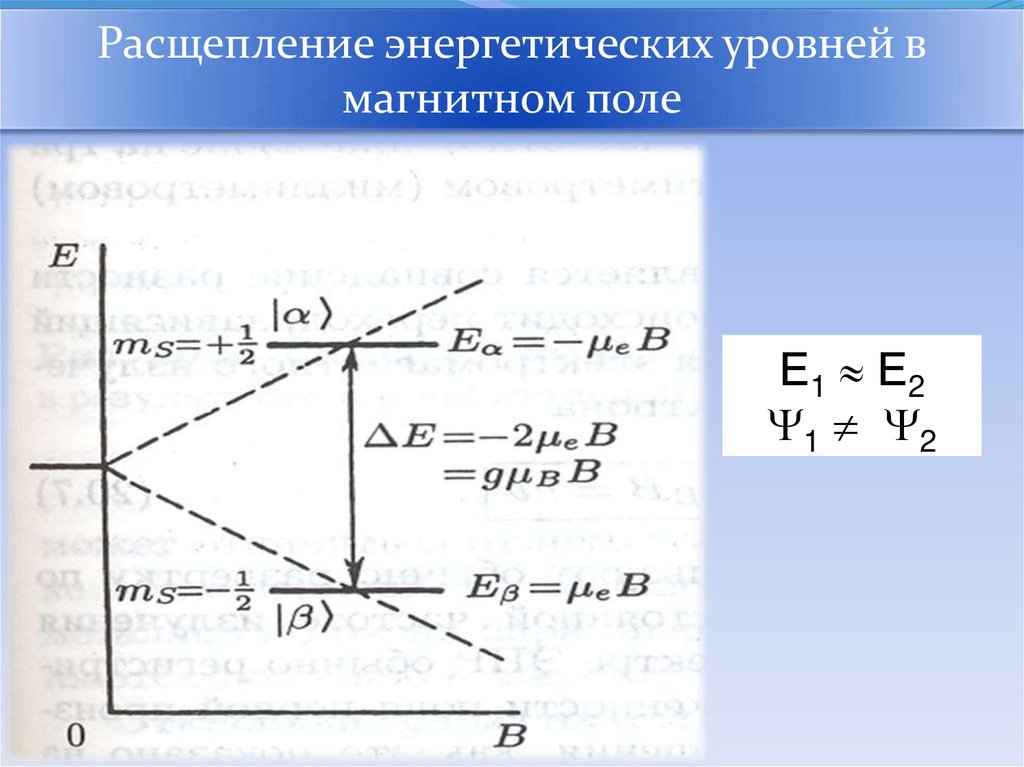
Расщепление энергетических уровней вмагнитном поле
Е1 Е2
1 2
17.
Расщепление энергетических уровней вмагнитном поле
Е1 Е2
1 2
18.
ТЕРМ – набор различных дискретных квантовых чисел,которым соответствует энергетический уровень.
Квантовые числа:
1. Главное квантовое число – n
определяет степень удаления электрона от ядра,
размер облака,n=1 .
2. Орбитальное кв. число – l
характеризует форму электронного облака, l=0 (n-1).
3. Магнитное орбитальное кв. число – ml
характеризует пространственную ориентацию
электронного облака, ml= -l +l .
4. Магнитное спиновое кв. число – ms
характеризует собственный механический момент
электрона, связанный с его вращением вокруг своей
оси, ms = ± ½.
19.
Строение вещества и происхождение спектровСтроение атомов
Атом – дискретная
частица вещества
размером примерно ~ 1010 м (0,1нм). Атом
состоит из ядра и
электронной оболочки.
Электроны в атоме
размещены на разных
энергетических уровнях.
Строение молекул
Молекулы состоят из
атомов, их строение
намного сложнее,
возможны разные
виды взаимодействия
ЭМИ с веществом.
20.
Квантуемые степени свободы у атома и молекулыАТОМ
МОЛЕКУЛА
Электронные
Электронные
переходы
переходы
Колебательные
переходы
Вращательные
переходы
21.
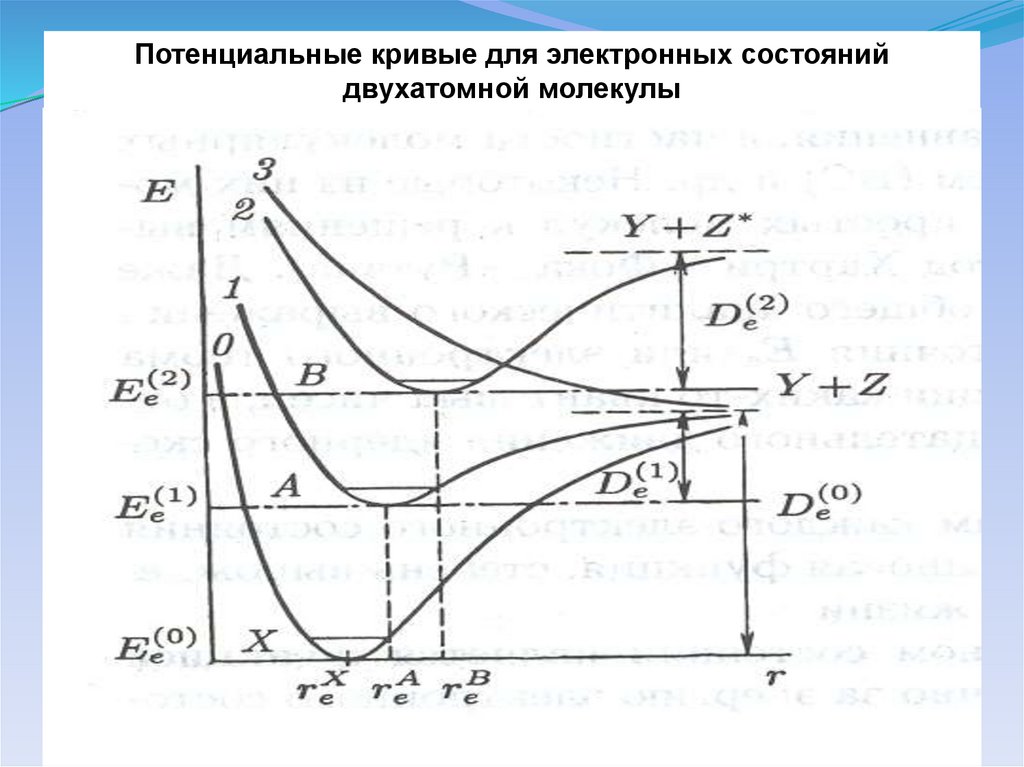
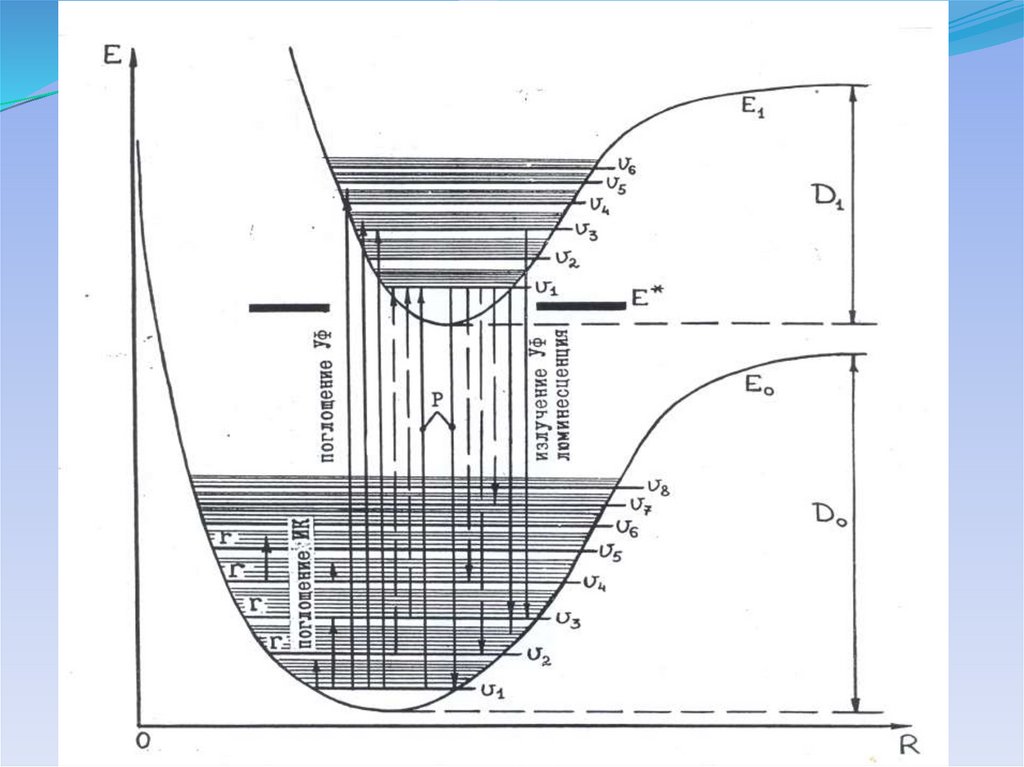
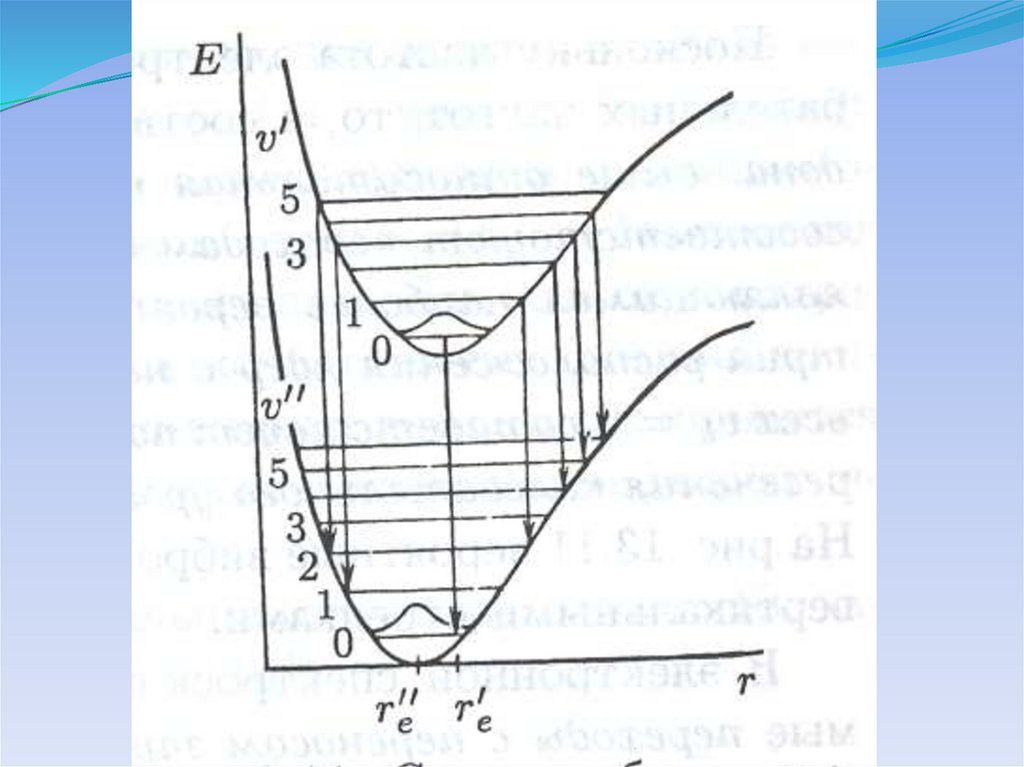
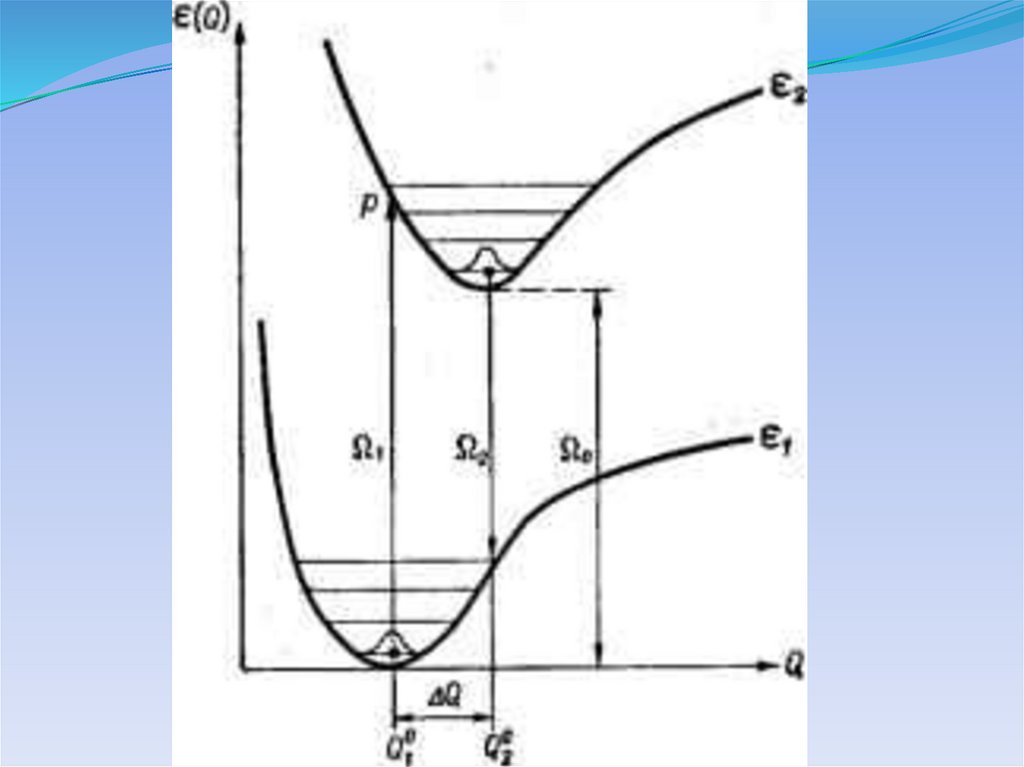
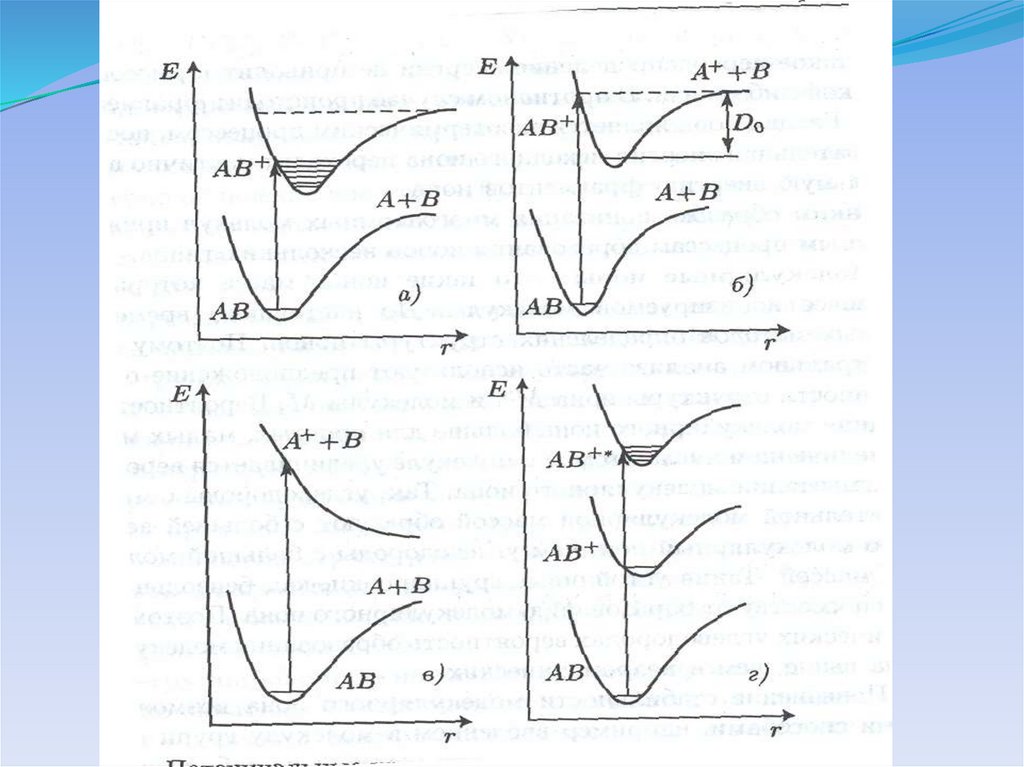
Потенциальные кривые для электронных состоянийдвухатомной молекулы
22.
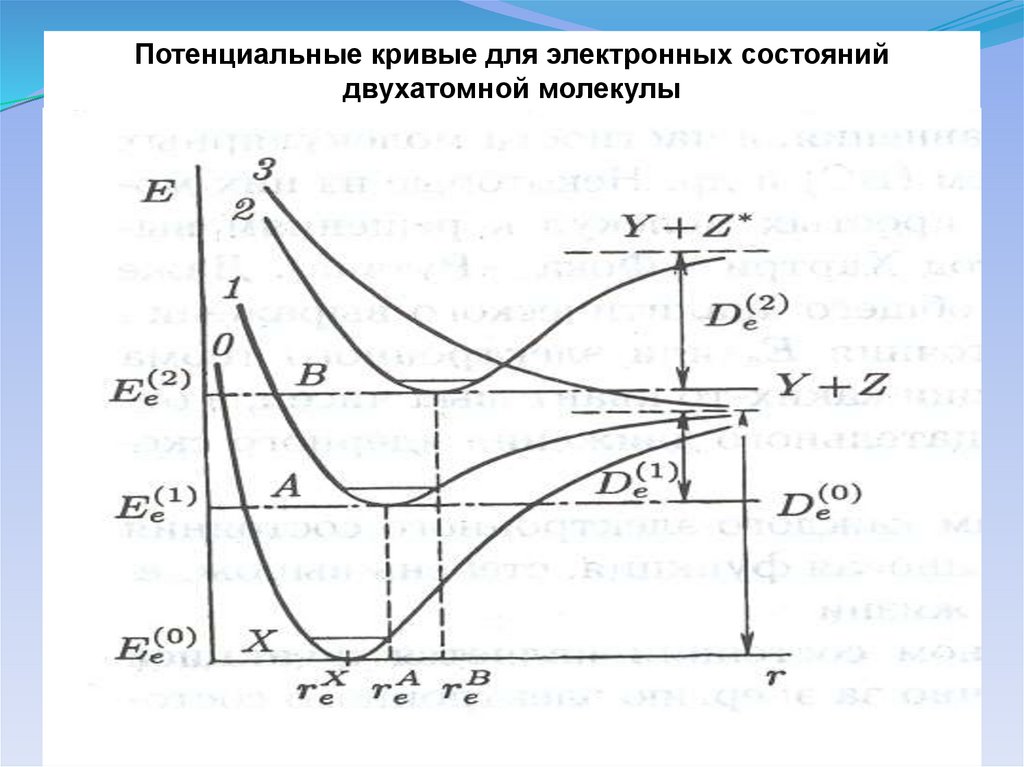
Потенциальные кривые для электронных состоянийдвухатомной молекулы
23.
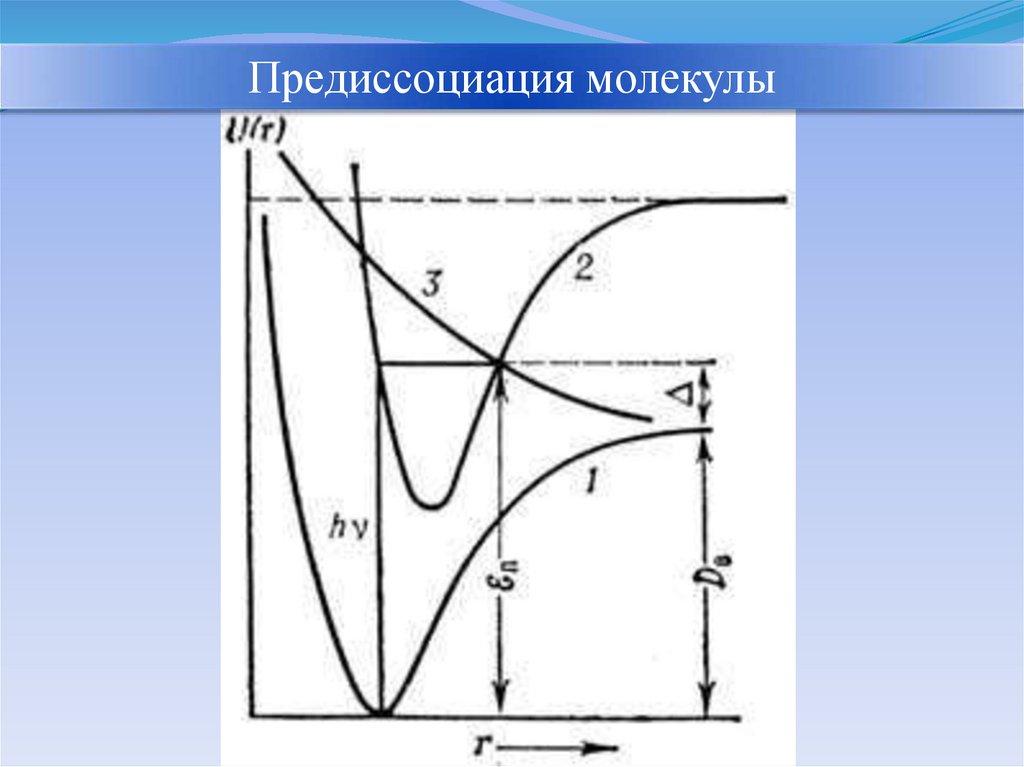
Предиссоциация молекулы24.
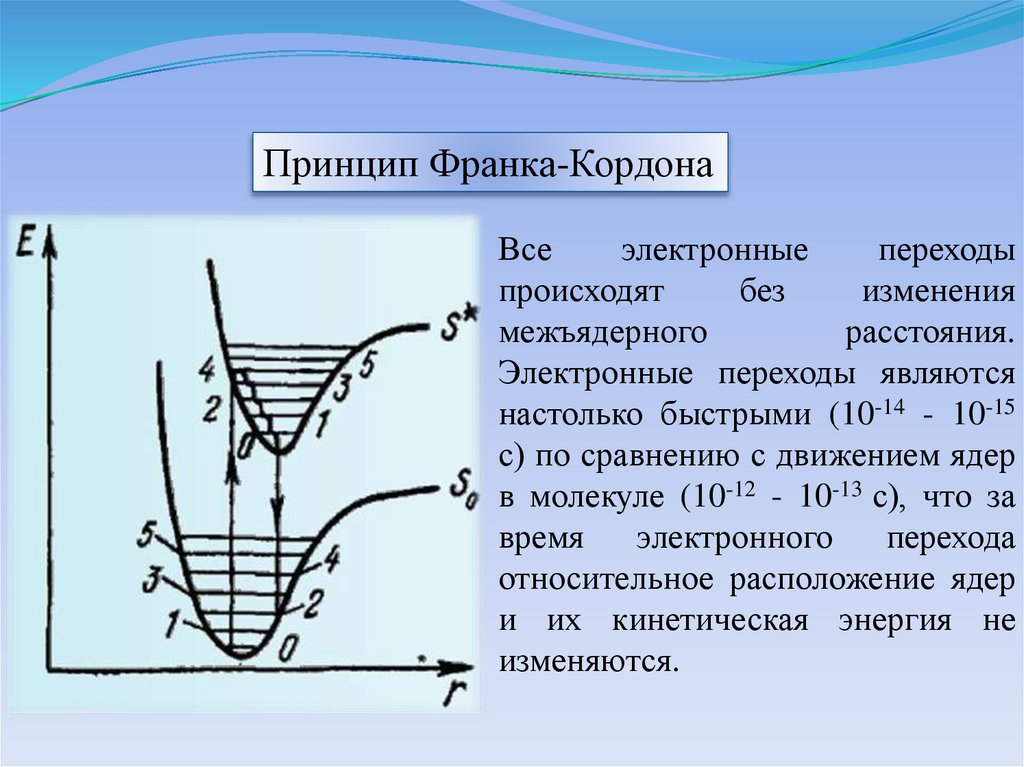
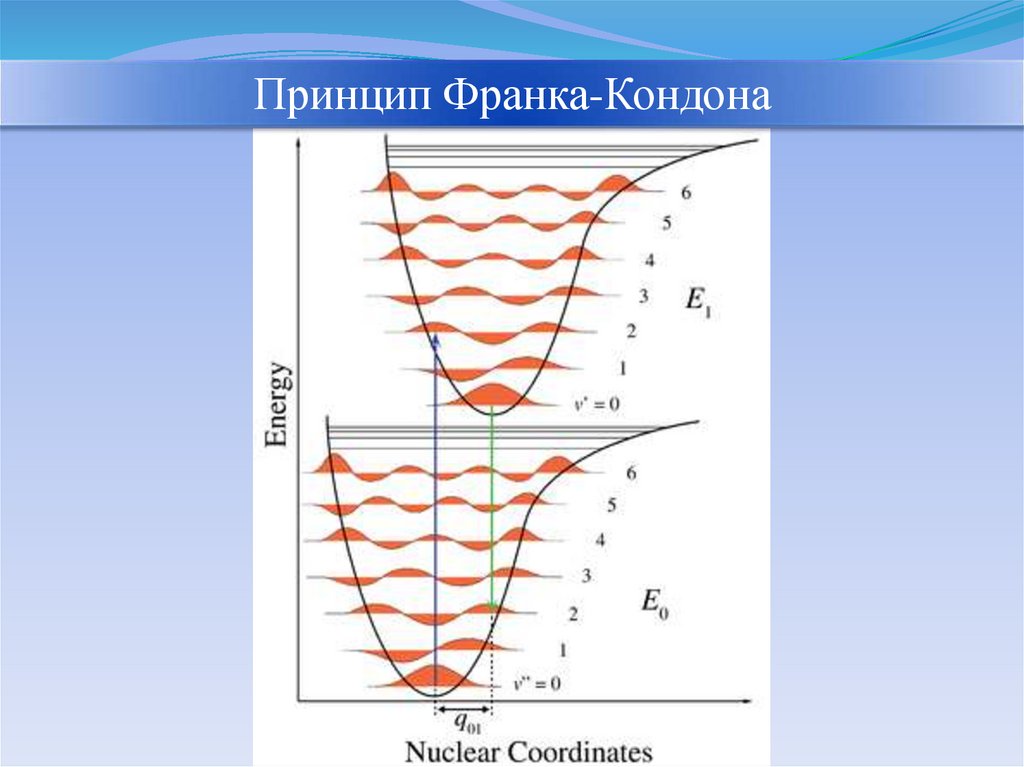
Принцип Франка-КордонаВсе
электронные
переходы
происходят
без
изменения
межъядерного
расстояния.
Электронные переходы являются
настолько быстрыми (10-14 - 10-15
с) по сравнению с движением ядер
в молекуле (10-12 - 10-13 с), что за
время
электронного
перехода
относительное расположение ядер
и их кинетическая энергия не
изменяются.
25.
Принцип Франка-Кондона26.
27.
ФОТОХИМИЯ – раздел науки, который изучаетхимию возбужденных состояний.
Ar + Xe →
Ar + Xe + h → Ar2Xe













 Физика
Физика








