Похожие презентации:
Скорость химических реакции
1. Скорость химических реакций
2.
- раздел химии, который изучает скорости химическихреакций, их зависимость от различных факторов.
Быстрые химические процессы:
взрывы, ионные реакции в растворах,
передача нервного импульса
3.
Медленные химические процессы:Коррозия металлов, фотосинтез, биосинтез белка
Белки обновляются наполовину за 70 суток
Неорганическая основа костных тканей за 4-7 лет
4.
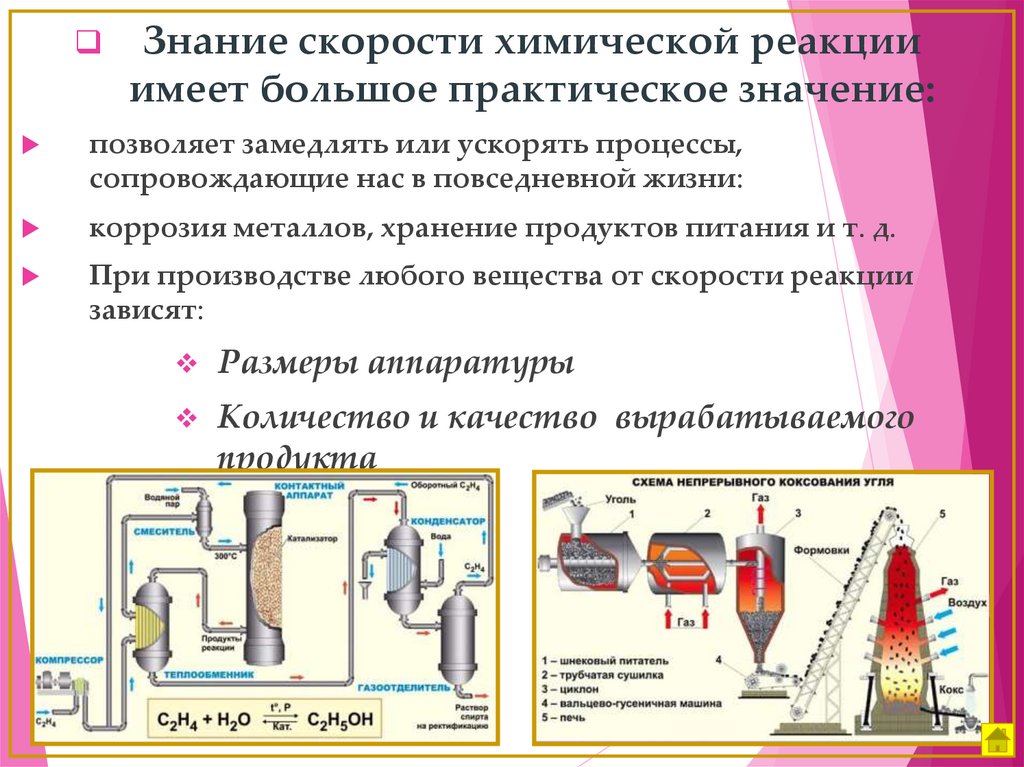
Знание скорости химической реакцииимеет большое практическое значение:
позволяет замедлять или ускорять процессы,
сопровождающие нас в повседневной жизни:
коррозия металлов, хранение продуктов питания и т. д.
При производстве любого вещества от скорости реакции
зависят:
Размеры аппаратуры
Количество и качество вырабатываемого
продукта
5. Лабораторный опыт 6 стр. 19
Прочитайте ход опытаЗапишите уравнения химических
реакций
Чем различаются химические реакции?
6. T
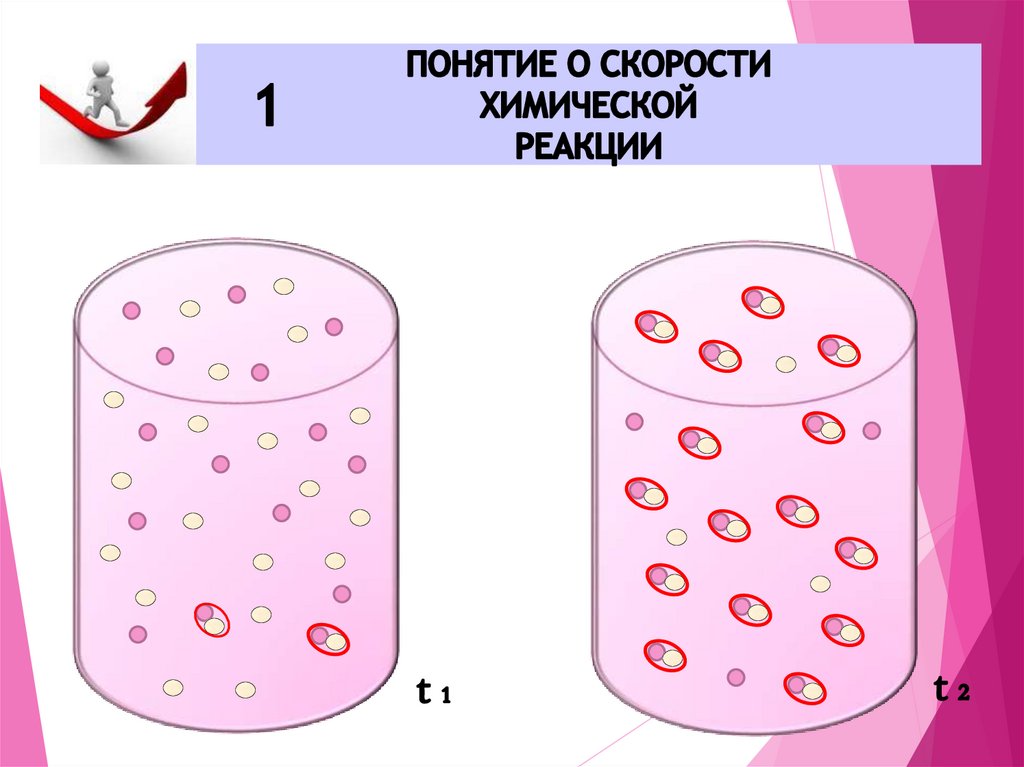
7. ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВЕЩЕСТВА ЗА Единицу ВРЕМЕНИ НАЗЫВАЕТСЯ СКОРОСТЬЮ ХИМИЧЕСКОЙ РЕАКЦИИ
CC2 – C1
V= ±
=±
t2 –t1
∆t
∆
V - скорость химической реакции
изменение молярной
∆C - концентрации
- временной интервал
∆t
моль/(л · с)
моль / л
с
8.
9.
Реакция происходит при столкновении молекул реагирующих веществ,её скорость определяется количеством столкновений и их силой
(энергией)
Природа
реагирующих
веществ
Площадь
соприкосновения
Концентрация
Катализатор,
ингибитор
Давление
Температура
10. Влияние ПРИРОДЫ ВЕЩЕСТВ
+ Mg+ Zn
HCl
Mg + 2HCl = MgCl2 + H2↑
+ Fe
HCl
Zn + 2HCl = ZnCl2 + H2↑
HCl
Fe + 2HCl = FeCl2 + H2↑
Лабораторный опыт 7,8
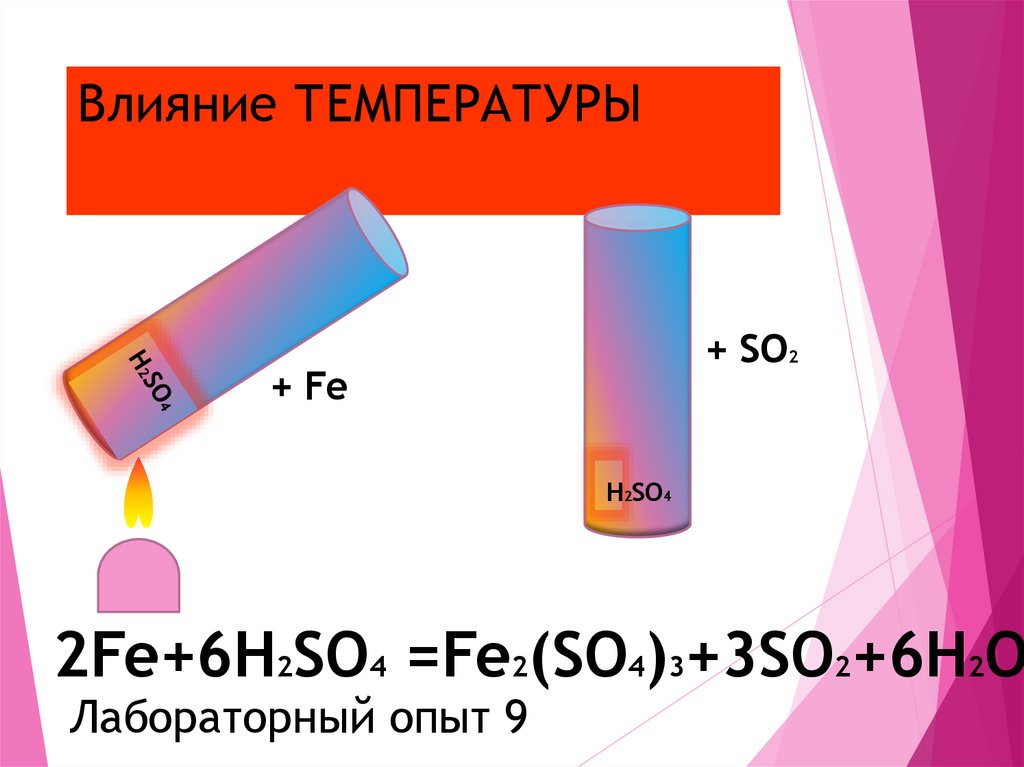
11. Влияние ТЕМПЕРАТУРЫ
+ SO2+ Fe
H2SO4
2Fe+6H2SO4 =Fe2(SO4)3+3SO2+6H2O
Лабораторный опыт 9
12. Влияние концентрации
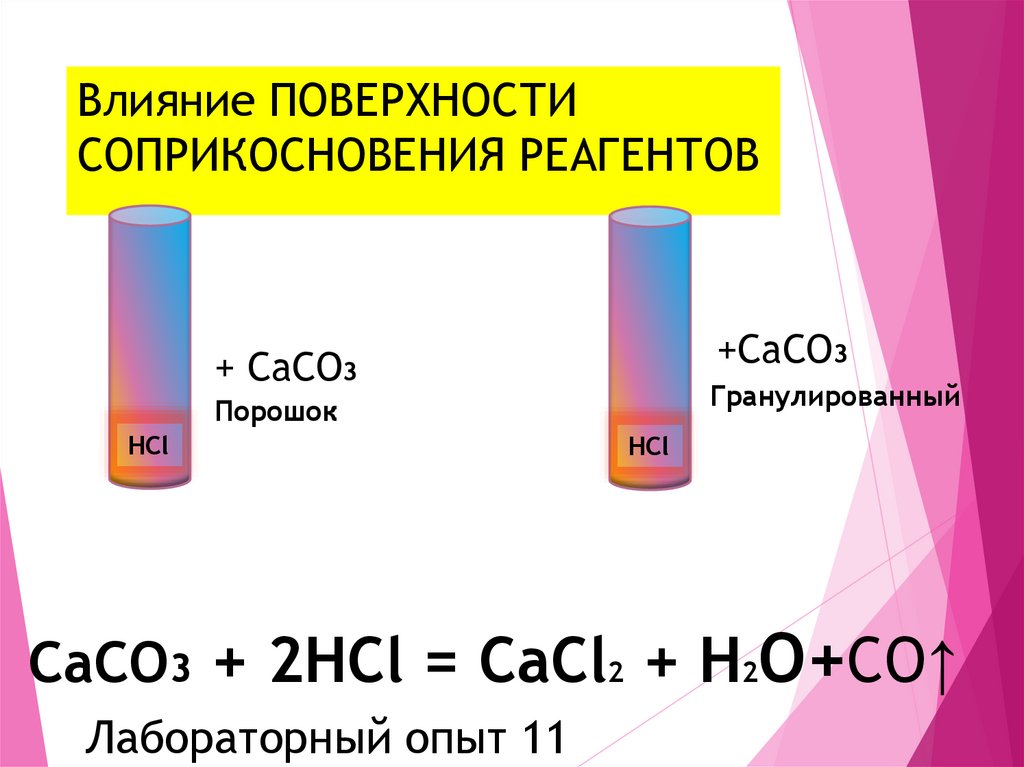
Лабораторный опыт 1013. Влияние ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ РЕАГЕНТОВ
+CaCO3+ CaCO3
Гранулированный
Порошок
HCl
HCl
CaCO3 + 2HCl = CaCl2 + H2O+CO↑
Лабораторный опыт 11
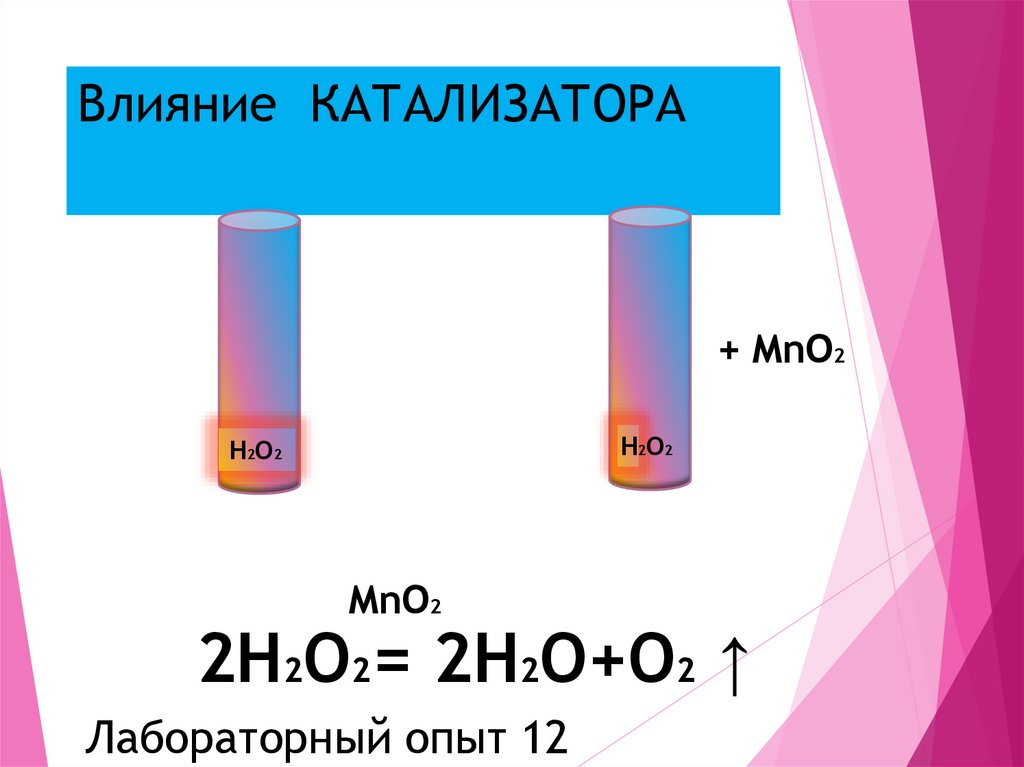
14. Влияние КАТАЛИЗАТОРА
+ MnO2H2O2
H2O2
MnO2
2H2O2= 2H2O+O2 ↑
Лабораторный опыт 12
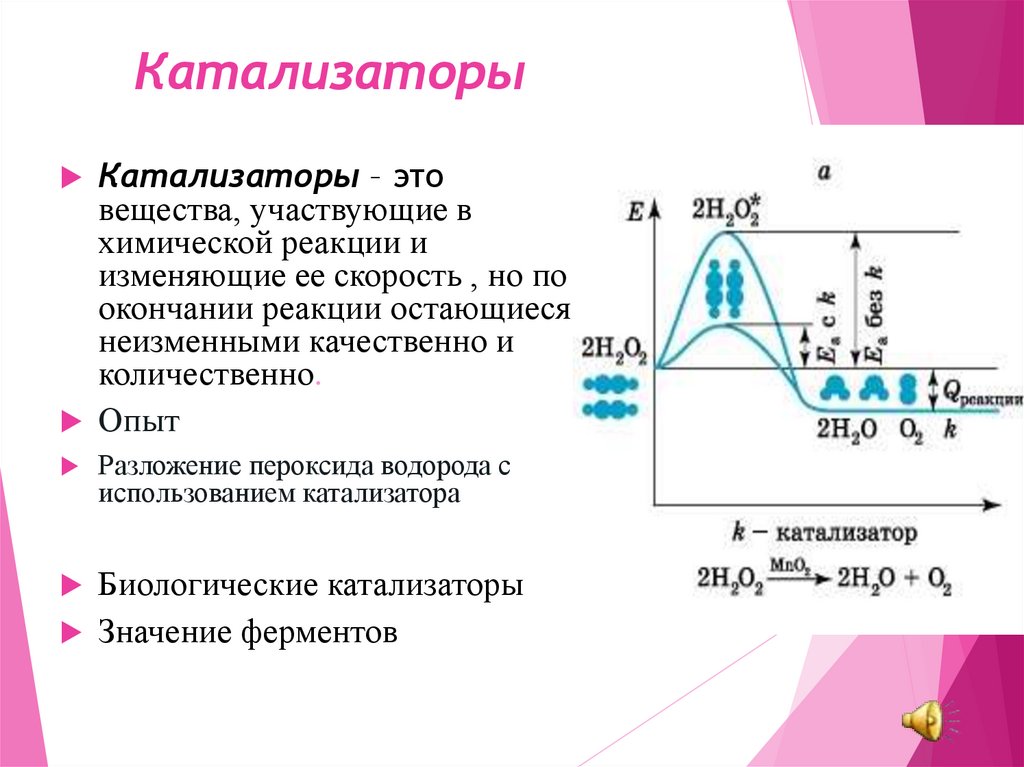
15. Катализаторы
Катализаторы – этовещества, участвующие в
химической реакции и
изменяющие ее скорость , но по
окончании реакции остающиеся
неизменными качественно и
количественно.
Опыт
Разложение пероксида водорода с
использованием катализатора
Биологические катализаторы
Значение ферментов
16. САМОПРОВЕРКА
ПРИМЕР1.Скорость
химической
реакции
определяется
изменением концентрации одного из реагирующих
веществ или одного из продуктов реакции в единицу
времени.
2.Катализатор понижает скорость химической реакции.
3.Скорость химической реакции не зависит от
температуры.
4. Порошок цинка взаимодействует с серной кислотой
медленнее, чем гранулы.
5. Оксид меди (II) быстрее взаимодействует с серной
кислотой при 60ºС, а не при 20ºС.
6.В чистом кислороде горение происходит интенсивнее,
чем в воздухе.
7. Для уменьшения скорости химической реакции
необходимо увеличить концентрацию реагирующих
ДА
НЕТ
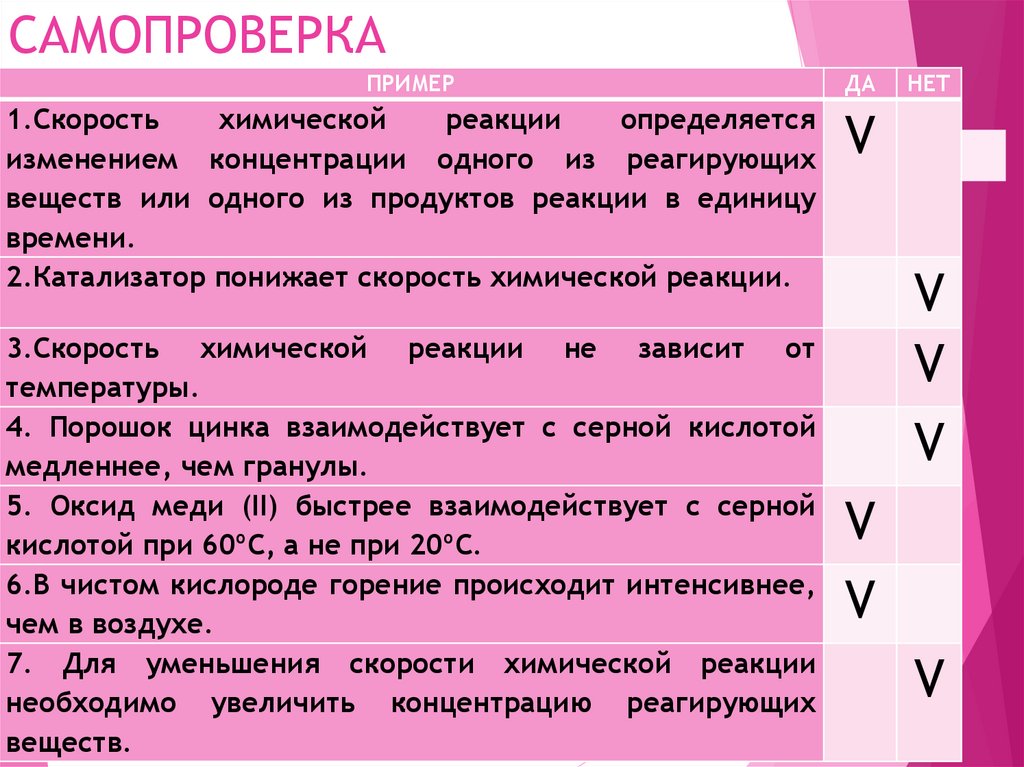
17. САМОПРОВЕРКА
ПРИМЕРДА
1.Скорость
химической
реакции
определяется
изменением концентрации одного из реагирующих
веществ или одного из продуктов реакции в единицу
времени.
2.Катализатор понижает скорость химической реакции.
V
3.Скорость химической реакции не зависит от
температуры.
4. Порошок цинка взаимодействует с серной кислотой
медленнее, чем гранулы.
5. Оксид меди (II) быстрее взаимодействует с серной
кислотой при 60ºС, а не при 20ºС.
6.В чистом кислороде горение происходит интенсивнее,
чем в воздухе.
7. Для уменьшения скорости химической реакции
необходимо увеличить концентрацию реагирующих
веществ.
НЕТ
V
V
V
V
V
V
18. Домашнее задание
Параграф 3. Вопросы послепараграфа.
Задание 3,5 письменно











 Химия
Химия








