Похожие презентации:
pH в водных растворах, буферные системы. Лекция 4
1. Лекция 4
pH в водных растворах,буферные системы
2.
Теория электролитическойдиссоциации (ТЭД) эл-тов Аррениуса это теория слабых эл-тов.
Важн. хар-ки слабого эл-та;
взаимосвязь уст. з-н Оствальда.
Факторы, влияющие на :
2
Kд
≈
Сα
1. природа в-ва
Кд
растворителя (дип. момент, диэлектр. проницаемость)
характер хим. связи в молекуле растворенного в-ва.
2. концентрация вещества ( с С, ↓)
3. температура (с Т, )
4. наличие одноименных ионов
(пр. Ле-Шателье):
3. СН3СООН СН3СОО Н
СН3СООН СН3СОО На) НCl, H+, х.р. ,
б) СН3СООNa, СН3СОО⁻ , х.р. ,
в) NaOH, OH⁻, х.р. ,
К д зависит:
= f (C, Т)
от природы электролита
от температуры: Т , К д
Кд ≠ f (C) , поэтому можно сравнивать силу
эл-тов. Чем больше Кд, тем сильнее эл-т.
4. Константы диссоциации некоторых слабых электролитов
HClO3,0 10
8
CH3COOH
HF
1,8 10
6,8 10
5
Увеличение силы кислот
4
5. Теория сильных электролитов (1923 г, Дебай, Хюккель)
1. Сильные эл-ты в водных р-рах диссоциируютполностью, т.е. для них = 1 или 100 %.
Понятия и Кд к сильным эл-там неприменимы.
2. В растворах ионы за счет сильного иондипольного вз-ия с молекулами Н2О
окружены гидратными оболочками.
3. Сильное ион-ионное вз-ие создает ионные
атмосферы (каждый гидратированный ион
окружен гидратированными ионами
противоположного заряда).
6.
В растворах сильных электролитов вместоконцентрации пользуются активностью а (условная
эффективная концентрация), моль/л.
а fa C
аналитическая
концентрация, моль/л
коэффициент активности (безразмерная
величина).
Коэффициент активности fa характеризует
отклонение
некоторых
свойств
реального
раствора сильного электролита от свойств
раствора при бесконечном разведении при
отсутствии межионных взаимодействий.
fa < 1. (fa ≈ кажущаяся ).
В сильно разбавленных р-рах fa 1; а С
Для реальных р-ров
7. fa зависит от :
1. концентрации раствораС , fa
С 0, fa 1
2. природы иона (заряд и радиус):
Z , fa ;
r , fa , если Z = cоnst;
3. температуры: Т , fa
4. природы растворителя ( , )
5. ионной силы раствора (I ): I , fa
8. Другой количественной характеристикой сильных электролитов является ионная сила раствора ( I ).
I = 1/2ƩCmi ∙Z2i
Cmi – моляльность данного иона,
Z2i заряд каждого иона.
моль/кг,
Ионная сила раствора – это мера
напряженности
электрического
поля
в
растворе, создаваемом всеми ионами в
растворе,
учитывает
электростатическое
взаимодействие всех ионов
9. Ионная например,
Ионная сила биологических жидкостей,например, плазмы крови ~0,15 моль/кг .
Изотонический раствор 0,85% (0,15 М) р-р NaCl ,
I= 0,15 моль/кг.
Сm (NaCl) = 0,15 моль/ кг
1
2
2
I (0,15 1 0,15 1 ) 0,15 моль / кг
2
Na
Cl
Между ионной силой раствора I и средним
коэффициентом
активности
для
данного
электролита fa существует взаимосвязь.
10. lg fa 0,5 Z Z I
Для разбавленных растворов, в которых I ≤ 0,01:lg fa 0,5 Z Z I
Для растворов электролитов с одинаково
заряженными ионами (MgSO4):
lg f a 0,5Z
2
I
Чем больше ионная сила раствора и величина
заряда
ионов,
тем
меньше
коэффициент
активности.
11. Протонная теория кислот и оснований.
Теория Бренстеда – Лоури (1923 г.)Основные положения :
1. Кислота - всякая частица (молекула,
ион) отдающая протон, т.е. донор
протонов.
Основание – частица, присоединяющая
протон, т.е. акцептор протонов.
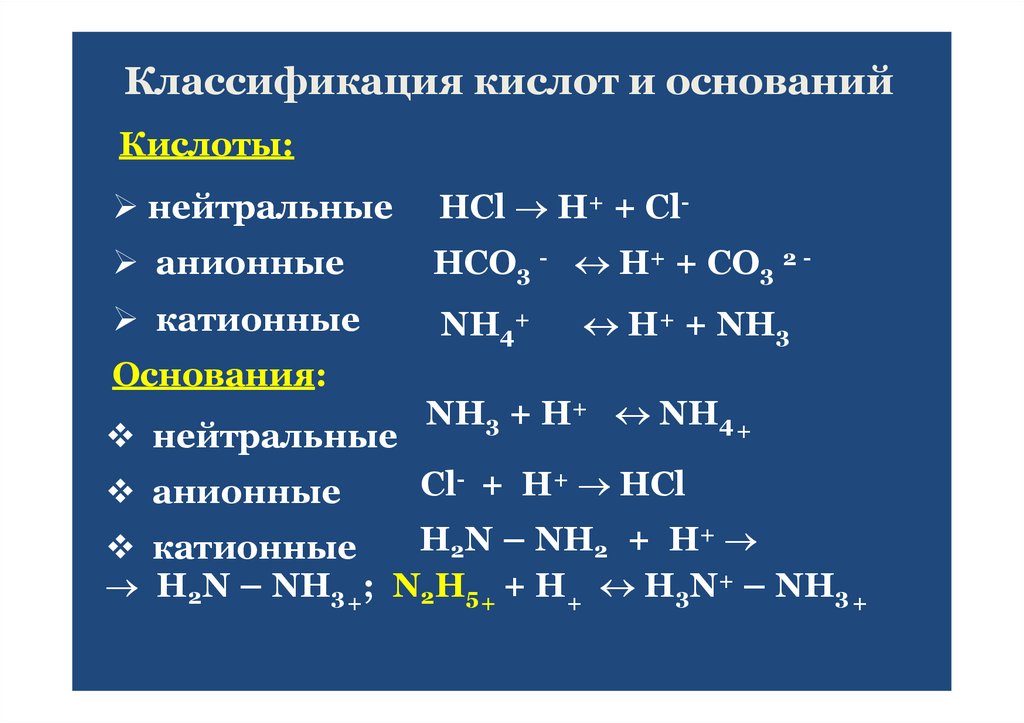
12. Классификация кислот и оснований
Кислоты:нейтральные
НCl H+ + Cl-
анионные
HCO3 - H+ + CO3 2 -
катионные
NH4+
Основания:
H+ + NH3
нейтральные
NH3 + H+ NH4 +
анионные
Сl- + H+ HCl
H2N – NH2 + H+
катионные
H2N – NH3 +; N2H5 + + H+ H3N+ – NH3 +
13. 2. Кислоты и основания существуют только как сопряженные пары: кислота, отдавшая протон, превращается в сопряженное ей
основание, а основание, приняв протон,превращается в сопряженную ему кислоту.
Кислота
Н3О+
Н2О
NH4+
CH3COOH
HCl
H2PO4 -
протон
Н+
Н+
Н+
Н+
Н+
Н+
+
+
+
+
+
+
+
основание
Н2О
ОНNH3
CH3COOClHPO4 2-
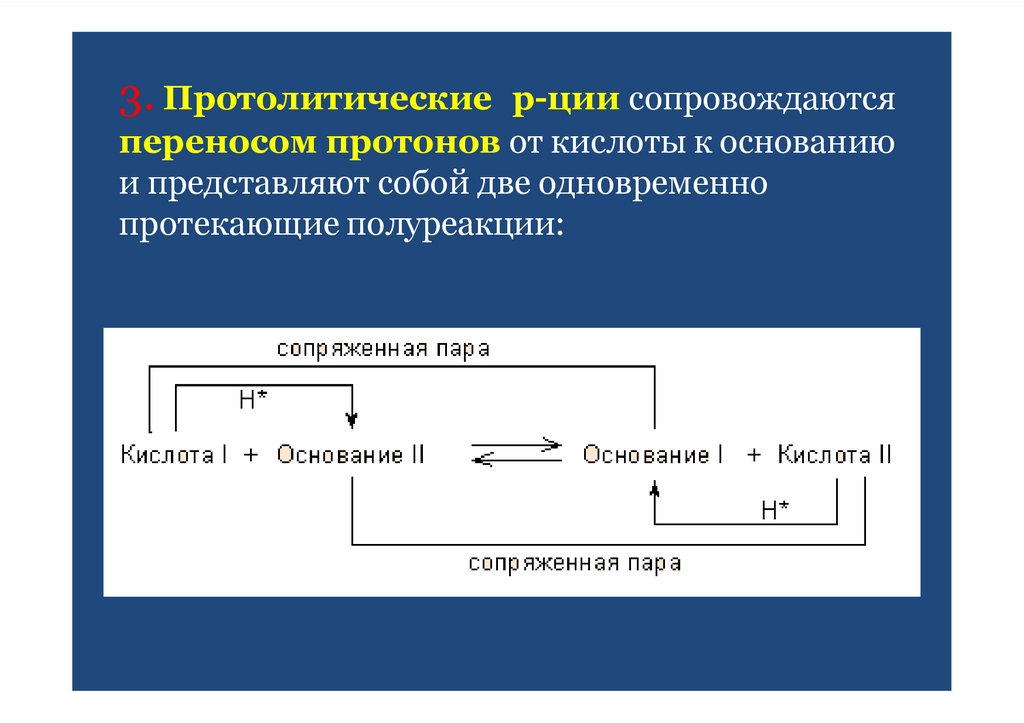
14. 3. Протолитические р-ции сопровождаются переносом протонов от кислоты к основанию и представляют собой две одновременно
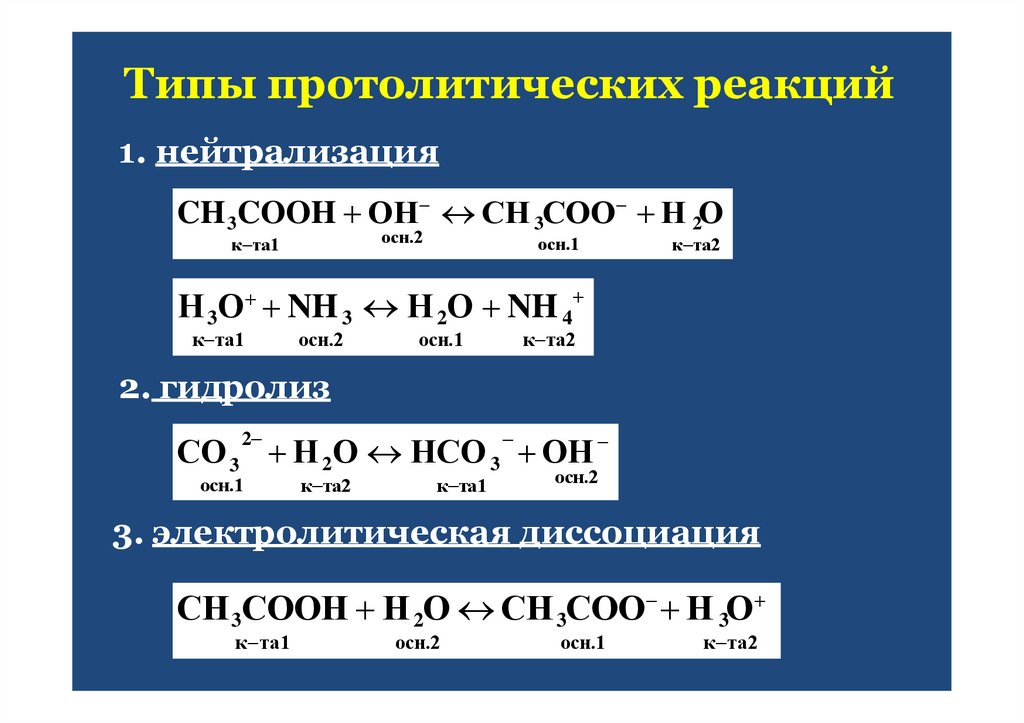
протекающие полуреакции:15. Типы протолитических реакций
1. нейтрализацияCH 3COOH ОН СН 3СОО Н 2О
осн.2
к та1
осн.1
к та2
Н 3О NH 3 Н 2О NH 4
к та1
осн.2
осн.1
к та2
2. гидролиз
СО 3 Н 2О НСО 3 ОН
2
осн.1
к та2
к та1
осн.2
3. электролитическая диссоциация
СН 3СООН Н 2О СН 3СОО Н 3О
к та1
осн.2
осн.1
к та2
16.
4.Кислотно-основные св-ва в-во проявляет вконкретной хим. р-ции. В зависимости от
партнера в-ва могут быть амфолитами.
Характеристика воды как амфолита
НСl Н 2О Cl Н 3О
к та1
осн.2
осн.1
к та2
NH3 Н 2О NH 4 ОН
осн.1
к та2
к та1
осн.2
5. Протон в водных растворах гидратирован,
существует в виде иона –гидроксония Н3О+
17. Классификация растворителей
1. апротонные (нет Н+) : СS2, CCl4 и др.2. протолитические :
протогенные – отдают Н+
(Н2SO4, CH3COOH)
протофильные - присоединяют Н+
(NH3 жидкий)
амфипротонные (Н2О)
18. Теория Льюиса
• Кислота – акцептор электронной пары• Основание – донор электронной пары
• H+[] + :OH- → H2O
• H3N:
+
[]BF3 →
H3N-BF3
19. H O H O ОН Н О
Диссоциация воды. Ионноепроизведение воды.
H 2O H 2O ОН Н 3О
к та 1
осн.1
осн.2
к та 2
автопротолиз
Н2О Н+ + ОН
сокращ.
[H ] [OH ]
16
Кд
1,8 10
[H 2O]
const
0
(25 C)
20.
(Н2О) =1,8 10-9 , это значит, что из50 000 000 молекул распадается - 1
1000
m
[H 2O]
55,56 моль/л
M 18 г/моль
(t 250 C и Р 1 атм.)
К д [H 2O] [H ] [OH ] K H 2O const
Ионное произведение воды
KН2О [H ] [OH ] 1,8 10 55,56 10
16
14
KW
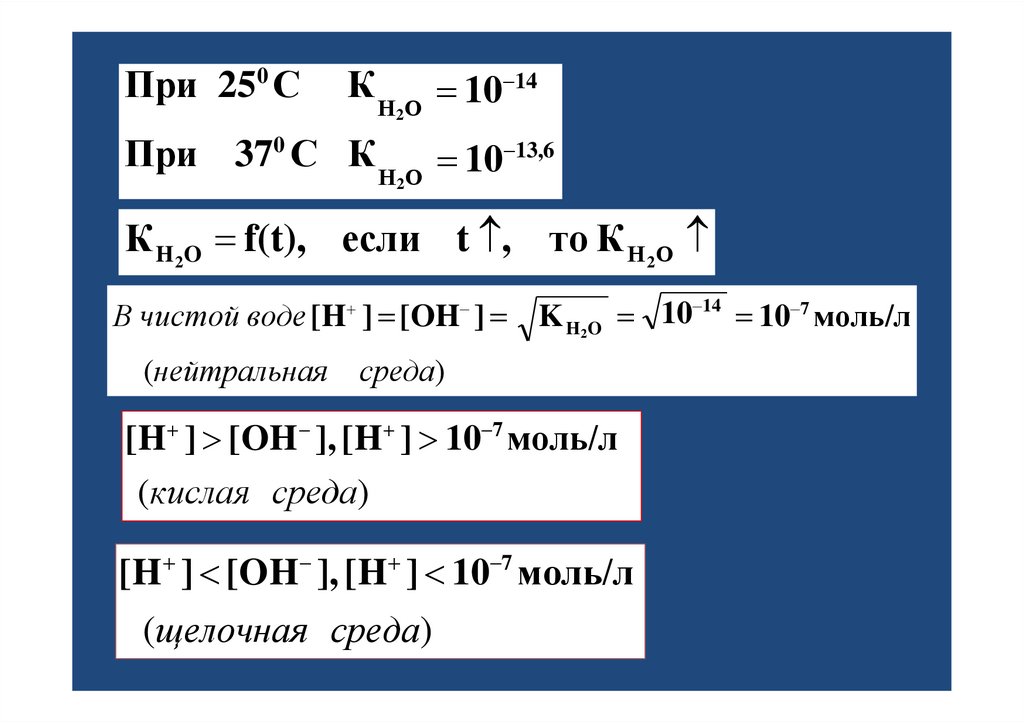
21. При 250 С К При 370 С К
При 250 СК Н О 10 14
2
При 370 С К Н О 10 13,6
2
К H 2O f(t), если t , то К Н 2О
В чистой воде [H ] [OH ] K H2O 10 14 10 7 моль/л
(нейтральная среда)
[H ] [OH ], [H ] 10 7 моль/л
(кислая среда)
[H ] [OH ], [H ] 10 7 моль/л
(щелочная среда)
22.
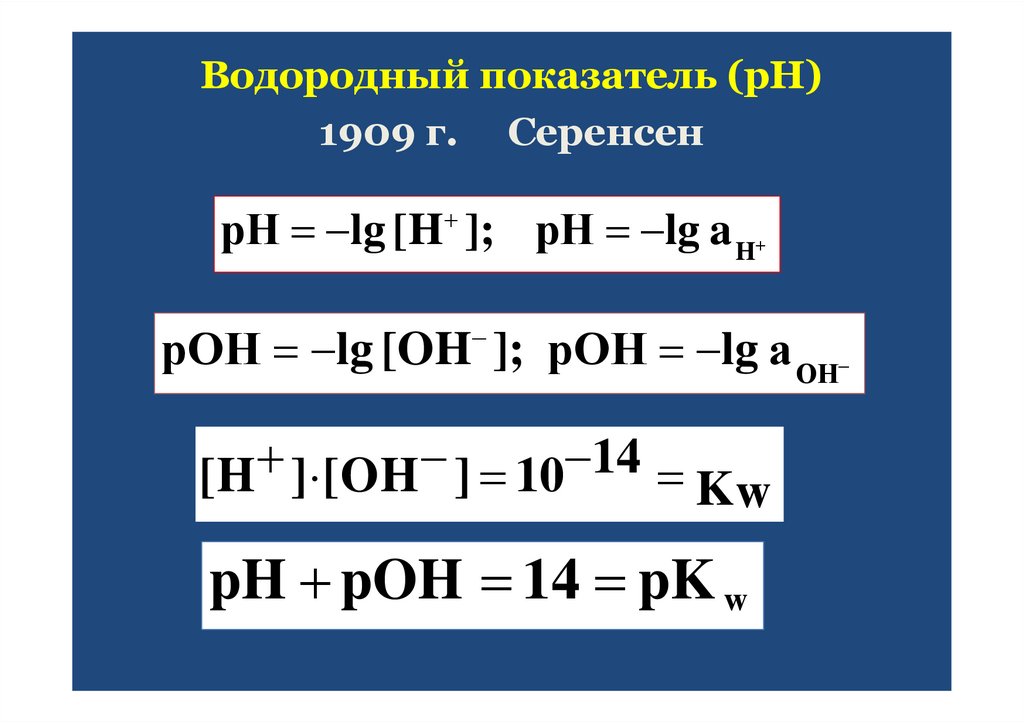
Водородный показатель (рН)1909 г. Серенсен
рН lg [H ]; рН lg a H
рОН lg [OH ]; рОН lg а ОН
14
[H ] [OH ] 10
Kw
pH pOH 14 pK w
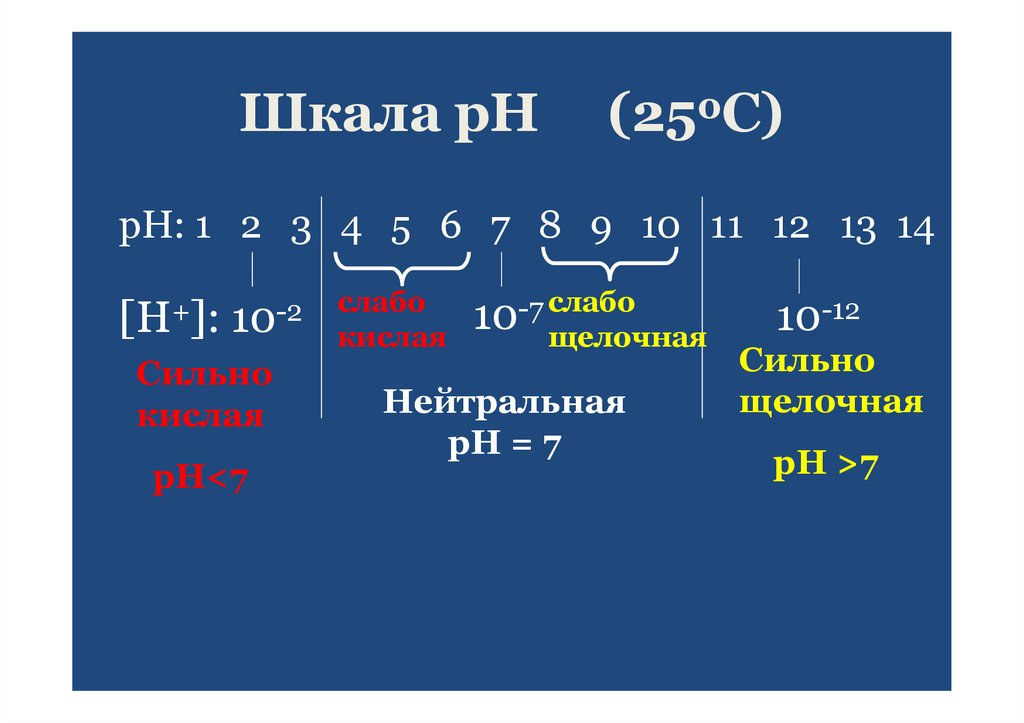
23. Шкала рН
(250С)рН: 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[H+]: 10-2
Сильно
кислая
рН<7
слабо
кислая
10-7 слабо
щелочная
Нейтральная
рН = 7
10-12
Сильно
щелочная
рН >7
24. Расчет рН растворов
I. Сильных кислот и оснований fa 1а) НСl Н Сl , [H ] Cн (к ты)
рН lg [H ] lg C н (к ты)
б) NaOH Na OH , [OH ] C н (щел.)
рОН lg [OH ] lg C н (щел.)
рН 14 рОН
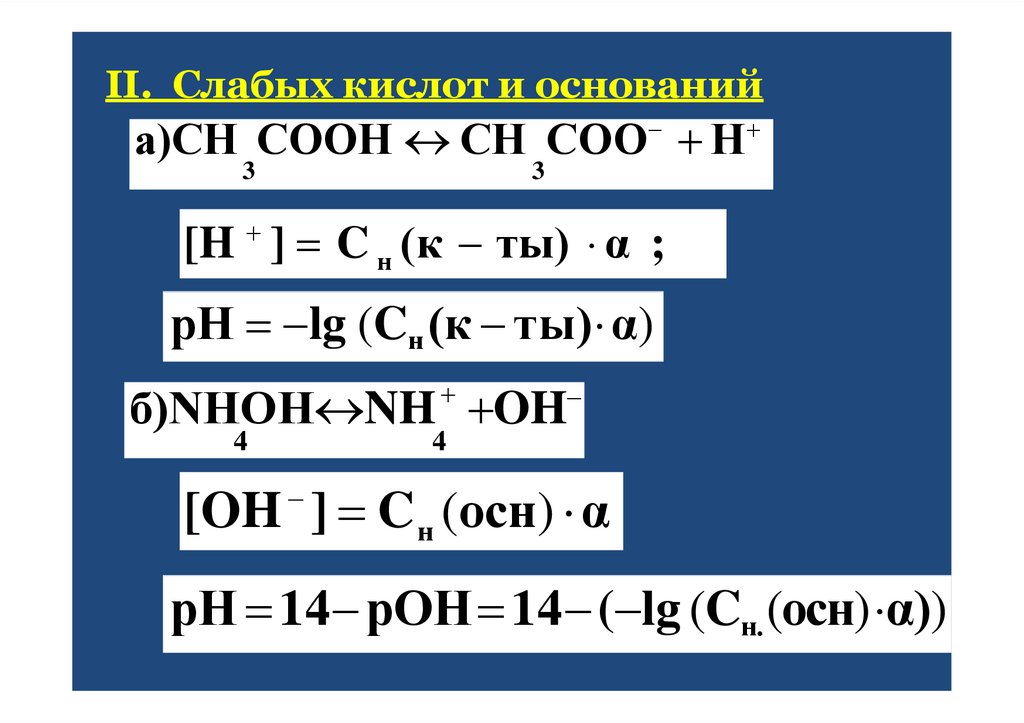
25.
II. Слабых кислот и основанийа)СН СООН СН СОО Н
3
3
[H ] C н (к ты) α ;
рН lg (Cн (к ты) α)
б)NHOH NH OH
4
4
[OH ] C н (ocн) α
рН 14 рОН 14 ( lg (Cн. (ocн) α))
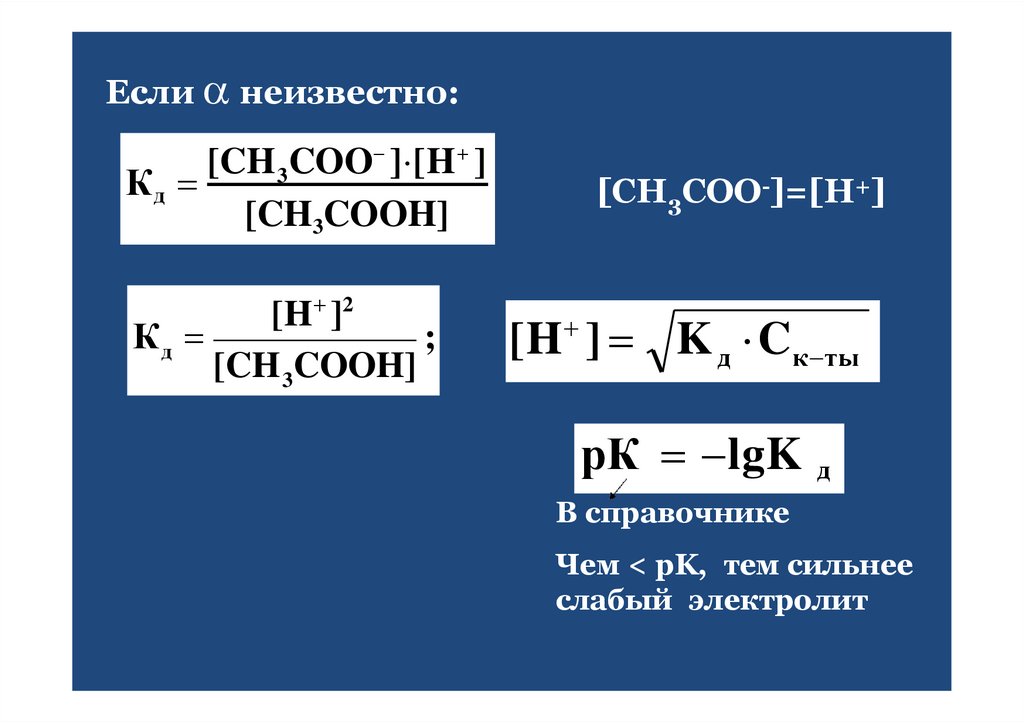
26.
Если неизвестно:[CH 3COO ] [H ]
Кд
[CH3COOH]
[H ]2
;
Кд
[CH 3COOH]
[СН3СОО-]=[Н+]
[H ] K д Cк ты
рК lgK д
В справочнике
Чем < pK, тем сильнее
слабый электролит
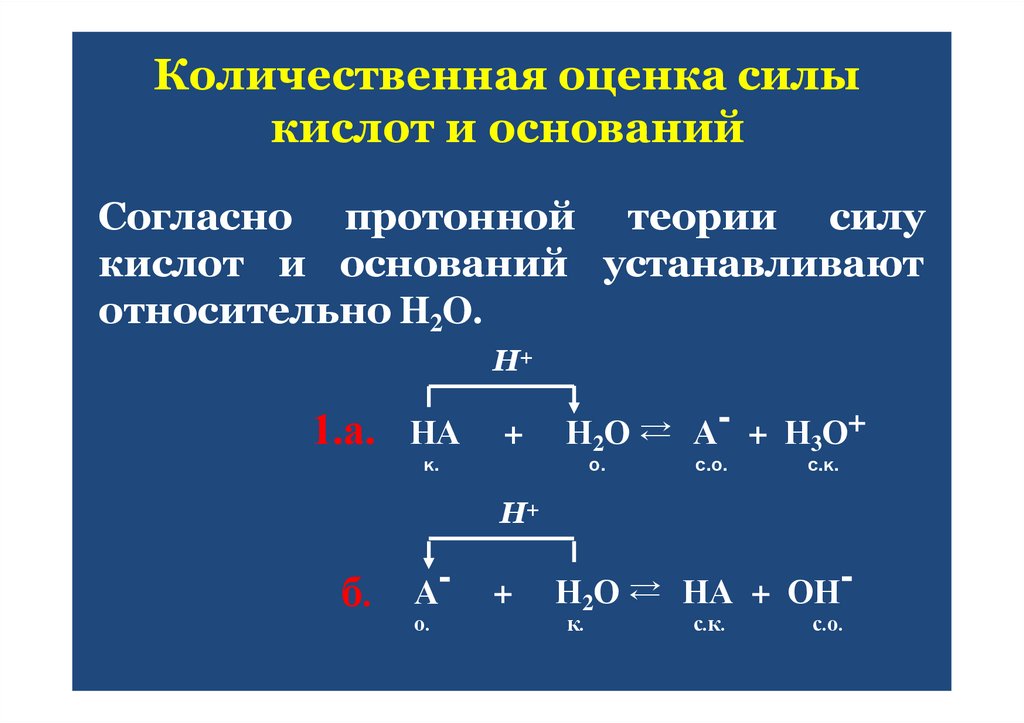
27. Количественная оценка силы кислот и оснований
Согласно протонной теории силукислот и оснований устанавливают
относительно H2O.
Н+
1.а.
НА
+
Н2О ⇄ А- + Н3О+
о.
к.
с.о.
с.к.
Н+
б.
Ао.
+
Н2О ⇄ НА + ОНк.
с.к.
с.о.
28. [А][Н О ]
а.[А ] [Н3О ]
Кх.р
; Кх.р. [H2O] Ка
[НА] [H2O]
[А ] [Н 3О ]
Ка
[НА]
б.
– константа
кислотности
[HA] [ОH ]
Кх.р
; Кх.р. [H2O] Кb
[А ] [H2O]
[HA] [ОH ]
Кb
[А ]
– константа
основности
29. К К [Н О ]
Ка Кb [Н3О ] [OH ] КWКа Кb 10 14
- ℓgKa = pKa;
- ℓgKb = pKb
рКа + рКb = 14
а. Чем > Ka , < pKa темсильнее
кислотаНА
емсильнее
б. Чем > Kb , < pKb т
с.онованиеА
30.
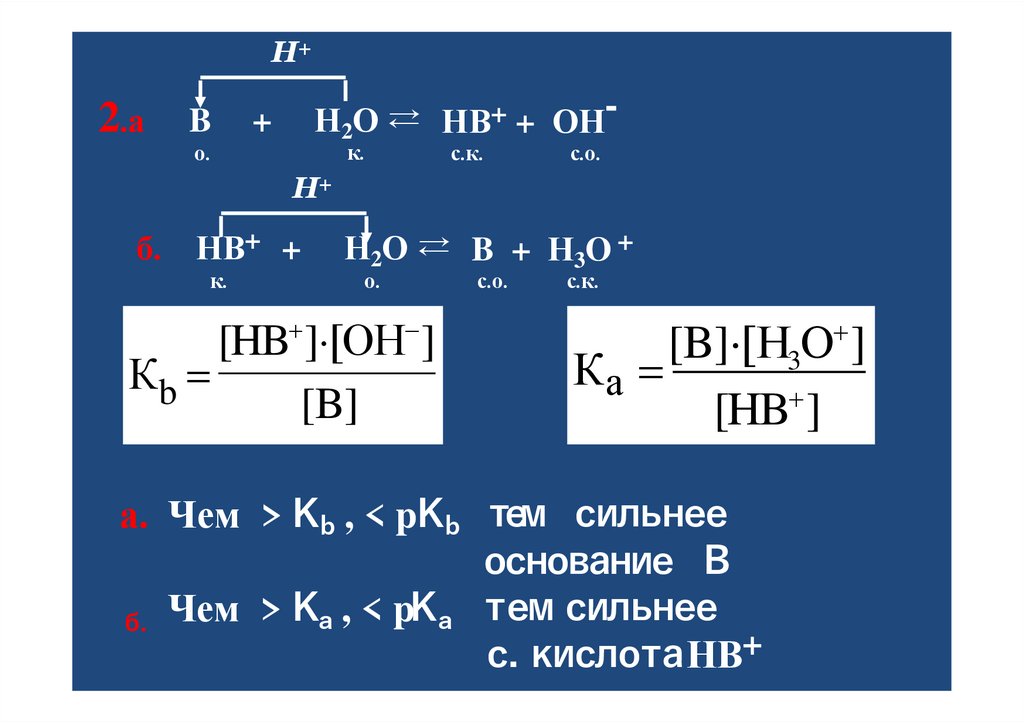
Н+2.а
B
Н2О ⇄ НB+ + ОН-
+
к.
о.
с.к.
с.о.
Н+
б.
НB+ +
к.
Н2О ⇄ B + Н3O +
о.
с.о.
[HB ] [ОH ]
Кb
[B]
с.к.
[B] [Н3О ]
Ка
[HB ]
е
м сильнее
а. Чем > Kb , < pKb т
основание В
емсильнее
б. Чем > Kа , < pKа т
с.кислотаНB+
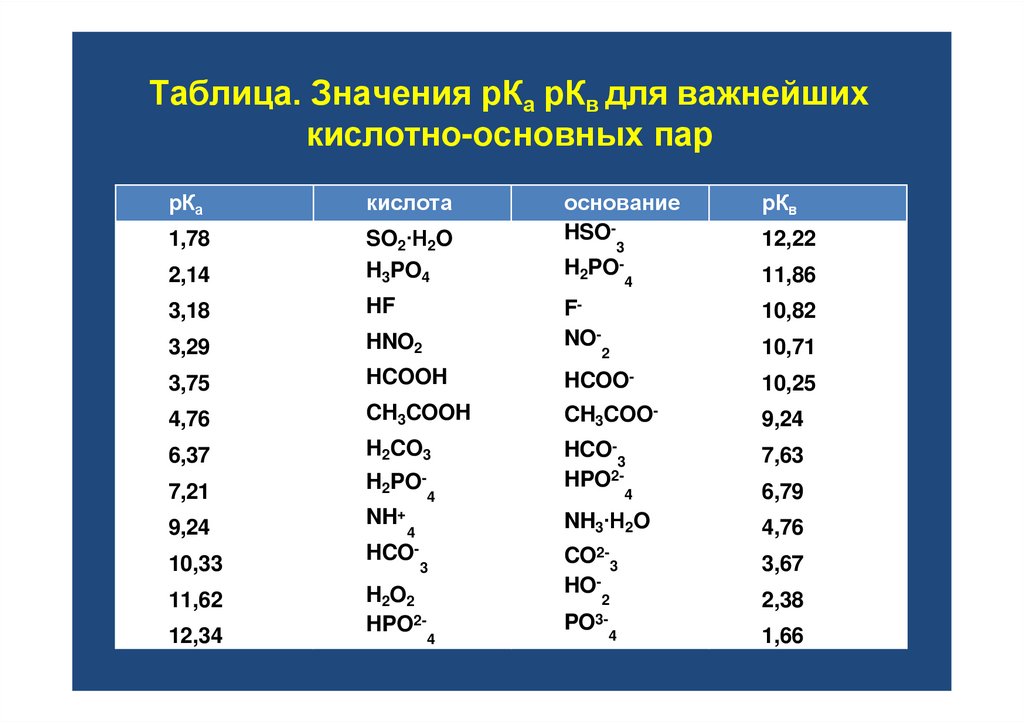
31. Таблица. Значения рКа рКв для важнейших кислотно-основных пар
рКакислота
1,78
2,14
SO2∙H2O
H3PO4
3,18
HF
3,29
HNO2
FNO-
2
10,71
3,75
HCOOH
HCOO-
10,25
4,76
CH3COOH
CH3COO-
9,24
6,37
H2CO3
7,63
7,21
H2PO-
HCO- 3
HPO2-
9,24
NH+
NH3∙H2O
4,76
CO2- 3
HO-
3,67
10,33
11,62
12,34
4
HCO-
3
H2PO-
4
4
рКв
12,22
11,86
10,82
4
4
3
H2O2
HPO2-
основание
HSO-
2
PO3- 4
6,79
2,38
1,66
32. Кислотность биологических жидкостей
Биол. жидк. содержат к-ты:• соляную
• угольную
• пировиноградную
• молочную и др.
Общая кислотность – соответствует общей конц.
сильных и слабых к-т; опр-ся м. кислотно-основного
титрования.
Активная кислотность - равна конц. (активности)
свободных ионов Н+ , возник. при диссоциации
сильных и слабых эл-тов; опр-ся колорим. Или
потенциометрическим методом по рН раствора.
Потенциальная кислотность - равна конц.
непродиссоциировавших молекул слабых к-т и
рассчит-ся по разности общей и активной кислотностей
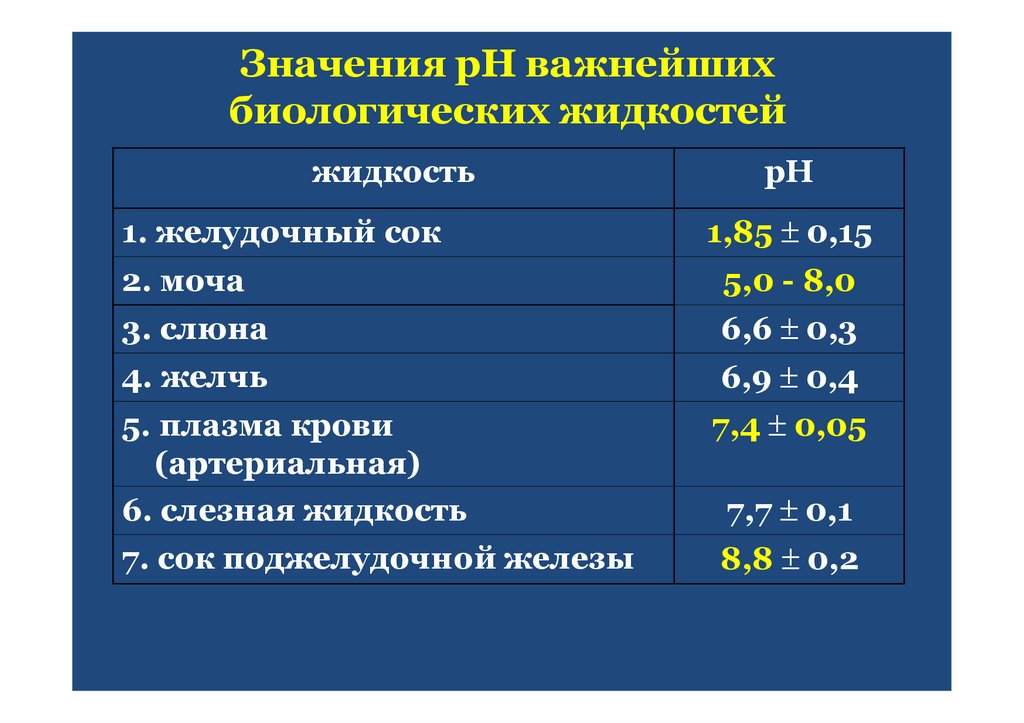
33. Значения рН важнейших биологических жидкостей
жидкостьрН
1. желудочный сок
1,85 0,15
2. моча
5,0 - 8,0
3. слюна
6,6 0,3
4. желчь
6,9 0,4
5. плазма крови
(артериальная)
6. слезная жидкость
7,4 0,05
7. сок поджелудочной железы
8,8 0,2
7,7 0,1
34.
ионы Н+ каталитизируют многие биохим. процессы;активность ферментов и гормонов проявляется в
определенных, довольно узких интервалах рН.
Примеры:
пепсин желудочного сока активен при рН = 1,5 – 2,0;
тканевые катапсины:
при рН 7 катализируют синтез белков,
при рН < 7 расщепляют их.
рН
pH <
ацидоз
норма
> pH
алкалоз
В результате процессов метаболизма
в организме человека ежесуточно образуется
к-во к-ты, эквивалентное 2,5 л НСl (конц.)
35. Защитные мех-мы поддержания постоянства рН:
физиологические – это процессыметаболизма, дыхания и мочевыделения
физико-химические мех-мы регуляции
кислотно-основного равновесия в организме с
помощью буферных систем организма.
36. Буферные системы (БС)
БС – это с-мы, которые сохраняют постоянствозначения рН при добавлении небольших количеств
сильных кислот и оснований, а также при разведении.
слабая кислота
I.
сопряжен. основание
слабое основание
II.
сопряжен. кислота
37. Классификация БС
I.кислотные:
ацетатная: СН3СООН + СН3СООNa
СН3СООН
СН 3СОО
Слабая кислота
Сопряженное
основание
гидрокарбонатная :
Н 2 СО 3
НСО 3
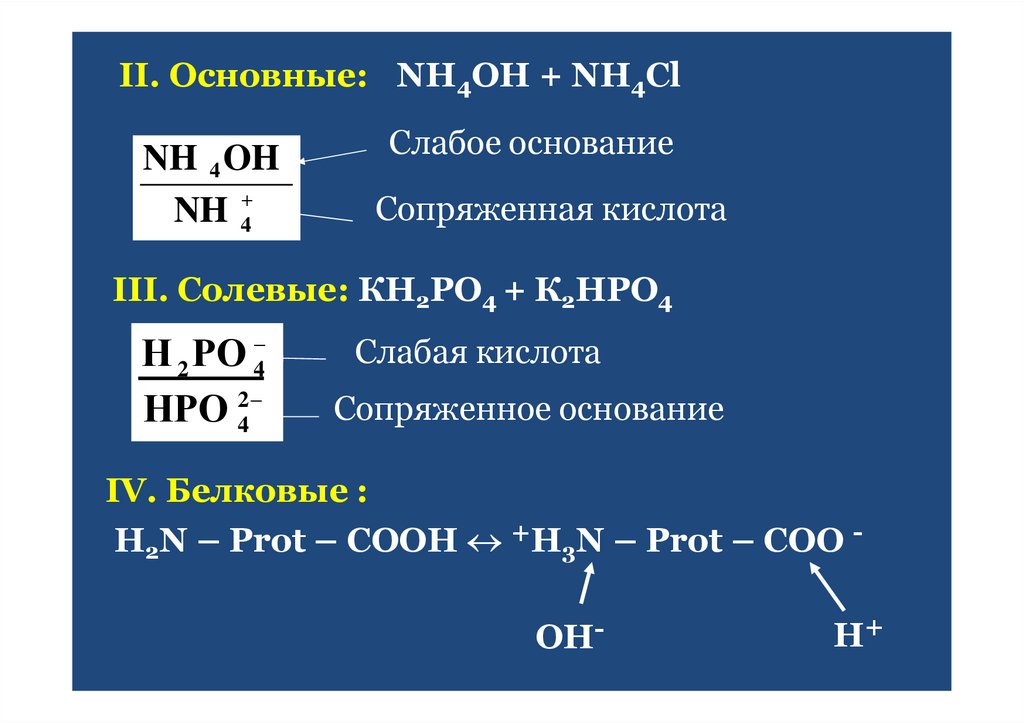
38.
II. Основные: NH4OH + NH4ClNH 4 OH
NH 4
Слабое основание
Сопряженная кислота
III. Солевые: КН2РО4 + К2НРО4
Н 2 РО 4
НРО 42
Слабая кислота
Сопряженное основание
IV. Белковые :
H2N – Prot – COOH +H3N – Prot – COO OH-
H+
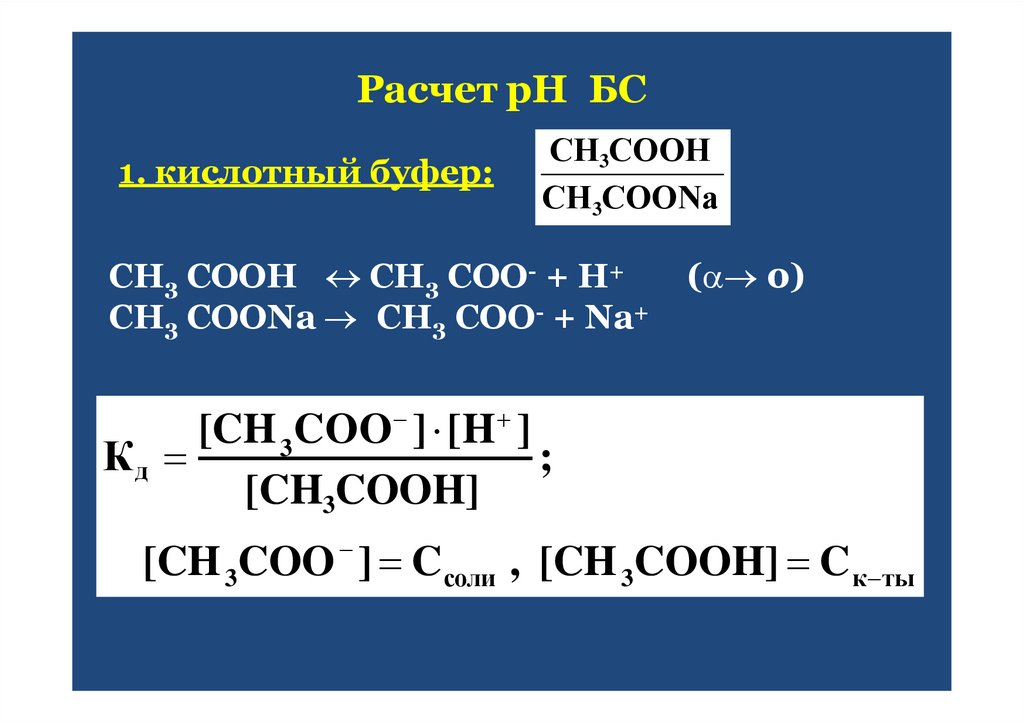
39. Расчет рН БС
СН3СООНСН3СООNa
1. кислотный буфер:
СН3 СООН СН3 СОО- + Н+
СН3 СООNa СН3 СОО- + Na+
( 0)
[CH 3COO ] [H ]
Кд
;
[CH3COOH]
[CH 3COO ] C соли , [CH 3COOH] C к ты
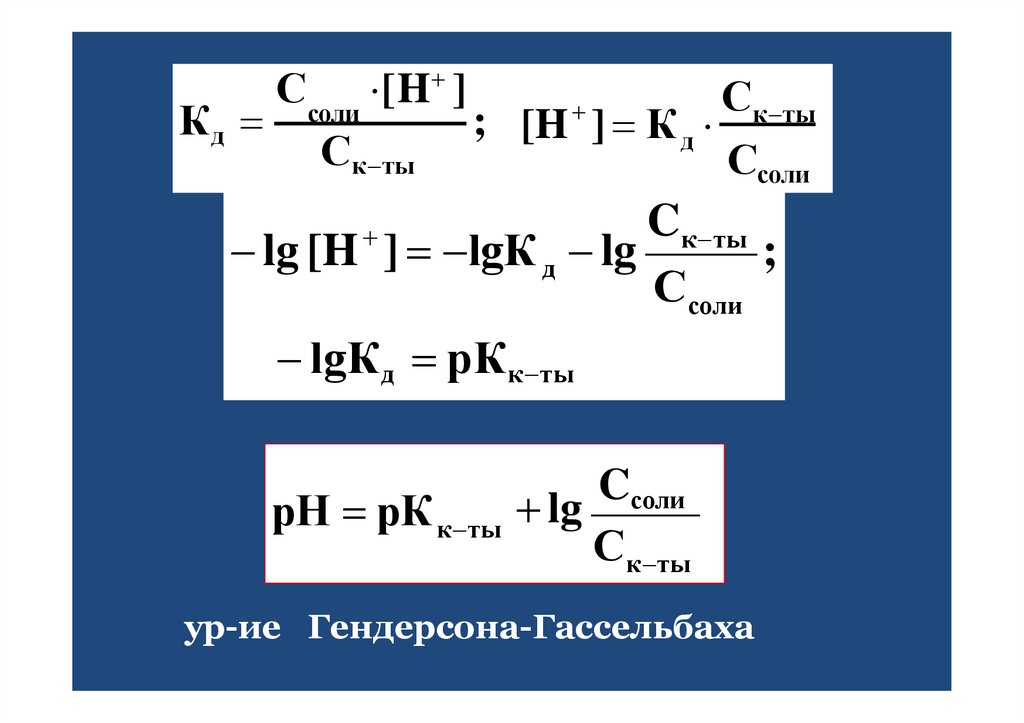
40.
Ссоли [H ]Ск ты
Кд
; [H ] К д
Ск ты
Ссоли
Cк ты
;
lg [H ] lgК д lg
Ссоли
lgКд рКк ты
Cсоли
рН рК к ты lg
Ск ты
ур-ие Гендерсона-Гассельбаха
41.
2. основной буфер:NH4OH
NH4Cl
Cсоли
; рН 14 рОН
рОН рК осн lg
Сосн.
БС устойчиво поддерживает рН р-ра в пределах:
рК 1 для кислотных БС;
14 - (рК 1) для основных БС.
Пример: рН плазмы крови = 7,4 ;
рК СН3СООН = 4,75,
рК Н2РО4 - = 7,2
42. рН БС зависит:
от величины рК (т.е. от Кд),а следовательно и от Т, т.к. Кд= f (Т)
от соотношения концентраций
компонентов;
рН БС не зависит от разбавления,
т.к. Кд остаётся const
Кд ≠ f (С)
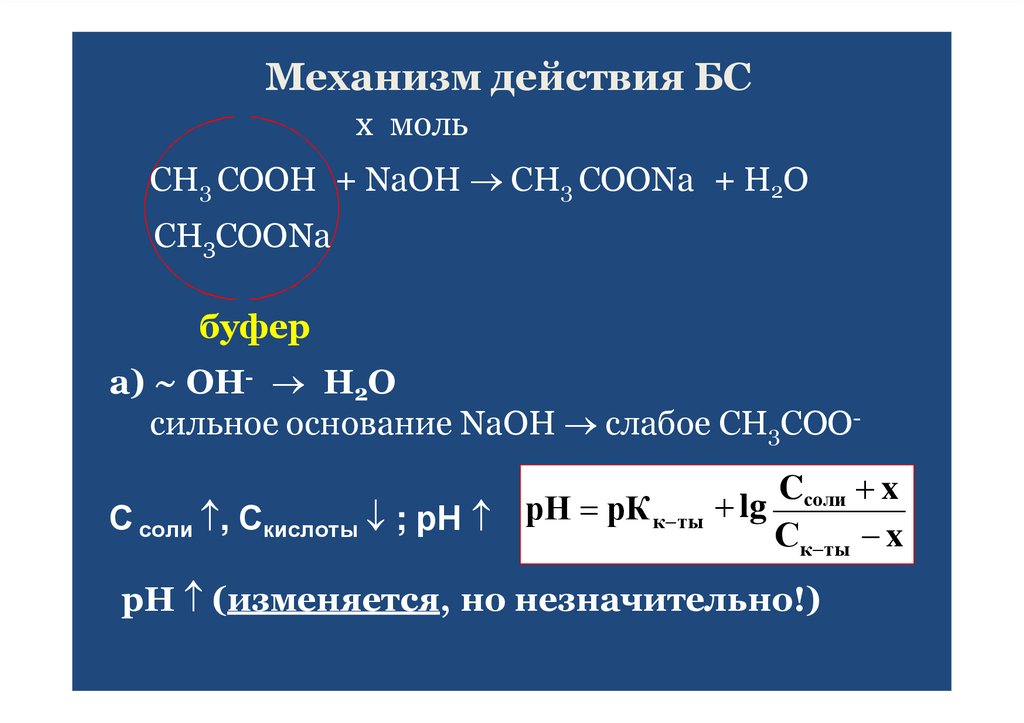
43. Механизм действия БС
х мольСН3 СООН + NaOH CH3 COONa + H2O
CH3COONa
буфер
а) ~ OH- Н2О
сильное основание NaOH слабое СН3СОО-
Cсоли x
С соли , Скислоты ; рН рН рК к ты lg С
к ты x
рН (изменяется, но незначительно!)
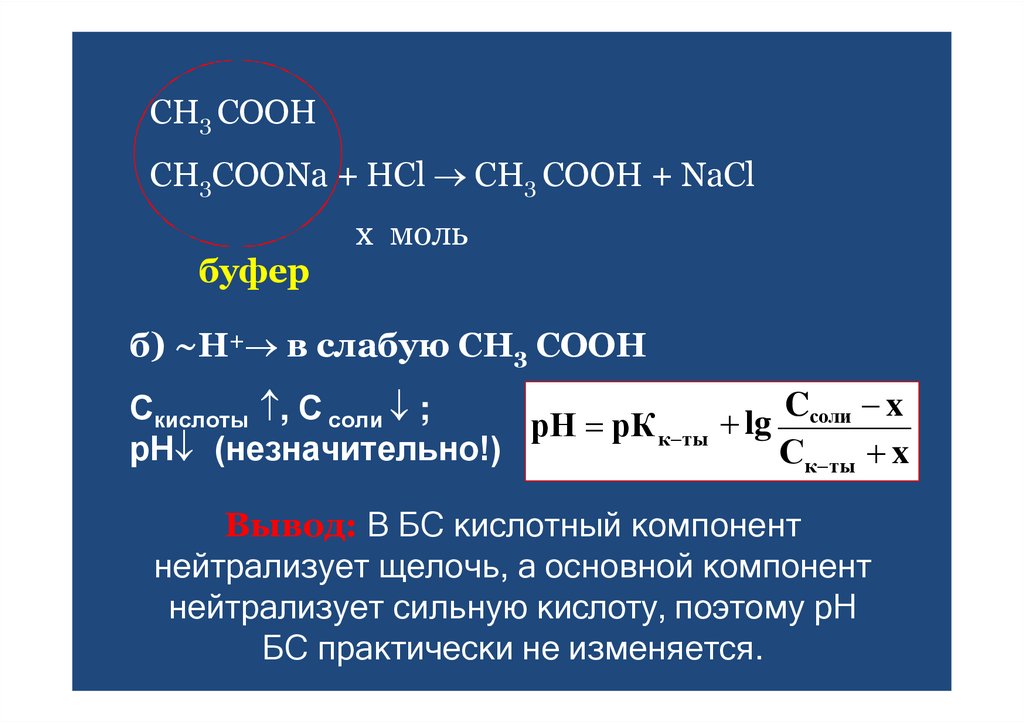
44. СН3 СООН
CH3COONa + HCl CH3 COOH + NaClбуфер
х моль
б) ~Н+ в слабую СН3 СООН
Cсоли x
Скислоты , С соли ;
рН рК к ты lg
рН (незначительно!)
Ск ты x
Вывод: В БС кислотный компонент
нейтрализует щелочь, а основной компонент
нейтрализует сильную кислоту, поэтому рН
БС практически не изменяется.
45.
Буферная емкость (БЕ)БЕ – это к-во экв-тов ионов Н+ или ОН-, которые надо
добавить к 1 л буферного р-ра, чтобы изменить его
рН на единицу
n э (Н )
;
БЕ по кислоте
Vбуф. р ра (л) рН
nэ (Н ) Сн (к ты) V (к ты) (л)
nэ (ОН )
БЕпо щелочи
;
Vбуф. р ра (л) рН
nэ (ОН ) С н (осн.) V (осн.) (л)
46. БЕ зависит:
от абсолютных зн-ний конц-ий компонентов(влияет разбавление).
При разбавлении р-ра БЕ уменьшается!
от соотношения концентраций компонентов
Буф. р-ры с более высокими и равными
концентрациями компонентов хар-ся
max устойчивостью рН
При соотношении конц. компонентов = 1 БЕ max.
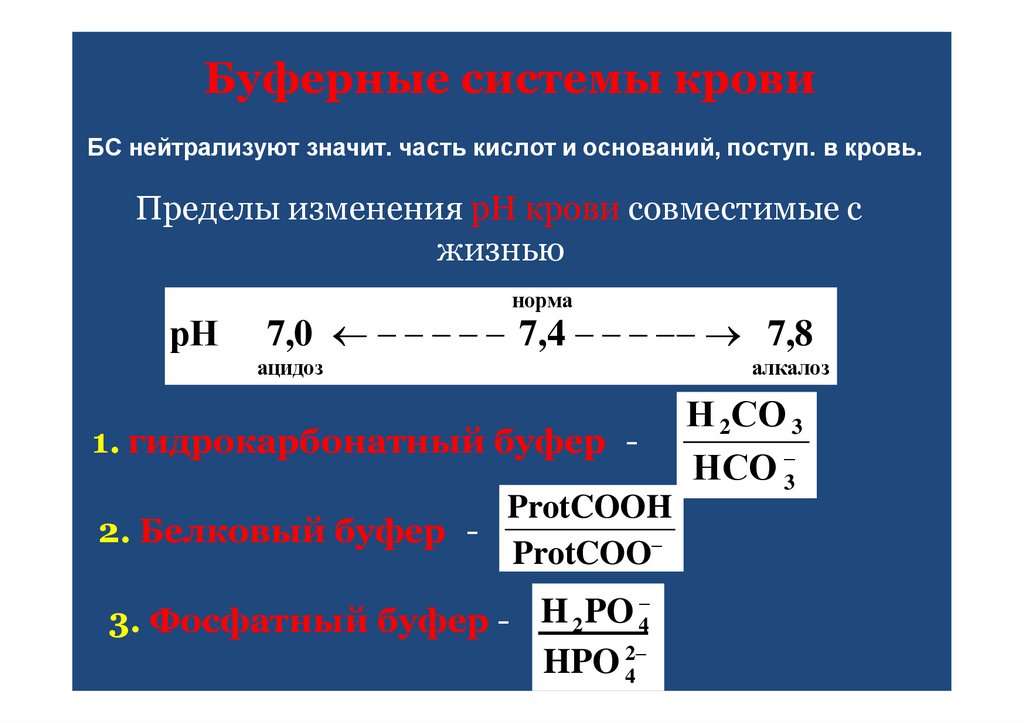
47. Буферные системы крови
БС нейтрализуют значит. часть кислот и оснований, поступ. в кровь.Пределы изменения рН крови совместимые с
жизнью
норма
рН
7,0 7,4 7,8
ацидоз
1. гидрокарбонатный буфер ProtCOOH
2. Белковый буфер ProtCOO
H
PO
3. Фосфатный буфер 2
4
HPO 42
алкалоз
Н 2СО 3
НСО 3
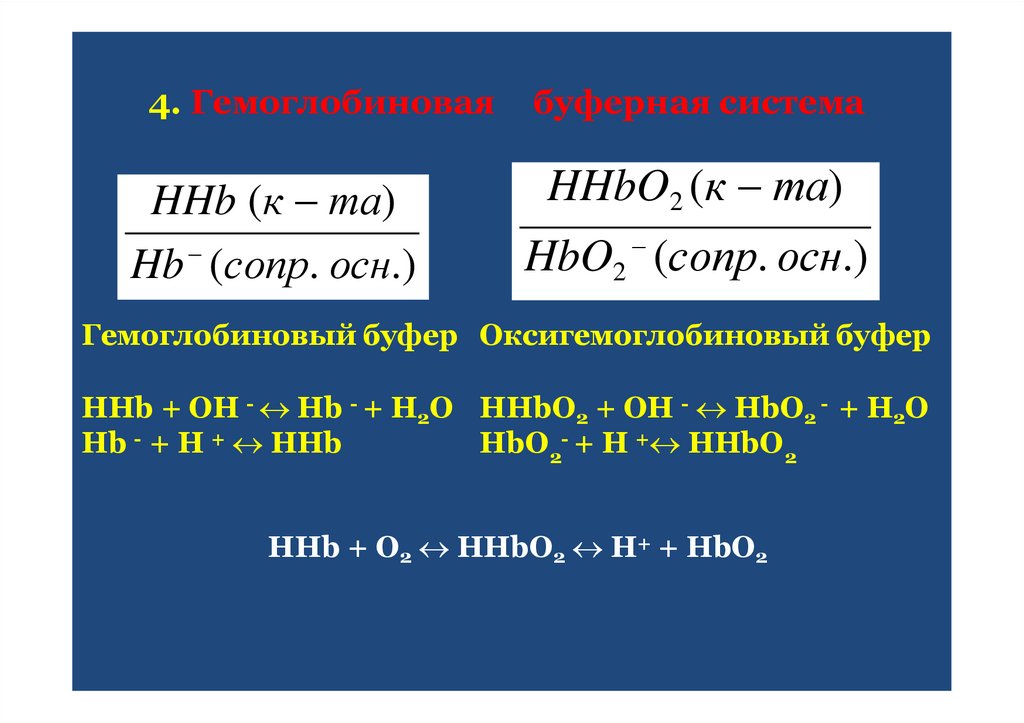
48. HHbO2 (к та) HbO2 (сопр. осн.)
4. Гемоглобиноваябуферная система
HHb (к та)
Hb (сопр. осн.)
HHbO2 (к та)
HbO2 (сопр. осн.)
Гемоглобиновый буфер Оксигемоглобиновый буфер
HHb + OH - Hb - + H2O HHbO2 + OH - HbO2 - + H2O
Hb - + H + HHb
HbO2- + H + HHbO 2
HHb + O2 HHbO2 H+ + HbO2
49. БС вносят различный вклад в БЕ крови.
Плазма рН=7,4Гидрокарбонатная……………………35 %
Фосфатная……………………………. 3 %
Белковая…………………………………7 %
45%
Эритроциты рН=7,25
Гемоглобиновая…………………………35 %
Гидрокарбонатная………………………18 % 55 %
Фосфатная…………………………………..2 %
Гидрокарбонатная БС главная – 53 % БЕ крови
Гемогл. БС эффективно функционирует в сочетании
с гидрокарбонатной
50.
ГИДРОКАРБОНАТНАЯН 2СО 3
НСО 3
БС
NaHCO3 → в плазме;
КHCO3 → в эритроцитах.
Непосредственно измерить концентрацию угольной
кислоты [H2CO3] в крови практически невозможно.
Поэтому в уравнение Гендерсона-Гассельбаха вместо
[H2CO3] вводят концентрацию углекислого газа [CO2] ,
которую можно рассчитать.
рН рКк ты
НСО
lg
3
СО2
51. В норме в крови:
1. Парциальное давление р(СО2)=5,3 кПа;константа растворимости СО2 (const Генри) = 0,23 =>
[СO2] = р(СО2) • Kр-ти (СО2) = 5,3 • 0,23 = 1,219
[СO2] = 1,2 ммоль/л
2. [HCO3-] = 24 ммоль/л
3. Соотношение [HCO3 - ]/[СO2] = 24/1,2 = 20/1
4. pK = - lgKд1 (H2CO3 ) = 6,1
По уравнению Гендерсона-Гассельбаха
рН = 6,1+ lg 20/1 = 6,1 + 1,3 = 7,4
Таким образом, активная реакция плазмы артериальной
крови у здоровых людей соответствует рН= 7,40.
52. Поскольку [HCO - ] > [СO ], то БЕ крови значительно
Поскольку [HCO 3- ] > [СO2], то БЕ крови значительнобольше для кислот, чем для оснований. Это имеет
большое биологическое значение, т.к. в процессе обмена
веществ кислот образуется больше, чем оснований.
[HCO3- ] – это щелочной резерв крови!
Патология
1. Если [HCO 3- ]/[СO2] < 20,
то рН (крови) < 7.4 => ацидоз
Газовый ацидоз – при ↑С(СО2) во вдыхаемом воздухе,
заболевании органов дыхания (пневмония), угнетение
дыхательного центра (анестетики, седативные препараты).
Метаболический ацидоз – накопление нелетучих
продуктов обмена при ожогах и воспалительных
процессах.
53. 2. Если [HCO - ]/[СO ] > 20,
2. Если [HCO 3- ]/[СO2] > 20,то рН (крови) > 7.4 => алкалоз
Газовый алкалоз – при ↓С(СО2) во вдыхаемом
воздухе; при гипервентиляции легких (частое, глубокое
дыхание, ↑С(О2), астма).
Метаболический алкалоз – потеря больших
количеств НСl при рвоте, выведение больших
количеств H+ при приёме диуретиков, длительный
приём минеральных вод с большим содержанием
щелочей.
54. Основные клинические проявления при ацидозе и алкалозе
Ацидоз: Угнетение ЦНС,при рН ниже 7 угнетение достигает такой степени,
при которой теряется ориентация ; человек впадает
в коматозное состояние;
Учащение дыхания с целью выведения углекислого
газа, как приспособительная реакция
Алкалоз: Перевозбуждение нервной системы, которое
сопровождается тетоническими (судорожными)
сокращениями;
может наступить гибель от тетонического
сокращения дыхательной мускулатуры
55.
КоррекцияПри ацидозе применяют трисамин,
связывающий избыточные протоны:
H2N-C(CH2OH)3 + H+ → H3N+-C(CH2OH)3.
При алкалозе применяют р-р аскорбиновой
кислоты.
Гемоглобиновая БС
эффективно функционирует в сочетании
с гидрокарбонатной БС


















![[А][Н О ] [А][Н О ]](https://cf5.ppt-online.org/files5/slide/c/CSaYTAFjZq8UoxJOne12uitGHDEbB45Kpy0mfX/slide-27.jpg)
![К К [Н О ] К К [Н О ]](https://cf5.ppt-online.org/files5/slide/c/CSaYTAFjZq8UoxJOne12uitGHDEbB45Kpy0mfX/slide-28.jpg)












![Поскольку [HCO - ] > [СO ], то БЕ крови значительно Поскольку [HCO - ] > [СO ], то БЕ крови значительно](https://cf5.ppt-online.org/files5/slide/c/CSaYTAFjZq8UoxJOne12uitGHDEbB45Kpy0mfX/slide-51.jpg)
![2. Если [HCO - ]/[СO ] > 20, 2. Если [HCO - ]/[СO ] > 20,](https://cf5.ppt-online.org/files5/slide/c/CSaYTAFjZq8UoxJOne12uitGHDEbB45Kpy0mfX/slide-52.jpg)


 Химия
Химия








