Похожие презентации:
Bílkoviny v živých organismech. Enzymy. Hemoglobin
1.
Bílkoviny v živých organismechEnzymy
Hemoglobin
©
Biochemický ústav LF MU, 2024, Hana Paulová
1
2. Proteiny
RNH2
• základní stavební jednotka-aminokyseliny (AK)
R
• spojení AK peptidovou vazbou
O
O
CH C
OH
R
H2N CH C NH CH COOH
N-konec
C-konec
peptidová vazba
• biopolymery: 50 AMK (peptidy 2 až 50 AK)
• vznikají proteosyntézou
• charakteristická struktura, prostorové uspořádání
• struktura proteinů je popisována na více úrovních
• funkce proteinů: strukturní, metabolické, informační, obranná
2
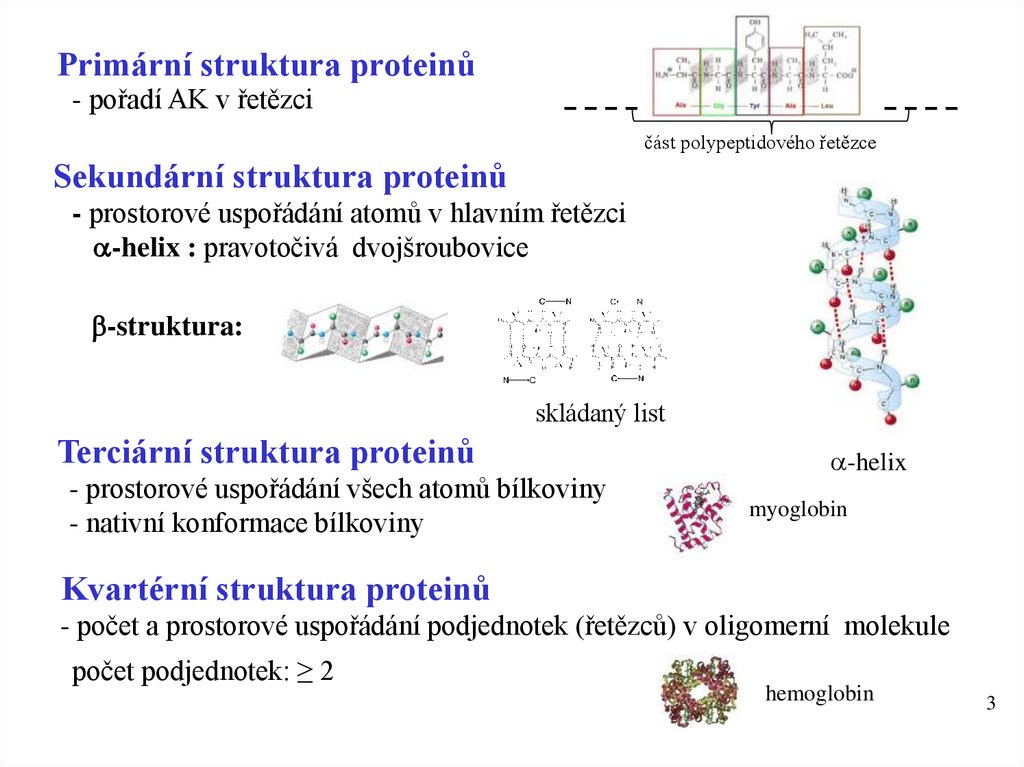
3. Primární struktura proteinů
- pořadí AK v řetězcičást polypeptidového řetězce
Sekundární struktura proteinů
- prostorové uspořádání atomů v hlavním řetězci
a-helix : pravotočivá dvojšroubovice
b-struktura:
skládaný list
Terciární struktura proteinů
- prostorové uspořádání všech atomů bílkoviny
- nativní konformace bílkoviny
a-helix
myoglobin
Kvartérní struktura proteinů
- počet a prostorové uspořádání podjednotek (řetězců) v oligomerní molekule
počet podjednotek: ≥ 2
hemoglobin
3
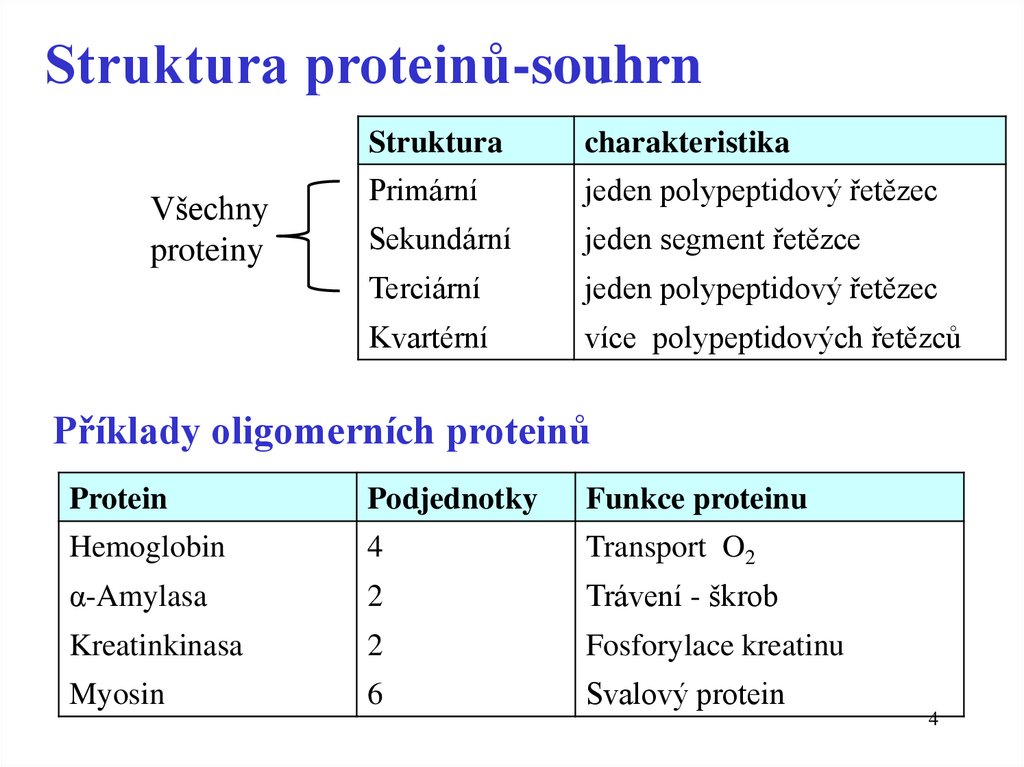
4.
Struktura proteinů-souhrnVšechny
proteiny
Struktura
charakteristika
Primární
jeden polypeptidový řetězec
Sekundární
jeden segment řetězce
Terciární
jeden polypeptidový řetězec
Kvartérní
více polypeptidových řetězců
Příklady oligomerních proteinů
Protein
Podjednotky
Funkce proteinu
Hemoglobin
4
Transport O2
α-Amylasa
2
Trávení - škrob
Kreatinkinasa
2
Fosforylace kreatinu
Myosin
6
Svalový protein
4
5. Enzymy
Nezbytné pro průběh většiny reakcí v těle• proteiny
• biokatalyzátory
• specifické, vysoce účinné
• tvoří isoenzymy – různá distribuce v těle (buňky, orgány)
• regulovatelné
5
6. Enzym je protein
• různé proteiny• mohou obsahovat prostetickou skupinu (př. kov)
• oligomery
• multienzymové komplexy
Enzym je biokatalyzátor
• vysoce efektivní
• urychluje průběh reakce
• snižuje aktivační energii reakce
• zůstává nezměněn
Enzym je specifický
• reaguje s jedním substrátem (nebo skupinou podobných substrátů)
• katalyzuje určitý typ reakce
6
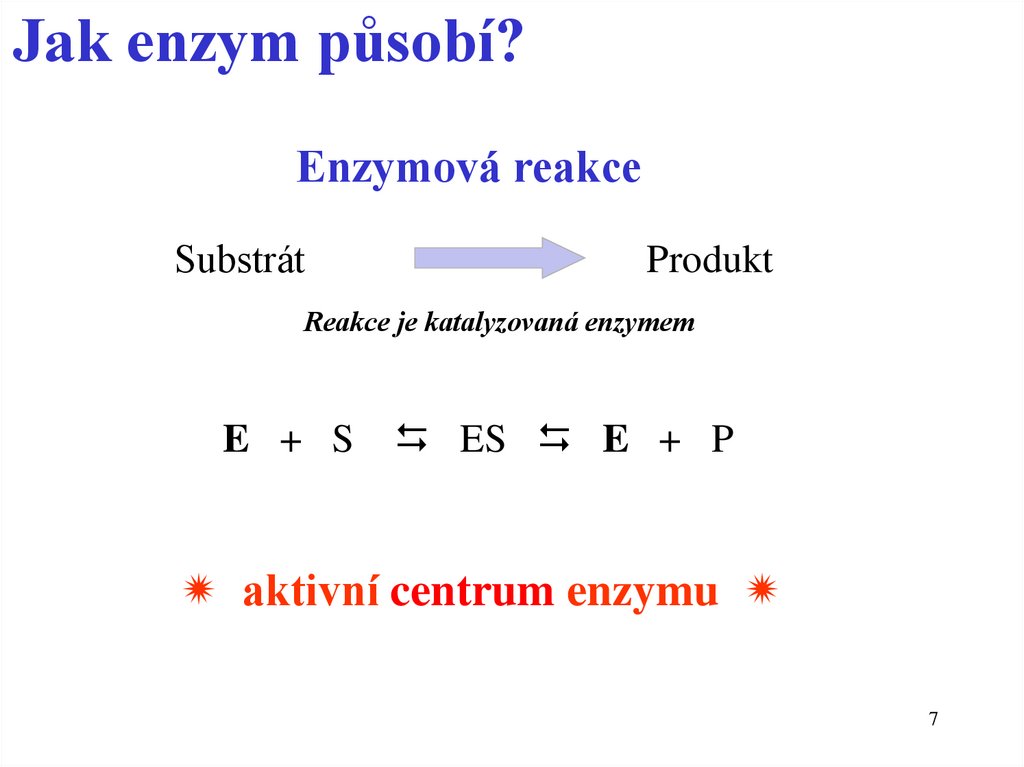
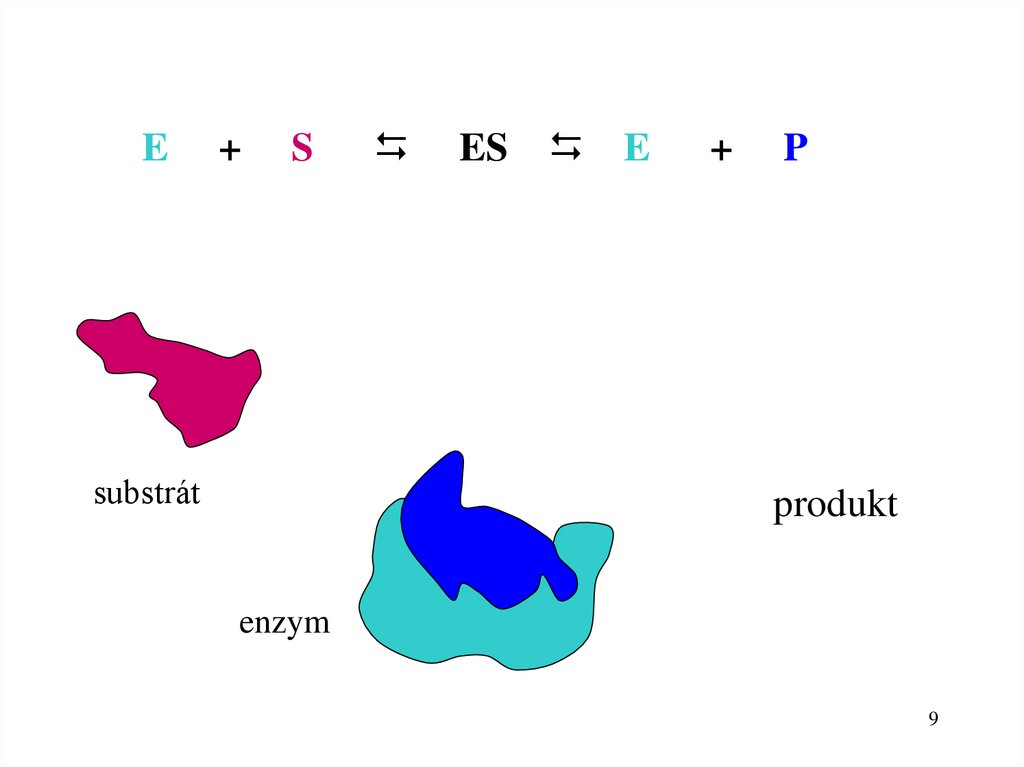
7.
Jak enzym působí?Enzymová reakce
Substrát
Produkt
Reakce je katalyzovaná enzymem
E + S
ES E + P
aktivní centrum enzymu
7
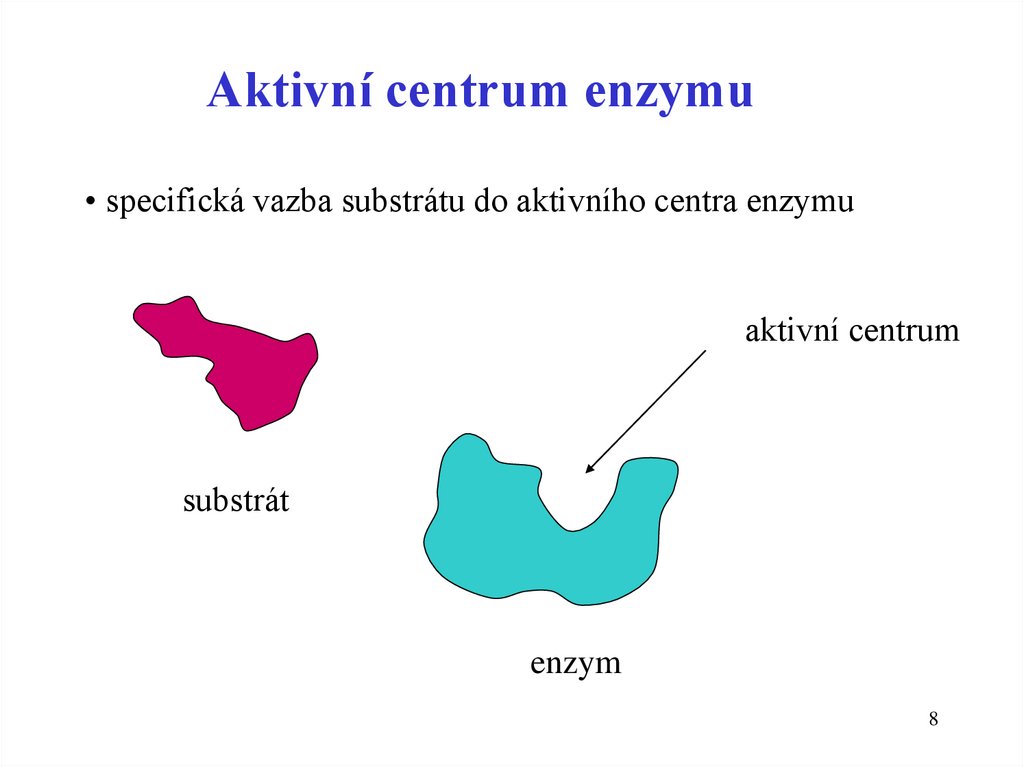
8.
Aktivní centrum enzymu• specifická vazba substrátu do aktivního centra enzymu
aktivní centrum
substrát
enzym
8
9.
E+
S
substrát
ES
E
+
P
produkt
enzym
9
10.
Katalytická aktivita enzymuIU (international unit), 1 IU = μmol/min
• jednotka: katal, 1 kat = mol/s
1 μkat = 60 IU, 1 IU = 16.6 nkat
• přeměna jednoho molu substrátu za jednu sekundu
• běžně užívaná jednotka: mkat
(mkat = mmol/s)
Katalytická koncentrace enzymu
• activita vztažená na objem biologické tekutiny (serum)
• běžně užívaná jednotka: mkat/l
10
11. Příklady názvů enzymů
Názvosloví enzymů: koncovka -asaSystematické názvy:
• informace o substrátu a typu reakce
• číselný kód EC
Doporučené názvy:
• kratší než systemické názvy
• historické názvy (pepsin, amylasa)
EC (abbr. Enzyme Commission) of International Union of
Biochemistry (IUB)
. číslo hlavní třídy
. číslo podtřídy
. číslo pod- podtřídy
. číslo enzymu
Příklady názvů enzymů
Doporučený název: alcoholdehydrogenasa
Systematický názec: EC 1.1.1.1 ethanol:NAD+-oxidoreductase
Reakce: ethanol + NAD+ acetaldehyd + NADH + H+
Doporučený název: alaninaminotransferasa (ALT)
Systematický název: EC 2.6.1.2 L-alanine:2-oxoglutarate-aminotransferase
Reakce: L-alanin + 2-oxoglutarát pyruvát + L-glutamát
11
12. Faktory ovlivňující rychlost enzymové reakce
• teplota• pH
• koncentrace substrátu
• aktivátory a inhibitory
12
13.
Teplota• rychlost reakce stoupá s teplotou
• optimální teplota: kolem 40oC
• při vyšší teplotě (nad 50oC) rychlost enzymové reakce klesá
vzhledem k denaturaci enzymu
- ztráta biologické aktivity
- převážně irreversibilní proces
• termostabilní enzymy: např. DNA polymerasa (Taq polymerasa z
bakterie Thermus aquaticus), teplotní
optimum kolem 75oC
- využití v metodě PCR
13
14.
Denaturace- při denaturaci proteinu dochází k rozrušení a možné destrukci
sekundární a terciární struktury
příklady: ▪ vaření jídla (př.vařené vejce)
▪ lékařské nástroje jsou sterilizovány při vysoké teplotě
(denaturace bakteriální proteinů)
-denaturační vlivy – příklady:
fyzikální vlivy: zahřívání >50oC, mechanický účinek, ultrazvuk,…
chemické vlivy: silné kyseliny, ionty těžkých kovů, …
14
15.
Mají obrázky něco společného ??
16.
pH• pH ovlivňuje disociaci ionizovatelných skupin v aktivním místě
enzymu
• pH optimum
- intracelulární enzymy: cca pH 7
- pepsin: cca pH 2
- trypsin: cca pH 8
koncentrace substrátu
• s rostoucí koncentrací substrátu stoupá rychlost reakce až do
„nasycení“ enzymu substrátem
16
17.
aktivátory• zvyšují rychlost reakce
• příklady: Ca2+, Mg2+, Zn2+, Mn2+
inhibitory
• snižují rychlost enzymové reakce nebo ji dokonce zastavují
• vazba vratná a nevratná
• příklady inhibitorů:
kompetitivní inhibitory: podobné substrátu, např. některá
léčiva
ionty těžkých kovů
17
18.
Enzymy a kofaktoryŘada enzymů vyžaduje přítomnost dalších látek – tzv. kofaktorů
Kofaktor : nízkomolekulární sloučenina
• koenzym: vázaný nekovalentně (ko-substrát)
př: NAD+
• prostetická skupina: vázaný kovalentně
př: FAD, Mg2+
Význam vitaminů
18
19.
IsoenzymyIsoenzymy (isoformy)
• katalyzují stejnou reakci
• vykazují rozdíly (geneticky dané) v primární struktuře
• mohou obsahovat více podjednotek
• vykazují rozdílnou subcelulární distribuci
• vykazují rozdílnou tkáňovou distribuci – využití k diagnostickým účelům
• Příklady:
Kreatinkinasa (CK): dimer, tvoří 3 izoenzymy (CK-MM, CK-MB, CK-BB)
Laktátdehydrogenasa (LD): tetramer, tvoří 5 izoenzymů
Alkalická fosfatáza: tvoří více než 17 izoenzymů. Klinicky významné jsou 3 izoenzymy
- placentární izoenzym
- střevní izoenzym
- tkáňově nespecifická ALP: jaterní, kostní, ledvinná izoforma
1919
20. Enzymy v lékařství
• enzymy v diagnostice• enzymy v analytických metodách
• enzymy jako léčiva
Pozn.: enzymy jsou využívány i v jiných, různorodých oblastech lidské činnosti
20
21. Enzymy v diagnostice
• stanovení katalytické koncentrace enzymů v plasmě• stanovení katalytické koncentrace izoenzymů v plasmě
21
22. Klasifikace enzymů v krvi
• Enzymy se specifickou funkcí v plasměEnzymy normálně přítomné v plasmě, které zde mají svoji úlohu.
Příklad: enzymy kaskády krevního srážení
Místo vzniku enzymu: játra
Místo působení enzymu: krev
• Intracelulární enzymy
Enzymy uvolňované z buněk, které nemají v plasmě žádnou funkci
Příklad: LD, ALT, AST, CK
Místo vzniku: různé buňky tkání
Místo působení enzymu: buňky
22
23. Změny aktivity enzymů v krvi při poškození orgánů
Při poškození buněk – aktivity intracelulárních enzymův extracelulární tekutině (plasmě) se zvyšují
Enzym
Referenční hodnoty
Zvýšení v plasmě
ALT
< 0,9 mkat/l
hepatopatie
CK
< 4 mkat/l
myopatie, infarkt myokardu
Při poškození orgánu, aktivity enzymů se specifickou funkcí v plasmě se snižují
ALT: alaninaminotransferasa, CK: kreatinkinasa
23
24.
Souhrn enzymů v krviEnzymy v krvi
Enzymy s funkcí v Buněčné enzymy
krvi
Příklady
Koagulační faktory AST, ALT, CK, LD
Místo vzniku
Játra
Buňky různých orgánů
Místo působení
Krev
Buňky různých orgánů
Změny aktivity při
poškození orgánu
Většina biochemických vyšetření
hodnot koncentrací enzymů v krvi
25.
Stanovení enzymůBiochemické analyzátory:
- klinicko-biochemická laboratoř
- diagnostické sety
- řádově až stovky (tisíce) testů za hodinu
POCT analyzátory: pro analýzu proteinů – též i enzymů, nízkomolekulárních
látek
-přenosné analyzátory
-rychlá diagnostika
-využití: nemocnice – tzn: u lůžka pacienta
praktické a odborné ambulance
v terénu – rychlá záchranná služba
Cobas h232
25
26.
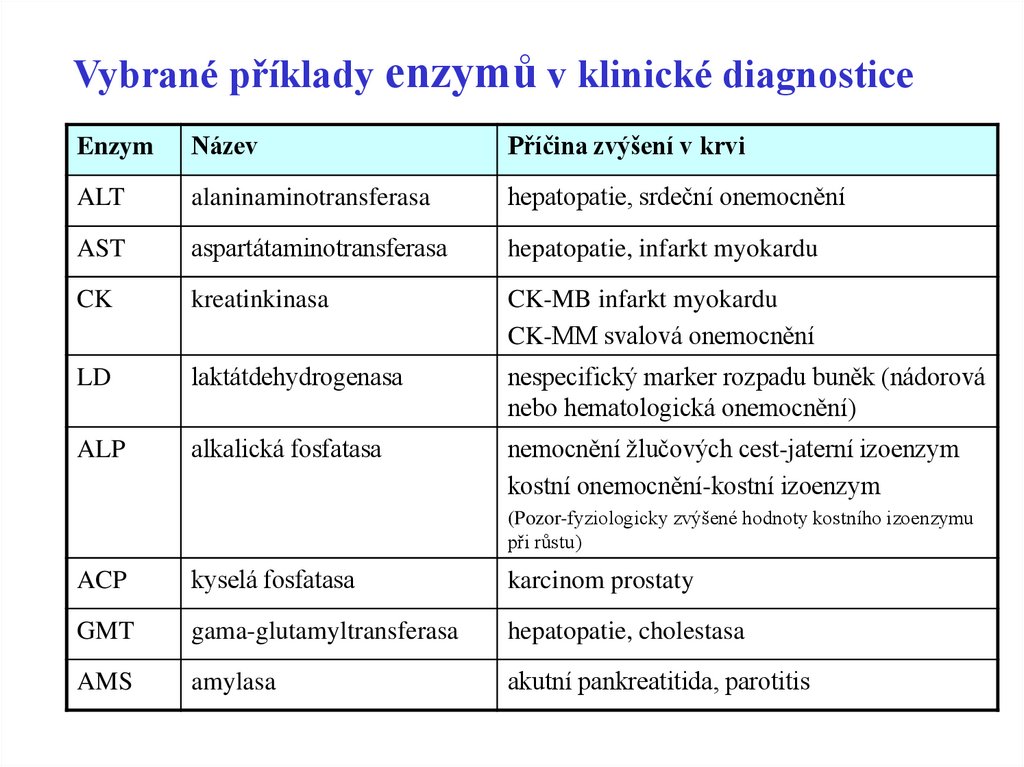
Vybrané příklady enzymů v klinické diagnosticeEnzym
Název
Příčina zvýšení v krvi
ALT
alaninaminotransferasa
hepatopatie, srdeční onemocnění
AST
aspartátaminotransferasa
hepatopatie, infarkt myokardu
CK
kreatinkinasa
CK-MB infarkt myokardu
CK-MM svalová onemocnění
LD
laktátdehydrogenasa
nespecifický marker rozpadu buněk (nádorová
nebo hematologická onemocnění)
ALP
alkalická fosfatasa
nemocnění žlučových cest-jaterní izoenzym
kostní onemocnění-kostní izoenzym
(Pozor-fyziologicky zvýšené hodnoty kostního izoenzymu
při růstu)
ACP
kyselá fosfatasa
karcinom prostaty
GMT
gama-glutamyltransferasa
hepatopatie, cholestasa
AMS
amylasa
akutní pankreatitida, parotitis
27. Enzymy v analytických metodách
• využití enzymů při rutinním stanovení koncentrace některýchparametrů v krvi (např. stanovení cholesterolu, TG, glukosy)
- diagnostické sety (např. Erba Lachema)
- POCT (např. Accutrend Plus)
• využití enzymů v dalších analytických metodách:
Accutrend Plus
- ELISA (Enzyme-Linked Immunosorbent Assay)
stanovení antigenů nebo protilátek
- PCR (Polymerase Chain Reaction)
sekvenování DNA, diagnostika dědičných onemocnění
- vývoj nových přístupů-např. imobilizace enzymů na nanovlákna
(hojení rány)
27
28. Enzymy jako léčiva
Vybrané příklady:- laktasa
- proteolytické enzymy
- fibrinolytika
28
29.
Hemoglobin29
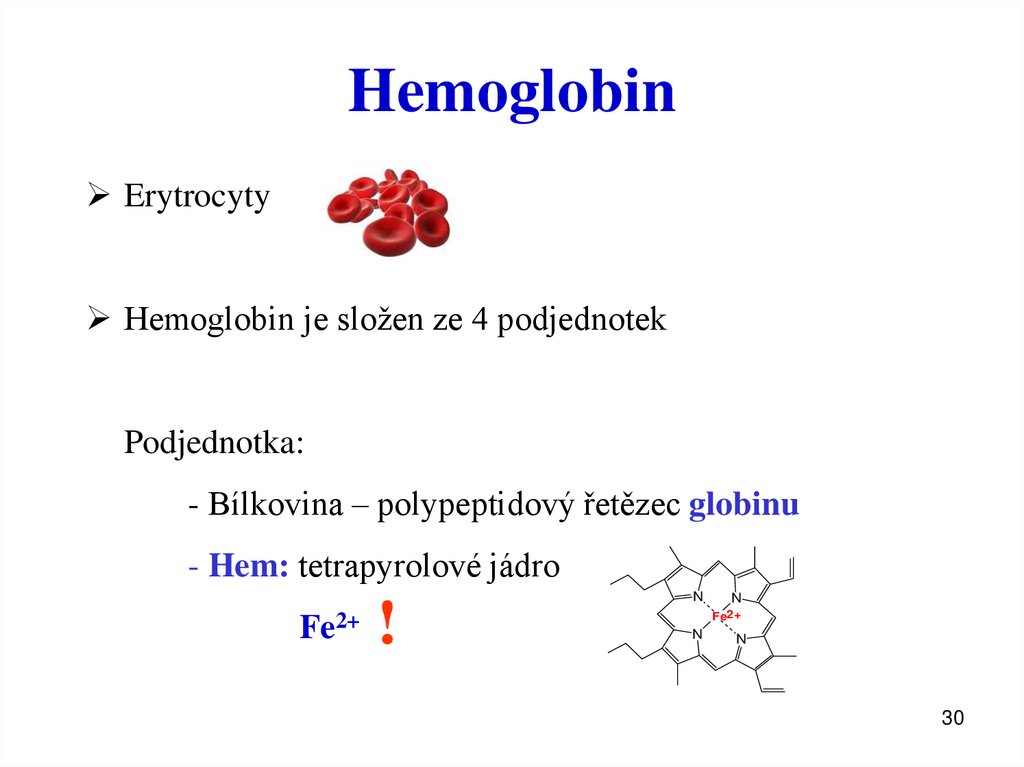
30. Hemoglobin
ErytrocytyHemoglobin je složen ze 4 podjednotek
Podjednotka:
- Bílkovina – polypeptidový řetězec globinu
- Hem: tetrapyrolové jádro
Fe2+
!
N
N
Fe2+
N
N
30
31.
Hemoglobin je tetramer4 podjednotky: podjednotky a a b
b
a
a
b
Typy hemoglobinu
HbA : a2b2 (cca 95%, hlavní hemoglobin dospělých)
https://cs.wikipedia.org/wiki/Hemoglobin#/media/Soubor:Hemoglobin.jpg
HbA2 : a2d2 (cca 2,5%, minoritní hemoglobin dospělých)
HbF : a2g2 (fetální hemoglobin)
Genetická informace: řetězce a, b, g, d
31
32.
Jaká je hlavní funkcehemoglobinu ?
! přenos kyslíku !
32 32
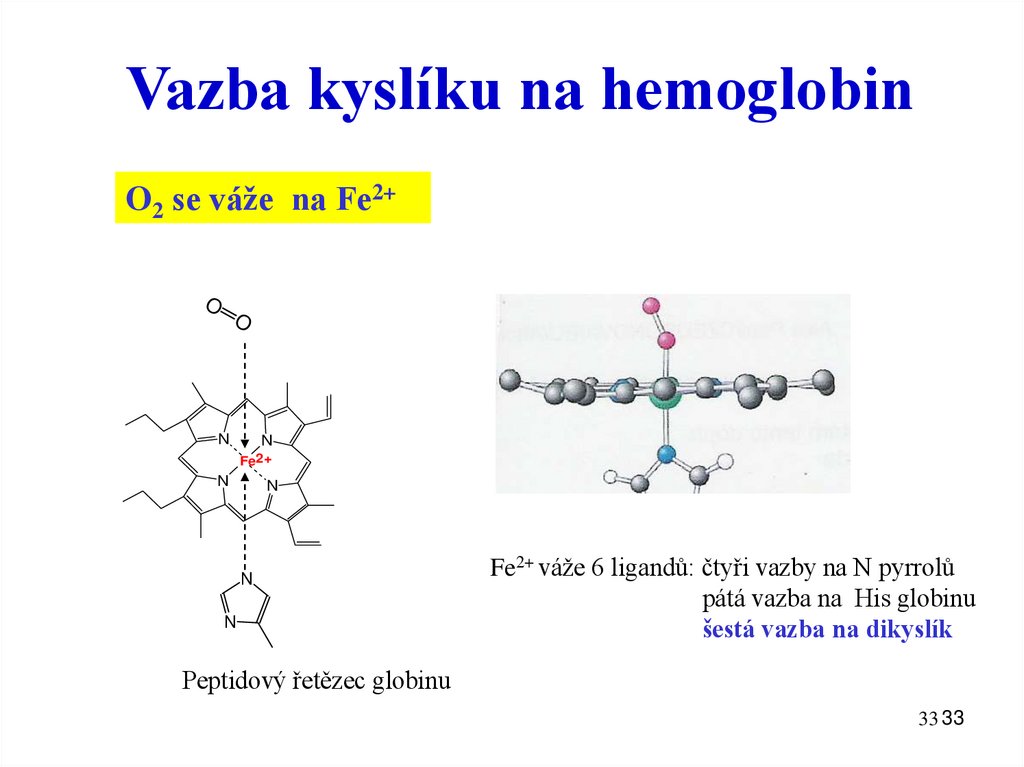
33.
Vazba kyslíku na hemoglobinO2 se váže na Fe2+
O
O
N
N
Fe2+
N
N
N
N
Fe2+ váže 6 ligandů: čtyři vazby na N pyrrolů
pátá vazba na His globinu
šestá vazba na dikyslík
Peptidový řetězec globinu
33 33
34.
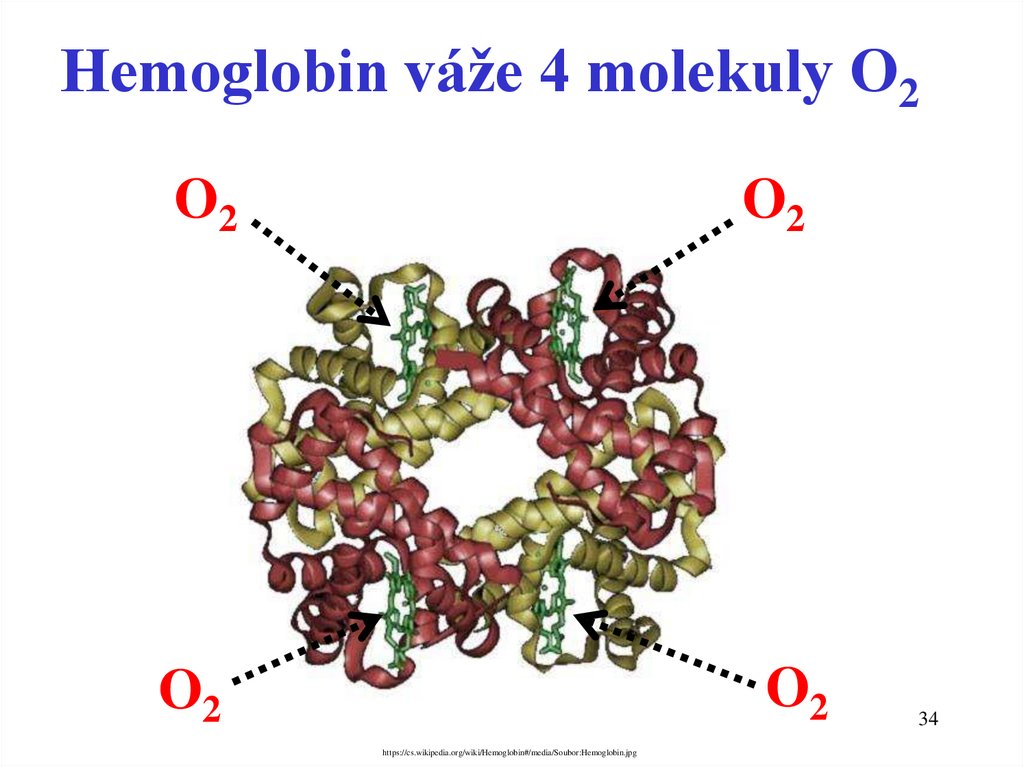
Hemoglobin váže 4 molekuly O2O2
O2
O2
O2
https://cs.wikipedia.org/wiki/Hemoglobin#/media/Soubor:Hemoglobin.jpg
34
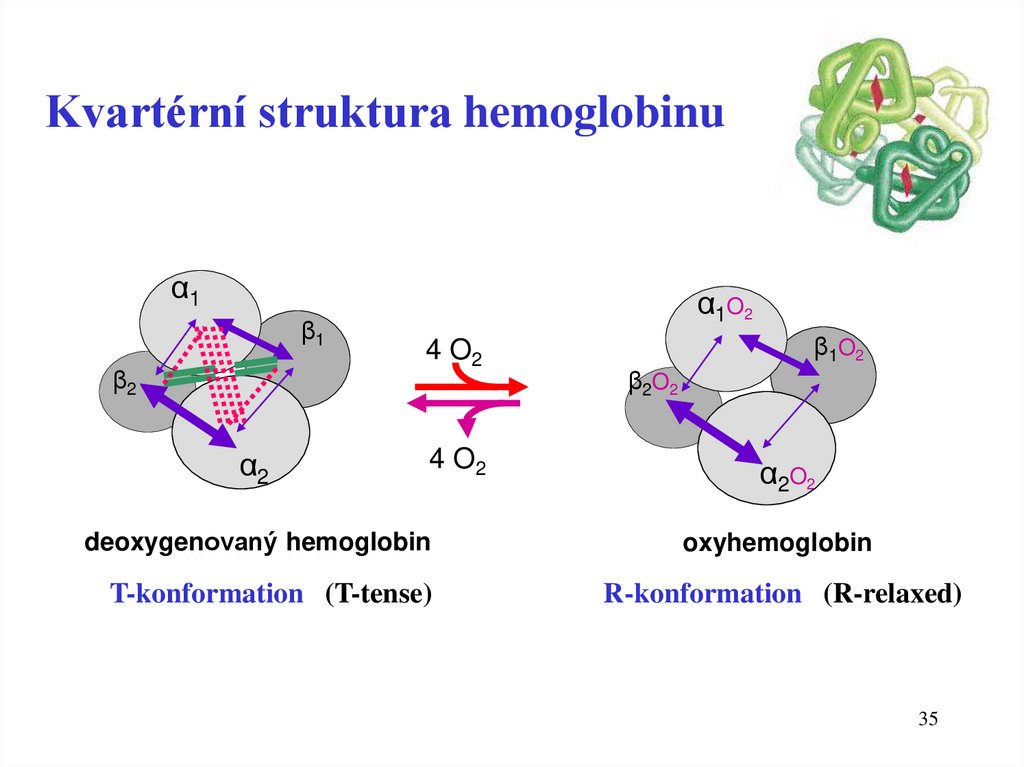
35.
Kvartérní struktura hemoglobinuα1
β1
β2
α2
α1O2
4 O2
4 O2
β1O2
β2O2
α2O2
deoxygenovaný hemoglobin
oxyhemoglobin
T-konformation (T-tense)
R-konformation (R-relaxed)
35
36.
Hemoglobin se vyskytuje ve dvou formáchKvarterní struktura (T-forma a R-forma)
Oxyhemoglobin – HBO2
• R- forma
• vysoká afinita ke kyslíku
• vazba kyslíku na Hb probíhá v plicích
Deoxyhemoglobin - Hb
• T-forma (stabilizace pomocí 2,3BPG)
• nízká afinita ke kyslíku
• uvolnění kyslíku z HBO2 probíhá v tkáních
36
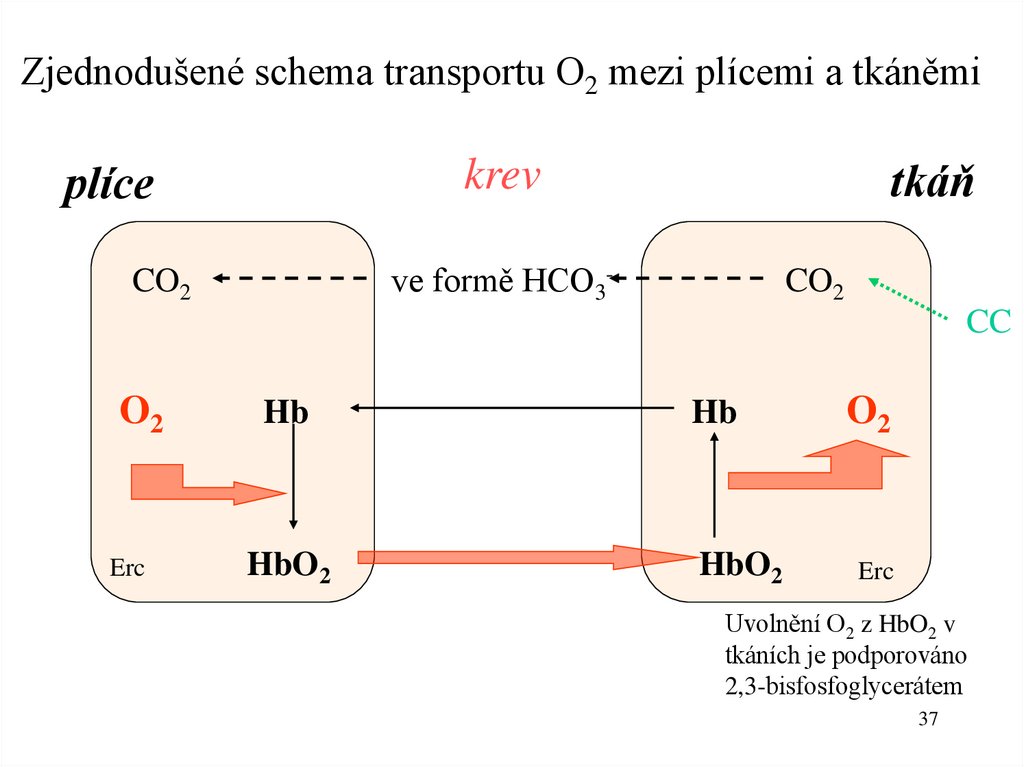
37.
Zjednodušené schema transportu O2 mezi plícemi a tkáněmitkáň
krev
plíce
ve formě HCO3-
CO2
CO2
CC
O2
Hb
Hb
O2
Erc
HbO2
HbO2
Erc
Uvolnění O2 z HbO2 v
tkáních je podporováno
2,3-bisfosfoglycerátem
37
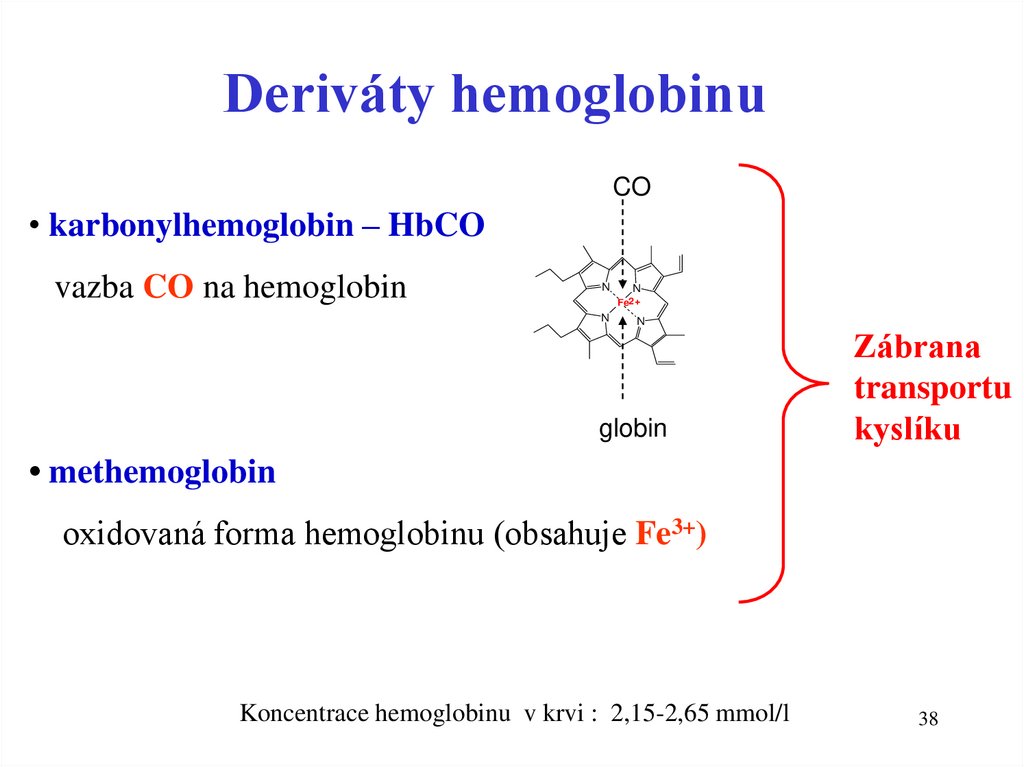
38.
Deriváty hemoglobinuCO
• karbonylhemoglobin – HbCO
vazba CO na hemoglobin
N
N
Fe2+
N
N
globin
Zábrana
transportu
kyslíku
• methemoglobin
oxidovaná forma hemoglobinu (obsahuje Fe3+)
Koncentrace hemoglobinu v krvi : 2,15-2,65 mmol/l
38
39.
Karbonylhemoglobin (Hb-CO)• oxid uhelnatý (CO) se váže na Fe2+ hemoglobinu
• affinita hemoglobinu k CO je 200-krát větší než k O2
• Hb-CO netransportuje kyslík
• charakteristická karmínově-červená barva
39
40.
CO - toxicita a terapie:•Zdroje CO:
kouř (př.požáry, výfukové plyny), cigaretový kouř
prostředí obsahující 0,1% CO – smrtelná koncentrace
endogení zdroj CO: katabolismus hemu
heme Fe2+ + CO + biliverdin ( bilirubin)
•Terapie: ventilace s vysokým pO2 , hyperbarické komory
40
41.
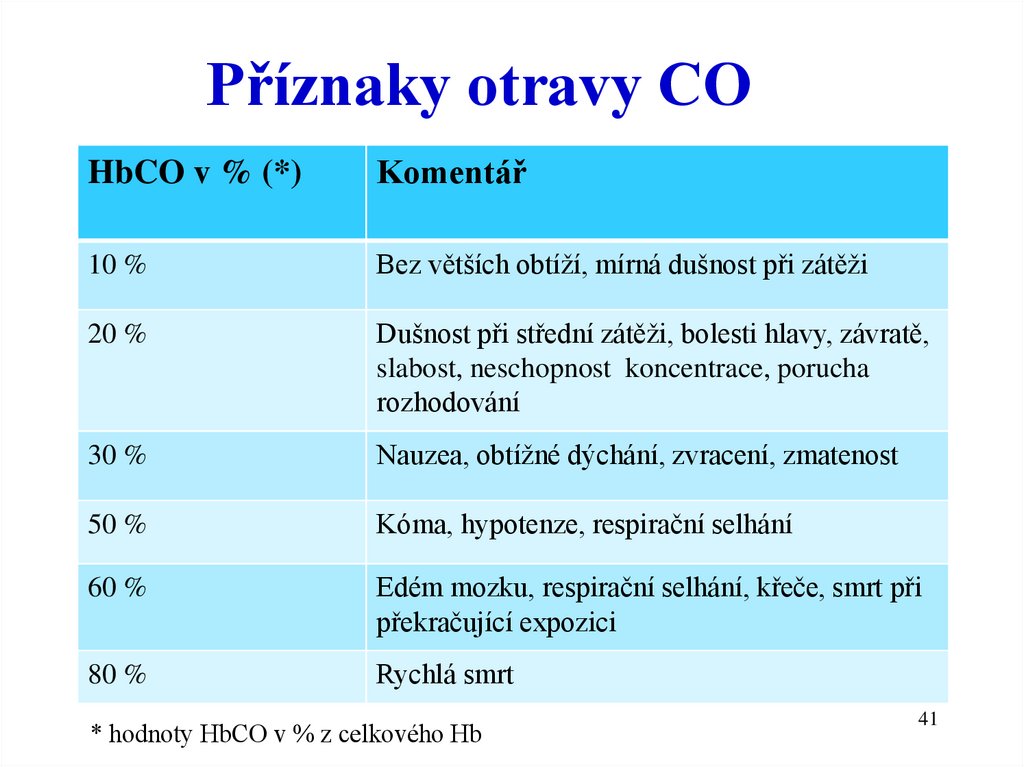
Příznaky otravy COHbCO v % (*)
Komentář
10 %
Bez větších obtíží, mírná dušnost při zátěži
20 %
Dušnost při střední zátěži, bolesti hlavy, závratě,
slabost, neschopnost koncentrace, porucha
rozhodování
30 %
Nauzea, obtížné dýchání, zvracení, zmatenost
50 %
Kóma, hypotenze, respirační selhání
60 %
Edém mozku, respirační selhání, křeče, smrt při
překračující expozici
80 %
Rychlá smrt
* hodnoty HbCO v % z celkového Hb
41
42.
Karbonylhemoglobin v krviJedinec
HbCO (%) z celkového Hb
Novorozenec
0.4
Dospělý (venkov)
1-2
Dospělý (město)
4-5
Kuřák
10-12
Dopravní policista
12-15
42
43.
Methemoglobin• obsahuje Fe3+
• oxidovaná forma hemoglobinu
• neváže O2
Hemoglobin
Methemoglobin
https://www.rcemlearning.co.uk/reference/methaemoglobinaemia/
• methemoglobin netransportuje kyslík
• čokoládově hnědá krev
• oxidace hemoglobinu (Fe2+) na methemoglobin (Fe3+) může být
způsobena různými látkami, např.:
nitrity, chlorečnany
• methemoglobinreduktasa: methemoglobin (Fe3+) → → hemoglobin (Fe2+)
43
44.
Methemoglobinemie – klinické příznakyPříznaky methemoglobinemie: cyanóza
MetHb v % (*)
Komentář
10-15 %
Bolesti hlavy, závratě, akrální cyanóza
(nehty, rty nos, uši), tachykardie
30-50 %
Zmatenost, dušnost, „švestkově“ modrá
cyanóza, „čokoládově“ hnědá krev
50-70 %
Koma, respirační deprese
60-70 % a více
smrt
* hodnoty MetHb (methemoglobinu) v % z celkového Hb
44
45.
Methemoglobinemie – příčiny vznikuVrozená methemoglobinemie:
- defekt methemoglobinreduktasy
methemoglobin (Fe3+) → → hemoglobin (Fe2+)
- přítomnost abnormálního hemoglobinu M (HbM)
mutace genu pro globin v hemoglobinu
důsledek: stabilizace železa v hemu ve formě Fe3+
Získaná methemoglobinemie: náhodné otravy průmyslovými
látkami nebo léky
45
46.
Získaná methemoglobinemie- otrava některými průmyslovými látkami (př. anilin a jeho deriváty –barviva)
- působením některých léků (př.sulfonamidy, lokální anestetika – př.benzokain)
- zvýšený obsah dusičnanů a dusitanů v pitné vodě a potravě
ohroženi především kojenci („modrání kojenců“)
limit NO3- v pitné vodě: 50mg/l
https://www.vitalia.cz/katalog/nemoci/cyanoza/
alimentární intoxikace zeleninou z nekontrolovaných zdrojů !
- terapie: podávání redukčních činidel (methylenová modř, kyselina askorbová)
46
47.
Další deriváty hemoglobinuKarbaminohemoglobin
• vazba CO2 na globin (neenzymová karboxylace na dusíku)
• minoritní forma transportu CO2 z tkání do plic
Glykovaný hemoglobin
• vazba glukosy na globin (Lys-zbytek)
• posouzení léčby diabetu/kompenzace diabetu
47
48.
Myoglobin• monomer
globin, hem
(Fe2+)
• vazba jedné molekuly kyslíku
Pamatuj:
• vyšší afinita kyslíku než u hemoglobinu
4 molekuly O2 se
váží na hemoglobin
• svaly, srdce
48



































 Биология
Биология







