Похожие презентации:
периодический закон_Б
1.
ПЕРИОДИЧЕСКИЙЗАКОН и
ПЕРИОДИЧЕСКАЯ
СИСТЕМА
Д. И. Менделеева
2. Цель урока.
• Рассмотреть на примере открытияПериодического закона основные
этапы становления научной теории
вообще: предпосылки, обобщение и
развитие.
• Повторить основные закономерности
Периодической системы.
• Формировать у учащихся чувство
гордости за отечественную науку.
3.
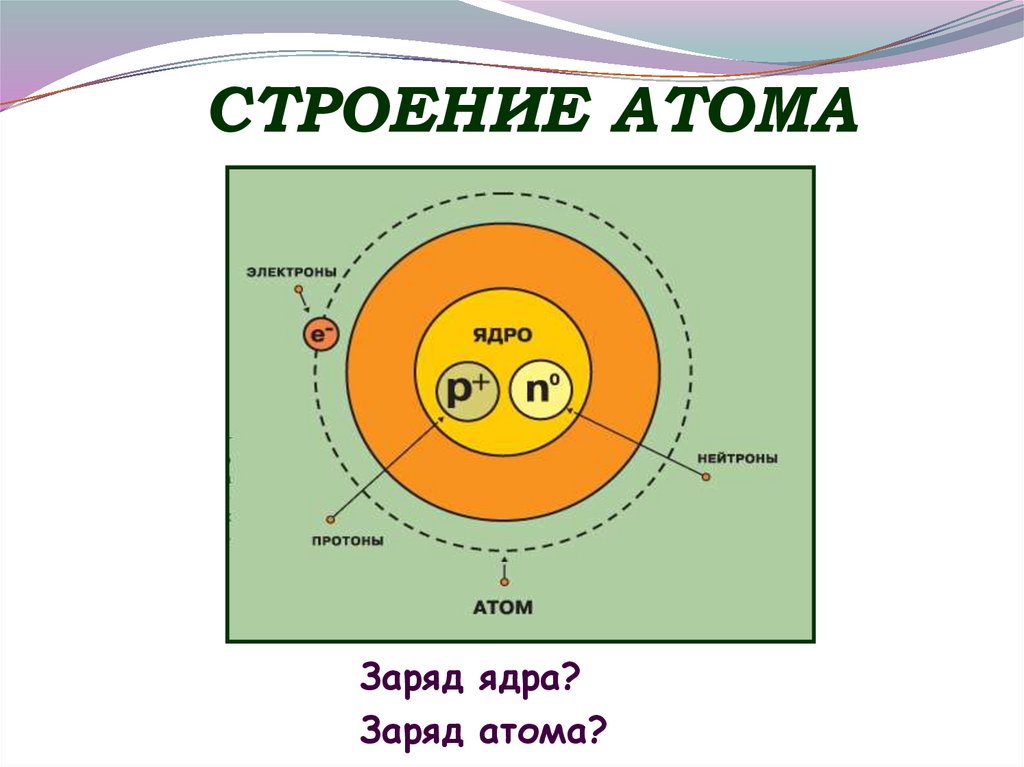
4. СТРОЕНИЕ АТОМА
Заряд ядра?Заряд атома?
5. АТОМ
p и n - нуклоны,из их массы слагается
масса атома.
Ядро атома ± p = новый атом
Ядро атома ± n = ИЗОТОП
ИЗОТОП – разновидность одного
и того же атома с одинаковым
зарядом ядра но разной
массой атома.
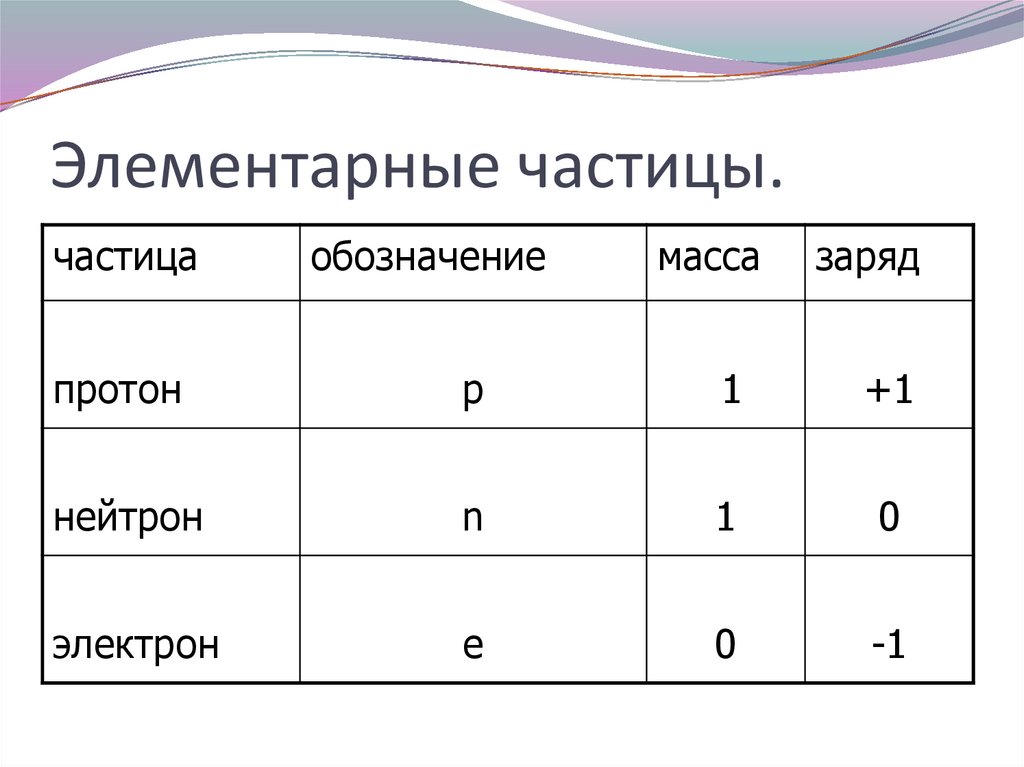
6. Элементарные частицы.
частицаобозначение
масса
заряд
протон
р
1
+1
нейтрон
n
1
0
электрон
e
0
-1
7. Взаимосвязь положения элемента в ПСХЭ и строением его атома
Порядковый номер элементасоответствует заряду ядра
атома и общему числу
электронов и протонов.
Ar - порядковый номер =
количеству нейтронов в ядре
атома
8. Характеристика серы S
Порядковый номер равен ?,следовательно заряд ядра
+ ?, общее количество
электронов ?, протонов, ?.
Ar (S) ? – ? = ?нейтронов
9.
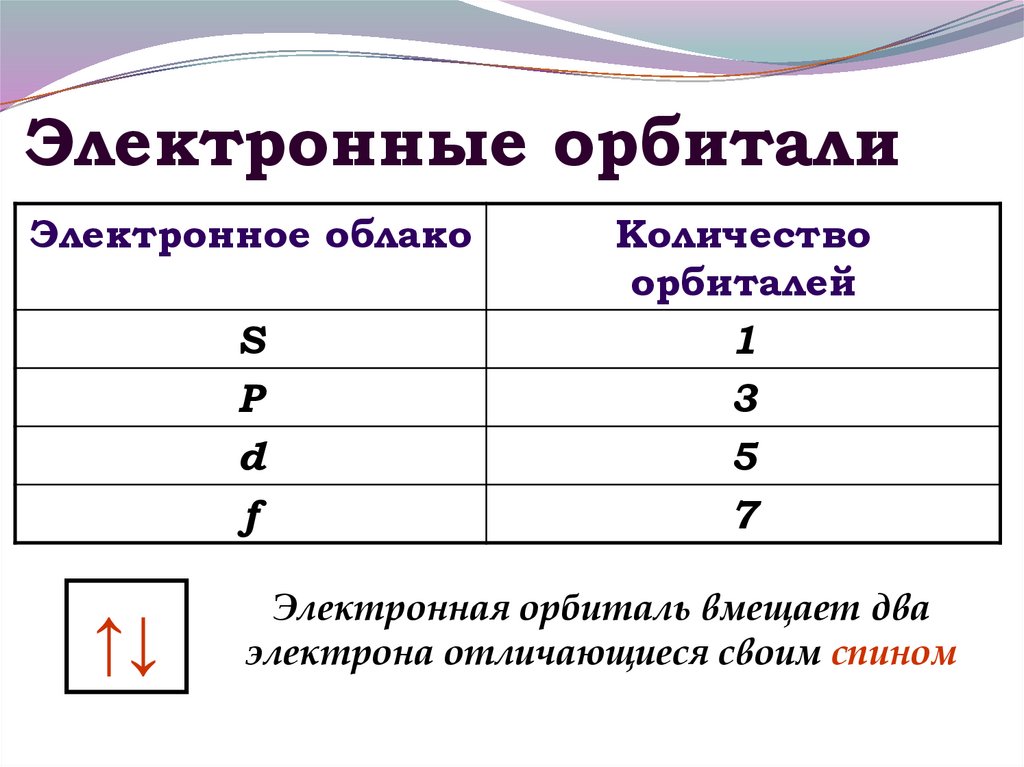
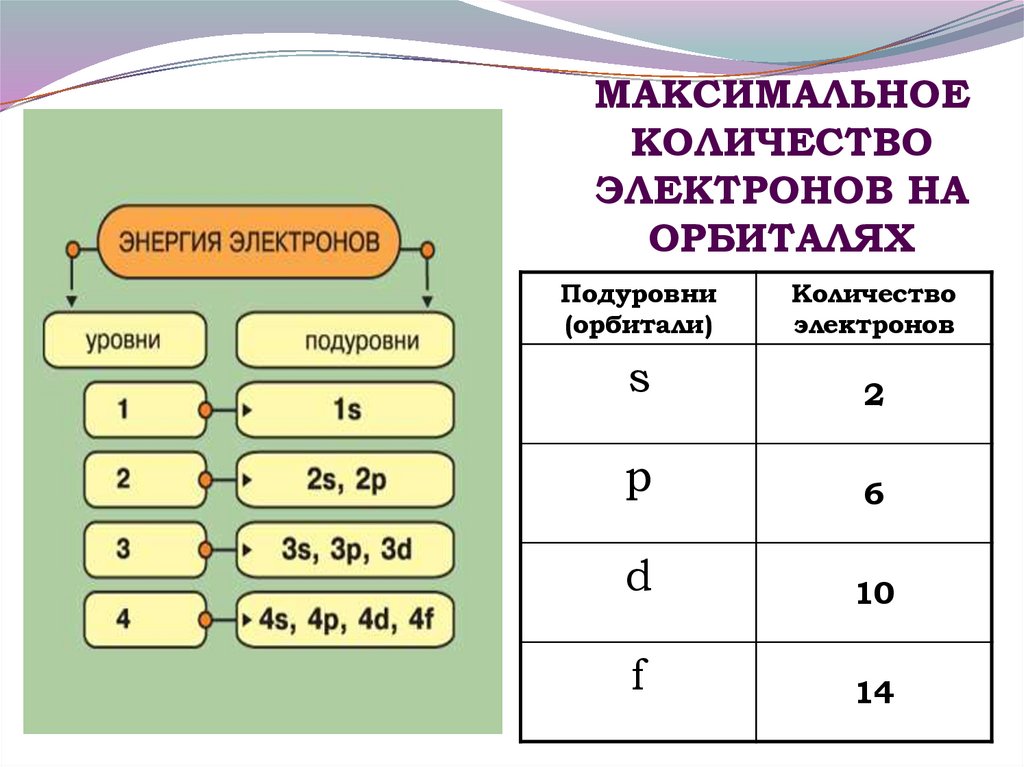
10. Электронные орбитали
Электронное облакоS
P
d
f
↑↓
Количество
орбиталей
1
3
5
7
Электронная орбиталь вмещает два
электрона отличающиеся своим спином
11. МАКСИМАЛЬНОЕ КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА ОРБИТАЛЯХ
Подуровни(орбитали)
Количество
электронов
s
2
p
6
d
10
f
14
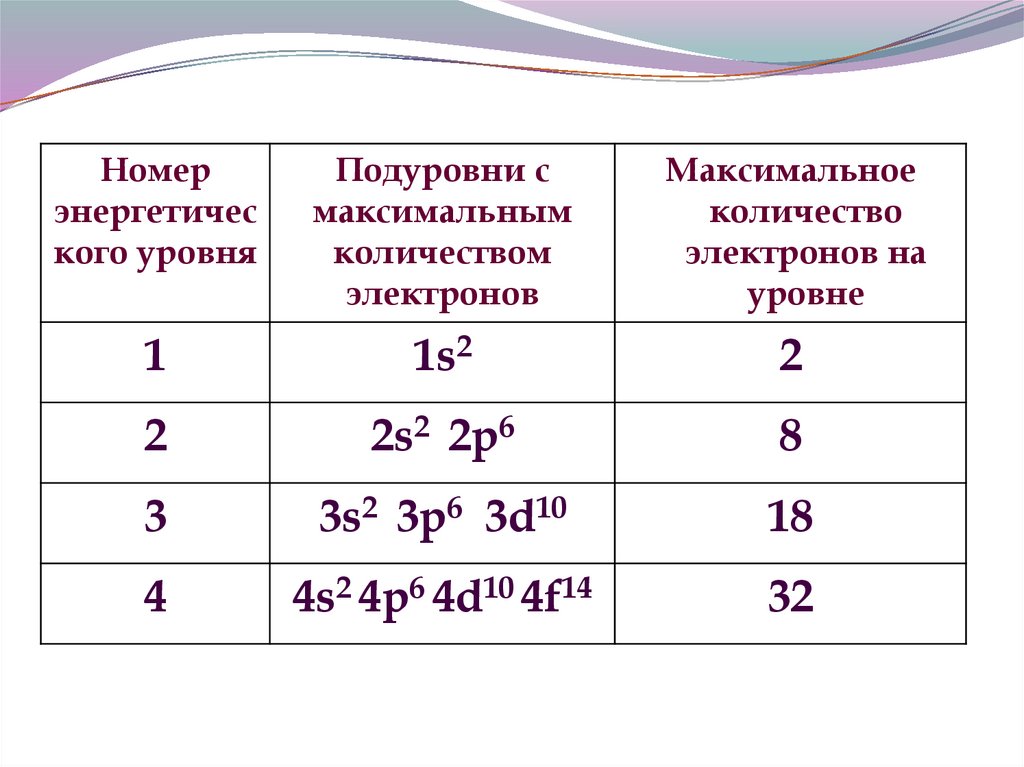
12.
Номерэнергетичес
кого уровня
Подуровни с
максимальным
количеством
электронов
Максимальное
количество
электронов на
уровне
1
1s2
2
2
2s2 2p6
8
3
3s2 3p6 3d10
18
4
4s2 4p6 4d10 4f14
32
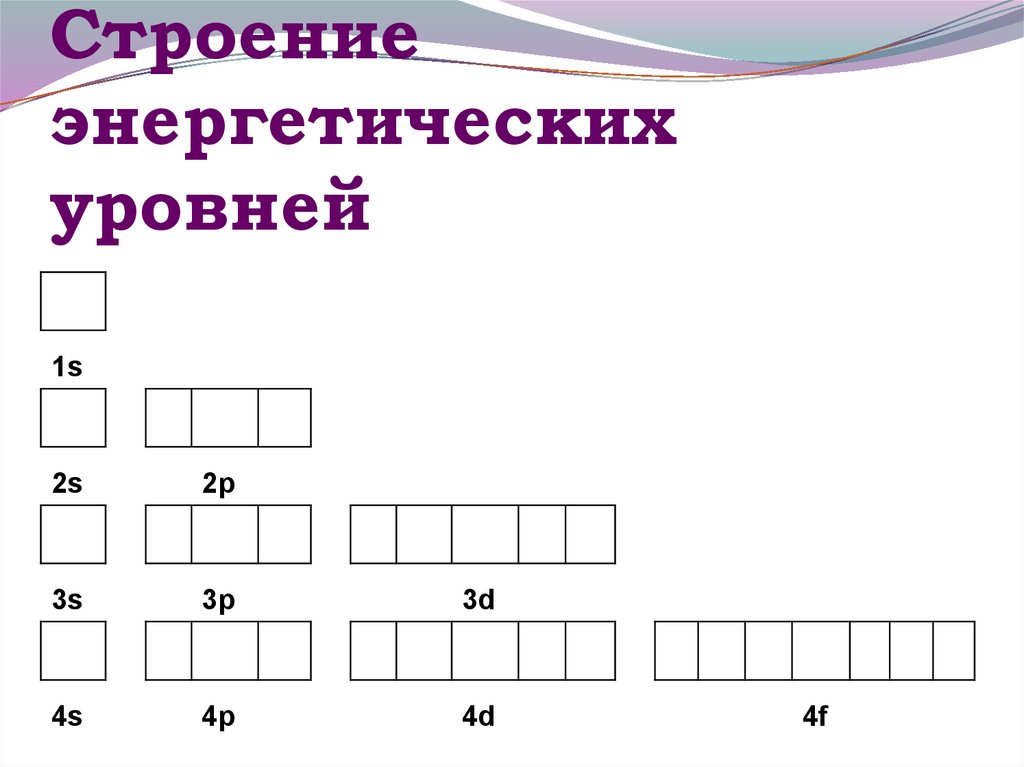
13. Строение энергетических уровней
1s2s
2p
3s
3p
3d
4s
4p
4d
4f
14. ШКАЛА ЭНЕРГИИ
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p15. Взаимосвязь положения элемента в ПСХЭ с электронным строением его атома
1. Порядковый номер элемента соответствуетзаряду ядра атома и общему числу электронов.
2. Номер периода соответствует количеству
энергетических уровней.
3. Номер группы соответствует количеству
электронов на последнем энергетическом уровне
и высшей валентности элемента.
16. 1. Порядковый номер равен 12, следовательно, заряд ядра + 12, ē =12, р=12 (n= 24-12=12). 2. Расположен в 3 периоде – имеет 3
СТРОЕНИЕ АТОМА1. Порядковый номер равен 12, следовательно,
заряд ядра + 12, ē =12, р=12 (n= 24-12=12).
2. Расположен в 3 периоде – имеет 3
энергетических уровня.
3. Стоит во II группе – на последнем
энергетическом уровне 2 электрона.
+ 12 Mg)))
↓↑
282
1s2
↓↑
↓↑ ↓↑
2s2
2p6
↓↑
↓↑
3s2
3p0
3d0
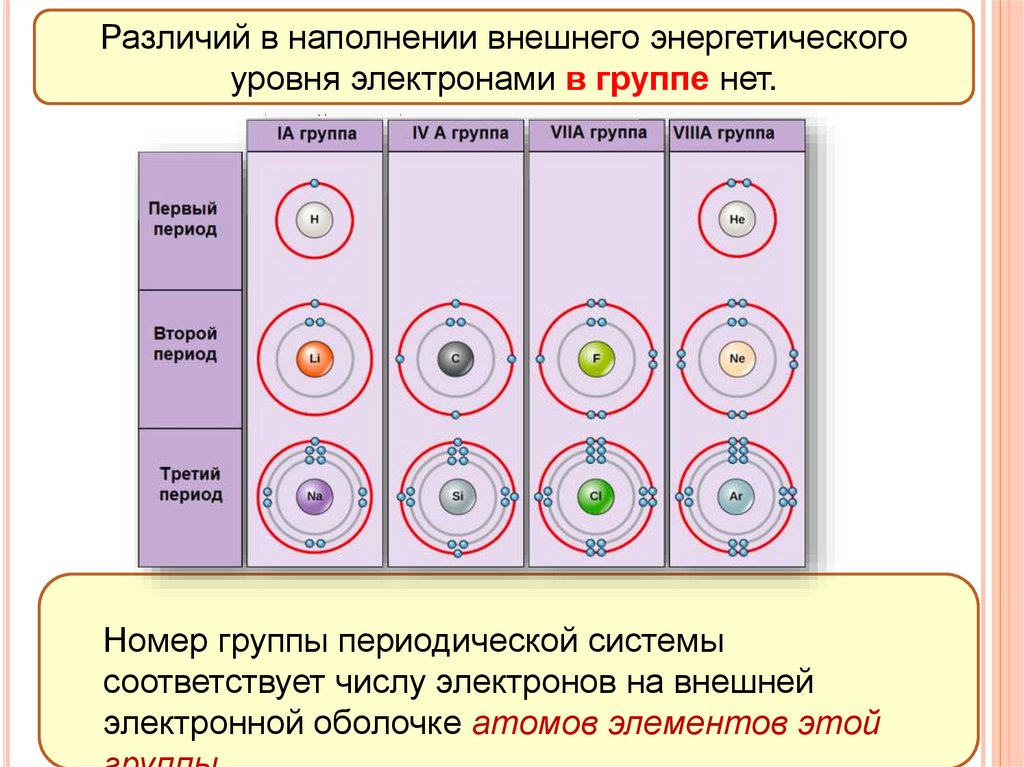
17. Строение электронных оболочек атомов
+1H)+2He)
1
2
+3Li) )
+4Be) ) +5B) )
21
22
23
+11Na
)))
+12Mg
)))
+13Al
)))
281
282
283
+6C) )
+7N) )
+8O) )
+9F) )
+10Ne ) )
24
25
26
27
28
+14Si +15P
)))
)))
284
285
+16S
)))
286
+17Cl
)))
287
+18Ar
)))
288
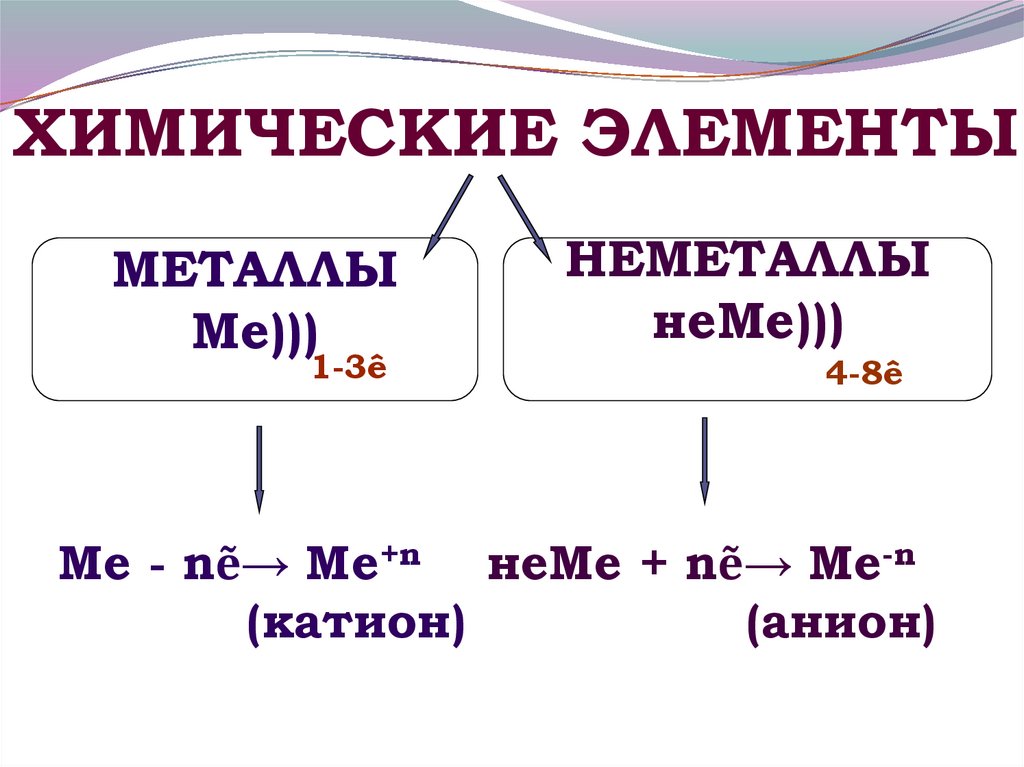
18. Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n (катион) (анион)
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫМЕТАЛЛЫ
Ме)))
1-3ê
НЕМЕТАЛЛЫ
неМе)))
4-8ê
Ме - nẽ→ Ме+n неМе + nẽ→ Ме-n
(катион)
(анион)
19. Почему ПСХЭ названа - ПЕРИОДИЧЕСКОЙ?
ПОЧЕМУ ПСХЭ НАЗВАНА ПЕРИОДИЧЕСКОЙ?ПСХЭ – это графическая запись
ПЕРИОДИЧЕСКОГО ЗАКОНА!
20. Предпосылки открытия Периодического закона.
ПРЕДПОСЫЛКИ ОТКРЫТИЯПЕРИОДИЧЕСКОГО ЗАКОНА.
Известно 63 элемента.
Классификация Берцелиуса Й.Я.(металлы и
неметаллы).
1816г. Триады Дебенейнера И.В.
1862г. Спираль А. Бегье де Шанткуртуа.
1865г. Октавы Ньюлендса Д.А.Р.
1864 г. Кривая Мейера Л.
1860г.Международный химический конгресс в г.
Карлсруэ (относительная атомная масса).
21. Открытие Периодического закона.
ОТКРЫТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА.1марта 1869 год.
Свойства химических элементов
и образованных ими веществ
находятся в периодической
зависимости от их
относительных атомных масс.
22. Современная формулировка Периодического закона.
СОВРЕМЕННАЯ ФОРМУЛИРОВКАПЕРИОДИЧЕСКОГО ЗАКОНА.
Свойства химических
элементов и образованных
ими веществ находятся в
периодической зависимости
от зарядов их атомных ядер.
23. Период и группа элементов.
ПЕРИОД И ГРУППА ЭЛЕМЕНТОВ.Период- горизонтальный ряд химических элементов в
пределах которого свойства элементов изменяются
последовательно от щелочного металла к инертному
газу.
Группа- вертикальный столбец химических элементов.
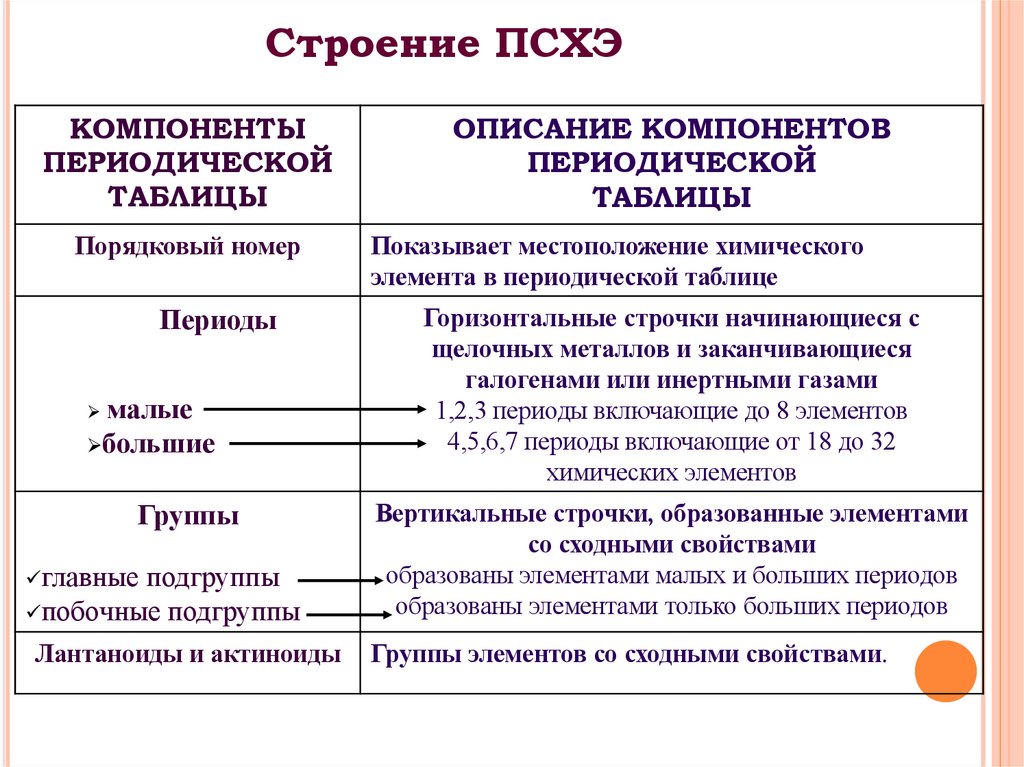
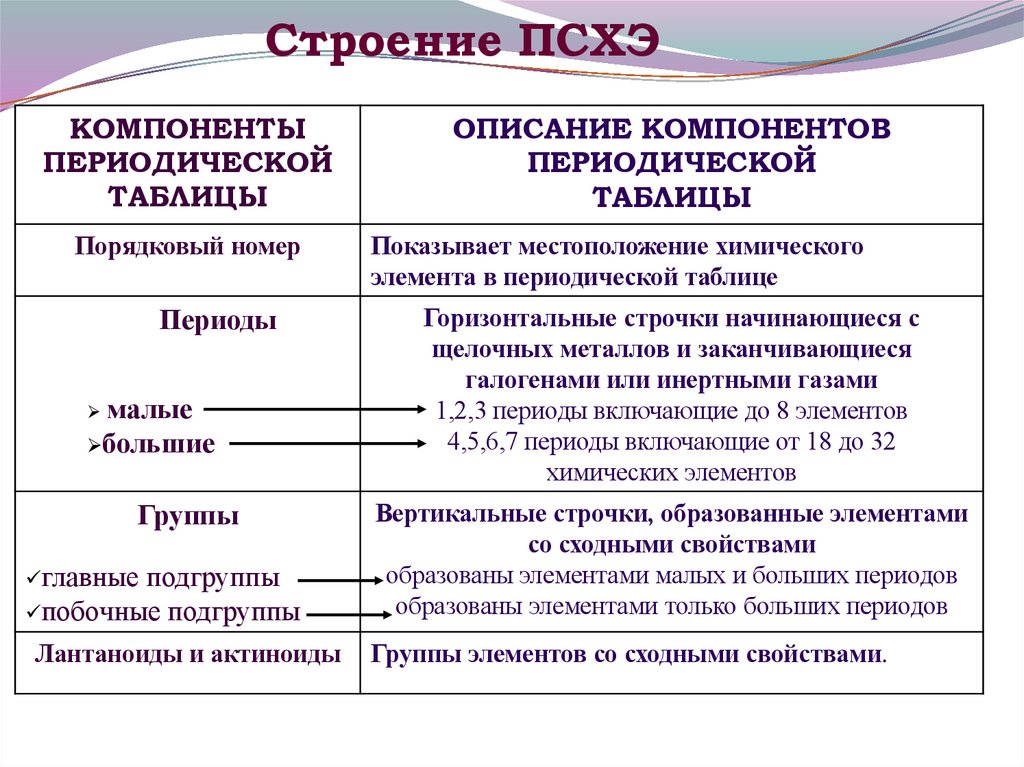
24. Строение ПСХЭ
КОМПОНЕНТЫПЕРИОДИЧЕСКОЙ
ТАБЛИЦЫ
Порядковый номер
Периоды
малые
большие
ОПИСАНИЕ КОМПОНЕНТОВ
ПЕРИОДИЧЕСКОЙ
ТАБЛИЦЫ
Показывает местоположение химического
элемента в периодической таблице
Горизонтальные строчки начинающиеся с
щелочных металлов и заканчивающиеся
галогенами или инертными газами
1,2,3 периоды включающие до 8 элементов
4,5,6,7 периоды включающие от 18 до 32
химических элементов
побочные подгруппы
Вертикальные строчки, образованные элементами
со сходными свойствами
образованы элементами малых и больших периодов
образованы элементами только больших периодов
Лантаноиды и актиноиды
Группы элементов со сходными свойствами.
Группы
главные подгруппы
25.
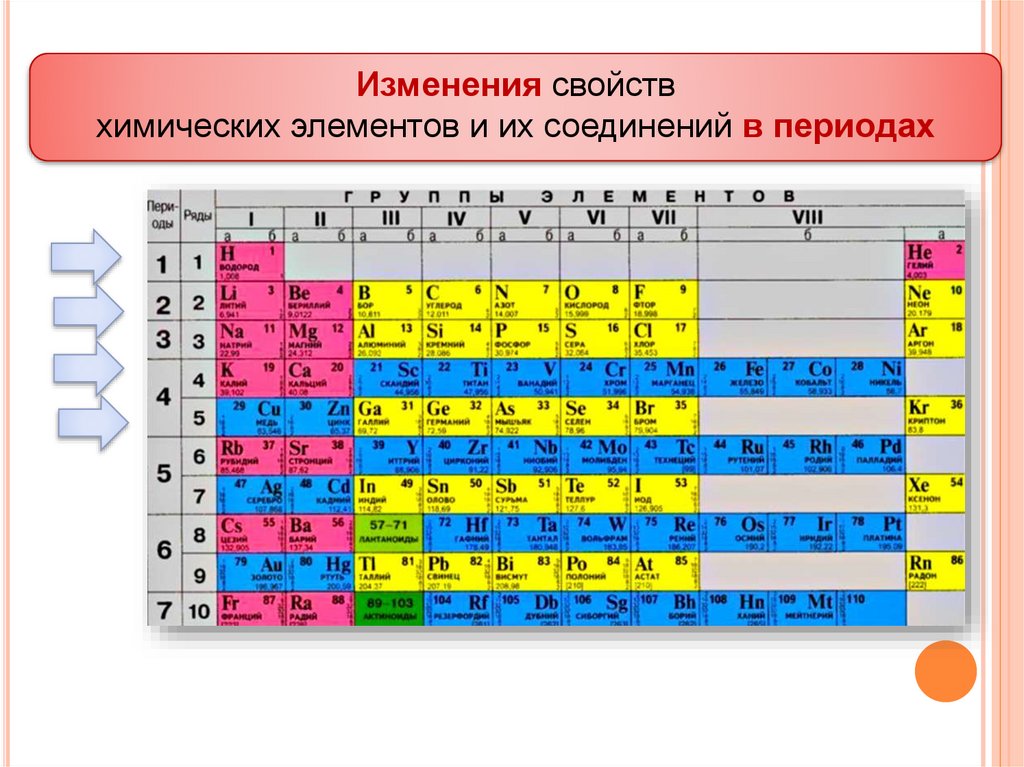
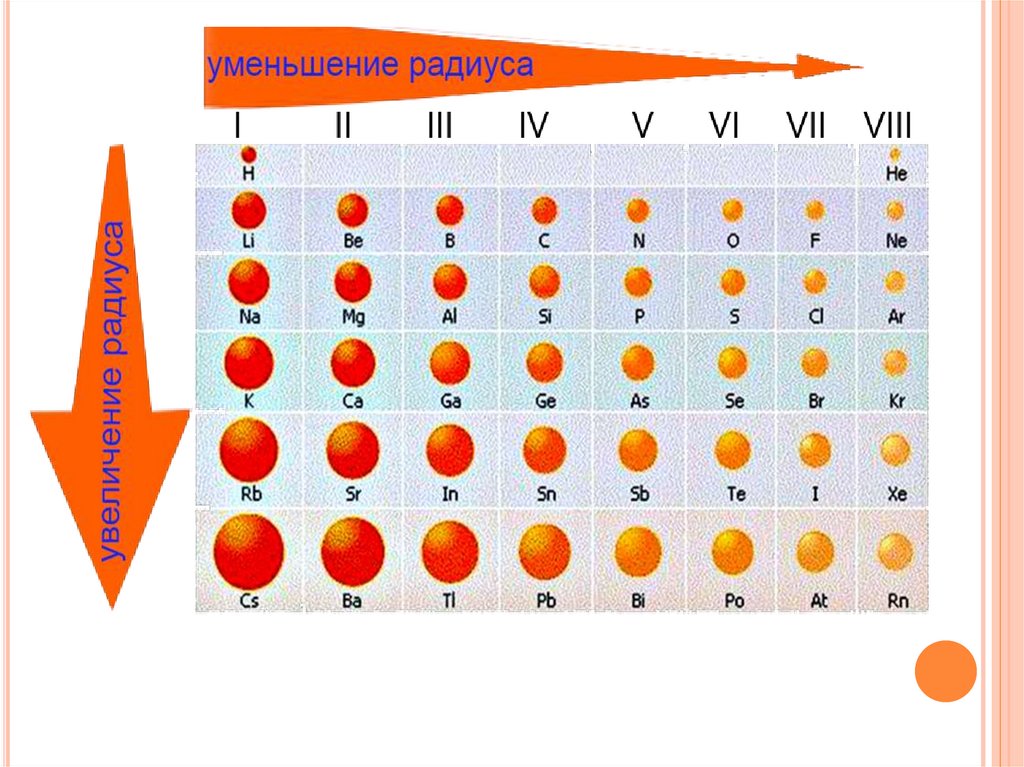
Изменения свойствхимических элементов и их соединений в периодах
26.
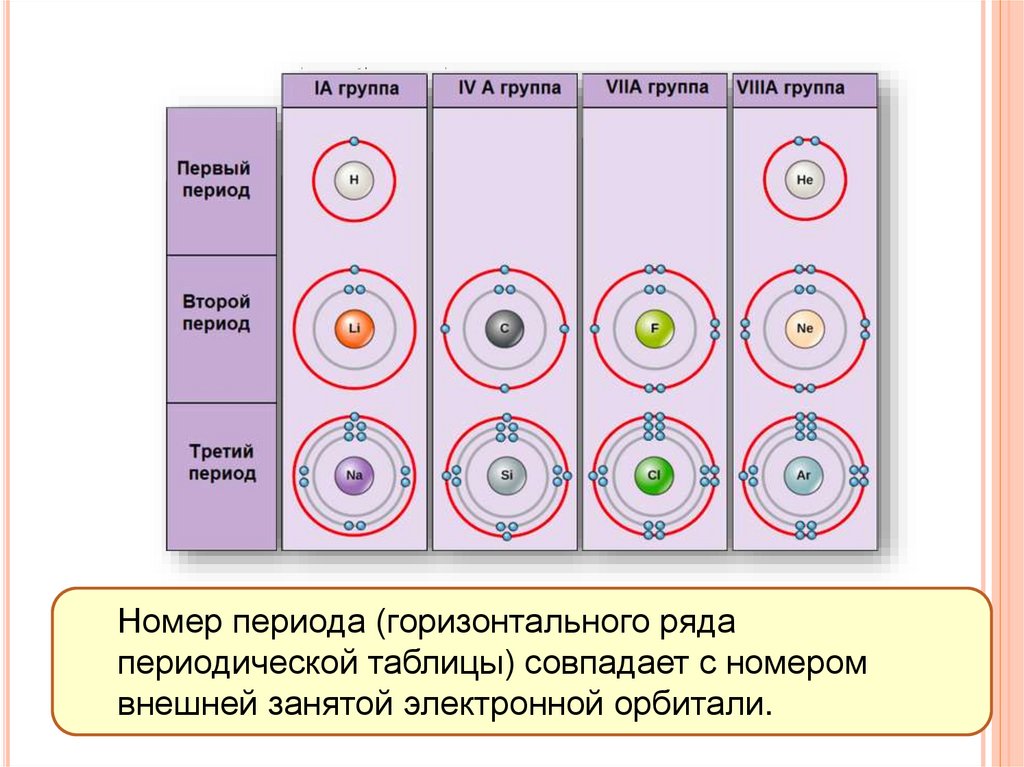
Номер периода (горизонтального рядапериодической таблицы) совпадает с номером
внешней занятой электронной орбитали.
27.
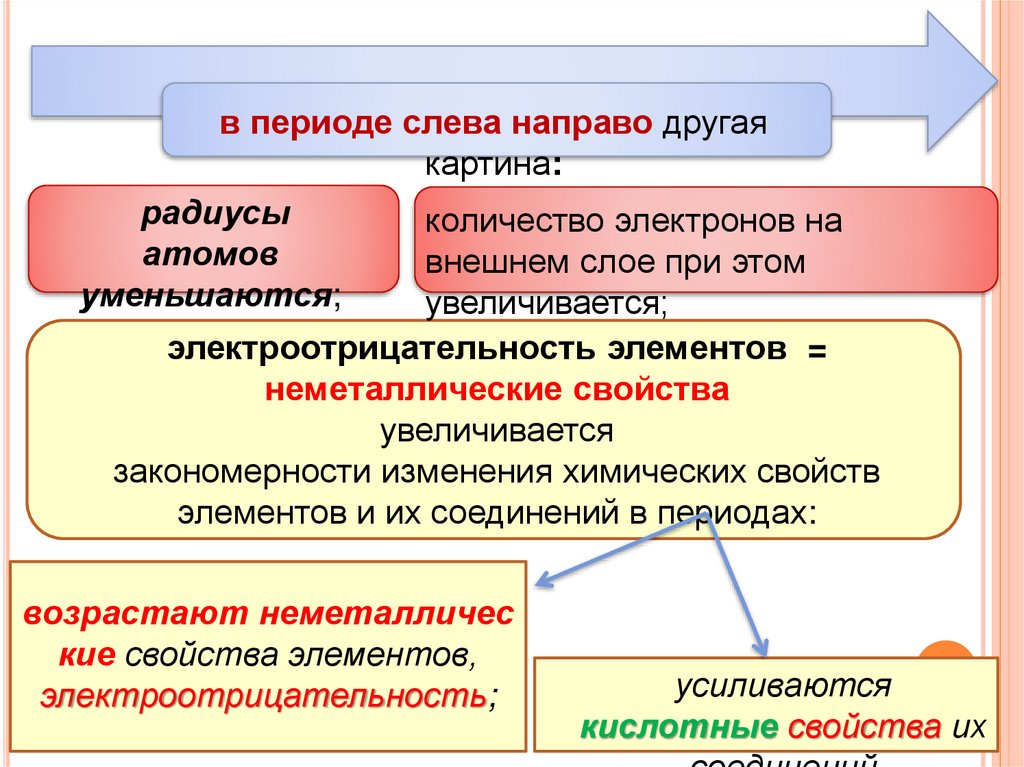
в периоде слева направо другаякартина:
радиусы
количество электронов на
атомов
внешнем слое при этом
уменьшаются;
увеличивается;
электроотрицательность элементов =
неметаллические свойства
увеличивается
закономерности изменения химических свойств
элементов и их соединений в периодах:
возрастают неметалличес
кие свойства элементов,
электроотрицательность;
усиливаются
кислотные свойства их
28.
29. Закономерности по периоду.
ЗАКОНОМЕРНОСТИ ПО ПЕРИОДУ.С увеличением зарядов атомных ядер:
число энергетических уровней остается
постоянным;
возрастает число электронов на последнем
энергетическом уровне;
уменьшается радиус атома;
возрастает электроотрицательность элементов;
уменьшаются металлические и увеличиваются
неметаллические свойства;
уменьшаются восстановительные и увеличиваются
окислительные свойства.
30.
Различий в наполнении внешнего энергетическогоуровня электронами в группе нет.
Номер группы периодической системы
соответствует числу электронов на внешней
электронной оболочке атомов элементов этой
31.
Меняется размер атома - сверху вниз вгруппе радиусы
атомов увеличиваются!
Периодический закон Д. И. Менделеева:
«свойства химических элементов; а также формы и
свойства образуемых ими простых веществ и
соединений находятся в периодической зависимости
от величины зарядов ядер их атомов»
это означает:
32.
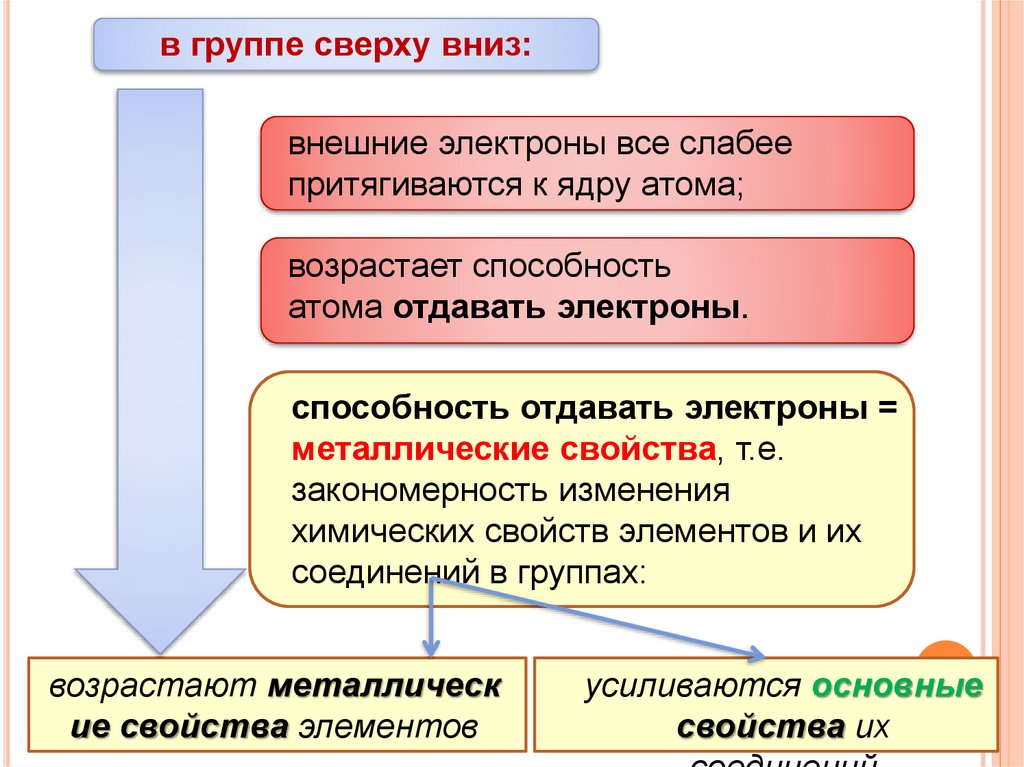
в группе сверху вниз:внешние электроны все слабее
притягиваются к ядру атома;
возрастает способность
атома отдавать электроны.
способность отдавать электроны =
металлические свойства, т.е.
закономерность изменения
химических свойств элементов и их
соединений в группах:
возрастают металлическ
ие свойства элементов
усиливаются основные
свойства их
33. Закономерности по группе.
ЗАКОНОМЕРНОСТИ ПО ГРУППЕ.С увеличением зарядов атомных ядер:
число электронов на последнем энергетическом
уровне постоянно;
число энергетических уровней увеличивается;
увеличивается радиус атома;
уменьшается электроотрицательность элементов;
увеличиваются металлические и уменьшаются
неметаллические свойства;
увеличиваются восстановительные и уменьшаются
окислительные свойства.
34. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПО ГРУППЕПО ПЕРИОДУ
По периоду слева направо металлическая
активность убывает, а неметаллическая возрастает.
Т.к. увеличивается количество электронов
на последнем энергетическом уровне,
атому становится легче присоединить
недостающие электроны, чем отдать имеющиеся.
По группе сверху в низ металлическая
активность возрастает, а неметаллическая убывает.
Т.к. увеличивается количество энергетических
уровней, следовательно радиус атома
увеличивается,атому становится легче отдать
электроны, чем присоединить недостающие.
35. Закономерности по диагонали.
ЗАКОНОМЕРНОСТИ ПО ДИАГОНАЛИ.С увеличением зарядов атомных ядер:
Сходство объясняется тем, что нарастание
неметаллические свойства в периодах уравновешивается
увеличением металлических свойств в группах.
Примеры:
B-Si-As-Te-At(делит элементы на металл и неметаллы);
Al-Ge-Sb (амфотерные элементы);
Zn-In-Pb
36.
Есть еще элементы, которые образуют такназываемые амфотерные соединения.
Они проявляют как металлические, так и
неметаллические свойства.
Zn Cr Al Sn Pb
Mn Fe Be
37. Закрепление материала Задание №1:
ЗАКРЕПЛЕНИЕ МАТЕРИАЛАЗАДАНИЕ №1:
Сравните металлические свойства элементов,
поставив вместо знак «<» или «>»:
Na K; Al Mg; Rb Sr; Na Cs; K Al
Сравните неметаллические свойства
элементов, поставив вместо знак «<» или
«>»:
S O; F P; Si C; P S; N O
38. Проверьте себя (задание №1):
ПРОВЕРЬТЕ СЕБЯ (ЗАДАНИЕ №1):Сравните металлические свойства элементов,
поставив вместо знак «<» или «>»:
Na < K; Al < Mg; Rb > Sr; Na > Cs; K > Al
Сравните неметаллические свойства
элементов, поставив вместо знак «<» или
«>»:
S < O; F > P; Si < C; P < S; N < O
39. Задание №2:
ЗАДАНИЕ №2:Расположите элементы в порядке
уменьшения их металлических свойств:
а) Al, Na, K, B, Bа, Mg
б) Na, Rb, Mg, Ca, Cs, Al
Расположите элементы в порядке
уменьшения их неметаллических свойств:
а) C, S, Si, O, P, Cl, F
б) Si, N, P, Cl, Br, As, S
40. Проверьте себя (задание №2):
ПРОВЕРЬТЕ СЕБЯ (ЗАДАНИЕ №2):Расположите элементы в порядке
уменьшения их металлических свойств:
а) K > Bа > Nа > Mg > Al > B
б) Cs > Rb > Ca > Na > Mg > Al
Расположите элементы в порядке
уменьшения их неметаллических свойств:
а) F > O > Cl > S > C > P > Si
б) N > Cl > Br > S > P > As > Si
41. Значение Периодического закона.
ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА.«До Периодического закона элементы
представляли лишь отрывочные случайные
явления природы: не было повода ждать какихлибо новых , а вновь находимые были полны
неожиданной новинкой. Периодическая
закономерность первая дала возможность видеть
не открытые еще элементы в такой дали, до
которой невооруженное этой закономерностью
зрение до сих пор не достигло.»
Д.И.Менделеев.
42. Значение Периодического закона.
ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА.установить взаимную связь между элементами и
объединить их по свойствам;
расположить элементы в естественной
последовательности;
вскрыть периодичность, т.е.повторяемость общих свойств;
исправить или уточнить относительные атомные масса
некоторых элементов (Ве с 13 до 9);
43. Значение Периодического закона.
ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА.исправить или уточнить степени окисления некоторых
элементов (Ве с +3 на +2);
Предсказать и описать свойства, указать пути открытия
еще некоторых элементов (Ga (открыт в 1875г.), Sc( в
1879г.), Ge (в 1886г.)).
Предсказано: №114 аналог свинца; №118 благородный
газ.
44. Вывод.
ВЫВОД.Рассмотрели на примере открытия Периодического
закона основные этапы становления научной теории
вообще: предпосылки, обобщение и развитие.
Повторили основные закономерности Периодической
системы.
45. Домашнее задание.
ДОМАШНЕЕ ЗАДАНИЕ.П.5
Упр.1-7.
46. Строение ПСХЭ
КОМПОНЕНТЫПЕРИОДИЧЕСКОЙ
ТАБЛИЦЫ
Порядковый номер
Периоды
малые
большие
ОПИСАНИЕ КОМПОНЕНТОВ
ПЕРИОДИЧЕСКОЙ
ТАБЛИЦЫ
Показывает местоположение химического
элемента в периодической таблице
Горизонтальные строчки начинающиеся с
щелочных металлов и заканчивающиеся
галогенами или инертными газами
1,2,3 периоды включающие до 8 элементов
4,5,6,7 периоды включающие от 18 до 32
химических элементов
побочные подгруппы
Вертикальные строчки, образованные элементами
со сходными свойствами
образованы элементами малых и больших периодов
образованы элементами только больших периодов
Лантаноиды и актиноиды
Группы элементов со сходными свойствами.
Группы
главные подгруппы
47. ИЗМЕНЕНИЕ СВОЙСТВ АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ПО ГРУППЕПО ПЕРИОДУ
По периоду слева направо металлическая
активность убывает, а неметаллическая возрастает.
Т.к. увеличивается количество электронов
на последнем энергетическом уровне,
атому становится легче присоединить
недостающие электроны, чем отдать имеющиеся.
По группе сверху в низ металлическая
активность возрастает, а неметаллическая убывает.
Т.к. увеличивается количество энергетических
уровней, следовательно радиус атома
увеличивается,атому становится легче отдать
электроны, чем присоединить недостающие.
48. Химический элемент. Изотоп.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ. ИЗОТОП.Химический элемент- вид атомов с одинаковым
зарядом ядра.
Изотоп- разновидности
атомов одного химического
элемента, но отличающихся по массе, а значит и по
числу нейтронов..
































 Химия
Химия








