Похожие презентации:
e437d5a22a844a5c9d497e62971cffd2
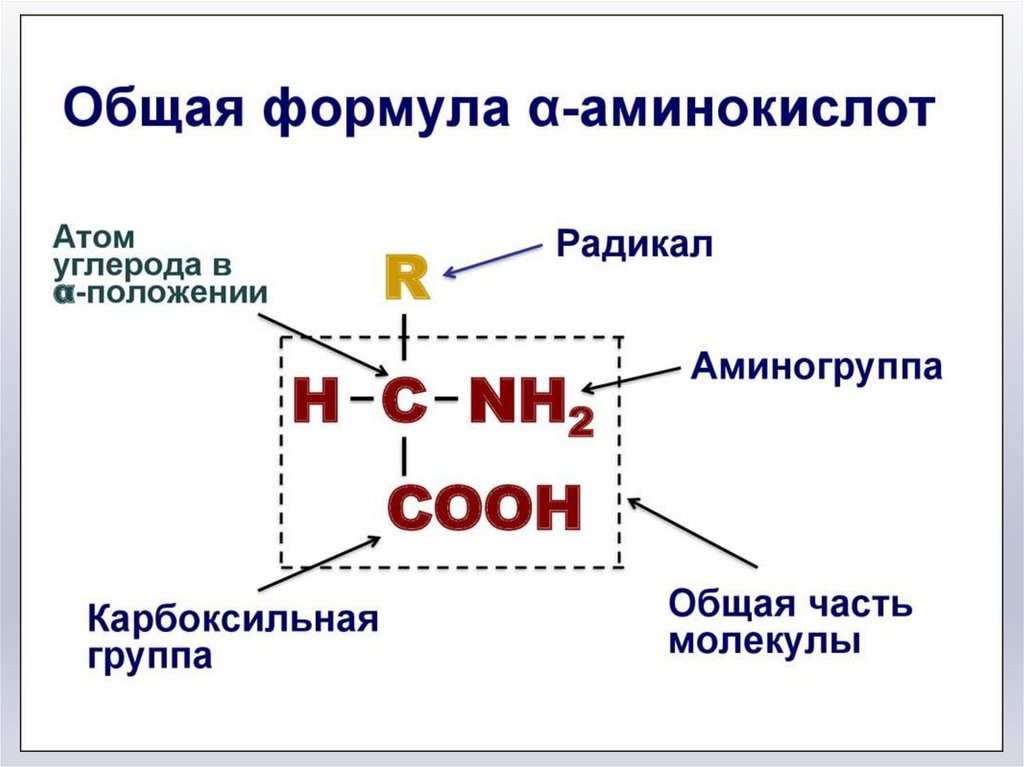
1. Белки. Строение белков
2.
Белки- линейные биополимеры,мономерами которых являются
аминокислоты
3.
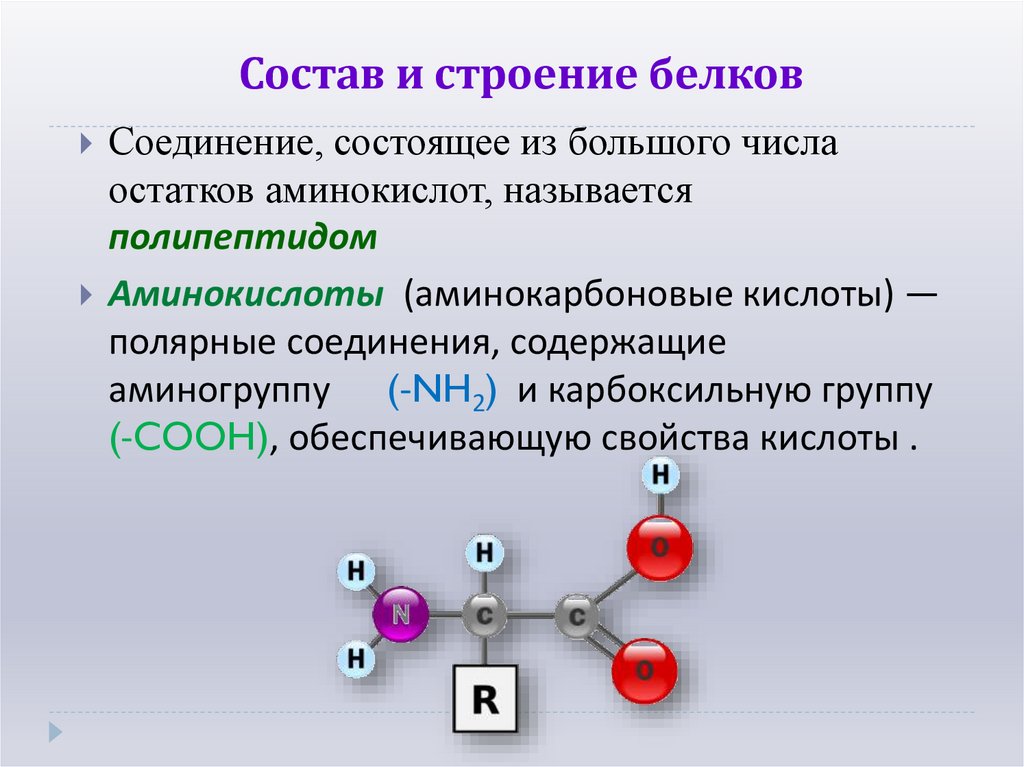
4. Состав и строение белков
Соединение, состоящее из большого числаостатков аминокислот, называется
полипептидом
Аминокислоты (аминокарбоновые кислоты) —
полярные соединения, содержащие
аминогруппу (-NH2) и карбоксильную группу
(-COOH), обеспечивающую свойства кислоты .
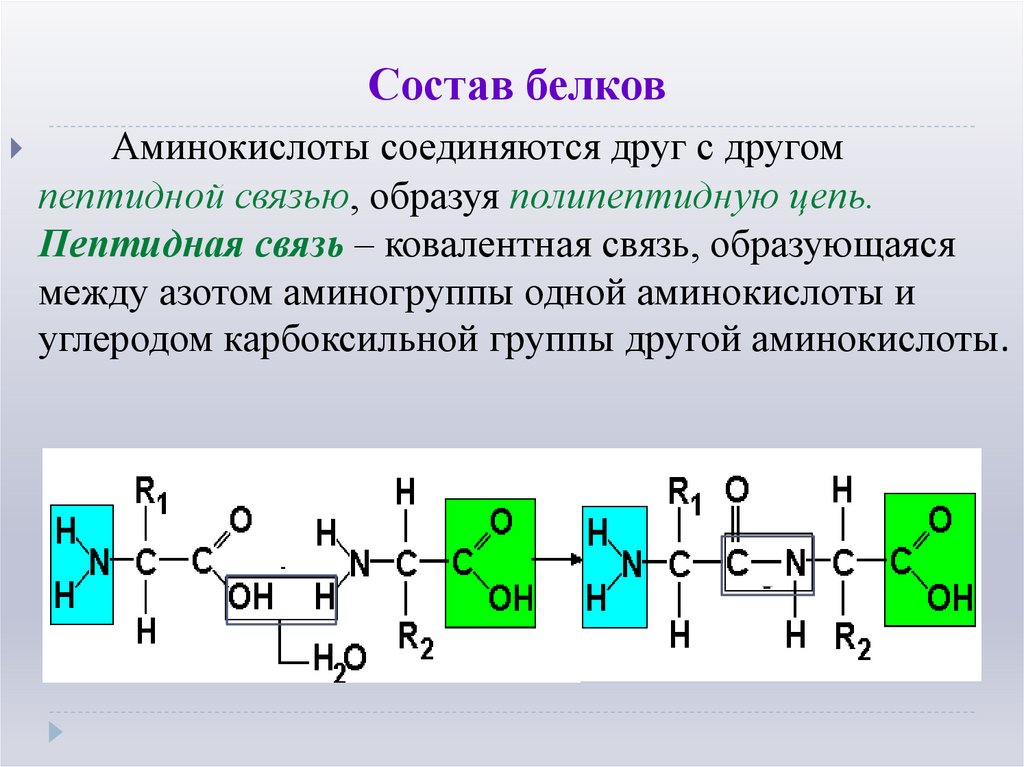
5. Состав белков
Аминокислоты соединяются друг с другомпептидной связью, образуя полипептидную цепь.
Пептидная связь – ковалентная связь, образующаяся
между азотом аминогруппы одной аминокислоты и
углеродом карбоксильной группы другой аминокислоты.
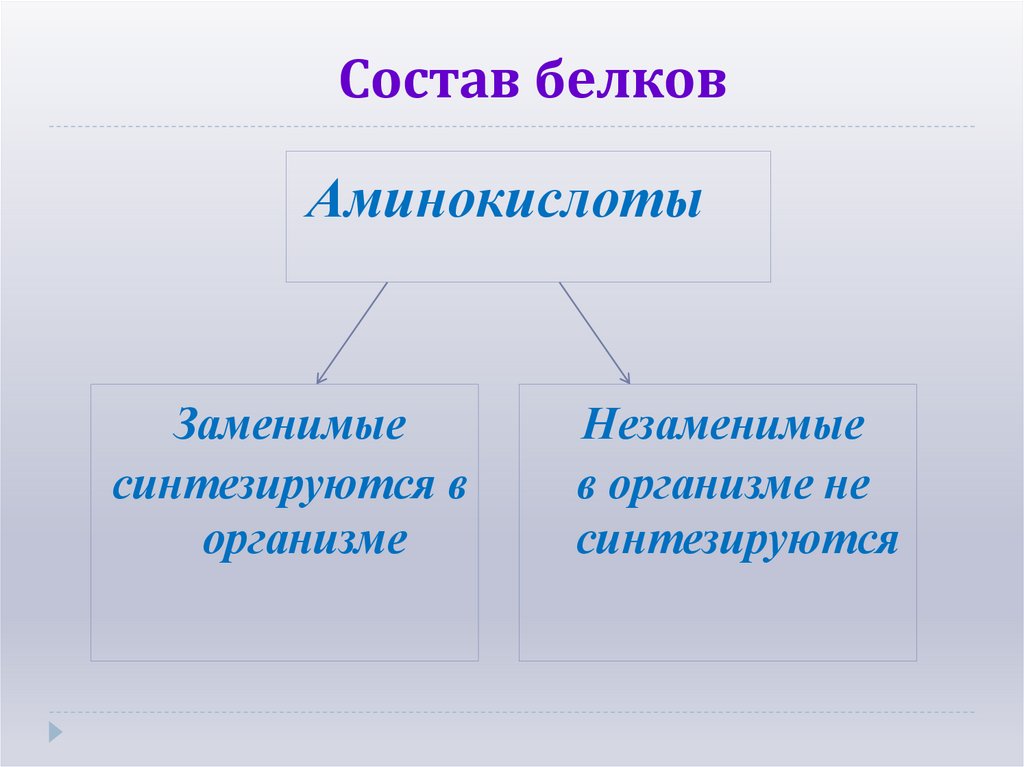
6. Состав белков
АминокислотыЗаменимые
синтезируются в
организме
Незаменимые
в организме не
синтезируются
7. Классификация белков
белкипростые
сложные
8. Классификация белков
простыесостоят из остатков аминокислот
9. Классификация белков
сложныекроме аминокислот содержат небелковую простетическую группу:
атомы металла – металлопротеины
молекулу липида – липопротеины
молекулу углевода – гликопротеины
остаток фосфорной кислоты –
фосфопротеины
молекулу нуклеиновой кислоты –
нуклеопротеины
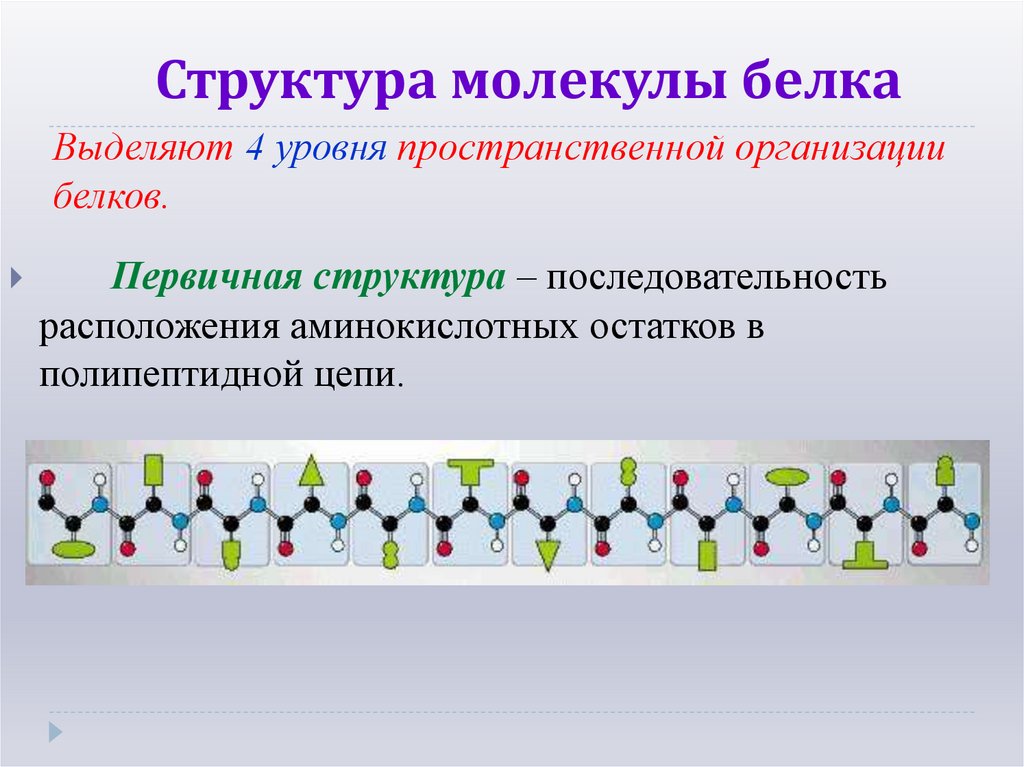
10. Структура молекулы белка
Выделяют 4 уровня пространственной организациибелков.
Первичная структура – последовательность
расположения аминокислотных остатков в
полипептидной цепи.
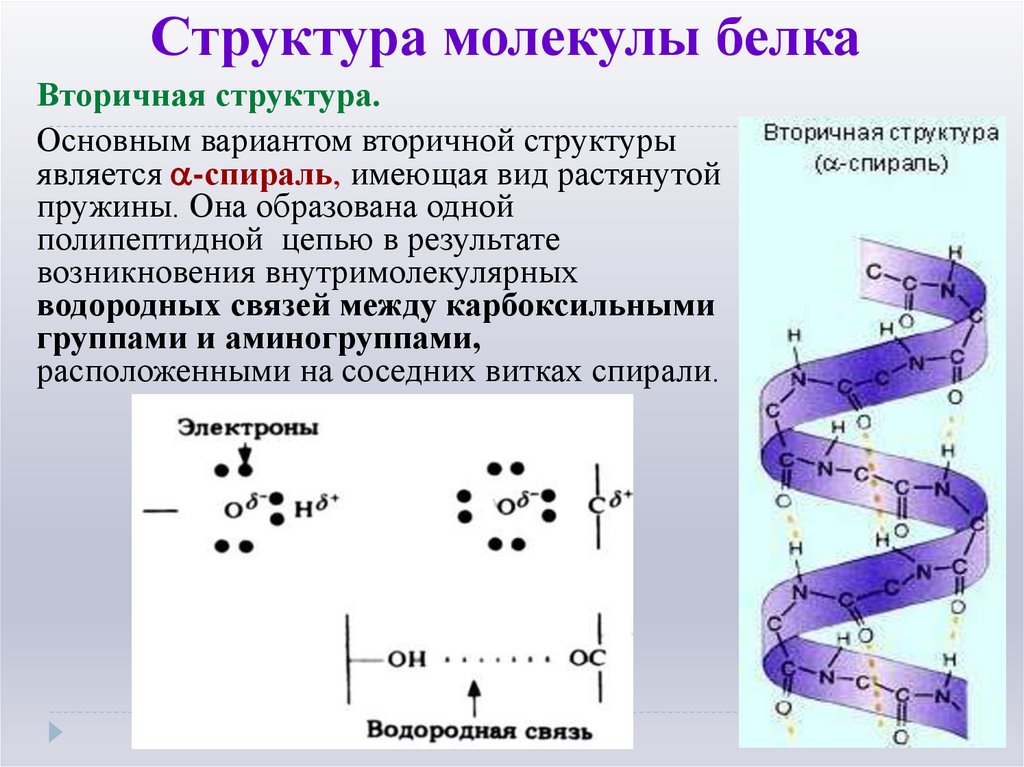
11. Структура молекулы белка
Вторичная структура.Основным вариантом вторичной структуры
является -спираль, имеющая вид растянутой
пружины. Она образована одной
полипептидной цепью в результате
возникновения внутримолекулярных
водородных связей между карбоксильными
группами и аминогруппами,
расположенными на соседних витках спирали.
12. Структура белковой молекулы
Третичная структура – глобула,возникающая в результате возникновения химических
связей: водородных, ионных, дисульфидных и
установления гидрофильно-гидрофобных
взаимодействий.
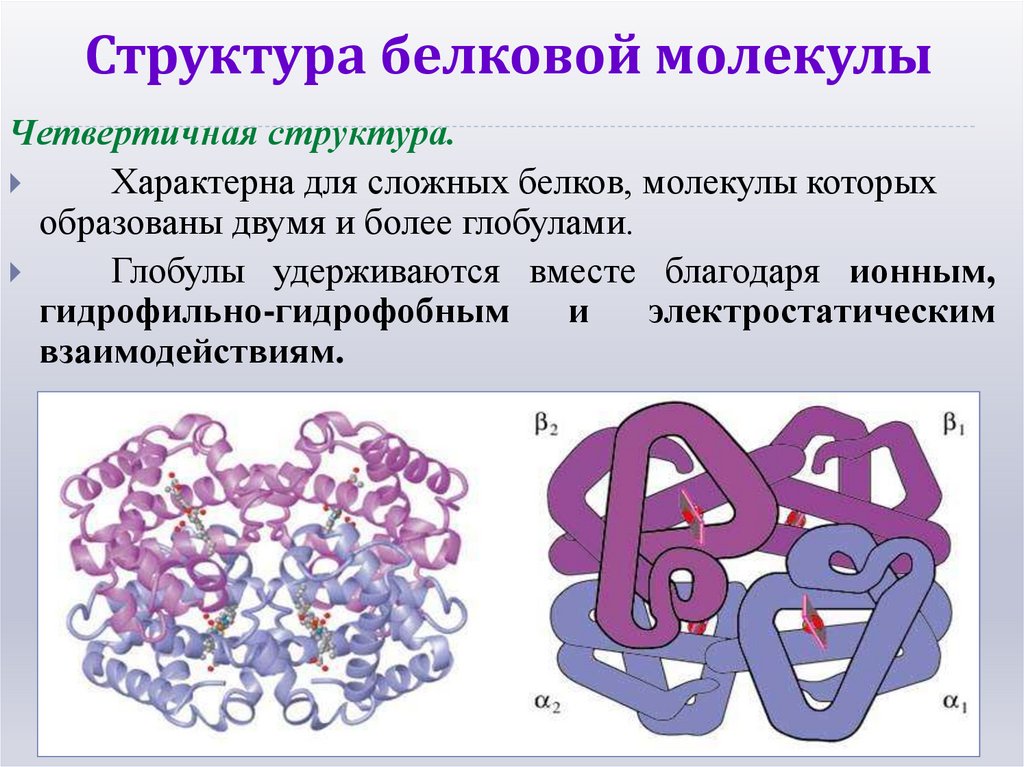
13. Структура белковой молекулы
Четвертичная структура.Характерна для сложных белков, молекулы которых
образованы двумя и более глобулами.
Глобулы удерживаются вместе благодаря ионным,
гидрофильно-гидрофобным
и
электростатическим
взаимодействиям.
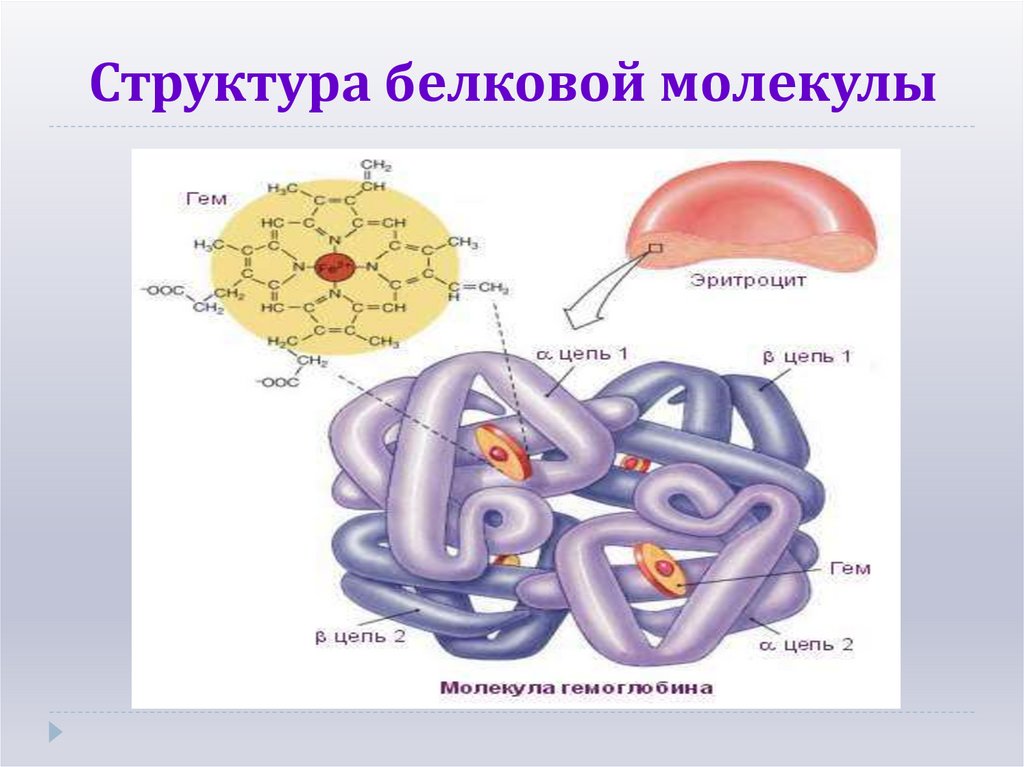
14. Структура белковой молекулы
Наиболее изученным белком, имеющимчетвертичную структуру, является
гемоглобин.
Он образован двумя -субъединицами
(141 аминокислотный остаток) и двумя субъединицами (146 аминокислотных
остатков).С каждой субъединицей связана
молекула гема, содержащая железо.
15. Структура белковой молекулы
16. Свойства белков
Гидролиз белков – разрушение первичнойструктуры белка.
Денатурация – полное разрушение
пространственной структуры белка.
Обратимая денатурация – частичное разрушение
пространственной структуры белка.
Обратный процесс называется ренатурация.
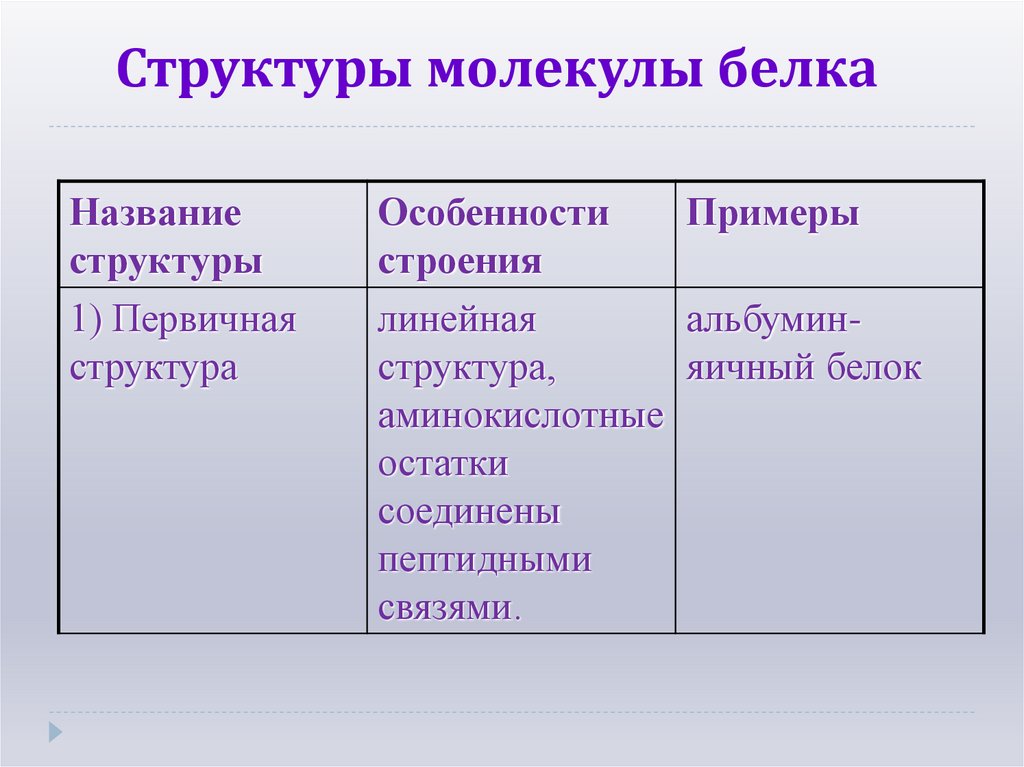
17. Структуры молекулы белка
Названиеструктуры
1) Первичная
структура
Особенности
Примеры
строения
линейная
альбуминструктура,
яичный белок
аминокислотные
остатки
соединены
пептидными
связями.
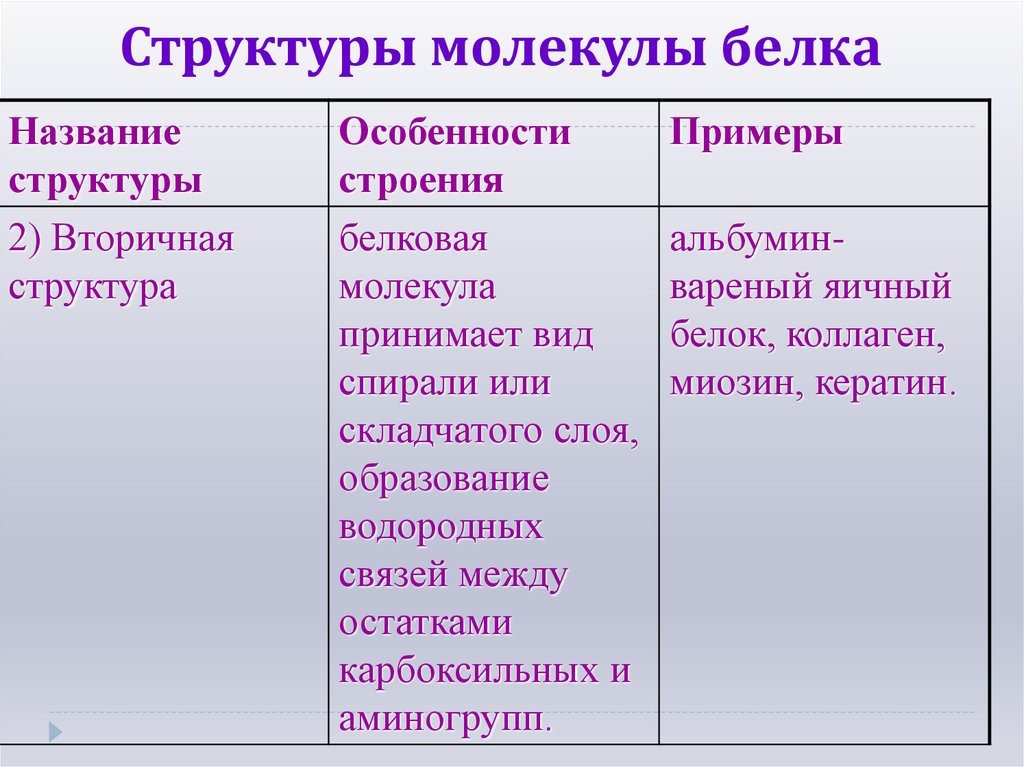
18. Структуры молекулы белка
Названиеструктуры
2) Вторичная
структура
Особенности
строения
белковая
молекула
принимает вид
спирали или
складчатого слоя,
образование
водородных
связей между
остатками
карбоксильных и
аминогрупп.
Примеры
альбуминвареный яичный
белок, коллаген,
миозин, кератин.
19. Структуры молекулы белка
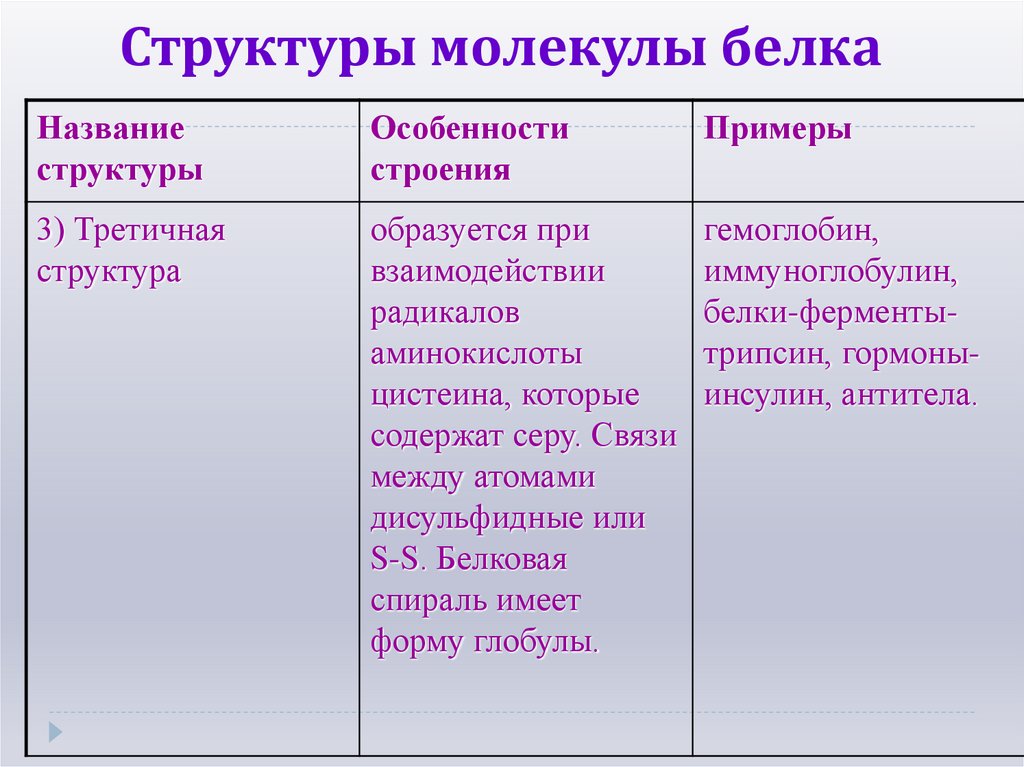
Названиеструктуры
Особенности
строения
Примеры
3) Третичная
структура
образуется при
взаимодействии
радикалов
аминокислоты
цистеина, которые
содержат серу. Связи
между атомами
дисульфидные или
S-S. Белковая
спираль имеет
форму глобулы.
гемоглобин,
иммуноглобулин,
белки-ферментытрипсин, гормоныинсулин, антитела.
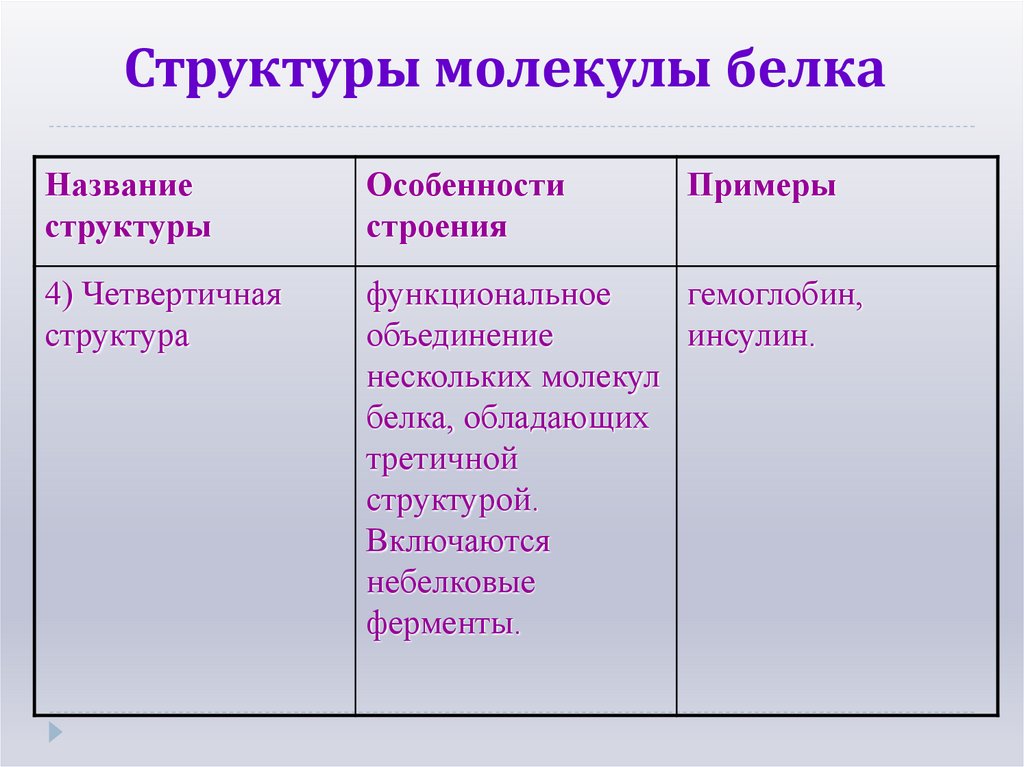
20. Структуры молекулы белка
Названиеструктуры
Особенности
строения
Примеры
4) Четвертичная
структура
функциональное
гемоглобин,
объединение
инсулин.
нескольких молекул
белка, обладающих
третичной
структурой.
Включаются
небелковые
ферменты.








 Биология
Биология








