Похожие презентации:
Химические реакции. § 9
1.
§ 9. ХИМИЧЕСКИЕРЕАКЦИИ
2.
Цель урока. Формирование понятий «химическаяреакция», «реакции горения», «экзо- и эндотермические
реакции», Формирование умений наблюдать и описывать
признаки и условия течения химических реакций.
Проблемный вопрос урока.
В чем заключается сущность химической реакции?
3.
При химических явлениях, или химических реакцияхпроисходит превращение одних веществ в другие.
Химическая реакция – это процесс превращения
одних веществ в другие, отличающихся от исходных
по составу и свойствам.
4.
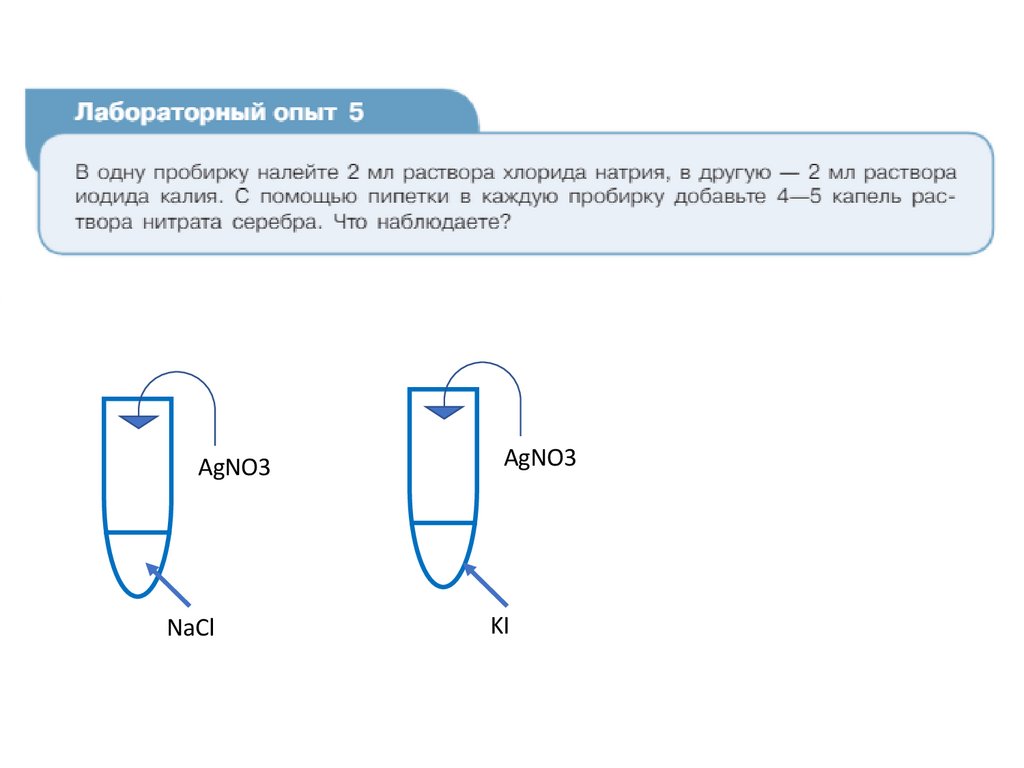
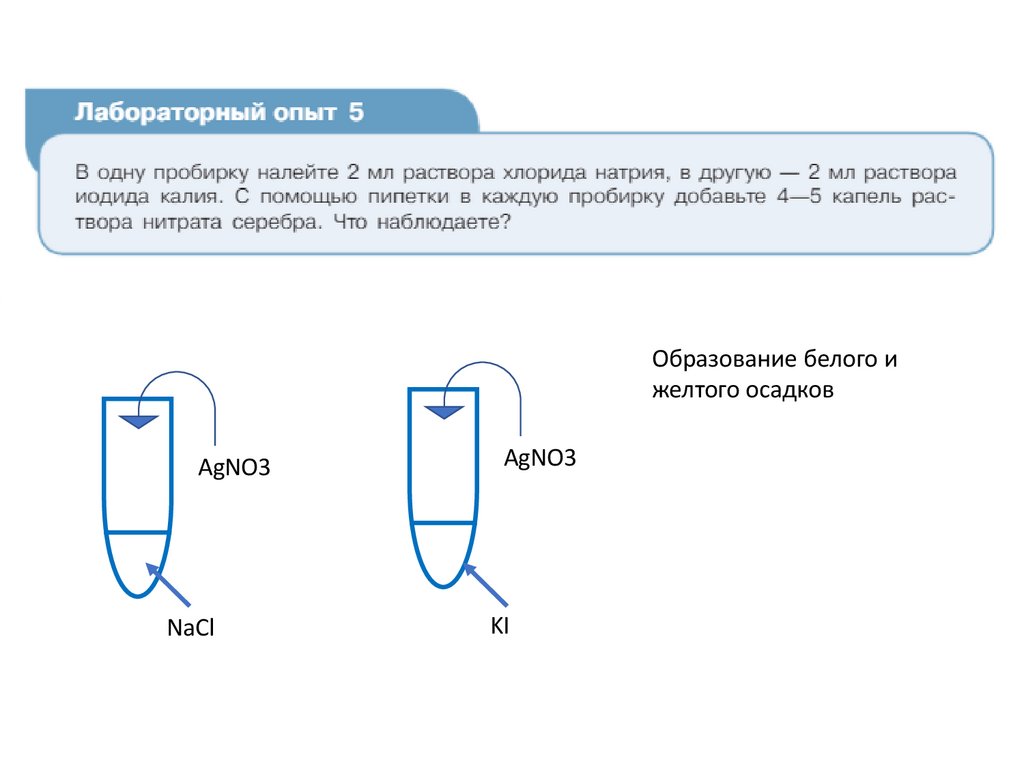
Лабораторный опыт №5«Взаимодействие иодида и хлорида
натрия с ионами серебра»
5.
AgNO3NaCl
AgNO3
KI
6.
Образование белого ижелтого осадков
AgNO3
NaCl
AgNO3
KI
7.
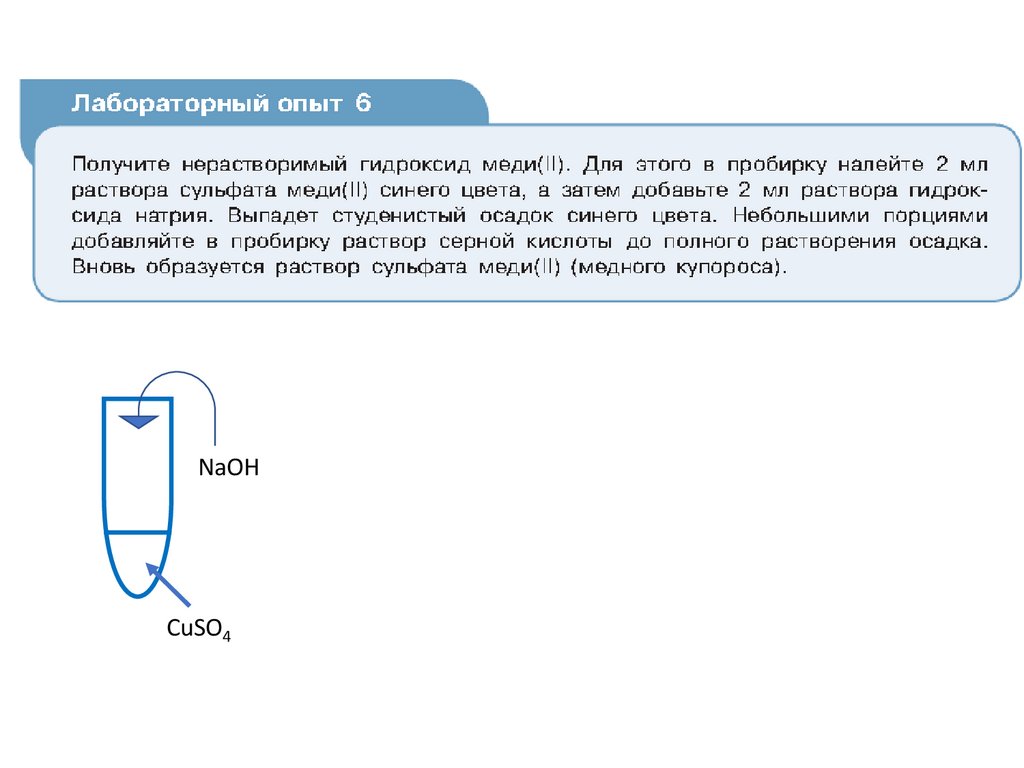
Лабораторный опыт №6«Получение гидроксида меди (II) и
растворение его в кислоте»
8.
NaOHCuSO4
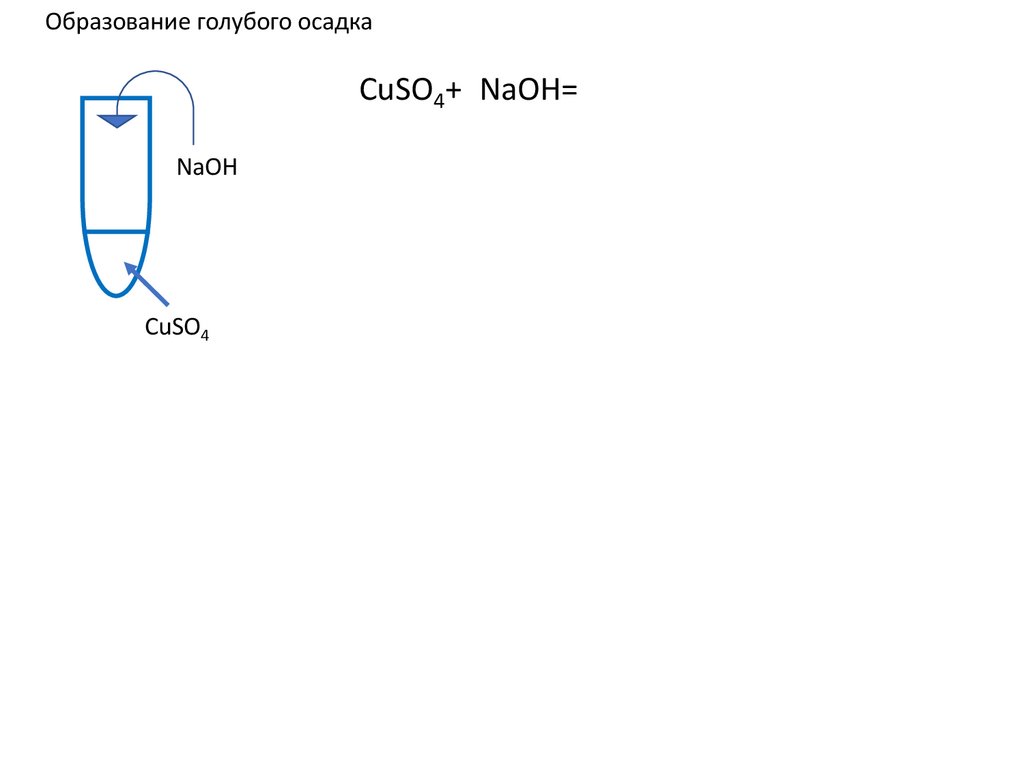
9.
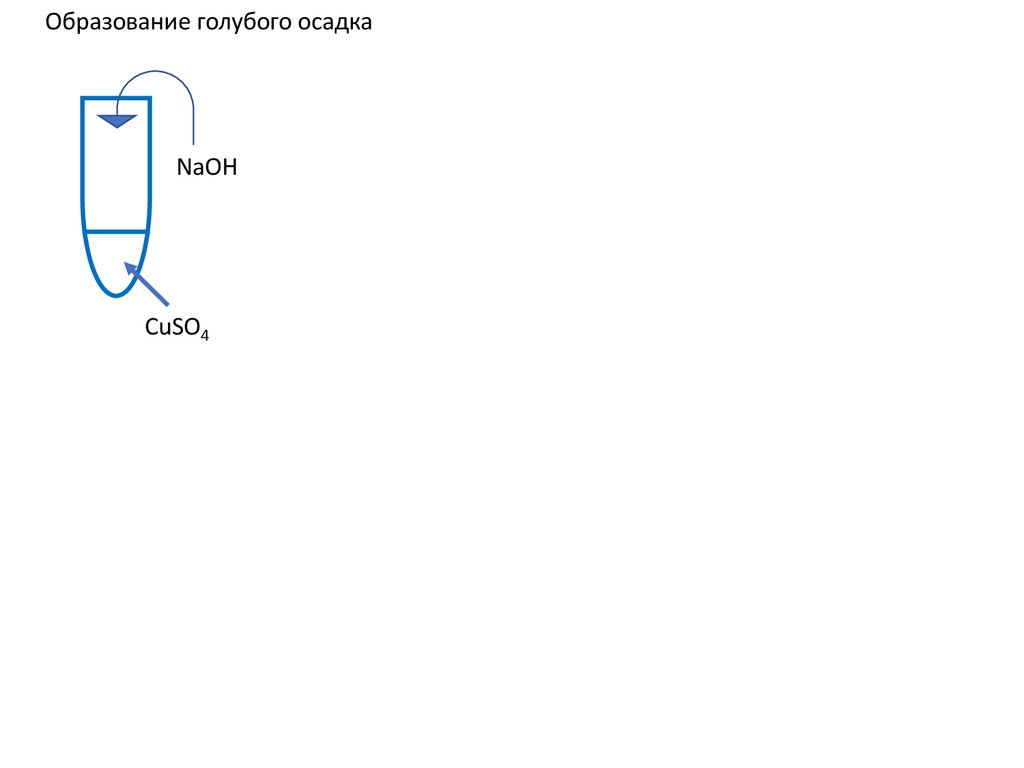
Образование голубого осадкаNaOH
CuSO4
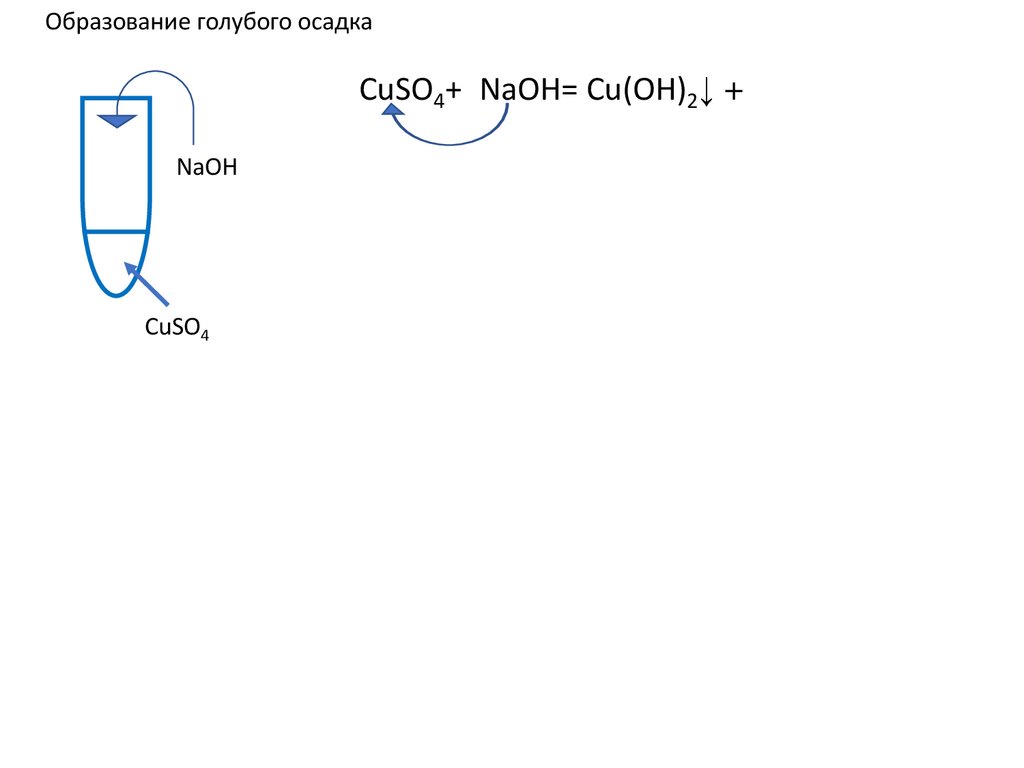
10.
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2+
NaOH
CuSO4
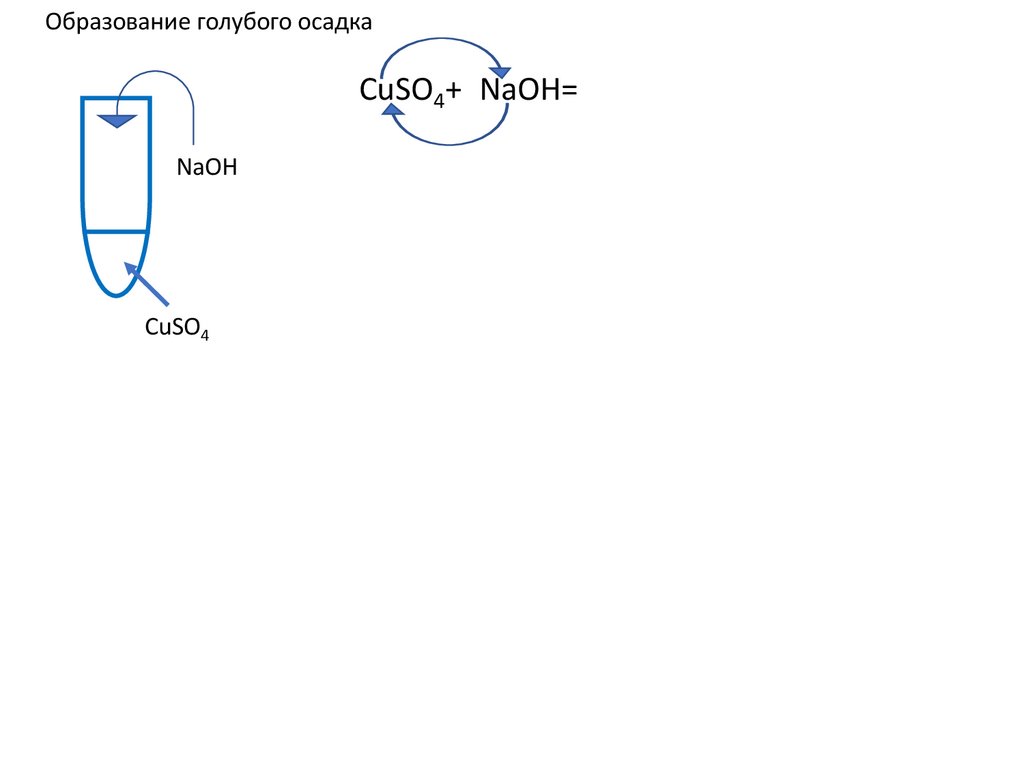
11.
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2+
NaOH
CuSO4
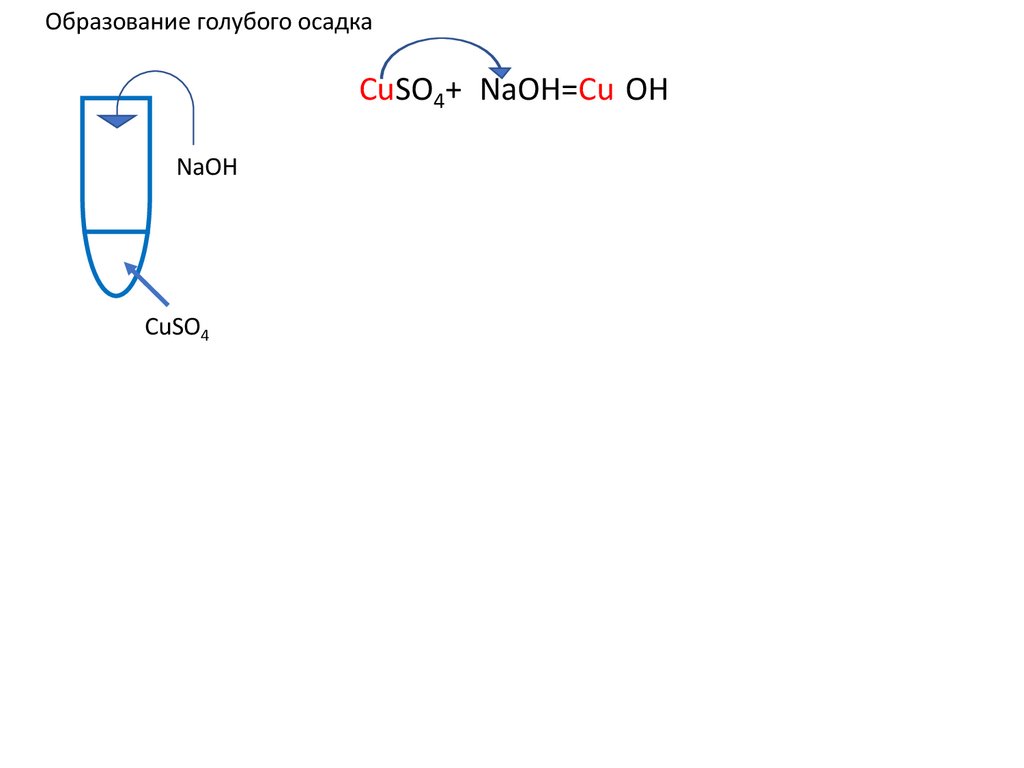
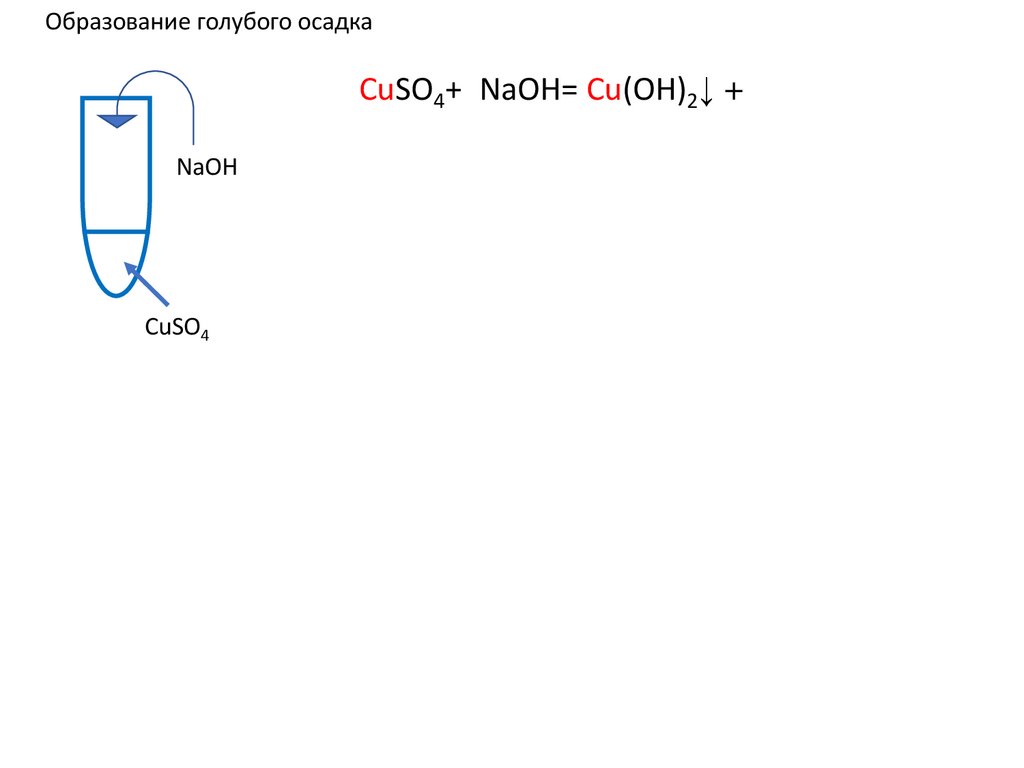
12.
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
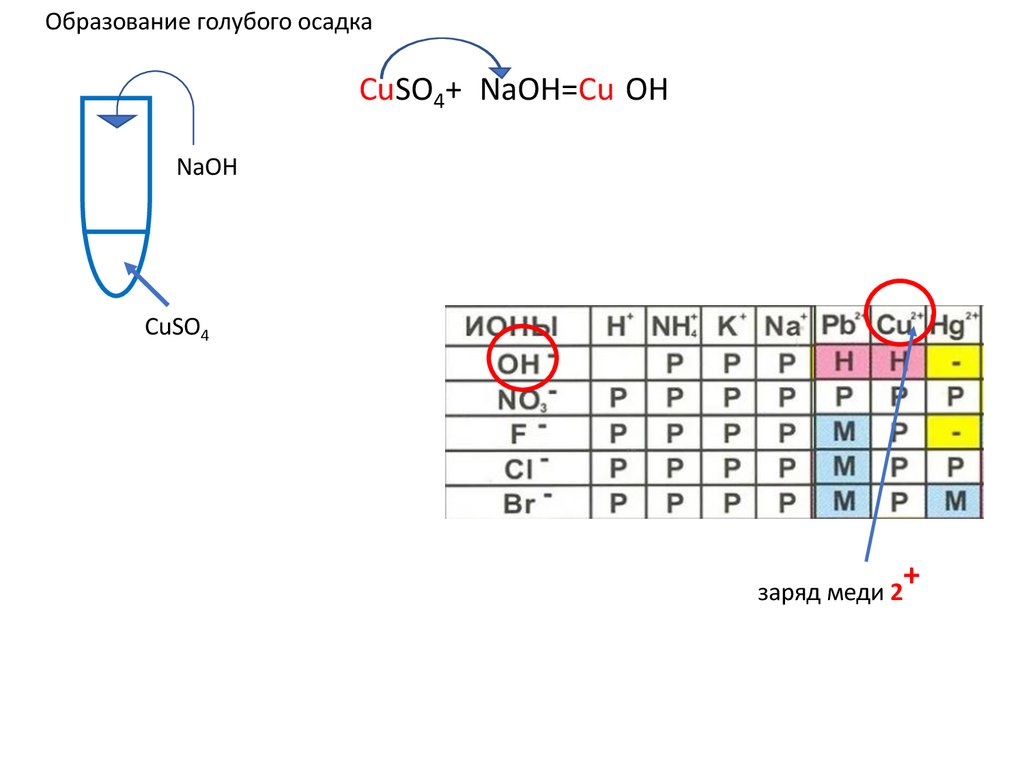
13.
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
+
заряд меди 2
14.
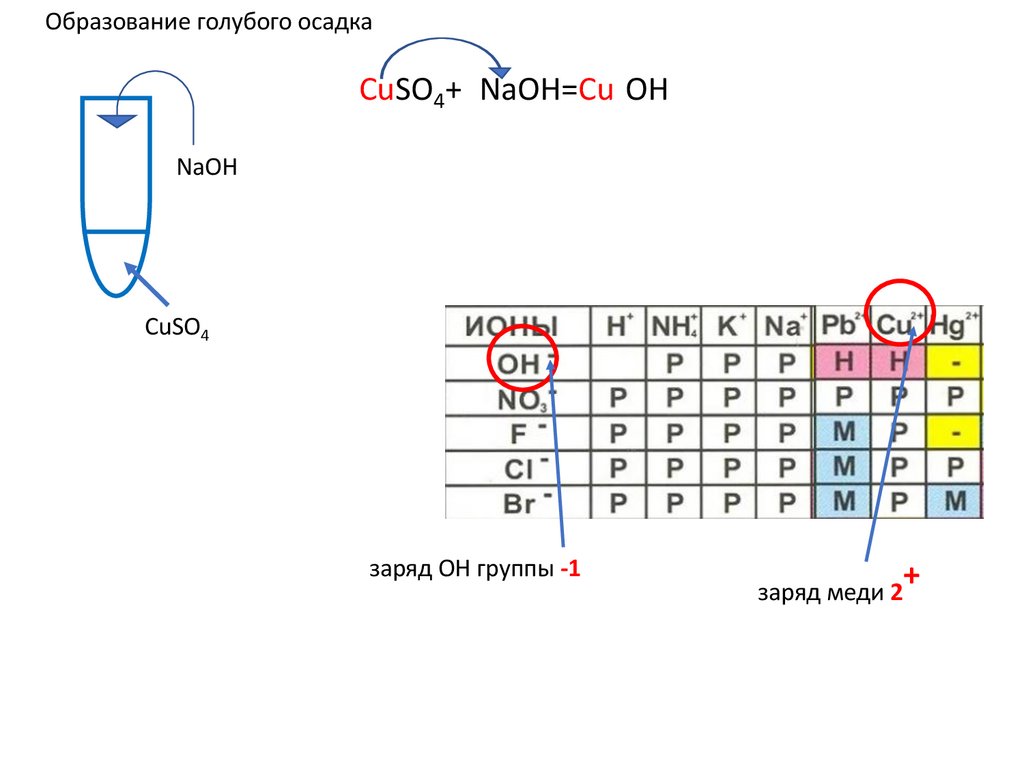
Образование голубого осадкаCuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
заряд OH группы -1
+
заряд меди 2
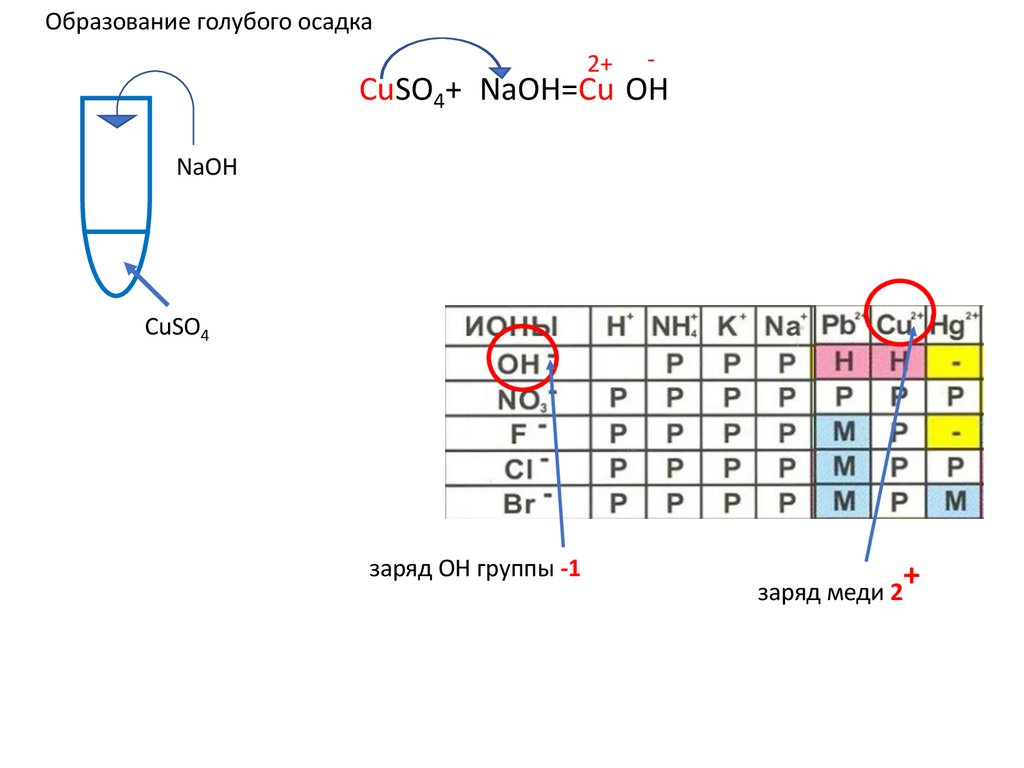
15.
Образование голубого осадка2+
-
CuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
заряд OH группы -1
+
заряд меди 2
16.
Образование голубого осадка2+
-
CuSO4+2NaOH=Cu(OH)2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
17.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
18.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2↓ u(OH)2+ u(OH)2+
NaOH
CuSO4
19.
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
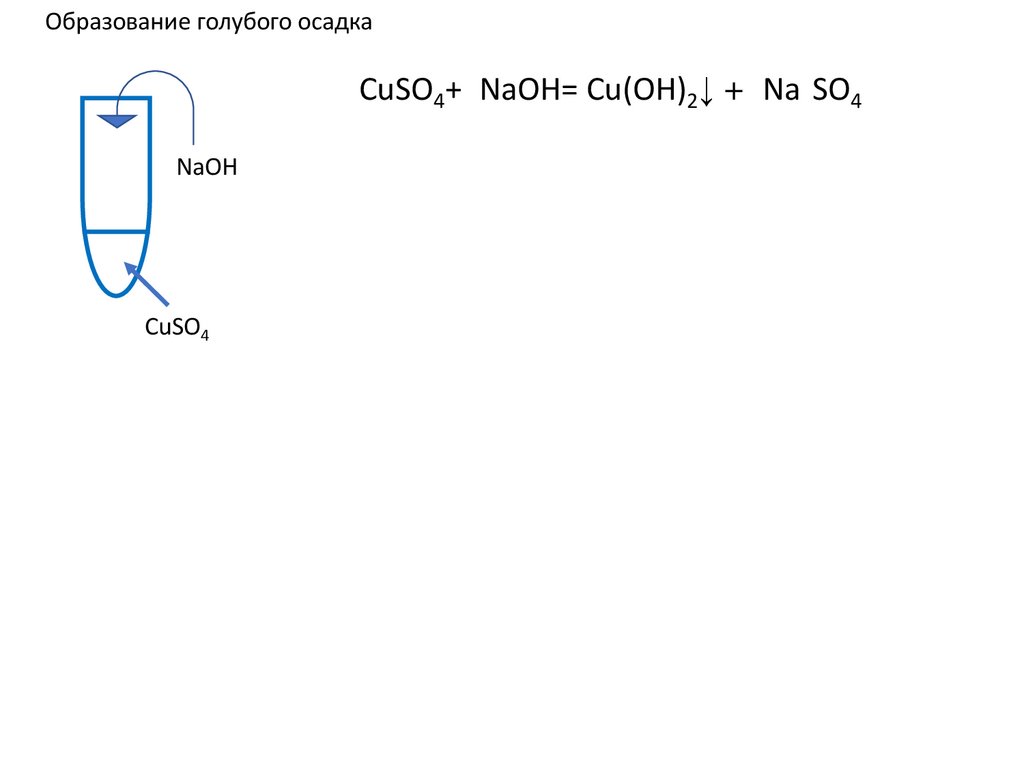
20.
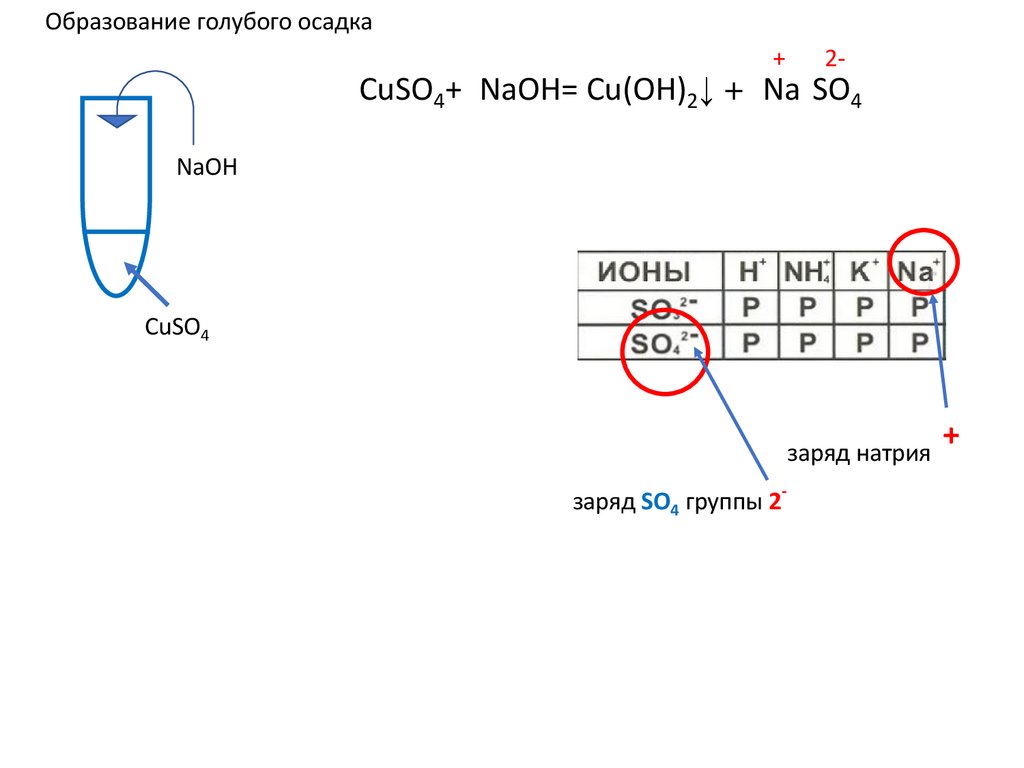
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
заряд натрия
заряд SO4 группы 2-
+
21.
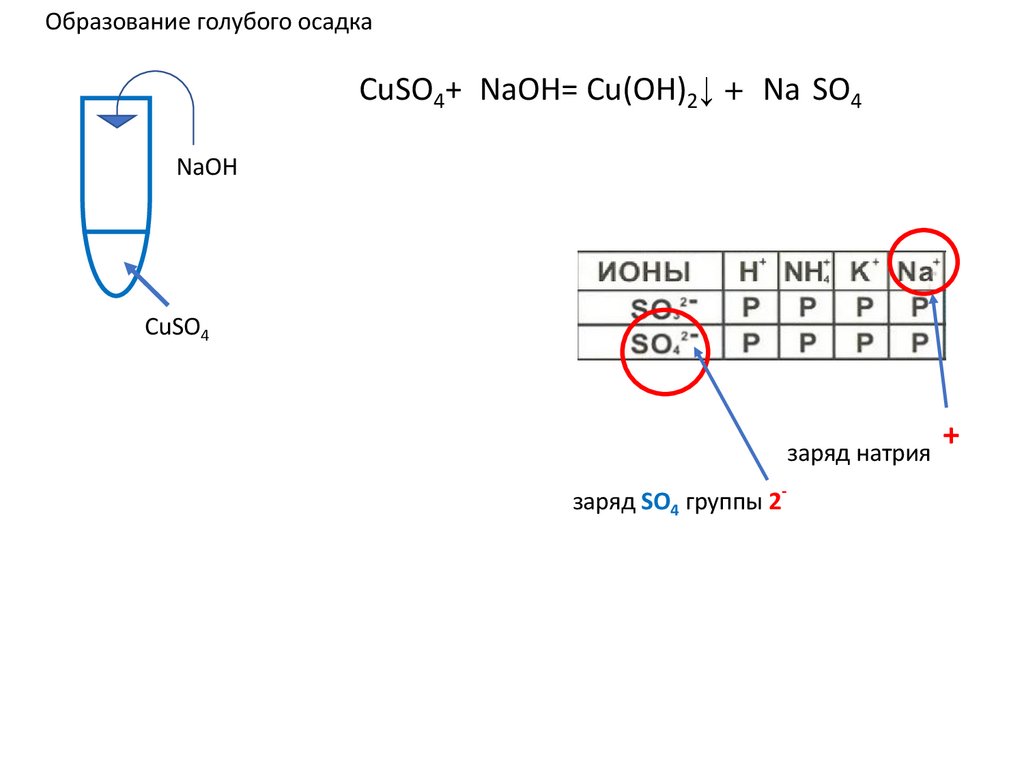
Образование голубого осадка+
CuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
заряд натрия
заряд SO4 группы 2-
+
22.
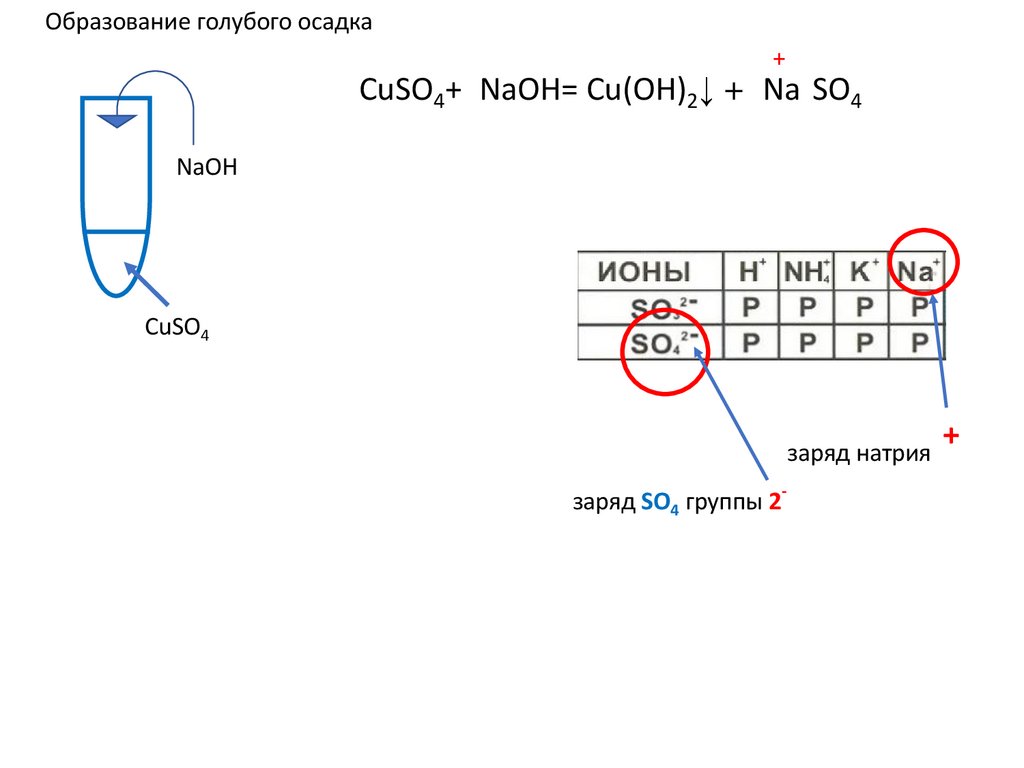
Образование голубого осадка+
2-
CuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
заряд натрия
заряд SO4 группы 2-
+
23.
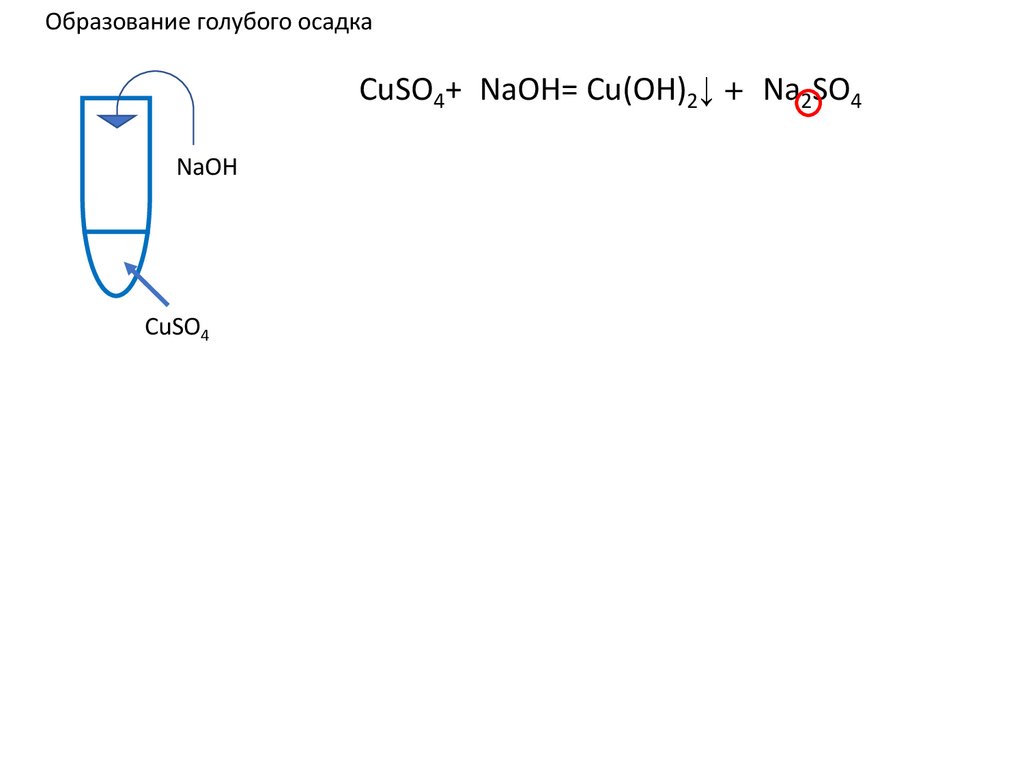
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
24.
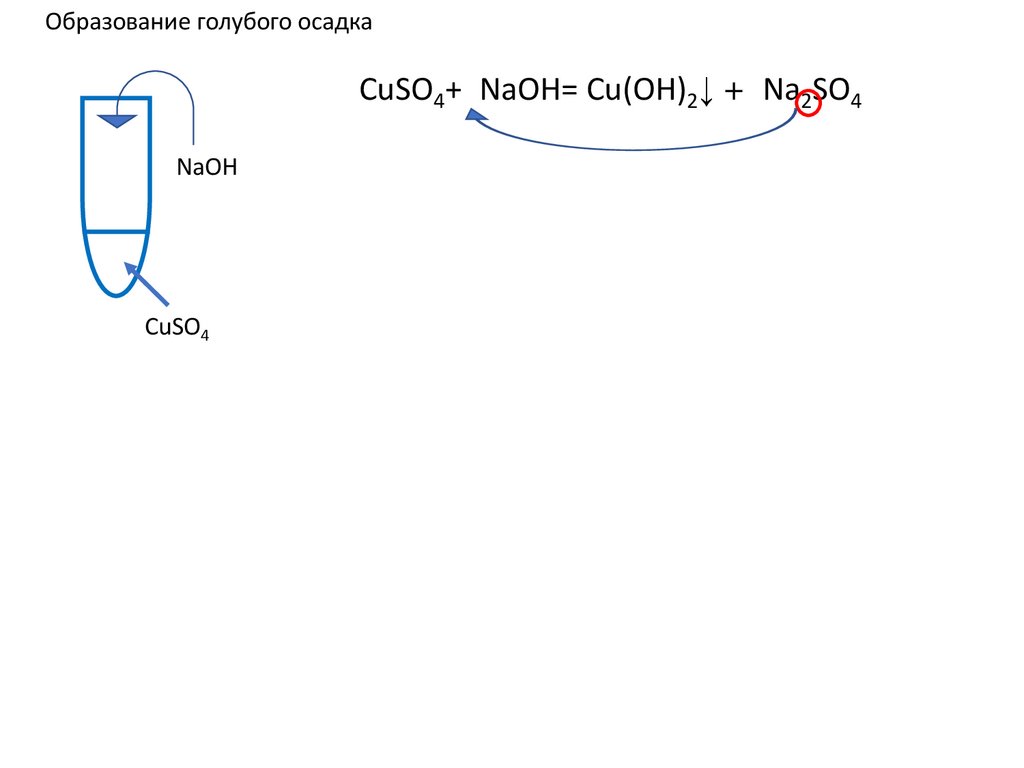
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
25.
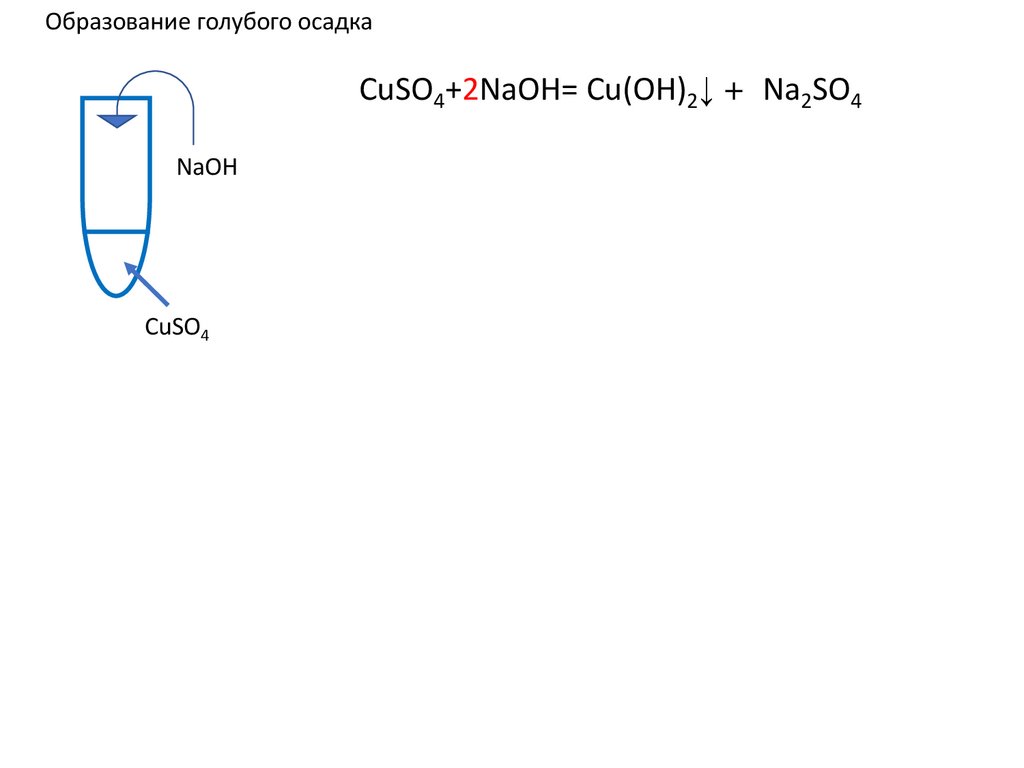
Образование голубого осадкаCuSO4+2NaOH= Cu(OH)2↓ +2 Na2SO4 ↓ u(OH)2+
u(OH)2+
NaOH
CuSO4
26.
РАСТВОРЕНИЕ ОСАДКАВ КИСЛОТЕ
27.
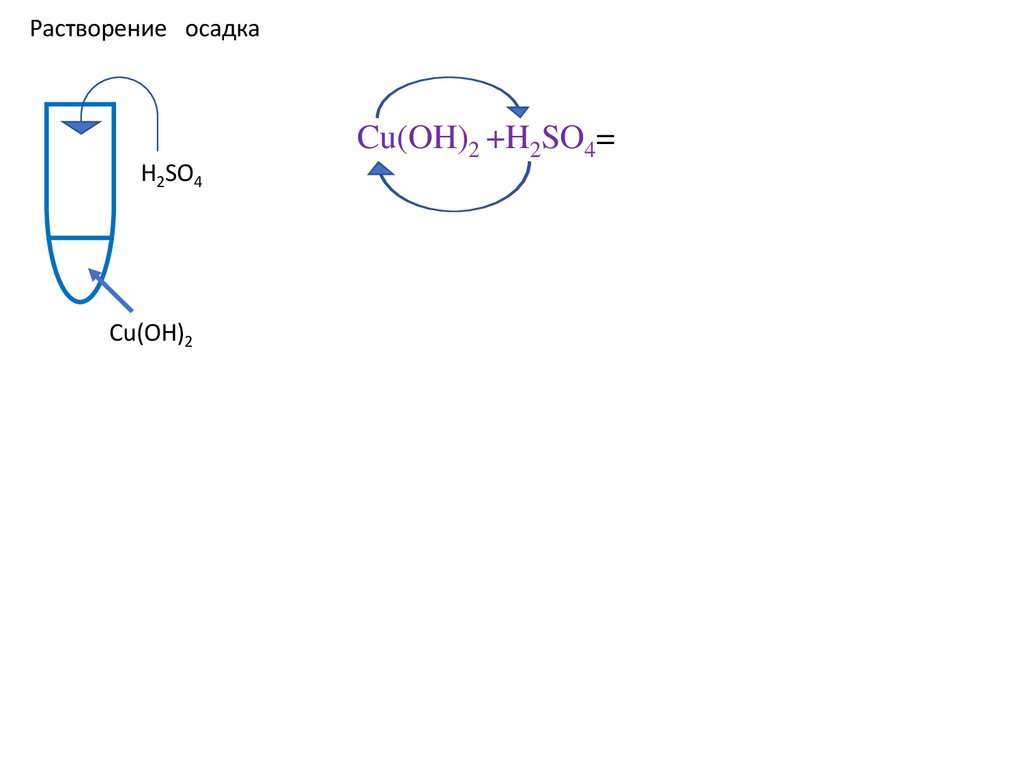
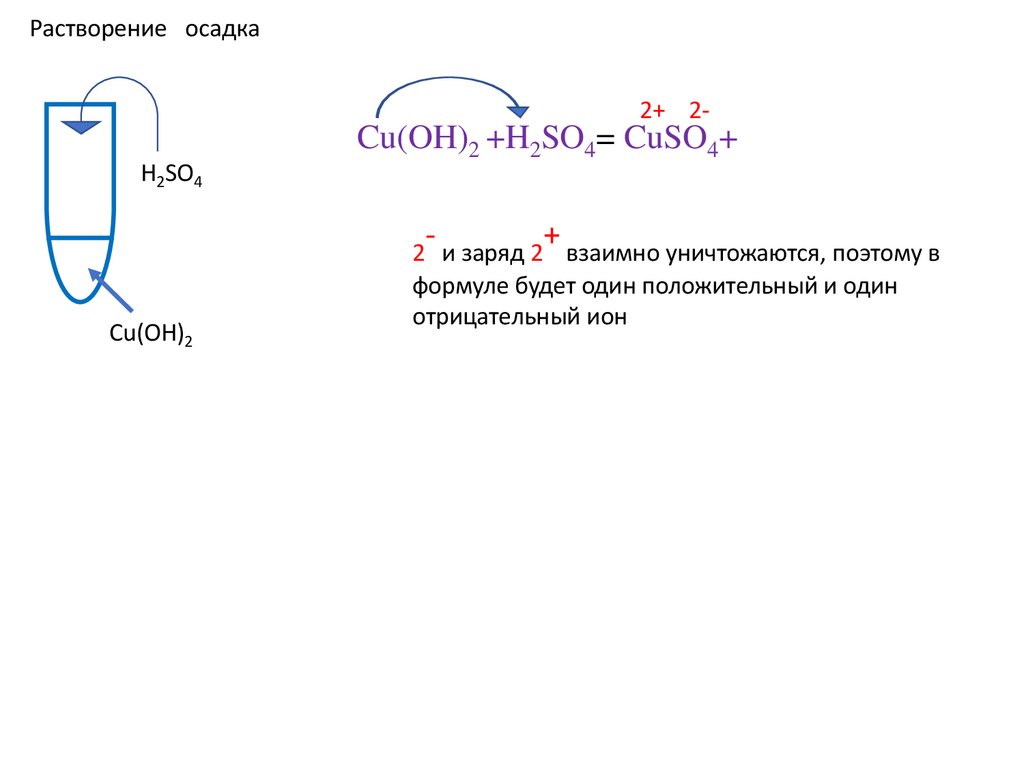
Растворение осадкаH2SO4
Cu(OH)2
Cu(OH)2 +H2SO4=
28.
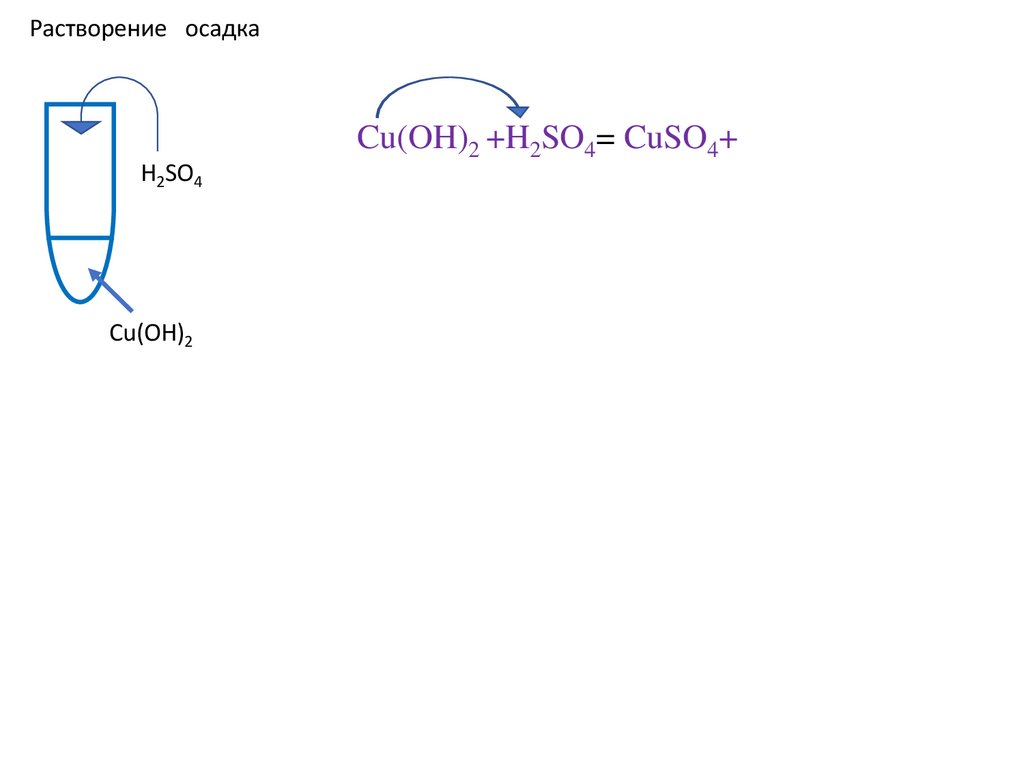
Растворение осадкаH2SO4
Cu(OH)2
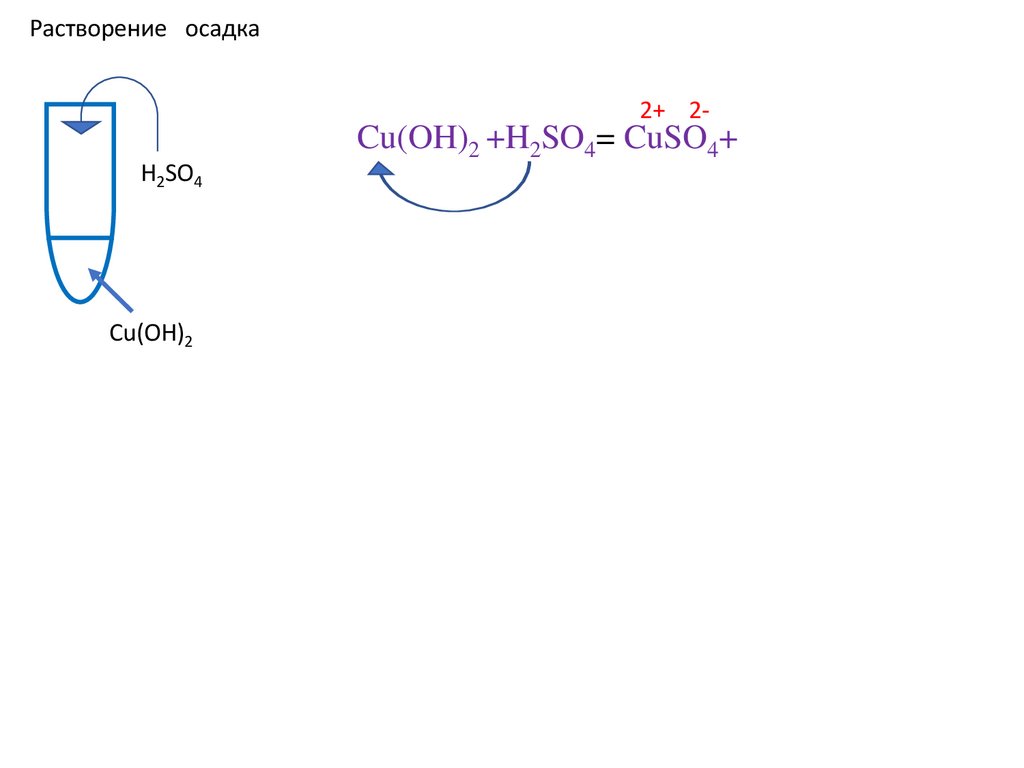
Cu(OH)2 +H2SO4= CuSO4+
29.
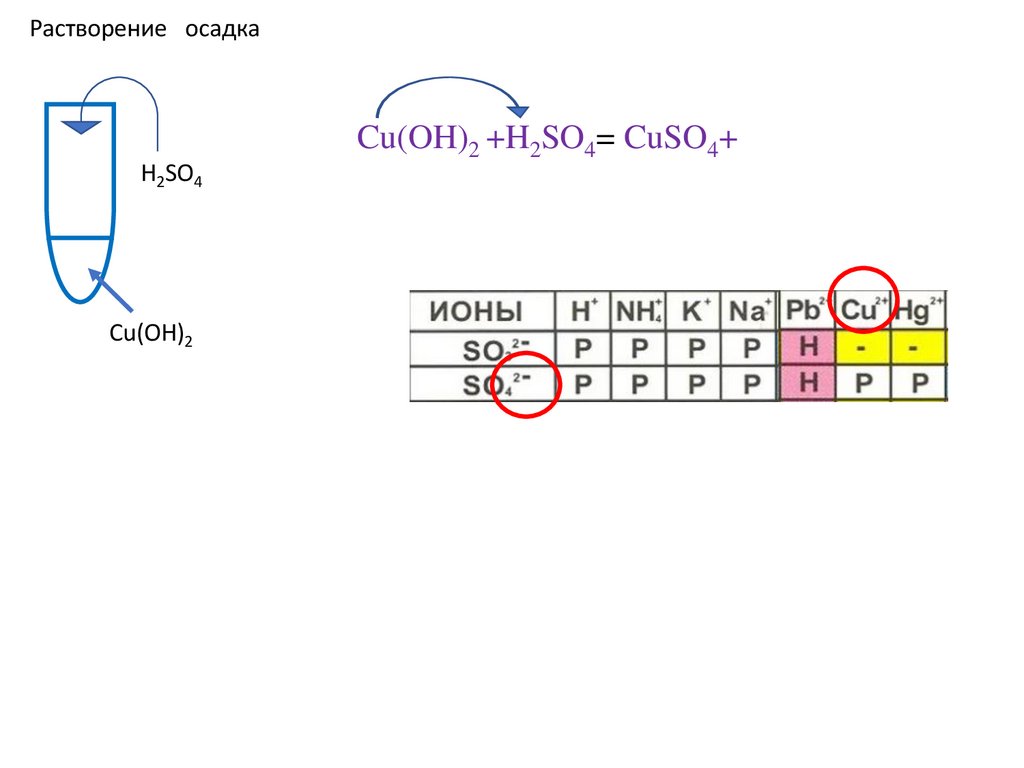
Растворение осадкаH2SO4
Cu(OH)2
Cu(OH)2 +H2SO4= CuSO4+
30.
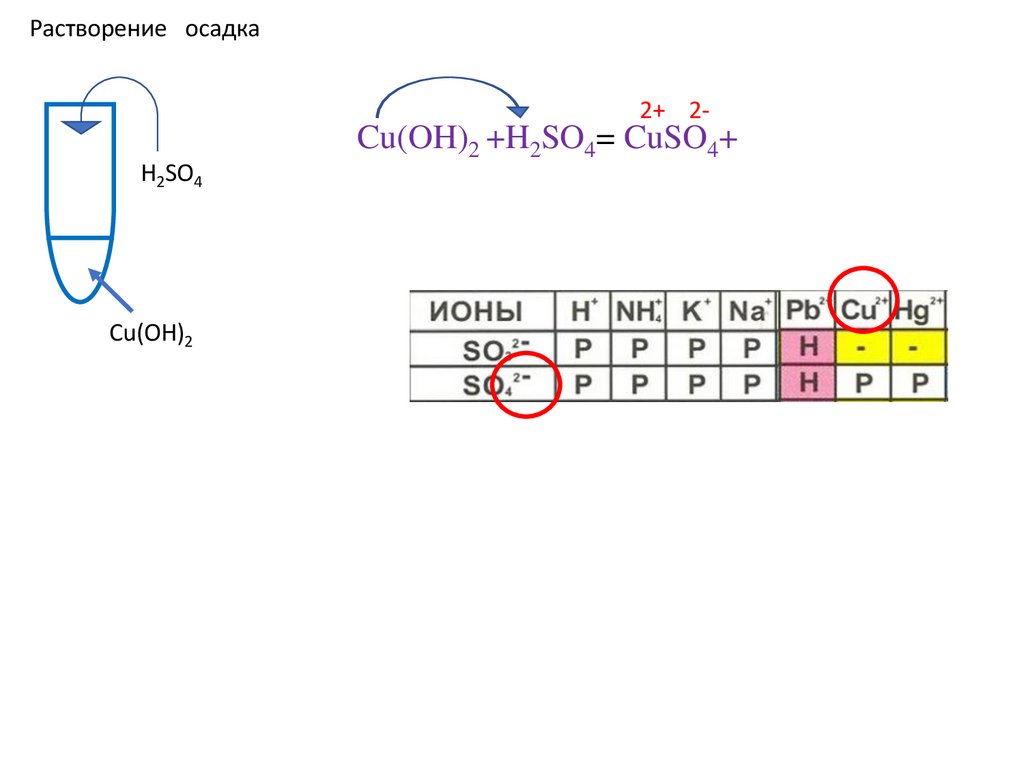
Растворение осадка2+ 2H2SO4
Cu(OH)2
Cu(OH)2 +H2SO4= CuSO4+
31.
Растворение осадка2+ 2H2SO4
Cu(OH)2 +H2SO4= CuSO4+
-
Cu(OH)2
+
2 и заряд 2 взаимно уничтожаются, поэтому в
формуле будет один положительный и один
отрицательный ион
32.
Растворение осадка2+ 2H2SO4
Cu(OH)2
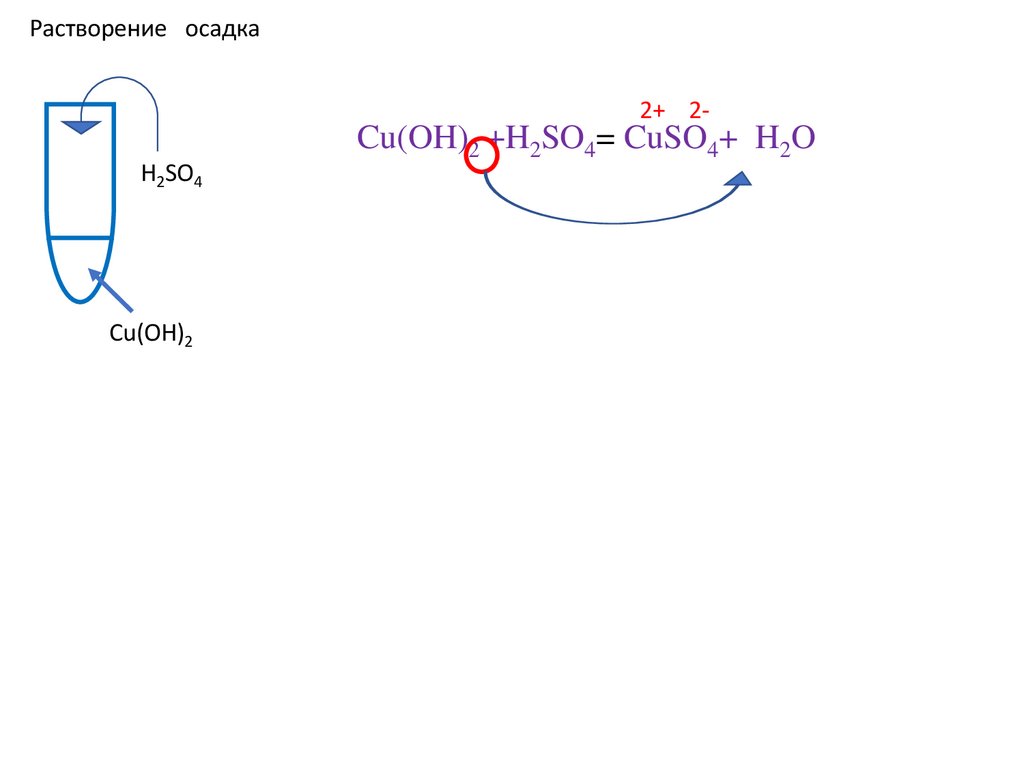
Cu(OH)2 +H2SO4= CuSO4+
33.
Растворение осадка2+ 2H2SO4
Cu(OH)2
Cu(OH)2 +H2SO4= CuSO4+ H2O
34.
Растворение осадка2+ 2H2SO4
Cu(OH)2
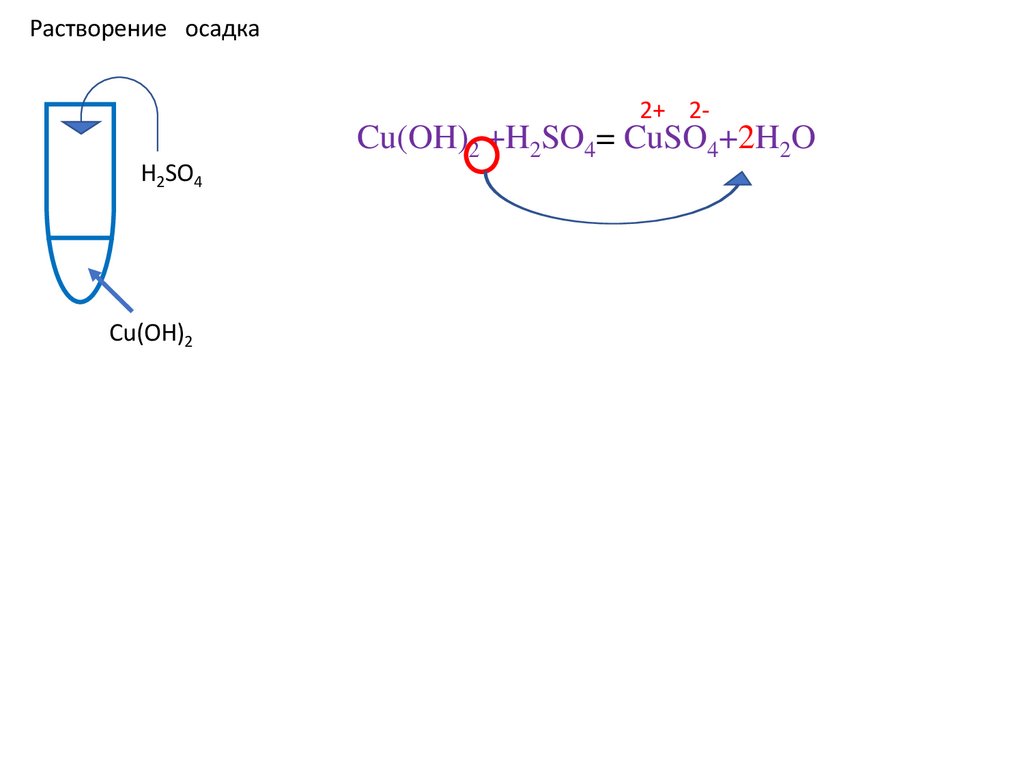
Cu(OH)2 +H2SO4= CuSO4+ H2O
35.
Растворение осадка2+ 2H2SO4
Cu(OH)2
Cu(OH)2 +H2SO4= CuSO4+2H2O
36.
Типы химических реакций37.
Получение углекислого газа и его свойства38.
39.
Взаимодействие хлорида железа(III) ироданида калия
40.
Взаимодействие железа и серы41.
О протекании реакции можносудить по изменению цвета,
появлению газа с резким
запахом, выделению теплоты
и света
42.
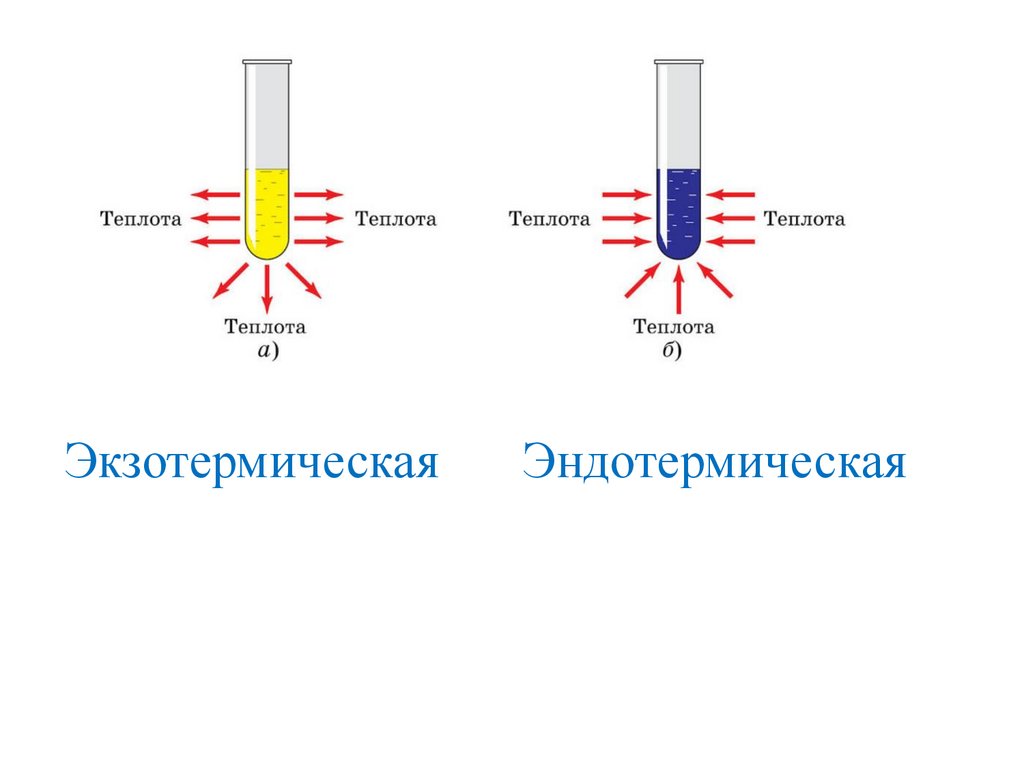
Реакцию мгновенного горения порошка магния использовали прифотографировании в качестве «вспышки», пока не появилась электрическая
лампа. Реакции горения — это частный случай большой группы химических
реакций, протекающих с выделением теплоты
43.
ЭкзотермическаяЭндотермическая
44.
Горение фосфора в кислороде45.
Взаимодействие оксида меди с кислотой46.
По каким признакам можно сделатьвывод о протекании химических
реакций?
47.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
48.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
• выпадение осадка или его растворение;
49.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
• выпадение осадка или его растворение;
• выделение газа;
50.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
• выпадение осадка или его растворение;
• выделение газа;
• изменение цвета;
51.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
• выпадение осадка или его растворение;
• выделение газа;
• изменение цвета;
• выделение или поглощение теплоты,
выделение света.
52.
Записи в тетрадиПризнаки протекания химической реакции:
• появление запаха;
• выпадение осадка или его растворение;
• выделение газа;
• изменение цвета;
• выделение или поглощение теплоты,
выделение света.
Реакции, протекающие с выделением теплоты и
света, называются реакциями горения.
53.
Условия протекания химических реакций:54.
Условия протекания химических реакций:• соприкосновение реагирующих
веществ;
55.
Условия протекания химических реакций:• соприкосновение реагирующих
веществ;
• нагревание (иногда);
56.
Условия протекания химических реакций:• соприкосновение реагирующих
веществ;
• нагревание (иногда);
• действие электрического тока, света
(иногда)
57.
IV. Подведение итоговВ чем заключается сущность химической реакции?
58.
IV. Подведение итоговВ чем заключается сущность химической реакции?
Сущность химических реакций заключается в
разрушении химических связей между атомами одних
веществ и в перегруппировке атомов с образованием
новых веществ.
59.
IV. Подведение итоговДомашнее задание: § 9, выполнить
задания № 1-4 после § 9





























 Химия
Химия








