Похожие презентации:
Степень окисления. Бинарные соединения
1.
2.
Сложное вещество — этовещество, состоящее из атомов
разных химических элементов.
Cl
O2
3.
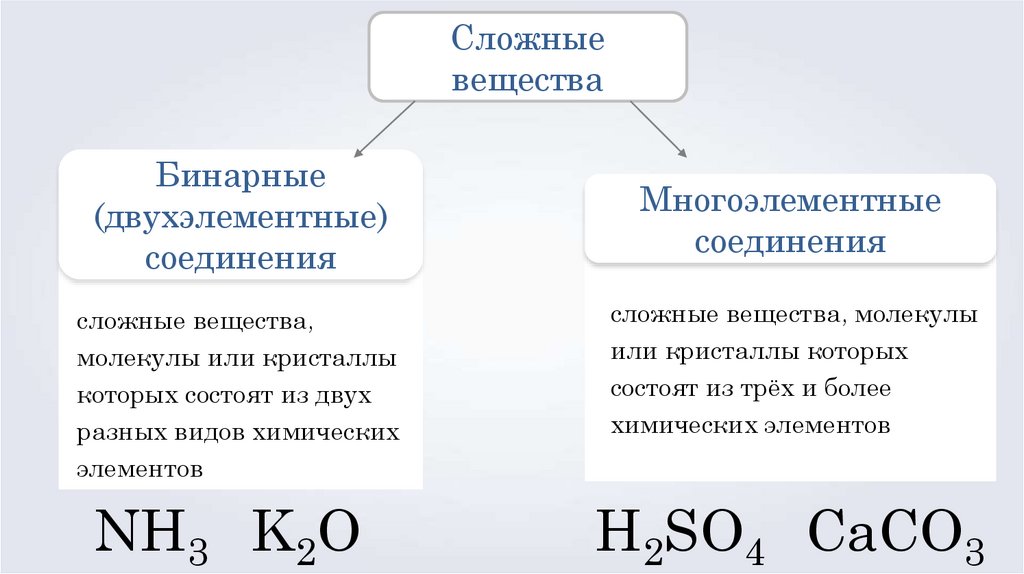
Сложныевещества
Бинарные
(двухэлементные)
соединения
Многоэлементные
соединения
сложные вещества,
молекулы или кристаллы
которых состоят из двух
разных видов химических
элементов
сложные вещества, молекулы
или кристаллы которых
состоят из трёх и более
химических элементов
NH3 K2O
H2SO4 CaCO3
4.
Бинарные веществаNaCl
H2O
CO2
5.
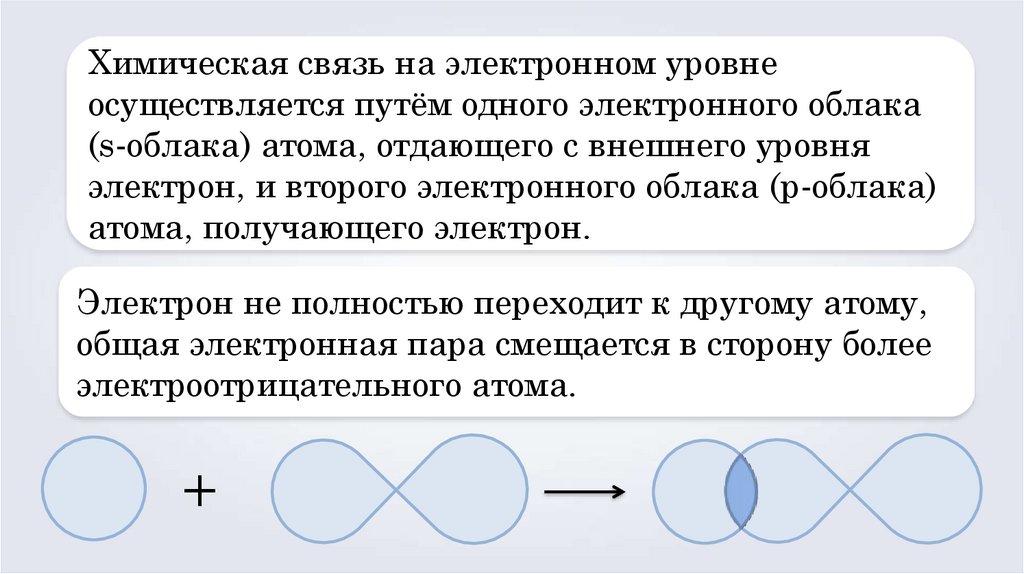
Химическая связь на электронном уровнеосуществляется путём одного электронного облака
(s-облака) атома, отдающего с внешнего уровня
электрон, и второго электронного облака (p-облака)
атома, получающего электрон.
Электрон не полностью переходит к другому атому,
общая электронная пара смещается в сторону более
электроотрицательного атома.
+
6.
Водород приобретает положительный заряд,хлор приобретает отрицательный заряд.
H + Cl
HCl
Химическая связь образуется за счёт спаривания
неспаренных внешних электронов и образования
внешней электронной пары атомов водорода и хлора.
Такие условные заряды называются степенью
окисления.
7.
+1-2
Na2S
0
Cl2
Степень окисления — это условный
заряд атомов химического элемента в
соединении, вычисленный на основе
предположения, что все соединения (и
ионные, и ковалентно-полярные)
состоят только из ионов.
8.
Определение степеней окисления1. У металлов IА группы
таблицы Менделеева во
всех соединениях степень
окисления равна +1.
+1
–2
Na2O
9.
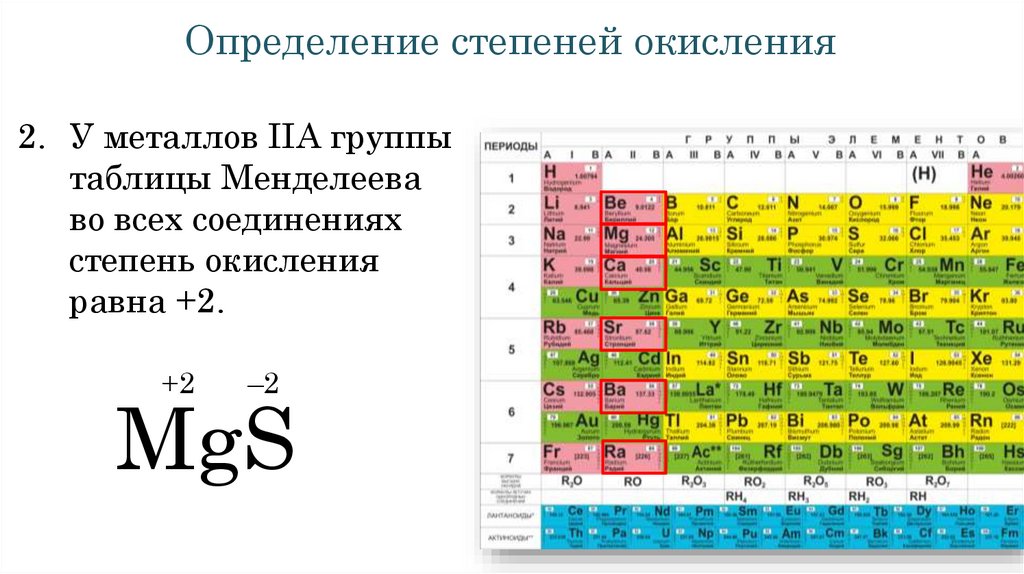
Определение степеней окисления2. У металлов IIА группы
таблицы Менделеева
во всех соединениях
степень окисления
равна +2.
+2
–2
MgS
10.
Определение степеней окисления3. У металлов IIIА
группы таблицы
Менделеева во всех
соединениях степень
окисления равна +3.
+3
–1
AlF3
11.
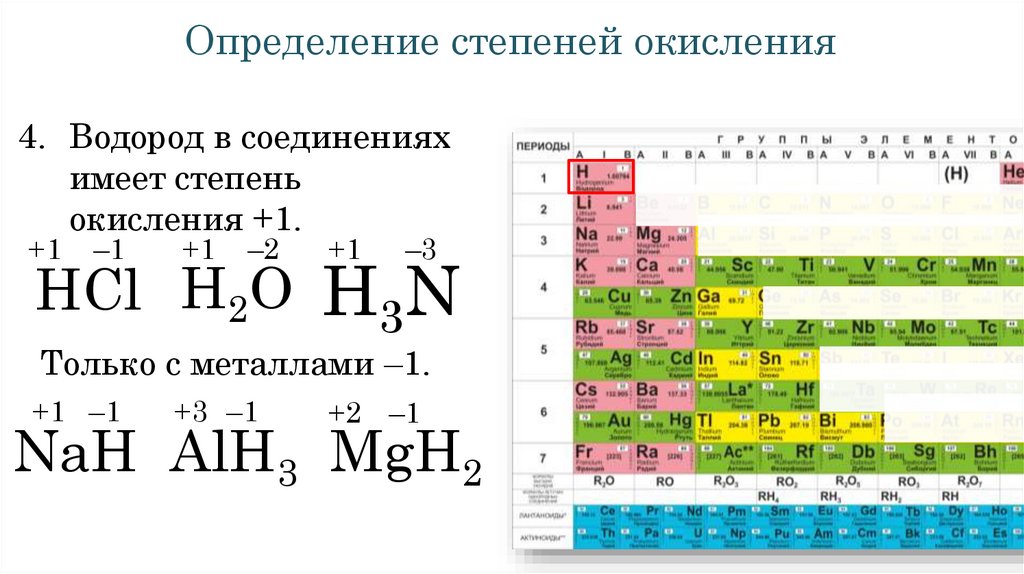
Определение степеней окисления4. Водород в соединениях
имеет степень
окисления +1.
+1
–1
+1
–2
+1
–3
HCl H2O H3N
Только с металлами –1.
+1 –1
+3 –1
+2 –1
NaH AlH3 MgH2
12.
Определение степеней окисления5. Нулевое значение
степени окисления
имеют атомы в
молекулах простых
веществ и атомы в
свободном состоянии:
0
0
H2 N2
0
0
Fe Na
13.
+1Рассмотрим несколько соединений и
определим степень окисления атомов в
частицах:
-2
0
-2
+1
Na2S
+5
-2
+1
-2
N2O5
Н2О
Na2S
N2O5
0
0
Н2О
2Na =S
-2
+5
2N =5O
+1
-2
2H =O
14.
Отличия степени окисления отвалентности:
1. Степень окисления имеет заряд, а
валентность нет.
-2
II
Н2 О
2. Понятие о валентности
применимо только к веществам,
имеющим молекулярное строение.
3. Численные значения валентности
и степени окисления часто не
совпадают.
-1
IV
Cl C2H2
15.
Алгоритм составленияформулы сульфида железа (III)
6
+3
-2
FeS
Fe2S3
1. Запишем знаки железа и серы рядом. Железо как менее
элекроотрицательный элемент становится на первое место, а
сера на второе.
2. Каждый атом железа отдает три внешних электрона атомам серы,
каждому из которых не хватает двух электронов до завершения
внешнего энергетического уровня. Записываем эти значения в
формулу.
3. Находим наименьшее общее кратное для них, которое равно
шести. Рассчитываем и записываем индексы.
16.
Названия бинарных соединенийПервое слово указывает на электроотрицательную часть
соединения, к нему прибавляется окончание –ид в
именительном падеже.
Второе слово записывается в родительном падеже и обозначает
положительную часть соединения. Вторая часть может быть
либо металлом, либо менее электроотрицательным элементом,
чем элемент в первой части.
Пример 1.
KCl — хлорид калия
FeO — оксид железа
CaH2 — гидрид кальция
17.
Названия бинарных соединенийПервое слово указывает на электроотрицательную часть
соединения, к нему прибавляется окончание –ид в
именительном падеже.
Второе слово записывается в родительном падеже и обозначает
положительную часть соединения. Вторая часть может быть
либо металлом, либо менее электроотрицательным элементом,
чем элемент в первой части.
Пример 2.
SiO2 — оксид кремния
NO — оксид азота (II)
18.
Принципы химической номенклатуры былиразработаны в 1785 г.
Антуан
Лавуазье
Антуан де
Фуркруа
Луи Гитон де
Морво
Клод
Бертолле












 Химия
Химия








