Похожие презентации:
Эрмаханова Санду ГПП 9 такырып
1.
«Дәрілер технологиясы және фармакогнозия» кафедрасыТақырыбы: Дәріхана ұйымының стерильді емес
дәрілік формаларды өндіруге құқығы бар үйжайлары мен жабдықтары.
Орындаған: Эрмаханова С.Б.
Тобы: ФҚҚ 01-24
2.
Жоспар:1.Дәріхана ұйымының стерильді емес дәрілік формаларды өндіруге
құқығы бар үй-жайлары мен жабдықтары.
2. Бөлме кластары
3. Қойылатын санитарлық талаптар
3.
Инъекциялық ерітінді – бір немесе бірнеше дәрілікзаттарды еріту жолымен алынған, парентеральды қолдануға
арналған сұйық дәрілік түр.
Инъекциялық дәрілерге организмге тесік ине арқылы тері
бетінің және шырышты қабықтың бүтіндігін бұза енгізілетін
дәрілік түрлер жатады.
Инъекциялық
ерітінділерге,
сулы
және
майлы
ерітінділерден басқа, суспензиялар мен эмульсиялар,
стерильді ұнтақтар мен таблеткалар (оларды стерильді
еріткіштерде дәріні егу алдында ерітеді) жатады.
4.
Ампулалықөндірістің
фармацевтік
өндірістің
басқа
салаларымен
салыстырғанда өзіне тән ерекшеліктері бар:
инъекциялық
ерітінділерді енгізгенде дәрілік затпен бірге
организмнің жергілікті немесе жалпы инфекциясын
тудыратын микроорганизмдер түсуі мүмкін. Сондықтан,
инъекцияға
арналған
ерітінділерді
стерилдейді
(зарарсыздандырады) және оларды асептика ережелері мінсіз
орындалатын жағдайларда дайындайды;
ерітіндімен бірге организмге механикалық бөлшектер түсуі
мүмкін. Олар патологиялық өзгерістердің, тромбоздардың,
эмболияның, гранулемалардың пайда болуына себепкер
болады.
5.
Дайын өнімге механикалық қоспалардың түсіп кетуініңнегізгі көзі болып: өндіріс орындарының ауасы, қосымша
материалдар,
қолданылатын
жабдықтар,
ампулалар
(алғашқы орауыш материалы ретінде), персонал табылады.
Осыған байланысты аса жауапты операциялар (мысалы,
ампулаларды толтыру) А класты таза бөлмелерде
жүргізіледі;
дроттарды мұқият жууға және ампулаларды көп қайтара
жууға, фильтрлеуге, асептикалық жағдайда жұмыс істейтін
персоналға және оның арнайы киімдеріне аса үлкен мән
берілуі керек;
www.themegallery.com
6.
инъекциялықерітінділерде ешбір механикалық қоспалар
болмауы тиіс. Механикалық қоспалар болып талшық, нүкте
тәріздес қоспалар түріндегі және т.б.қозғалып жүрген
бөлшектер саналады, олар ерітіндіде қарусыз көзбен
көрінеді.
Дайындау
процессі кезінде ерітінділер біріншілік және
екіншілік көзбен шолып бақылауға тартылады.Біріншілік
бақылау фильтрлеуден кейін жүргізіледі. Механикалық
қоспалар табылған кезде, олар қайтадан фильтрленеді де,
қайта бақыланады.
ww
7.
Инъекцияға арналған дәрілерге келесі негізгі талаптарқойылады:
1. Механикалық қоспалардың болмауы
2. Стерильдік
3. Апирогендік
4. Тұрақтылық
www.themegallery.com
8.
Асептика – технологиялық процестің барлық сатыларындадәрілік құралдарды оларға микроорганизмдер мен
механикалық бөлшектердің түсіп кетуінен
қорғауға
бағытталған технологиялық және гигиеналық шаралардың
жиынтығы.
www.themegallery.com
9.
Бірқатар дәрілік түрлер асептикалықдайындауды талап етеді. Бұлар:
жағдайларда
инъекциялық дәрілік түрлер,оларды қолдану тәсілі
организмнің қорғаныс барьерлерін бұзу арқылы жүреді;
көз дәрілік түрлері,себебі,көздің шырышты қабатының
микроорганизмдерге сезімталдығы жоғары;
күйік жаралар мен ашық жараларды емдеуге арналған
дәрілік түрлер,жара беттері микроорганимздерге сезімтал
келеді;
www.themegallery.com
10.
Стерильді өнімдерді шығаруға талаптар келесі құжаттардакелтірілген:
GMP ВОЗ «Sterile pharmaceutical products» (1992)
Европалық
одақтың (ЕС) GMP «Manufacture of sterile
medicinal products» (1997)
«Надлежащая
производственная практика лекарственных
средств» (1999)
«Надлежащая
производственная практика лекарственных
средств» (2001)
Правила
надлежащей производственной
Good manufacturing practice)
практики (GMP-
11.
Приказ и.о. Министра здравоохранения Казахстан от 4 февраля 2021 года № ҚРДСМ-15.
Об утверждении надлежащих фармацевтических практик
Зарегистрирован в Министерстве юстиции РК 09.02.2021 года № 22167
В соответствии с подпунктом 9) статьи 10 Кодекса Республики Казахстан от 7 июля
2020 года «О здоровье народа и системе здравоохранения»
ПРИКАЗЫВАЮ:
1. Утвердить:
1)Стандарт надлежащей лабораторной практики (GLP) согласно приложению 1 к настоящему
приказу;
2)Стандарт надлежащей клинической практики (GCP) согласно приложению 2 к настоящему
приказу;
3)Стандарт надлежащей производственной практики (GMP) согласно приложению 3 к
настоящему приказу;
4)Стандарт надлежащей дистрибьюторской практики (GDP) согласно приложению 4 к
настоящему приказу;
5)Стандарт надлежащей аптечной практики (GPP) согласно приложению 5 к настоящему
приказу;
6)Стандарт надлежащей практики фармаконадзора (GVP) согласно приложению 6 к
www.themegallery.com
настоящему
приказу.
12. People helping
GMP - Good Manufacturing Practiсе (жақсы [немесетиісті өндірістік
People
helping]
практика) деп анықталады және өндірістік циклдің ең басынан бастап
өнімнің сапасын қамтамасыз етуге бағытталған фармацевтік өндірісті
ұйымдастыру ережелері болып табылады.
Тиісті өндірістік практика – бұл халықаралық сапа стандарты, оған
сәйкес қатаң регуляторлы системасы бар мемлекеттерде дәрілік
құралдарды өндіру жүргізіледі , ЕО мемлекеттері және регуляторлық
органдары фармацевтік инспекция қызметтері системасының мүшесі
мемлекеттер (PIC/S), США, Япония
Әрбір фармацевтік өндірістің міндеті - дәрілік құралдарды өндіруді
ұйымдастыру нәтижесінде олар өзінің қолданылу мақсатына сәйкес
болуы, лицензия талаптары орындалуы тиіс және пациенттер
қауіпсіздік,сапа немесе әсерлігі бойынша талаптардың бұзылуы әсерінен
қауіпке ұшырамауы керек.
13.
Инъекциялық дәрілердің ластануымен күреспроблемасының негізгі көздері:
өндіріс орындары
персонал
шикізат көзі
жабдықтар
орауыш ыдыстың тазалығы.
www.themegallery.com
14.
«Таза» өндіріс орындарында:ауа қысымы айырмашылығы 10-15 Па;
температура 23±2ºС;
салыстырмалы ылғалдылығы 30-40%.
Ауа
қысымы айырмашылығы – бұл «таза» өндіріс
орнындағы қысым мен осыған жанасып жатқан кез-келген
бөлмедегі қысым арасындағы айырмашылық.
www.themegallery.com
15.
«Жабдықталған» жағдай – бұл таза бөлмелердің салынғанжәне жұмыс істеп тұрған жағдайы, технологиялық
қондырғылар толық жинақталған, бірақ персонал жоқ.
«Эксплуатацияланған» жағдай – бұл таза бөлмелер және
технологиялық қондырғылар тиісті режимде жұмыс істеуші
персоналдың берілген санымен жұмыс істеп тұрған
жағдайы.
16. Өндірістік орындарға қойылатын талаптар:
Өндірістік зоналар.Фармацевтік өндіріс таза бөлмелерде жүргізілуі тиіс.
Таза өндіріс орны (бөлме) – бұл белгілі класс тазалығына
сәйкес ауадағы аэрозольді бөлшектер, қажет болғанда,
микроорганизмдердің
есептеулі
концентрациясы
қалыптасатын және берілген шамадан жоғары емес
мөлшерде бақыланатын өндіріс орны.
www.themegallery.com
17. Өндірістік орындарға қойылатын талаптар:
Таза зона - бұл белгілі класс тазалығына сәйкес ауадағыаэрозольді
бөлшектер,
қажет
болғанда,
микроорганизмдердің
есептеулі
концентрациясы
қалыптасатын және берілген шамадан жоғары емес
мөлшерде бақыланатын шектеулі кеңістік.
Бір таза бөлмеде бірнеше таза зона бола алады.
www.themegallery.com
18. Өндірістік орындарға қойылатын талаптар:
Аэрозольді бөлшек – бұл көлемдері 0,05 - 100 мкм ауадатозаңданған қатты, сұйық көп фазалы объект немесе
микроорганизм. Класс тазалығын анықтау үшін көлемдері
0,5 және 5 мкм бөлшектерді бақылайды.
Тазалық классы – бұл
1 м3 немесе 1 фут3 ауадағы
бөлшектердің есептеулі концентрациясымен анықталатын
ауаның тазалық дәрежесі.
www.themegallery.com
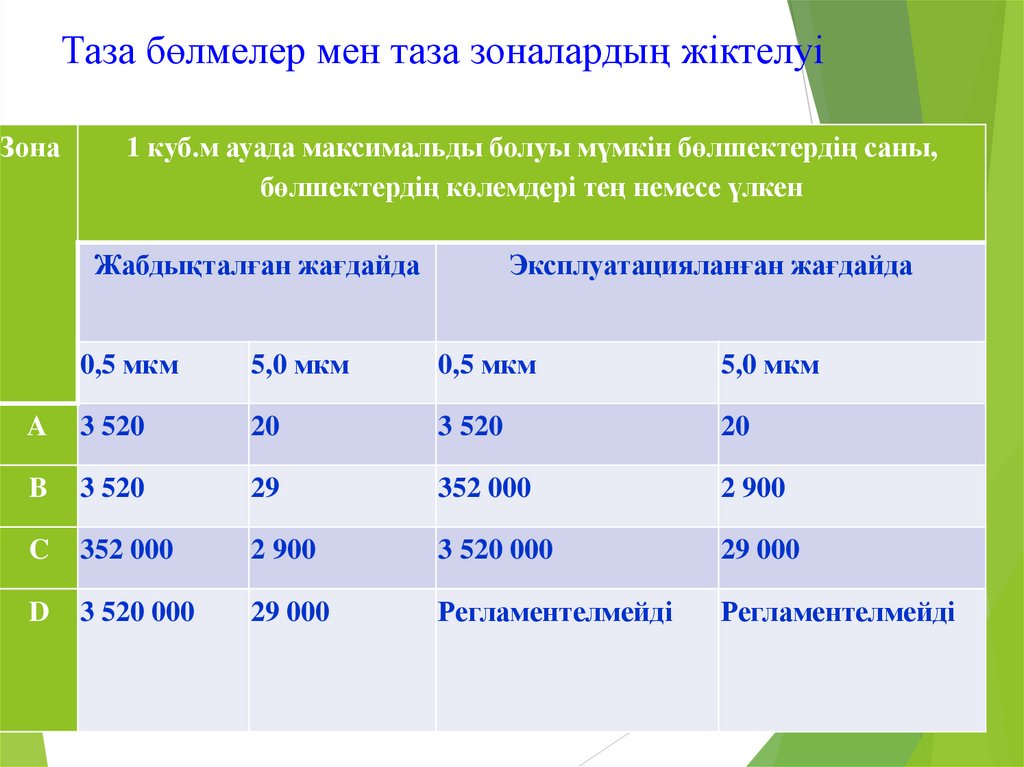
19. Таза бөлмелер мен таза зоналардың жіктелуі
Зона1 куб.м ауада максимальды болуы мүмкін бөлшектердің саны,
бөлшектердің көлемдері тең немесе үлкен
Жабдықталған жағдайда
Эксплуатацияланған жағдайда
0,5 мкм
5,0 мкм
0,5 мкм
5,0 мкм
A
3 520
20
3 520
20
B
3 520
29
352 000
2 900
C
352 000
2 900
3 520 000
29 000
D
3 520 000
29 000
Регламентелмейді
Регламентелмейді
20.
Ас е п т и к а л ы қ ф а р м а ц е вт і к ө н д і р і с ү ш і н т а з аз о н а л а р д а о р ы н д а л ат ы н о п е р а ц и я л а р
Зона Орындалатын операциялар
типі
А
В
С
D
Асептикалық дайындау және толтыру
Кейін стерильді фильтрациядан өтпейтін ерітінділерді дайындау
Асептикалық жағдайда дайындалған өнімдерді өңдеу және
толтыру операциялары
Жартылай жабылған біріншілік орауыштарды тасымалдау,
мысалы, лиофильді кептіру кезінде орамдау аяқталғанға дейін
Стерильді жағар майларды, кремдерді, суспензиялар мен
эмульсияларды дайындау және өнім ашық түрде болған және әрі
қарай фильтрлеуге жатпайтын жағдайда, толтыру
«А» зонасын қоршап тұрған зона
Ерітінділерді фильтрлеуге дайындау
«Үрлеу-толтыру-герметизация» технологиясы бойынша
автоматты орауыш линиялар
Жуғаннан кейін материалдармен операциялар
Изолятордың айналасындағы зона
21.
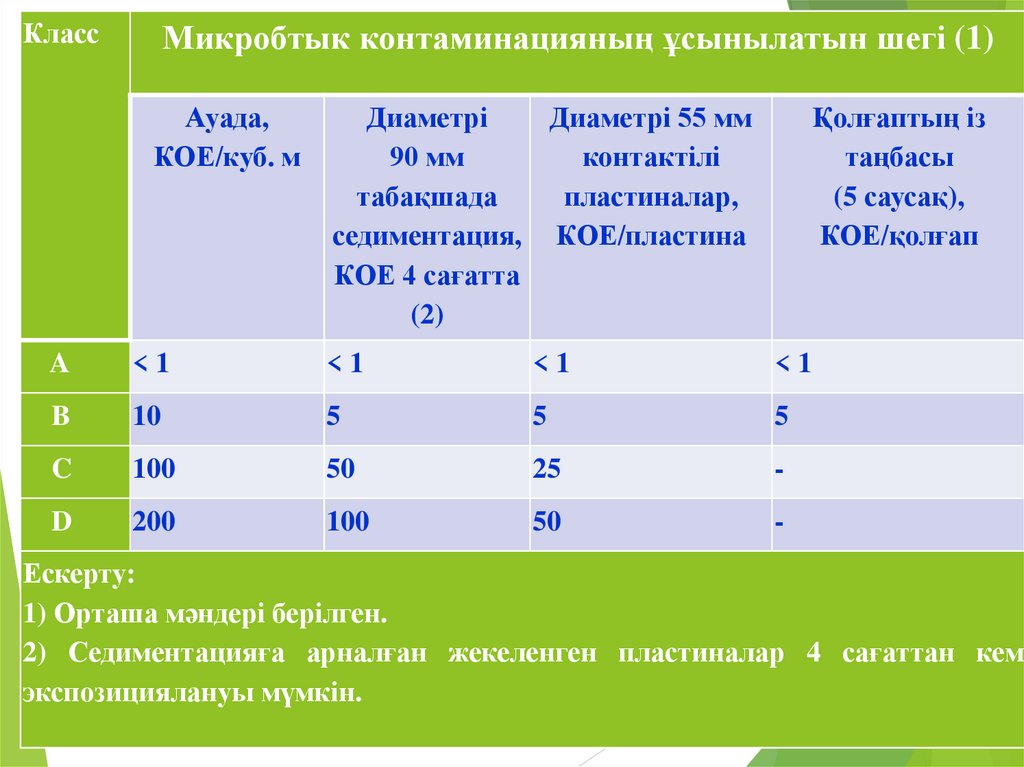
КлассМикробтык контаминацияның ұсынылатын шегі (1)
Ауада,
КОЕ/куб. м
Диаметрі
Диаметрі 55 мм
90 мм
контактілі
табақшада
пластиналар,
седиментация, КОЕ/пластина
КОЕ 4 сағатта
(2)
Қолғаптың із
таңбасы
(5 саусақ),
КОЕ/қолғап
A
<1
<1
<1
<1
B
10
5
5
5
C
100
50
25
-
D
200
100
50
-
Ескерту:
1) Орташа мәндері берілген.
2) Седиментацияға арналған жекеленген пластиналар 4 сағаттан кем
экспозициялануы мүмкін.
22.
23. Қорытынды
Дәріхана ұйымының стерильді емес дәрілік формаларды өндіруіне арналғанүй-жайы мен жабдығы — қауіпсіздік, сапа және бақылау талаптарына сәйкес
құрылып, тиісті нормативтік актілерге және кәсіби нұсқаулықтарға (SOP, USP
⟨795⟩, ASHP т.б.) негізделуі тиіс. Қазақстанда бұл талаптар Денсаулық сақтау
министрлігінің бұйрықтарымен және санитарлық-эпидемиологиялық
ережелермен бекітіледі; жергілікті талаптарға сәйкестік (лицензиялау, тіркеу,
инспекция) міндетті. Қысқаша: дұрыс зонирлеу, жеңіл тазаланатын беттер,
калибрленген таразылар мен араластырғыштар, жеткілікті желдету,
құжаттандыру және персонал дайындығы — негізгі талаптар.
24.
Пайдаланылған әдебиет (негізгідереккөздер)
1. Қазақстан Республикасы Денсаулық сақтау министрінің бұйрықтары
(қатысты нормалар — мысалы № ҚР ДСМ-287/2020 және басқа).
2.
«Устройство, оборудование и эксплуатация аптечных организаций» —
санитарлық ережелер/нормалар (ресми нормативтер жинағы).
3. Санитарлы-эпидемиологиялық талаптар және санитарлықэпидемиологиялық нормалар (Қазақстан Республикасының тиісті актілері).
4.
USP General Chapter ⟨795⟩ — Pharmaceutical Compounding — Nonsterile
Preparations (US Pharmacopeia).
5.
ASHP Technical Assistance Bulletin — Compounding Nonsterile Products
in Pharmacies (American Society of Health-System Pharmacists).
6.
Қосымша — Қазақстанның лицензиялық және тіркеу талаптары
туралы Денсаулық сақтау министрлігінің басқа бұйрықтары және
мемлекеттік нормативті актілер.