Похожие презентации:
Дәрілік заттардың сапасын реттемелеуші мемлекеттік заңдар мен ережелер (GMP рөлі, МФ, ФМ, ЖФМ)
1.
ӘЛ – ФАРАБИ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ УНИВЕРСИТЕТІДәрілік заттардың
сапасын реттемелеуші
мемлекеттік заңдар мен ережелер
(GMP рөлі, МФ, ФМ, ЖФМ)
1
2.
1991 жылы ҚР тәуелсіздігін алған соң, мемлекет алдында жедел түрдесапасыз, потенциалды қауіпті дәрілік заттардан қорғау міндеті тұрды.
Қазақстан республикасында ДЗ-ның қауіпсіздігі, тиімділігі мен сапасына
жауапты болатын және тіркеу жұмыстарын жүргізетін құрылым болған жоқ.
Қазақстанда ДЗ мемлекеттік тіркеудің даму жолы ДЗ медициналық қолданысқа
жіберудің жоғары либеральды деңгейінен тиімді тіркеу жүйе деңгейіне дейін
қалыптасты.
90-шы жылдардың басында Қазақстан терең экономикалық дағдарысқа
ұшырады. «Дәрілік ашаршылықтың» басталуына шынайы қауіп төнді: меншікті
өндіріс сұраныстың 3%-ын құрады, ал Кеңес Одағы кезінде болған дәрілік
заттардың жеткізілім желісі толығымен үзілді. Фармсектор мемлекетпен
мүлдем реттелінбеді. ДЗ-тың медициналық қолданыс аясына түсу рұқсаты
өтініш берушінің шешімі бойынша құрастырылған өтініштің ерікті формасы мен
құжаттар пакеті негізінде берілетін.
3.
Мемлекет және денсаулық сақтау облысындағы атқарушы органның тарапынан1993 жылдан бастап фармқызметті реттеу жұмыстары, сонымен қатар ДЗ
мемлекеттік тіркеу жүйесі де ретке алына бастады. Ақырындап нормативті –
құқықтық база мен ДЗ мемлекеттік тіркеуді жүргізетін органдардың құрылымы
құрыла бастады.
1998 жылдың қыркүйек айында алғаш рет ҚР-да ДЗ мемлекеттік тіркеу тәртібі
бекітілді және сараптама жүргізу жұмыстары «Дәрі-дәрмек» Дәрілік заттар
Орталығына жүктелінді.
Қазіргі таңда, ДЗ мемлекеттік тіркеу жұмыстарын Денсаулық Сақтау
Министрлігінің (ДСМ) ведомствосы – Фармация Комитеті РМК «Дәрілік заттарды,
медициналық мақсаттағы бұйымдарды және медицина техникасын сараптау
ұлттық Орталығының» ДЗ-тың қауіпсіздігі, тиімділігі және сапасы туралы
қорытындысы негізінде жүргізеді.
2003 жылы қаңтарда «Дәрілік заттар туралы» Заңын (күші жойылған)
қабылдаудан бастап ДЗ мемлекеттік тіркеу жүйесін құруда заң базалар
жасалынды. Қазіргі кезде клиникаға дейінгі және клиникалық зерттеулер, ДЗ
жанама әсерлерінің мониторинг тәртіптері бекітілді, ДЗ туралы ақпараттар
реттеліп жатыр.
4.
ДЗ тіркеу ережелері жетілдірілді:Тіркеу құжаттамаларын құрастыру талаптары сәйкестендірілді
Тіркеу куәлігінің жарамдылық мерзімі кезінде тіркеу
құжаттамасына енгізетін өзгерістер классификациясы бекітілді (І
тип – ДЗ жаңадан тіркеуді талап етпейтін өзгерістер, ІІ тип – ДЗ
жаңадан тіркеуді талап ететін өзгерістер)
Өтініш беруші белгілі периодтылықпен Фармация Комитетіне ДЗтың қауіпсіздігі, тиімділігі және сапасы туралы есеп беру міндетін
енгізді
Тіркеу куәлігінің жарамдылық мерзімі кезінде жеткізілетін ДЗ
мемлекеттік тіркеуге алынған үлгілерге сай болуына арыз
берушінің жауапкершілігі бекітілді
Тіркеуге, қайтадан тіркеуге бас тартудың себептері, ДЗ-тың бұрын
белгісіз болған қауіпті қасиеттері немесе жанама әсерлері
анықталынған жағдайларда тіркеу куәлігінің күшін тоқтату тәртібі
белгіленілді
Сараптама жұмыстарын жүргізу регламенті орнатылды –
«сағатты тоқтату» механизмін қолданумен 6 айдан аса емес
5. ДЗ-тың сапасын стандарттау
ДЗ-тың сапасын бақылау тіркеу процедурасындаміндетті кезеңдерінің бірі болып табылады. Әрбір
қарастырылатын мемлекеттерде ДЗ-дың сапасын
нормалатын регламенттер мен құжаттардың жинағы
Фармакопея болып табылады. Ресейде – РФ
Мемлекеттік Фармакопеясы, Беларусьте – БР Ұлттық
Фармакопеясы (2007), ал Қазақстанда – ҚР
Мемлекеттік Фармкопеясы (2007) қолданылады. Бұл
мемлекеттер Европалық Фармакопея Комиссиясының
бақылаушылары болғанымен, бұл ұлттық
формулярлар бір-бірінен елеулі түрде ерекшеленеді.
БР-ның Фармакопеясы халықаралық талаптарға
максимальды түрде үйлестірілген болып келеді.
6.
ҚР территориясында көптеген халықаралықФармакопеялар танылған. Қазақстанның Мемлекеттік
Фармакопеясындағы редакцияларға түсірілген
материалдары Европалық Фармакопеямен
жақындастырады, бірақ елеулі айырмашылықтардың
болуына орай, оны ұлттық ретінде сипаттауға жағдай
туғызады.
Ресей өзіндік Мемлекеттік Фармакопеясын жасау
концепциясын ұстанады. Бұл айырмашылықтар шетел
өндірушілерінің дәрілік заттарының сапасын бақылау
әдістемелерінің қолжетімділігін анықтайды, сондықтан
мемлекетаралық фармакопеяларды үйлестіру сұрағы
әлі ашық болып тұр.
7.
Стандарттау процесіндестандарттау нысанына қатысты нормалар, ережелер талаптар және сипаттамалар нормативтік құжат
түрінде дайындалады.
ХСҰ/МЭК басқармасы мыналарды ұсынады: стандарттар, техникалық жағдайдың құжаттары (ұйымның
стандарттары), ережелер құрамы, регламенттер, қаулылар.
Стандарттау мақсаты :
- жоспарланған және орындалатын тапсырмаларды орындауда бекітілген ережелерді, талаптарды және
нормаларды бір салада кең көлемде қолдану үшін жоғары дәреже реттеу;
- өнімнің (қызметтің) талапқа сәйкестік дәрежесін жоғарылатуға, халықаралық тауар алмасудағы
кедергілерді жоюға, ғылыми-техникалық прогреспен әртүрлі салалармен бірлесіп жұмыс жасауға
бағытталған болу керек.
Стандарттау — бұл сапалы өнімді тиімді бағаға бағалау, тұтыну құқықтарын қорғайтын, еңбек қауіпсіздігін
қамтамасыз ететін орындалуы міндетті талаптар, ережелер, нормалар мен сипаттамалардан тұратын
қызмет түрі.
Мемлекеттік стандарттар сала аралық қажеттілігі бар өнімге, жұмысқа немесе қызметке арналып
жасалады. Бұл стандарттары Қазақстанның Мемлекеттік Стандарт мекемесі қабылдайды.
Аккредитация- заңды немесе жеке тұлғалардың ерекше міндеттерді нақты орындай алатынын мемлекеттің
өкілетті ұйымның тануы.
Тіркеу/Регистрация/ -өнімнің, процестің немесе қызметтің сапасы
дәлелдегенде және тексеруден өткенде, аккредитацияланған тұлға ХСҰ-ның реестріне енізіліп, тіркеледі.
8.
-Халықаралық Стандарт Ұйымы /ХСҰ/-Международная Организация Стандартизации /МОС/
-International Standardization Organization /ISO/ 9000
ХСҰ –өнім өндіретін ұйымның сапасын, менеджмент жоспарын жүзеге асыру және жобалау ұсыныстарын
және талаптарын анықтайтын сапаны басқаратын халықаралық стандарттар құжаты
Стандарт — бұл консенсус негізінде жасалған, нақты бір салада реттеудің жоғары деңгейіне жету
мақсатында дайындалған, белгілі бір ұйыммен бекітілген нормативтік құжат болып табылады.
Стандартта әртүрлі әрекеттер мен олардың нәтижелеріне тиісті жалпы немесе бірнеше рет қолданылатын
принціптер, ережелер және сипаттамалар көрсетіледі.
Стандарттаудың негізгі міндеттері:
- өнімнің , адам және жануар өмірі мен денсаулығына, сонымен қатар қоршаған ортаға қауіпсіздігін
қамтамасыз ету;
- өнімдердің өзара алмасуы мен бірлесуі;
-өнім, жұмыс және қызмет сапаларының ғылыми-техникалық прогрестің даму дәрежесіне сәйкес келу;
- өлшем бірліктер біртұтастығы;
- барлық ресурс түрлерінің үнемделуі;
әр түрлі зақымданулар мен ластанулардың туындауына байланысты өнідірістік кәсіпордардың қауіпсіздігін
қамтамасыз ету.
Стандарттау - стандарттау нысаны және стандарттау саласы деген түсініктермен тығыз байланысты.
Стандарттау нысаны (құралы) деп белгілі бір талаптарға, сипатамаларға, параметрлерге және ережелерге
бағынатын өнімді, процесті немесе қызметті (мысалы, дәрі немесе оны дайындау технологиясы ) айтады.
Стандарттау толық бір нысанға (дәрілік препаратқа) немесе оның құрамдас бір бөлігіне (әрекет етуші зат,
шикізат, толықтырғыш) қатысты болуы мүмкін.
Стандарттау саласы деп –стандарттау нысандарының өзара байланыс жиынтығын айтады. Мысалы,
биотехнология стандарттау саласы, ал осы саланың нысандарына технологиялық процестер, аппарат
түрлері, машиналардың экологиясы мен қауіпсіздігі (таблетка аппараты, автоклавтар, араластырғыштар,
қайнату қазандары, реакторлар) жатады.
9.
Стандарттау дәрежесі географиялық, экономикалық және саяси аймақтағықатысушы мемлекеттер қабылдаған стандарттарына байланысты болады.
Халықаралық стандарттау дегеніміз мемлекеттегі стандарттау қызметіне
басқа мемелекеттердегі сәйкес мекемелердің
қатысуы.
Аймақтық стандарттау — бір географиялық, саяси немесе экономикалық
аймақтағы елдердің (мысалы, ТМД елдері) тиісті ұйымдарына қатысты қызмет
түрі.
Ұлттық стандарттау- тек қана нақты бір мемлекеттегі жүргізілетін стандарттау.
Бұл жағдайда ұлттық стандарттау әртүрлі деңгейде: мемлекеттік, салалық,
экономикалық (мысалы, министрліктер деңгейінде), бірлестік, өнідірістік
кәсіпорындық (фабрика, завод) және ұйымдық дәрежеде қолданылуы мүмкін.
Әкімшілік-аймақтық (провинциялық, өңірлік және т.б.) бірлікте жүргізілетін
стандарттауды әкімшілік-аймақтық стандарттау деп атау қабылданған.
10.
Регламент — негізгі құқықтық нормалардан тұратын құжат түрі.Техникалық регламент —стандарттау нысанына арналған техникалық талаптардан тұрады.
Басқа жағдайларда техникалық регламентке толығымен нормативтік құжаттар енгізіледі.
Техникалық регламент ереже бойынша регламенттің талаптарына өнімнің (қызметтің,
процестің) сәйкестігін тексеру немесе бақылау әдістерінің нұсқауынан тұрады, сонымен қатар
әдістемелік құжаттармен
толықтырылып отырады
ҚР Стандарттау бойынша нормативтік құжаттары ҚР «Стандарттау туралы» Заңымен
бекітіліген.
Оларға мыналар жатады:
• Қазақстан Республикасының Мемлекеттік стандарттары (СТ РК) халқаралық, аймақтық
стандарттар, сонымен қатар стандарттау бойынша нормалар мен нұсқаулар қолданылады;
техниклық-экономикалық ақпараттардың жалпы қазақстандық классификаторлары;
салалық стандарттар;
кәсіпорынның стандарттары;
ғылыми-техникалық, инженерлік және басқа да қоғамдық бірлестіктердің стандарттары.
Стандарттаудың негiзгi принциптерi:
1) келiсу;
2) бүкпесiздiк;
3) ерiктiлiк;
4) отандық және шетелдiк өндiрушiлер
мен өнiм берушiлер үшiн стандарттау саласындағы бiрдей талаптар;
5) экономикалық қисындылық
болып табылады.
11.
Қазақстан Республикасының Мемлекеттік фармакопеясы дәрілік заттардыңсапасы мен қауіпсіздігін нормалайтын мемлекеттік стандарттар мен ережелер
жинағы;
Осы Заңда мынадай негізгі ұғымдар пайдаланылады:
• 1) биологиялық белсенді заттар - жануарлар мен адам ағзасының
физиологиялық функцияларының өзгеруіне әкелетін және дәрілік заттар алудың
ықтимал көздері болып табылатын әртүрлі тектегі заттар;
• 2) биоэквиваленттік - олардың бірдей тиімділігі мен қауіпсіздігіне сенім артуға
мүмкіндік беретін, бірдей дозада және бірдей жағдайда енгізгеннен кейін бірдей
биожетімділігін (жылдамдығы мен сіңірілу дәрежесін) растайтын екі дәрілік
заттың салыстырмалы сипаттамасы;
• 3) гомеопатикалық дәрілік заттар - дәстүрлі емес емдеу әдістері кезінде
гомеопатикалық ережелер бойынша қолданылатын, арнаулы технология
бойынша дайындалған немесе өндірілген, құрамында өсімдік, жануар, минерал
текті заттардың мөлшері тым аз, бір немесе көп құрамдас дәрілік заттар;
• 4) дәрілік заттар - аурулардың алдын алуға, оларды диагностикалауға және
емдеуге, сондай-ақ ағзасының күйі мен функцияларының өзгеруіне арналған
фармакологиялық белсенді заттарды білдіретін немесе олардан тұратын
құралдар: дәрілік зат, дәрілік субстанция, табиғи текті дәрілік шикізат, дәрілік
ангро - және балк өнімдері, дәрілік препараттар, иммунобиологиялық
медициналық препараттар.
• Аурулардың диагностикасы, алдын алу және емдеу мақсатында
пайдаланылатын парафармацевтикалар, медициналық техника мен
медициналық мақсаттағы бұйымдар (көзге салынатын және оны түзейтін
линзалар, керек-жарақтар және материалдар, бұйымдар, құрал-саймандар,
құрылғылар, аспаптар, аппаратура) дәрілік заттарға теңестіріледі;
12.
5) дәрілік заттар айналымы саласындағы мемлекеттік бақылау фармацевтикалық қызметті регламенттейтін нормативтік құқықтық актілердіңбұзылуын анықтауға әрі жолын кесуге және фармацевтикалық қызметті
Қазақстан Республикасының дәрілік заттар туралы заңнамасының
талаптарына сәйкес келтіруге бағытталған іс-қимылдар кешені;
6) дәрілік заттар айналымы саласындағы субъектілер - Қазақстан
Республикасының заңнамасында белгіленген тәртіппен фармацевтикалық
қызметті жүзеге асыратын жеке немесе заңды тұлғалар;
7) дәрілік заттарды орау - дәрілік заттар айналымы процесін, оларды бұзылу
мен жойылудан қорғау жолымен, сондай-ақ қоршаған ортаны ластанудан
қорғауды қамтамасыз ететін құралдар немесе құралдар жиынтығы;
8) дәрілік заттарды дайындау - дәрігерлердің рецептілері бойынша
дәріханаларда дәрілік түрлерді дайындаумен, сондай-ақ дәрілік субстанциялар
алумен, дайындалған дәрілік заттарды сақтаумен, сапасын бақылаумен,
ресімдеумен және өткізумен байланысты фармацевтикалық қызмет;
9) дәрілік заттарды жіктеу - физикалық-химиялық, уыттылық,
фармакологиялық немесе өзге де теңдес қасиеттері бойынша дәрілік заттарды
жекелеген топтарға жүйелеу немесе бөлу;
10) дәрілік заттарды сақтау мерзімі - дәрілік заттар сақталудың белгілі бір
шарттары жағдайында талдамалық нормативтік құжаттама талаптарына
сәйкес келетін уақыт кезеңі;
13.
24) дәрілік заттың сапасы - дәрілік заттың мақсаты бойынша әрекет етушіқабілетіне әсер ететін қасиеттері мен сипаттамаларының жиынтығы;
25) дәрілік заттың сараптамасы - физикалық-химиялық, клиникаға дейінгі
сынаулар, клиникалық зерттеулер өткізу жолымен дәрілік затты қауіпсіздігі,
тиімділігі және сапасы тұрғысынан зерттеу немесе сынау, сондай-ақ уәкілетті
орган белгілеген тәртіппен тіркеуге ұсынылған дәрілік заттың нормативтік
құжаттарын зерделеу;
26) дәрілік заттың сәйкестік сертификаты - бірдейлендірілген дәрілік заттың
техникалық регламенттер, стандарттар немесе өзге де нормативтік құжаттар
талаптарына сәйкес келетіндігін көрсететін, белгіленген нысандағы құжат;
27) дәрілік заттың тиімділігі - аурудың клиникалық көріністеріне (дертті жайкүйіне) және себептеріне дәрілік заттың әсер ету деңгейінің сипаттамасы;
28) дәрілік заттың халықаралық патенттелмеген атауы - Дүниежүзілік
денсаулық сақтау ұйымы ұсынған дәрілік заттың атауы;
29) дәрілік өсімдік шикізаты - құрамында биологиялық белсенді заттар бар
және дәрілік зат ретінде, сондай-ақ дәрілік заттарды өндіру және дайындау
үшін пайдаланылатын өсімдіктердің бөліктері (тамырлары, түп тамырлары
мен түбірлері, шөбі, гүлдері, жемісі мен тұқымдары, сабақтары, қабығы,
жапырақтары);
30) дәрілік препарат - белгілі бір дәрілік түрдегі дәрілік зат;
31) дәрілік субстанция - дәрілік препараттарды өндіру үшін пайдаланылатын
дәрілік заттар;
32) дәрілік түр - дәрілік заттың қолайлы қолданылуына және қажетті емдік әрі
алдын алу әсеріне жетуі үшін келтірілетін белгілі бір жай-күйі;
14.
36) жалған дәрілік зат - құрамы, қасиеттері және басқа да сипаттамаларыбойынша түпнұсқаға немесе дайындаушының қайта өндірілген дәрілік
затына (генерикке) сәйкес келмейтін, заңға қайшы және әдейі қолдан
жасалған этикеткамен жабдықталған дәрілік зат;
37) жаңа дәрілік зат - мемлекеттік тіркеуден кейін медициналық қолдануға
және өндіруге алғаш рет рұқсат етілген дәрілік зат;
38) Қазақстан Республикасының Мемлекеттік фармакопеясы - дәрілік
заттардың сапасы мен қауіпсіздігін нормалайтын мемлекеттік стандарттар
мен ережелер жинағы;
39) қайта өндірілген дәрілік зат (генерик) - құрамы мен сапалық
көрсеткіштері, қауіпсіздігі мен тиімділігі жөнінен бірегей дәрілік затпен
бірдей және бірегей дәрілік затқа қорғау құжаттарының қолданылу мерзімі
өткеннен кейін айналымға түскен дәрілік зат;
40) қосалқы заттар - өндіру мен дайындау процесінде дәрілік түрлердің
нақты қасиеттеріне қол жеткізу үшін қажетті органикалық немесе
органикалық емес болмыстағы заттар;
15.
1) валидация - бағалау және кез келген тәсілдердің, жабдықтардың, өнімдердің (шикізат,материалдар, аралық немесе дайын өнімдер) әрекеттердің немесе жүйелердің шын мәнінде
өз мақсаттарына, белгіленген талаптарға сәйкестігін, ал оларды қолдану күтілген нәтижелер
беретінін және қайта өндірілуін қамтамасыз ететінін жоғары дәрежедегі нақтылықпен
растайтын тиісті өндірістік практика принциптеріне сәйкес құжаттық ресімделген
дәлелдемелерді ұсыну;
3) Қазақстан Республикасының Мемлекеттік фармакопеясы - Қазақстан Республикасы
фармакопеялық құжаттарының мемлекеттік стандарттар мәртебесі бар жинағы;
4) халықаралық патенттелмеген атауы - дәрілік заттың Бүкілдүниежүзілік денсаулық
сақтау ұйымы қабылдаған атауы;
5) біріншілік (ішкі) орам - тікелей дәрілік затпен жанасатын сосуд ыдыс немесе орамның
басқа түрі;
6) тұтыну орамы - белгіленген жарамдылық мерзімі ішінде дәрілік заттың сақталуын
қамтамасыз етеді, біріншілік (ішкі) және екіншілік (сыртқы) орамға бөлінеді;
7) Қазақстан Республикасының фармакопеялық құжаты - Қазақстан Республикасының
аумағында дәрілік заттың сапасы мен қауіпсіздігін айқындайтын нормативтік-техникалық
құжат;
8) Қазақстан Республикасының жалпы фармакопеялық құжаты - дәрілік заттың сапасы
мен қауіпсіздігін анықтайтын және талдаудың жалпы (физикалық, физикалық-химиялық,
химиялық, биохимиялық, биологиялық, микробиологиялық) тәсілдерін сипаттауды,
қолданылатын реактивтерге, титрленген ерітінділерге, индикаторларға, сондай-ақ
нормаланатын көрсеткіштерге немесе дәрілік нысандарды сынау тәсілдерінің тізбесіне
қойылатын талаптарды қамтитын нормативтік-техникалық құжат;
9) дербес фармакопеялық құжат - дәрілік заттың сапасы мен қауіпсіздігін айқындайтын
және нормаланатын көрсеткіштер тізбесін немесе дәрілік затты сынау тәсілдерін қамтитын
нормативтік-техникалық құжат.
16.
Содержание Фармакопеи:— описания методов
химических, физико-химических
и биологических анализов
лекарственных средств,
— сведения о необходимых для
этого реактивах и
индикаторах,
— описания статей на
отдельные лекарственные
субстанции и лекарственные
препараты,
— списки ядовитых (список А) и
сильнодействующих (список Б)
лекарств,
— таблицы высших разовых и
суточных доз для взрослых и
детей.
В настоящее время регуляторными
органами страны и производителями
лекарственных средств достигнуто
ясное понимание неизбежности
перехода к современным требованиям
качества. Только строгое следование
этим требованиям позволит обеспечить
конкурентоспособность и
экспортоориентированность
отечественного производства. Реальным
воплощением тенденций в данной
области явились разработка и
утверждение в декабре 2006 года
национальных стандартов в сфере
обращения лекарственных средств:
надлежащей лабораторной практики
(GLP);
надлежащей клинической практики
(GCP);
надлежащей производственной
практики (GMP);
надлежащей дистрибьюторской
практики (GDP);
надлежащей аптечной практики (GPP).
17.
Государственная фармакопея состоит из 2 томов. Первый том содержит общиефармакопейные статьи. Второй том включает частные фармакопейные статьи
(монографии). Срок издания второго тома Государственной фармакопеи
предусмотрен в 2009 году.
Общие фармакопейные статьи содержат наиболее общие требования,
распространяющиеся на:
методы испытаний;
упаковочные материалы и контейнеры;
реагенты;
показатели качества;
лекарственные формы;
морфологические группы лекарственного растительного сырья;
медицинские иммунобиологические препараты.
Частные фармакопейные статьи (монографии) регламентируют необходимые
требования к показателям качества и определяют методики испытаний для
контроля качества:
лекарственных субстанций;
вспомогательных веществ;
лекарственных препаратов;
лекарственного растительного сырья;
медицинских иммунобиологических препаратов.
18.
II уровень. Европейская фармакопея(Ph. Eur.)
I уровень. Государственная
фармакопея Республики Казахстан
(ГФ РК)
19.
Республика халқын қауіпсіз, тиімді және сапалы дәрі-дәрмектермен қамтамасыз етугемүмкіндік
беретін дәрі-дәрмектер сапасының мемлекеттік стандарттарын жасау арқылы қоғамның
денсаулығын
сақтау ҚР МФ-ның негізгі міндеті болып табылады.
Әлемнің көптеген фармакопеялары тәрізді ҚР МФ талаптары тек дәрі-дәрмектерге ғана емес
сонымен қатар медициналық мақсаттағы бұйымдарға да таралады. Осыған байланысты ҚР
МФ
анықтамасы медициналық практикада қолданылатын құралдардардың көрсетілген
категориясынан тұратын өзгеріске ұшырады. Осылайша ҚР МФ дәрі-дәрмектердің және
медициналық мақсаттағы бұйымдардың сапасын реттейтін мемлекеттік стандарттар мен
ережелер
жиынтығынан тұрады.
ҚР МФ дәрі-дәрмектерді стандарттау жүйесінде орталық орын алады. Фармакопея мемлекет
қамтамасыз ететін дәрі-дәрмектер сапасының рұқсат етілген шекті деңгейін белгілейді.
Өндіруші
специфика-цияларымен шектелетін сапа деңгейі төмен емес, тіпті фармакопеялық
талаптардан да
қатаң болуы тиіс. Өндірушілер спецификациялары негізінде олардың өмірлік кезеңінің барлы
сатыларында дәрі-дәрмектер сапасын бақылау жүзеге асырылады. Осылайша, фармакопея
талаптары
дәрі-дәрмектердің толық өмірлік кезеңін қамтиды. Осындай жұмыс істеу механизмі дәрідәрмектер
сапасын мемлекеттік реттеудің басты құралы ретінде ҚР МФ рөлін анықтайды.
20.
В настоящее время ГФ РК включает191 общий раздел, 24 общих текста и
90 общих монографий (рис. 3).
Изложенные в них общие требования
распространяются на следующее:
- испытания и методы испытаний;
- реактивы;
- показатели качества;
- упаковочные материалы и контейнеры;
- субстанции для фармацевтического
применения;
- лекарственные формы;
- лекарственные препараты, в том числе
гомеопатические препараты,
радиофармацевтические препараты;
- биологические продукты;
- лекарственные растительные
Рис. 3. Структура Государственной
средства;
фармакопеи Республики Казахстан
- морфологические группы
лекарственного растительного сырья;
- изделия медицинского назначения
(катетеры внутрисосудистые, шовные
материалы).
21.
Наряду с общими монографиями ГФРК содержит 646 частных
монографий, регламентирующих
требования к показателям качества,
методикам испытаний и критериям их
приемлемости (рис. 4). Частные
монографии распространяются на
следующее:
- субстанции для фармацевтического
применения, в том числе активные
субстанции и вспомогательные
вещества;
- лекарственные препараты в различных
лекарственных формах;
- лекарственное растительное сырье и
лекарственные растительные
препараты;
- радиофармацевтические препараты и
исходные материалы для
III уровень. Британская фармакопея
радиофармацевтических препаратов; (ВР) и Фармакопея США (USP)
- медицинские иммунобиологические
препараты (вакцины,
иммуноглобулины).
22.
Рис. 4. Структура Государственнойфармакопеи Республики Казахстан
Создание ГФ РК является важным
достижением независимого Казахстана,
проявлением заботы государства о
здоровье населения.
23.
Общая фармакопейная статья (ОФС) - документ, утвержденныйуполномоченным федеральным органом исполнительной власти и
содержащий перечень показателей качества и (или) методов контроля
качества конкретной лекарственной формы, лекарственного растительного
сырья, описания биологических, биохимических, микробиологических,
физико-химических, физических, химических и других методов анализа
лекарственного средства для медицинского применения, а также
требования к используемым в целях проведения данного анализа
реактивам, титрованным растворам, индикаторам.
Источник: Федеральный Закон N 61-ФЗ "Об обращении лекарственных
средств" от 24 марта 2010 г.
Фармакопейная статья предприятия (ФСП) - стандарт качества
лекарственного средства на лекарственное средство под торговым
названием, содержащий перечень показателей и методов контроля качества
лекарственного средства производства конкретного предприятия,
учитывающий конкретную технологию данного предприятия и прошедший
экспертизу и регистрацию в установленном порядке.
Источник: ОСТ 91500.05.001-00 Стандарты качества лекарственных
средств.
24.
ҚР Мемлекеттік фармакопеясы, жалпыфармакопеялық мақала (ЖФМ),
фармакопеялық мақала (ФМ),
аналитикалық нормативтік құжат (АНҚ).
НТҚ жалпы сипаттамасы (талаптары,
нормалары мен бақылау әдістері).
Дәрілік заттардың сапасын бақылау
жүйесін халықаралық стандарттары.
GMP, GLP, GCP, GPP – дәрілік
заттардың сапасын бақылау ұйымы мен
бірегей талаптар жүйесі.
25.
Фармакопеялық мақала – дәріге, оның дайындалуына, сақтау жағдайы жәнесапасын бақылау әдістеріне талаптар бекітетін нормативті техникалық құжат.
МФ медициналық қолдануға және өнеркәсіптік өндіруге Денсаулық сақтау
министрлігі рұқсат еткен, сериялы өндірілетін дәрілік препарат немесе дәрілік
өсімдік шиказатына бекітіледі.
Фармакопеялық мақаланың барлық түрлері және оларға енгізілген
өзгертулердің мемлекеттік күші бар және Денсаулық сақтау министрлігі
Фармация комитеті төреғасы бекітеді.
Дәрілік препаратарға ұсынылған МФ талаптары оларды дайындайтын,
сақтайтын, бақылайтын және қолданатын барлық кәсіпорын және мекемелерге
міндетті. МФ дәрілердің сапасын нормалайтын, міндетті жалпы мемлекеттік
стандарттар және ережелер жиынтығы болып табылады.
Уақытша Фармакопеялық мақала — дәрілік препарат немесе дәрілік өсімдік
шикізаты сапасына белгіленген талап және мемлекеттік стандарт сипатын
сақтайтын, шектеулі мерзімге бекітілген нориативті техникаплық құжат. Дәрілік
препараттар және дәрілік өсімдік шикізатына УФМ Фармация комитетімен
медициналық қолдануға ұсынылған және сериялы жаңа дәрілік препараттарға
бекітіледі.
26.
Стандарт — бұл әртүрлі қызметтер немесе олардың белгілі саладағы реттеудіңоптималды дәрежесіне жетуге арналған нәтижелеріне қатысты жалпы және көп
қайтара қолдануға бекітілген нормативті құжат.
Мемлекеттік және сапалық стандарттар — дәрілік препараттарды дайындауға
және жеткізіп беруге қажетті қосымша техникалық талаптар және топтық
сипаттамаларға тағайындалады. Кейбір шикізат, көмекші эаттар, тара және
орауыштар түрлері техникалық шарттармен немесе уақытша техникалық
шарттармен нормаланады.
Технологиялық регламент — дәрілік заттарды дайындаудың технологиялық
әдістері, техникалық құжаттар, нормалар және нормативті мазмұндалған
нориативті құжат.
Техникалық регламент күші өндірірстік бөлмелерді және персоналды жұмысқа
дайындауды; өндірістің қажетті санитарлық гигиеналық жағдайын жасауды;
еңбекті қорғау, техника қауіпсіздігі, қоршаған ортаны қорғау талаптарының
орындалуын; НТҚ талаптарына сай дәрілік заттар алуды кепілдендіретін құрал
жабдықтарды білікті, тиімді эксплуатациялауды қамтиды.
Өндірістік технолгиялық регламент — өндіріс әдістерін, технологиялық
нормативтерді,техникалық құралдарды, химиялық фармацевтік өнім шығаруда
сапалық көрсеткіштері Фармакопеялық мақаланың талаптарына сәйкес дәрілік
препараттар алуды қамтамсыз ететін технологиялық процестердің жүргізілу
тәртібі мен шарттарын реттейтін, сонымен қаттар, жұмыстарды жүргізу
қауіпсіздігі мен өндірістің жеткілікті техникалық экономикалық көрсеткіштерге
жетуін қамтамасыз ететін негізгі нормативті техникалық құжат.
27.
Өнімнің өңделу сатысына, оны өндіру технологиясын меңгеру дәрежесіне немесежүргізілетін жұмыстың мақсатына байланысты технологиялық регламенттер келесі
түрлерге бөлінеді:
1.Лабораториялық регламент
2.Өндірістік тәжірибелік регламент
3.Іске қосу регламент
4.Өндірістік регламент
5.Типтік өндірістік регламент
Лабораториялық регламент — жаңа өнім түрі өндірісінің технологиясын немесе
сериялы шығарылатын өнімнің жаңа технологиялық тәсілін лаборатория жағдайында
жасаудағы ғылыми жұмыстарды аяқтаумен бітетін технологиялық құжат.
Өндірістік — тәжірибелік регламент — оның негізінде жаңа өнім түрі өндірісінің
технологиясын іске қосу және жаңа технологияяны меңгеруде өндірістік тәжірибелік
жұмыстарды жүргізу іске асырылатын технологиялық құжат.
Іске қосу регламент — оның негізінде жаңадан жасалынған өнім өндірісін меңгеру
және эксплуатацияға енгізу жүргізілетін технологиялық құжат.
Өндірістік регламент — жұмыс істеп тұрған сериялы өнім шығарушы өндірістің
технологиялық құжаты. Өндірістік регламент іске қосу регламенті негізінде оған өндірісті
меңгеруде қабылданған өзгерістер мен толықтыруларды енгізген соң құрастырылады.
Өндірістік регламент негізінде өнімнің сериялы шығарылуы меңгеріледі.
Типтік өндірістік регламент — өндірістің типтік технологиялық тәсілдерін, біртекті топ
өнімдерін өндіру прцесі үшін техникалық құралдарды, жұмыстарды жүргізу қауіпсіздігі
мен алдыңғы қатарлы техникалық экономикалық көрсеткіштерді қамтамасыз ететін,
нормалар мен нормативтерді бекітетін жетекші нормативті құжат.
28.
ДДТ ірі көлемде шығару жағдайлары.Дайын дәрі дәрмектер химиялық фармацевтік зауыттарда, бірлестіктерде,
фармацевтік кіші өндірістерде жасалып шығарылады.
Қазіргі уақытта республикамызда дәрілік құралдар өндіру нан астам
мамандандырылған өндіріс орындарында ұйымдастырылған.Дайын дәрі
дәрмек дәріхана рецептурасының 80% — дан астам бөлігін құрайды. Кейбір
дамыған елдерде бұл сан 95% — ға дейін көтерілген.
Өндірістік дәрежеде дайын дәрілерді жаппай шығару үшін міндетті алдын- ала
шарттар керек. Мұндай шарттар болып:
1) осы дәріні жаппай қолдану, яғни, өндірістің тиімділігін қамтамасыз ететін
осы өнімге деген жоғарғы сұраныс;
2)дайындалған өнімнің жеткілікті сақталуы, яғни, қолдану мерзімінің ұзақтығы.
Себебі, аяққы өнім тұтынушыға белгілі уақыт аралығы өткен соң жетеді.
Шикізат пен қосымша материалдар өндіріске бірден келіп түспейді. Сонымен
қатар, дайын өнім қоймаларында дәрілерге сұранысты үздіксіз қамтамсыз етіп
отыру үшін олардың жетклікті қоры болуы керек. Сақтау кезінде препарат
өзінің терапевтік әсерін төмендетпеуі немесе жоғалтпауы керек. Дәрілік
препараттардың қолданылу мерзімін ұзарту үшін зауыттық жағдайда әртүрлі
технологиялық операциялар қолданылады: тұрақтандыру, лиофилизация,
қорғаушы қабықшалармен қаптау, концервация, орауыштардың арнайы
түрлерін қолдану және т.б.
3)дәрілік құралды сенімді стандарттау мүмкіндігі. Бір текті өнім шығару үшін
бастапқы шикізат пен аяққы өнім стандартты болу керек. Олар нормативті
теникалық құжаттардың талаптарына сәйкес болуы тиіс. Зауыттық жағдайда
стандарттау дәрілік құрал өндірісінің әр сатысында жүргізіледі.
29.
Дайын дәрілік түрлерді өндірудің артықшылықтары:1)дәріханадан дәрілерді жіберуді жылдамдатады, бұл
әсіресе, әртүрлі эпидемиялар шыққан кезде өте маңызды;
2)дәрінің сапасын көтереді, өйткені, өндіріс жағдайында дәрі
дайындауда оның сапасын технологиялық процестің әр
сатысында тексеріп отырады;
3)дәрі дәрмектерді дәріханаларда жеткізу олардың жинақты
болуына байланысты, жеңілденеді;
4)дәрінің өзіндік бағасы төмендейді;
5)дәрі түрлерінің ассортиментін кеңейту, бұл олардың ішінен
ең тиімдісін таңдауға мүмкіндік береді;
6)дәрілік заттардың тиімді әсерін қамтамсыз етеді;
7)дәрілік құралдардың сапасы жоғарылайды, олардың
қолданылу мерзімі ұзарады, сақтау және тасымалдау
жағдайлары жақсарады;
8)алдыңғы қатарлы технологиялар енгізіледі және
технологиялық процестерді бақылау сапасы жоғарылайды;
9)технологиялық процестердің комплексті механизациясы
мен автоматизациялануы .
30.
іздің мемлекетіміздің дәрі- дәрмектерге деген сұранысыжылына 300 млн. Доллар бола тұра, қолда бар қуаттар тек 3%ын ғана қамтамасыз етті. Қалғандары таяу (55%) және алыс
(42%) шетелдерден импортталды. Сөйтіп денсаулық сақтау ісі
шетелден дайын препараттар сатып алу үшін валюта
қаражатының болуына 97% тәуелді болды
Қазіргі кезде отандық фармацевтік өнеркәсіптерде дәрілік
құралдардың 6%- ға жуық бөлігі шығарылады, оның ішінде
фармацевтік өнім 18 млн долларды, ал медициналық бұйымдар
9 млн долларды құрайды
Болашақта Қазақтан Республикасы ірі фармацевтикалық
кәсіпорындар салады деп ойлаймын. Ол үшін қазіргі таңда 2050
бағдарламасы бойынша бірнеше кәсіпорындар Шымкент,
Алматы қалаларында салуды жоспарлап отыр. Біздер технолог
ретінде сол кәсіпорындардың дамуына үлес қосамыз деген
сенімдемін. Дәрілер өндірісінің болашағы зор және айқын.
31.
32.
GMP («Good Manufacturing Practice»)GMP стандарты (Өндірістің тиісті тәжірибесі/ Надлежащая
производственная практика) – жоғары сапалы және қауіпсіз
өнім шығарылуын қамтамасыз ету үшін өндіріске қатысты
нормалар, ережелер мен нұсқаулықтар жүйесі. GMP
стандарты
толық
бастаманы
бейнелейді,
өндіріс
параметрлерін және зертханалық тексерісті реттейді, әрі
бағалайды.
33.
GMP стандарттарын енгізуге дайындық 2007 жылдан басталды. Ең алғашқы қадамретінде 2011 жылы мекемеде ИСО 9001:2009 стандарттары – Дәрілік заттар жасау,
өндіру мен айналымға шығару саласындағы сапа менеджмент жүйесі енгізілді.
2014 жылы компания ҚР Денсаулықсақтау мен әлеуметтік даму министрлігінің
медициналық және фармацевтикалық қызметті бақылау комитетінің
инспекциясынан сәтті өтіп, ҚР СТ 1617-2006 «Дәрілік заттар өндірісі. Тиісті
өндірістік тәжірибе. Негізгі ережелер» GMP мемлекеттік ұлттық стандарттарына
сәйкестік туралы қорытынды алды.
GMP талаптарына сәйкестік сертификациясына дайындық үлкен, әрі күрделі
жұмыстарды талап етті. Өндірістік орындар GMP стандарттарының талаптарын
ескеріп жобаланып құрылды, қазіргі заманғы қондырғылар квалификациядан өтті,
өндіріс үрдісінің валидациясы жүргізілді, ішкі нормативті құжат жасалды, ұйымның
ұйымдастырушылық құрылымы ойластырылды.
Жоғары квалификацияланған персонал маңызды рөл атқарды. Үнемі ішкі және
сыртқы оқыту арқылы компания қызметкерлері шығарылатын өнімнің тұрақты
сапасын қамтамасыз ету үшін GMP енгізілуіне үлкен жауапкершілікпен қарады.
Орындалған жұмыстың нәтижесі ретінде күшіне ие жүйенің тиісті өндірістік
тәжірибе талаптарына сәйкес тиімді және нәтижелі қызмет етуі саналды.
Компанияның жақын арадағы жоспарында – ЕАЭС елдерінің нарығына шығу,
өндірістің толық циклын жүзеге асыру. Бұл мақсаттарға жету үшін 2015 жылдан
бастап өзінің өсімдік шикізатын өсіру бойынша плантацияны арттыру көзделді.
Мәдени өсіру мен жинаудың тиісті тәжірибесінің негізгі ұстанымдары (GACP):
мәдени өсіру, жинау, кептіру, ұсақтау, өсімдік материалының жоғары сапасын және
биологиялық белсенді заттардың тұрақты құрамын қамтамасыз етуде маңыздысы –
дәрілік шикізатты сақтау енгізілуде.
34.
35.
САПАНЫ ҚАМТАМАСЫЗ ЕТУ БӨЛІМІ «БІЗ САПАНЫ БАҚЫЛАМАЙМЫЗ, БІЗБАСҚАРАМЫЗ!»
Компанияның сапаны қамтамасыз ету концепциясына кіреді:
Персоналды үздіксіз оқыту
Сенімді жеткізушілерден шикізат пен материалдарды сатып алу
Айқаспа контаминацияны болдырмайтын бөлмелер
GMP талаптарына сәйкес қондырғылар
Құжаттандырудың бірыңғай жүйесі мен оның таралуын бақылау
Материалдар, аралық өнім, дайын өнім, қондырғылар, өндірістік мекеме
статусын өзгерту мен идентификациялау жүйесі
Валидация жүргізу тәртібі және өндіріс мониторингі
Өзгерістерді бақылау жүйесі
Сәйкессіздіктерді қарастыруды ұйымдастыру және жүргізу
Ішкі және сыртқы аудиттер жүргізу, түзетуші әрекеттерді бақылау
Тәуекелдерді бағалау
Фармакобақылау бойынша іс-шараларды ұйымдастрыу
36.
«Антибиотик» сөзі грек тілінен аударғанда «autі» — қарсы және «bіos» — тіршілікдегенді білдіреді. Антибиотиктер микроорганизмдердің өсуін, көбеюін тежейтін
өсімдіктер мен жануарлар жасушасынан алынған органикалық зат. Олар әртүрлі
бактерияларға байланысты туындаған инфекцияларды емдеу кезінде қолданылады
және адамның барлық ағзаларына күшті әсерін тигізеді. Әсіресе, ауыр
инфекциялық аурулардан зардап шеккендер осы дәрі түрі арқылы ғана сауыға
алады. Алайда, бұл кез келген сырқатты жазуға көмектеседі дегенді білдірмейді.
Бірақ бүгінде ауырғанның бәрі антибиотиктің көмегіне жүгінетін болды. Ал дәріні
жүйесіз қолдану денсаулыққа қауіп төндіретіні анық.
Антибиотиктерді өз еркімен жиі пайдалану ағзаның микробтарға қарсы
препараттарға төзімділігін (резистенттілігін) арттырып, антибактериалды дәрілік
заттардың инфекциялық ауруларға қарсы тиімсіз болуына әкеліп соғады.
Дәрігер антибиотиктерді қолданғанда оның сапасына да ерекше мән беру керектігін
айтады. Оның ішінде түпнұсқа дәрілерді пайдаланған жөн. Алайда, қазір
дженериктер өтімді болып тұр. Ал дженерик дегеніміз — патенттік мерзімі аяқталған
дәрілердің өндірісі. Мәселен, дәрі жасап шығарушы жаңа дәрі ойлап тапқанда,
оны алдағы жиырма жыл ішінде өндіріп, сатуға тыйым салатын патентті иеленеді.
Сөйтіп, түпнұсқа дәрілерді шығарады. Ал жиырма жылдан соң патент мерзімі
аяқталып, дәріні шығаруға басқалар да мүмкіндік алады. Сөйтіп, дәрінің формуласы
өзгереді. Технологияны жетілдіруге көп шығын жұмсалмайтындықтан, әлгі дәрі дәл
сондай сапамен шықпауы ықтимал. Бірақ дженериктердің бағасы сәл арзан.
Түпнұсқа дәрілерді Ұлыбритания, Швейцария, Голландия елдері шығарса,
дженериктерді өндіруде Қытай мен Үндістан алда келеді.
37.
38.
Качество лекарственного средства - ?Качество определяется требованиями фармакопейной статьи
39.
Как обеспечивается качество ЛС?Таким образом, единственной общепризнанной в мире системой
обеспечения КАЧЕСТВА ЛС является система надлежащих практик на
всех этапах жизненного цикла медикаментов
40.
Жизненный цикл лекарственного средства имедицинского изделия
Фармацевтическая
разработка
Уничтожение
Доклинические
исследования
26.08.2015 г № 687
1
15
Реклама
27.02.2015 г №105
29.05.2015 г №415
27.05.2015 г №392
2
GLP
14
Закуп
30.10.2009 г № 1729
08.07.20015 г № 515
Мониторинг цен
22.05.2015 г № 639
Фармаконадзор
29.05.2015 г №421
27.05.2015 г №392
Розничная
реализация
14.09.2015 г № 713
27.05.2015 г № 392
Клинические
исследования
19.11.2009 г №744
27.05.2015 г №392
3
Производство
и ввоз/вывоз
GСP
13
GMP
12
4
5
GRP
в разработке
11
GVP
6
GPP
10
GSP
GDP
в разработке
9
8
Оптовая реализация
(дистрибуция)
14.09.2015 г № 713, 27.05.2015 г № 392
7
17.08.2015 г №668
27.05.2015 г №392
Регистрация/
Экспертиза
18.11.2009 г
№ 735/736
Фармацевтические
инспекции
19.11.2009 г № 742
Оценка
безопасности
и качества
26.11.2014 г № 269
Прослеживание
40
41. Стандарт GMP
• система норм, правил и указаний вотношении производства лекарственных
средств, медицинских устройств, изделий
диагностического назначения, продуктов
питания,пищевых добавок и активных
ингредиентов
• отражает целостный подход и регулирует и
оценивает собственно параметры
производства и лабораторной проверки.
42.
Впервые требования GMP были сформулированы в 1963 г. в США;1968 г. в Италии и Канаде,
1969 г. в Сингапуре и Швеции,
1971 г. - в Австралии, Великобритании, Норвегии, Польше,
1974 г. - на Филиппинах.
1971 г. первый международный симпозиум по GMP
(Международная федерация ассоциаций производителей лекарств (IFPMA)
1989г. в России ОСТ 42-510-98 «Правила организации производства и
контроля качества лекарственных средств (GMP)»
2004 г. Госстандартом России принят национальный стандарт Российской
Федерации ГОСТ Р 52249-2004 «Правила производства и контроля качества
лекарственных средств»
43. GMP носят системный и преду-преждающий характер
GMP носят системный и предупреждающий характерПроизводство лекарственных средств должно иметь
все необходимые условия включая:
• квалифицированный персонал;
• достаточные и пригодные для работы помещения;
• соответствующее оборудование;
• надлежащие исходные материалы;
• утвержденные технологические регламенты и
инструкции;
• подходящие условия складирования и транспорт;
• достаточные возможности и ресурсы для проведения
контроля качества
• ключевые стадии производственных процессов четко
определены, описаны и валидированы
44.
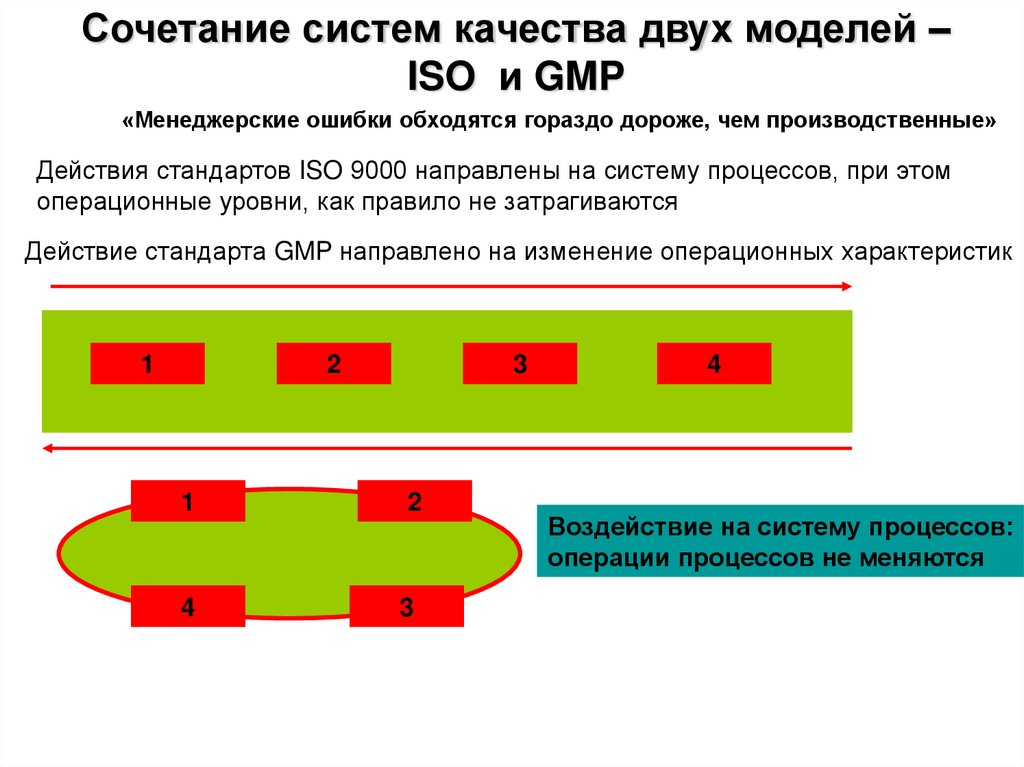
Сочетание систем качества двух моделей –ISO и GMP
«Менеджерские ошибки обходятся гораздо дороже, чем производственные»
Действия стандартов ISO 9000 направлены на систему процессов, при этом
операционные уровни, как правило не затрагиваются
Действие стандарта GMP направлено на изменение операционных характеристик
1
2
3
1
2
4
3
4
Воздействие на систему процессов:
операции процессов не меняются
45.
Вид гранулята в зависимости от технологии иоборудования для его приготовления
при проведении влажного
гранулирования на смесителях
с последующей сушкой на
полочных сушилках и размолом
и на грануляторах типа фирмы
Глатт, Болле или Занкеты
меняются свойства гранулята,
что может в дальнейшем
сказаться на ческих свойствах
таблетки.
Изменение операционных характеристик процесса
46.
47.
48.
■ Лабораториялық регламентКездейсоқтықты болдырмау мақсатында дәрілік заттарды шығаратын өнеркәсіп
мекемелерде өндіріс үдерісі анықталған нақты нұсқаулықтармен қарастырылған
стандартты жағдайларда жүргізіледі. Барлығы бір жинақты құжатқа біріккен – реттеме.
Өндірістің технологиялық реттемесі (лат. тәртіпке салу, реттеу) – бұл өндіріс әдістерін,
технологиялық нормативтерді, техникалық амалдарды, химико-фармацевтикалық өнімдерді
өндірудегі технологиялық үрдістерді жүргізу жағдайлары мен реттерін, сапа көрсеткіштері
фармакопеялық құжат талаптарына сәйкес келетін дәрілік затты алуды қамтамасыз ететін
орнатушы нормативті құжат. Сонымен қатар қауіпсіз жумыс жүргізуді және нақты
өнеркәсіптің оптималды технико-экономикалық көрсеткіштерге жетуді
орнататын
қДәрілік заттың өндіріс реттемесін негізгі технологиялық құжат ретінде келесі жағдайларда
қолданылады: әзірлеу және өндіріске жаңа дәрілік заттарды енгізу үрдістерінде
технологияны өңдеу кезінде; қауіпсіздік техникасы, өнеркәсіптік санитария және өртке
қарсы шаралар бойынша өндірістік нұсқаулық құрастыру кезінде; өндірістік қалдықтарды
жою, өндірістік ағынды суларды және атмосфетаға шығарылатын ластануларды
залалсыздандыру және тазалау бойынша іс-шараларды құрастыру және жүзеге асыру
кезінде; технико-экономикалық нормативтерді, сонымен қатар шикізаттар мен
материалдардың шығындалу нормасын орнату кезінде; өнеркәсіптік өндірісті жобалау үшін
бастапқы деректерді дайындау кезінде. ұжат.
49.
Дәрілік заттың өндіріс реттемесін негізгі технологиялық құжат ретінде келесі жағдайлардақолданылады: әзірлеу және өндіріске жаңа дәрілік заттарды енгізу үрдістерінде
технологияны өңдеу кезінде; қауіпсіздік техникасы, өнеркәсіптік санитария және өртке
қарсы шаралар бойынша өндірістік нұсқаулық құрастыру кезінде; өндірістік қалдықтарды
жою, өндірістік ағынды суларды және атмосфетаға шығарылатын ластануларды
залалсыздандыру және тазалау бойынша іс-шараларды құрастыру және жүзеге асыру
кезінде; технико-экономикалық нормативтерді, сонымен қатар шикізаттар мен
материалдардың шығындалу нормасын орнату кезінде; өнеркәсіптік өндірісті жобалау үшін
бастапқы деректерді дайындау кезінде. Бастапқы (уақытша) реттеме – бұл технологиялық
құжат болып табылады, оның негізінде дәрілік препараттың жаңадан шығарылған
өнеркәсіптік өнімін пайдалануға енгізу мен дәрілік заттың жаңадан құрылған өнеркәсіптік
өнімін игеру. Оны тәжірибелі-өнеркәсіптік реттеме және осы өнімді өндіруге жобалау
құжаттары негізінде құрады, сондай-ақ нақты қолданыстағы өндіріс негізінде жүзеге
асырылады. Өнеркәсіптік реттемелер дәрілік заттың ағымдағы сериялық өндірісінің
технологиялық құжаты болып табылады. Өндірісті дамыту кезінде қабылданған өзгерістер
мен толықтырулар енгізілгеннен кейін іске қосу рәсімінің негізінде жасалады. Типті
реттеме - бұл өндiрiстiң стандартты технологиялық әдiстерiн, нормалар мен нормативтерін,
өнімнің біртекті топтарын өндіру үрдістері үшін техникалық тәсілдерді орнататын
басқарушы нормативті құжат, мысалы, таблеткалар, капсулалар, инъекциялық ерітінділер
және т.б. Типтік реттемелер үлгілік реттеме әзірленген біртекті өнімдер санынан нақты
дәрілік препаратты өндіру үшін барлық санаттағы технологиялық реттемелерді дайындауға
бағытталады.
50.
GSP ережелері - Good Storage PracticeДәрілік заттардың сапасына сенімді кепілдік беруге болады, егер өндіріс
циклінің барлық кезеңдерінде бардық ережелері қатаң сақталса, атап айтқанда,
алдын-ала
клиникалық
және
клиникалық
зерттеулерде,
өндірісте,
фармацевтикалық өнімдерді көтерме және бөлшек сатуда. GLP, GCP, GMP, GDP,
GPP - халықаралық талаптар аса маңызды рөл атқарады. фармацевтикалық
сектордың қызметкерлерінің қызметінде ерекше мәнге ие GSP талаптары - дәрілік
заттарды сәйкес сақтау тәжірибесі. Қазіргі уақытта осы сапа стандартын зерттеу
және сақтау фармацевтикалық бизнестің өте өзекті міндеті болып табылады.
Фармацевтикалық материалдарды және өнімдерді сақтау және тасымалдау
олардың айналымының барлық кезеңдерінде жүреді және осы операцияларға фарм
Сондықтан GSP стандарттарына сәйкес келетін дәрілік заттарды сақтау үшін
ұлттық немесе ең болмағанда ішкі компания стандарттарын жасамай, оны
тәжірибеде сақтамай, дәрілік заттардың сапасы, қауіпсіздігі және тиімділігі туралы
сеніммен айту мүмкін емес. Сарапшылардың пікірі бойынша фармацевтикалық
нарық қатысушылары ішкі GDP стандартын әзірлеу және қабылдау көтерме сауда
буынының жұмысының сапасын арттыруда оң рөл атқаруы мүмкін.ацевтикалық
нарықтың барлық қатысушылары қатысады.
51.
GDP -нің негізгі қағидалары - Жақсы тарату тәжірибесі (фармацевтикалықөнімдерде көтерме сауданың тиісті деңгейіне қатысты ережелер) келесі ережелер
болып табылады. Индустриалды дамыған елдерде фармацевтика өнеркәсібі GMP
талаптарына сай келетін дәрі-дәрмектердің жоғары сапасына кепілдік береді.
Еуропалық Одақ елдерінде АҚШ, Канада, Жапония және басқа да бірқатар
фармацевтикалық өнімдер егер ол белгілі бір талаптарға сәйкес жүзеге асырылса
ғана сатуға жіберіледі. Бұл саясат сатуға шығарылған өнімдердің тиісті сапаға ие
болуын қамтамасыз етеді. Фармацевтикалық препараттарды жоғары сапалы
деңгейде сақтау керек, өйткені сатуға рұқсат етілген дәрілік заттар олардың
қасиеттерін өзгертпей көтерме және бөлшек сатылады. Фармацевтика
өнеркәсібінде сапаны басқару тұжырымдамасы GMP нұсқаулығында сипатталған
және мүмкіндігінше дәрілік заттарды сатуда қолданылуы керек. Бұдан басқа,
фармацевтикалық өнімдердің сапасын және көтерме саудагерлердің қызмет
көрсету деңгейін ұстап тұру үшін олар GDP қағидалары мен ережелерін қолдануы
керек.
Дәрілік заттардың дистрибьюторларымен (көтерме саудагерлерімен)
қолданылатын сапа жүйесі заңнамаға сәйкес пайдалануға рұқсат етілген дәрілік
заттардың сақталуын қамтамасыз етуі керек, барлық сақтау шарттары әрдайым
құрметтеледі, соның ішінде тасымалдау кезіндегі ластану мен ластаудың алдын
алу жөніндегі шаралар қабылданады, фармацевтикалық өнімдер қорының барабар
айналуы бар және өнім қауіпсіз және сенімді сақтау орындарында сақталады.
Нашар өнімдерді қайтару жүйесі және есірткіге қарсы тиімді схема болуы керек.
52.
GDP ережелері қызметкерлерге қойылатын талаптарды белгілейді, құжаттардыресімдейді (тапсырыстар, мәмілелер, есептер), үй-жайлар мен жабдықтар,
клиенттерге жеткізілімдер, өнімдерді қайтару (сенімді және ақаулы), өзін-өзі тексеру
және т.б. Сақтау және тасымалдау шарттары GSP стандартында толығырақ
сипатталады, онда фармацевтикалық өнімнің бастапқы сатысында өндірістен
тұтынушыға дейінгі бастапқы сапасының сақталуын қамтамасыз ететін нақты
талаптар бар. Фармацевтикалық препараттарға арналған жақсы сақтау тәжірибесі
туралы нұсқаулық мамандарға фармацевтикалық өнімдерді сақтау, тасымалдау
және тарату үшін негізгі талаптар жиынтығын ұсынады. Ол ДДҰ басшылығымен
өзара байланысты:
- Good trade and distribution practice (GTDP) of pharmaceutical starting materials
(сауда ұйымдастыру және бастапқы фармацевтикалық материалдарды тарату
ережелері)5; The stability testing of pharmaceutical products containing wellestablished drug substances in conventional dosage forms (information given in
connection with regulation for marketing authorization) (әйгілі дәрілік заттар бар
әдеттегі дәрілік формалардағы фармацевтикалық өнімдердің тұрақтылығын
тексеру (есірткіні тіркеуге байланысты ақпарат)
- ;
Good
manufacturing
practices
(GMP);
The
cold
chain,
especially for vaccines and biologicals (суық тізбегі, әсіресе вакциналар мен басқа
биологиялық
өнімдер
үшін);
The
International
Pharmacopoeia
(халықаралық фармакопея).
53.
САПАНЫ БАҚЫЛАУ фармацевтика өнеркәсібінде
54.
Дәрілік заттардың сапасын қамтамасыз ету жүйесі:
Өнім барлық талаптарға және стандарттарға сәйкес келеді;
Өндіріс пен бақылау бойынша барлық операциялар стандартты ережелерге
сәйкес айқын түрде ресімделеді;
жауапкершілік пен өкілеттілік қатаң анықталған;
шикізат пен буып-түю материалын өндіру, жеткізу және пайдалану бойынша
шаралар қабылданады;
Аралық өнімдер мен технологиялық процестерді бақылау, сондай-ақ валидация;
дайын өнімді бақылау және тексеру стандарттар мен заңнаманың талаптарына
сәйкес жүзеге асырылады;
сапаны қамтамасыз ету жүйесінің тиімділігі мен жарамдылығын үнемі
бағалайтын өздігінен тексеру және / немесе сапаны тексеру рәсімі жүргізіледі.
55.
GMP (Good Manufacturing Practice, Жақсы өндірістік тәжірибе) - адамдарға
және жануарларға арналған дәрілік заттарды өндіру мен сапасын бақылауға
қойылатын талаптарды, сондай-ақ белсенді фармацевтикалық заттар мен
дәрілік заттардың белгілі бір түрлерін өндіруге қойылатын арнайы талаптар.
GMP стандарттары өндірістік көрсеткіштер мен зертханалық тестілеуді реттейді
және бағалайды.
GLP (Good Laboratory Practice, Жақсы зертханалық практика) - ұйымдық
үдерісті және денсаулық пен экологиялық қауіпсіздікпен байланысты дәрілік
заттарды клиникалық емес зерттеулерді жүргізетін сапалық жүйе.
GCP (Good Clinical Practice, Жақсы клиникалық практика) - адами тақырыпты
зерттеуді жоспарлау және жүргізу үшін халықаралық этикалық және ғылыми
стандарт, сондай-ақ осындай зерттеулер нәтижелерін құжаттау және ұсыну.
GSP (Good Service Practice, Қызметтің жақсы тәжірибесі, сақтау) фармацевтикалық өнімдерді дұрыс сақтау мен тасымалдауды қамтамасыз етуге
бағытталған шаралар кешенін белгілейді.
GDP (Good Distribution Practice, Көтерме сауданың жақсы практикасы) - дәрілік
заттарды сақтау сапасын қамтамасыз етуге бағытталған ережелер жүйесі.
GPP (Good Participatory Practice, Жақсы бөлшек сауда) дәріхана
қызметкерлерінің халыққа ұсынатын фармацевтикалық қызметтердің тиісті
сапасын қамтамасыз етуге бағытталған ережелер мен ережелер жиынтығы.
56.
GxP басқару жүйесін енгізу артықшылықтары:
дәрілік заттардың сапасы мен қауіпсіздігін қамтамасыз ету тәсілін өзгерту, бұл
ақауларды жою және тауардың қайтарылуынан шығынды азайтады;
дәрі-дәрмектердің қауіпсіздігін қамтамасыз ету бойынша жауапкершіліктің нақты
анықтамасы;
дәрі-дәрмектердің қауіпсіздігіне деген сенімнің құжатталған растауы, бұл
тұтынушымен жұмыс істеу кезінде ерекше маңызды, сонымен қатар сот
процестерінде;
шикізаттан тұтынушыға дейін есірткінің қауіпсіздігінің барлық параметрлерін
қамтитын жүйелі тәсілдерді қамтамасыз ету;
қауіпсіздікті басқару үшін ресурстарды үнемді пайдалану;
стандартты емес өнімдерді шығарумен байланысты қаржылық шығындарды
азайту;
өндірілетін дәрі-дәрмектердің сапасына тұтынушылардың сенімін арттыру;
тұтастай алғанда кәсіпорынның жұмысын қамтамасыз ету және, атап айтқанда,
басқару және бақылау жүйелерінің оңтайлы жұмыс режимі;
жаңа нарықтарға шығу және бар мүмкіндіктерді кеңейту;
ЕО елдеріне көптеген дәрілік заттарды экспорттау мүмкіндігі;
шетел инвесторларының инвестицияларға дайындығын арттырды;
сапалы және қауіпсіз дәрілік заттарды өндіруші беделін қамтамасыз ету.






















































 Медицина
Медицина Право
Право