Похожие презентации:
Презентация 7 хим тд
1.
Общая и неорганическая химияРаздел: Закономерности протекания
химических процессов
Тема: Химическая термодинамика
Химическое равновесие
2.
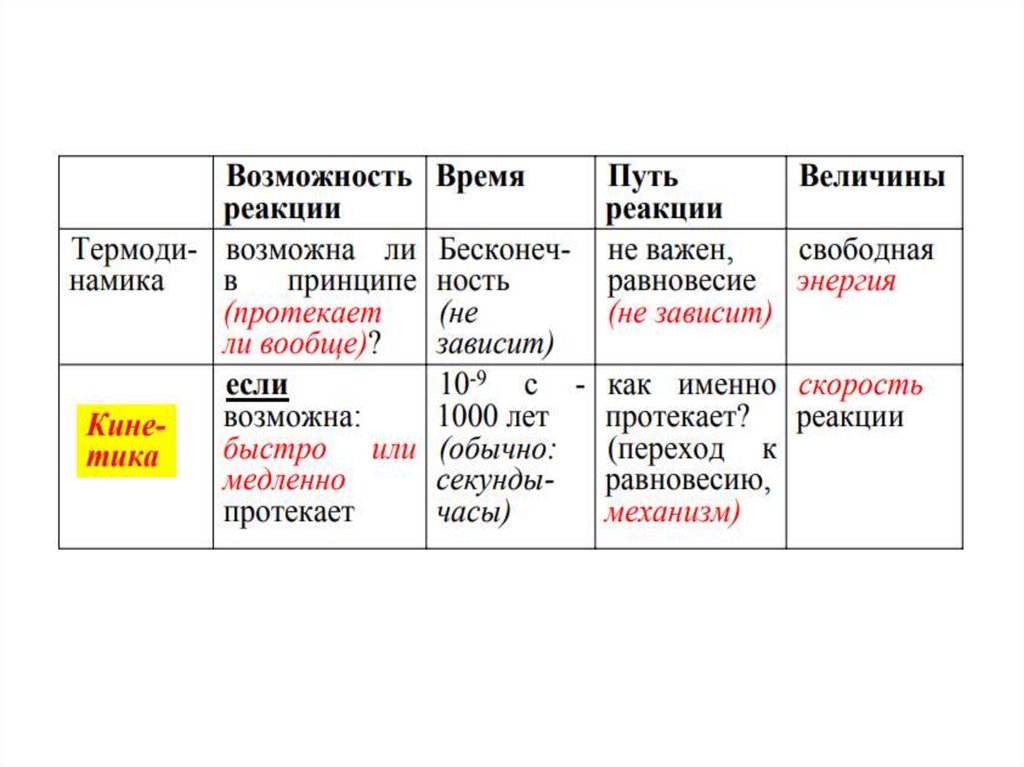
3. Химическая Термодинамика-изучает энергетические эффекты химических реакций, возможности их самопроизвольного протекания и
направления этих процессов, а также состояниеравновесия
В химической термодинамике системы
подразделяют на изолированные и
неизолированные:
- изолированная система – нет обмена энергией
с внешней средой;
- неизолированная система – обменивается
энергией с внешней средой – большинство
химических процессов неизолированные
4.
Классификация химических процессовТермохимия - раздел термодинамики, изучающий
выделение и поглощение тепла в химических
реакциях
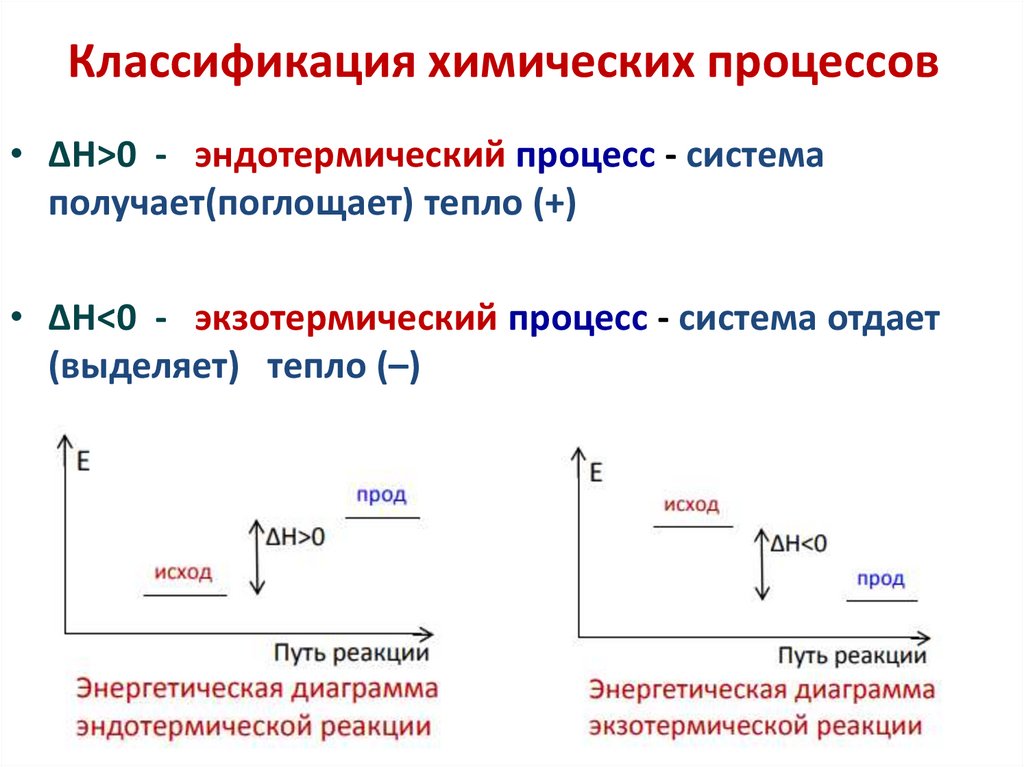
5. Классификация химических процессов
• ∆Н>0 - эндотермический процесс - системаполучает(поглощает) тепло (+)
• ∆Н<0 - экзотермический процесс - система отдает
(выделяет) тепло (–)
6. Уравнения химических реакций, в которых указывается количество вещества, агрегатное состояние, тепловые эффекты называются
термохимическими:Формы записи уравнений:
• 1 способ: термохимический
• А + В → С + D + Q, кДж
• Н2газ + 1/2О2газ → Н2Огаз +241,8 кДж
• 2 способ: термодинамический ∆Н= - Q
• ∆Н>0, тепло поглощается; эндотермический процесс
• ∆Н<0, тепло выделяется; экзотермический процесс
• А + В → С + D; - ∆Н, кДж
• Н2г + 1/2О2г → Н2Огаз ; ∆Н = - 241,8 кДж
• 2Н2г + О2г → 2Н2Огаз ; ∆Н= – 483,6 кДж
7.
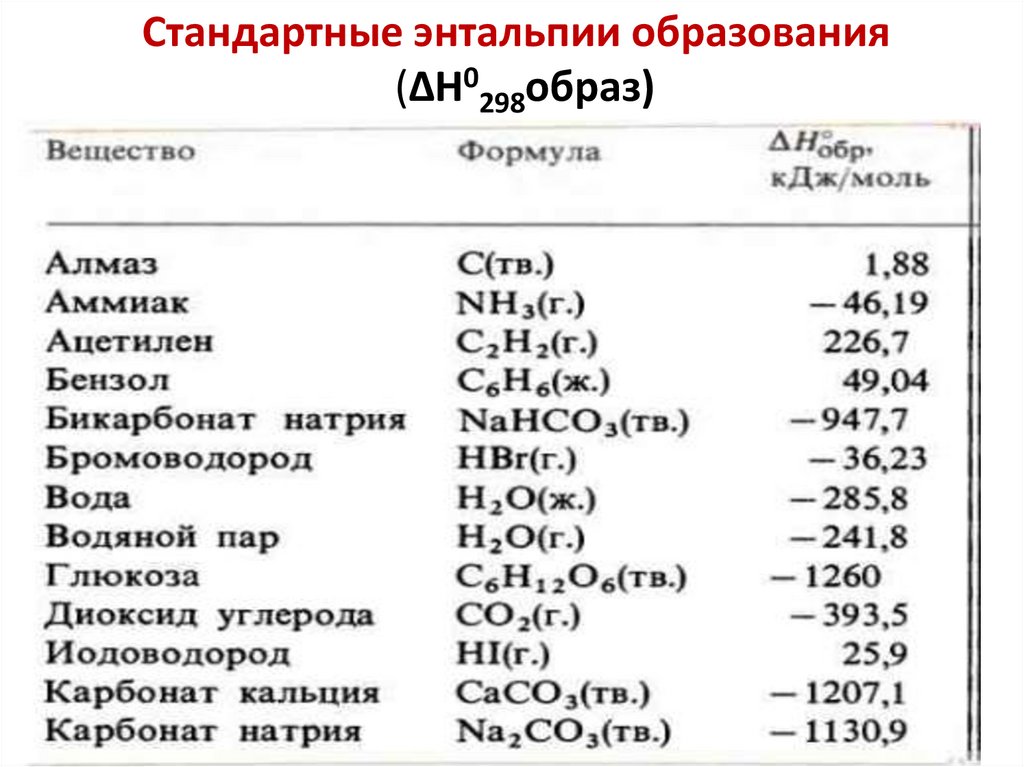
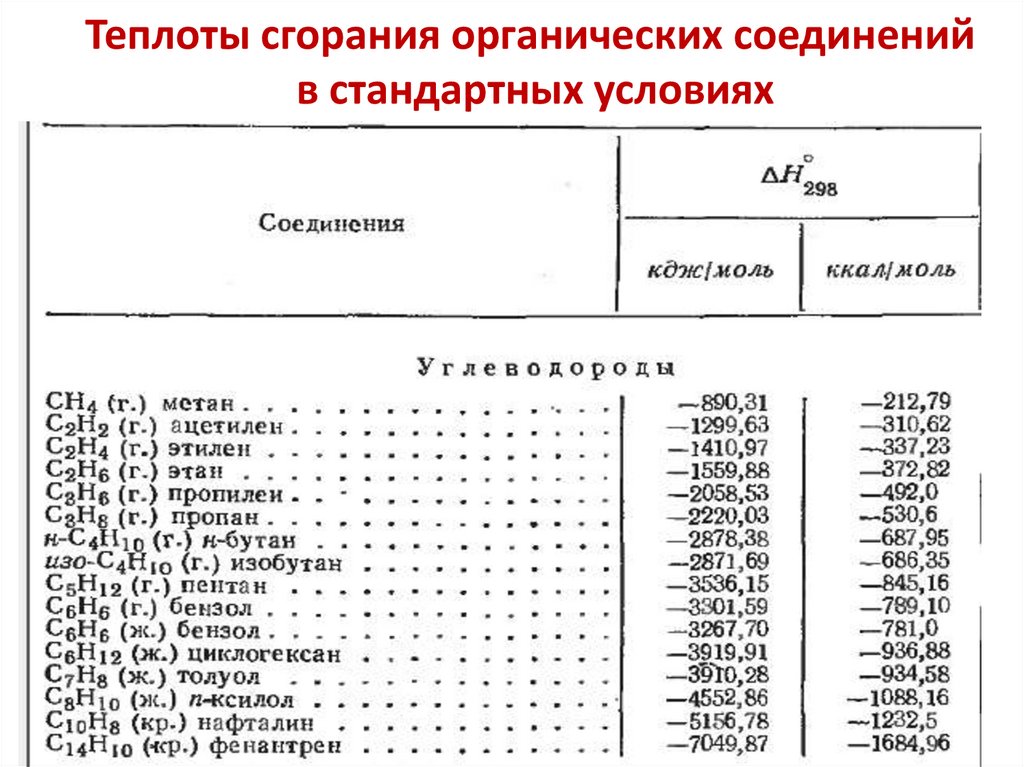
Расчеты по термохимическим(термодинамическим) уравнениям
Какое количество теплоты выделяется при сгорании
4,5 г метана, если при сгорании одного моля CH4
выделяется 890,25 кДж? Моль CH4 имеет массу 16,0 г.
ΔH = - 890,25 кДж
Решение: Выделяемое количество теплоты
равно













































 Химия
Химия








