Похожие презентации:
Лекция митохондрии 2025
1. Структура и функции митохондрий
Государственный научный центр Российской Федерации –Институт медико-биологических проблем Российской
академии наук
Структура и функции
митохондрий
Жидкова Ольга Владимировна
Лаборатория «Клеточной физиологии»
Москва – 2025
1
2.
Митохондрии. Основные характеристикиМитохондрии – двухмембранные органеллы округлой или вытянутой формы,
которые присутствуют в клетках практически всех эукариот
• Митохондрии сравнивают с энергетическими станциями клетки, т.к. они
отвечают за генерацию большей части необходимой энергии в виде АТФ
• Размер колеблется от 0,5 до 10 мкм
• Количество динамично меняется, составляет от 1 до 10 000 шт (могут занимать
до 25 % объема клетки), чаще митохондрии находятся в клетке в виде
митохондриальной сети, а не отдельных органелл
• Имеют 2 мембраны: наружную гладкую и внутреннюю складчатую
• Мембраны ограничивают 2 компартмента: межмембранное пространство и
матрикс
• Имеют свой собственный геном, представленный кольцевой ДНК (размер от 6
до 2900 тыс. пар оснований у разных видов)
2
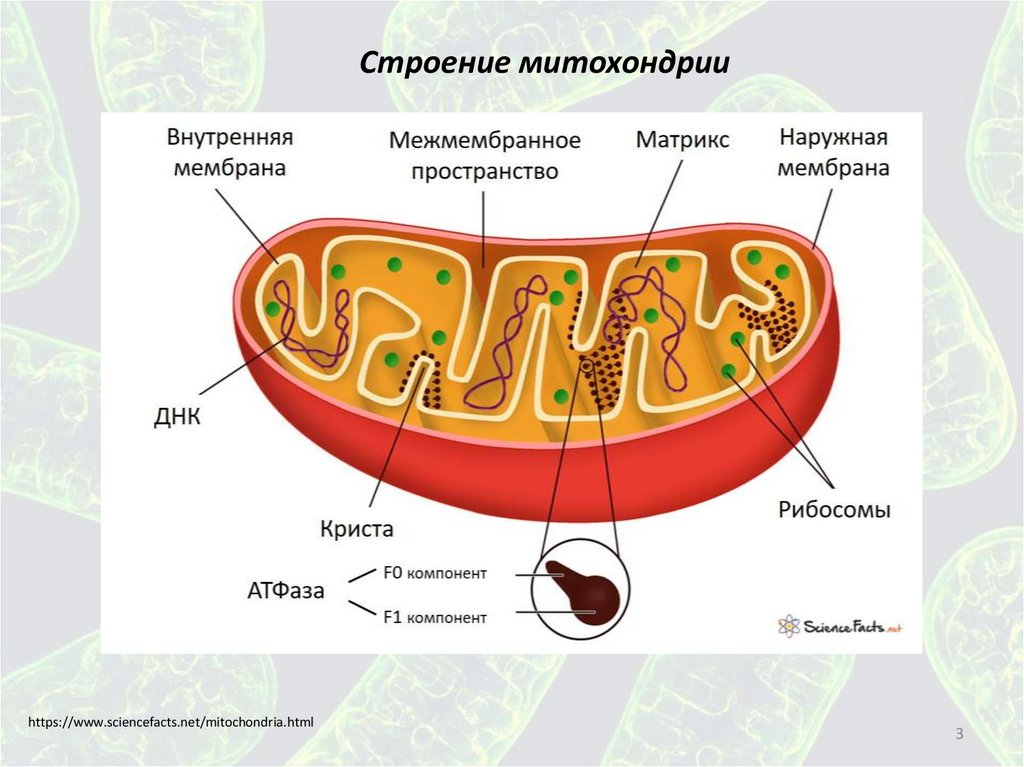
3.
Строение митохондрииhttps://www.sciencefacts.net/mitochondria.html
3
4.
Структура митохондрий• Наружная мембрана (содержит огромное количество порина,
проницаема для низкомолекулярных веществ (≤5 кДа), рецепторы
для митохондриальных белков )
• Внутренняя мембрана (содержит много кардиолипина,
транспортные белки, непроницаема для ионов, образует кристы)
• Кристы (включают ферменты дыхательной цепи, АТФ-синтазный
ферментный комплекс)
• Матрикс (содержит ферменты цикла трикарбоновых кислот, βокисления жирных кислот, мтДНК, рибосомы, тРНК)
• Межмембранное пространство
4
5.
Строение митохондрииНаружная мембрана
• Гладкая, по составу схожа с цитоплазматической мембраной клетки
• Состоит из липидов с вкраплениями белков (соотношение 2 : 1)
• Содержит огромное количество белка порина. Порин формирует каналы
размером 2-3 нм, проницаемые для низкомолекулярных веществ (менее
5кДа)
• Содержит транспортные белки для импорта крупных молекул (более
5кДа)
• Содержит рецепторы для митохондриальных белков
• Основная функция – ограничение митохондрии от цитоплазмы
5
6.
Строение митохондрииВнутренняя мембрана
Образует многочисленные гребневидные складки – кристы
Состоит в основном из белковых комплексов (соотношение белок:липид – 3:1, белки
составляют до 70% по весу)
Содержит белки дыхательной цепи и энергетического метаболизма (самые
многочисленные), переносчики и каналы, система импорта и созревания белков, белки
метаболизма липидов, нуклеиновых кислот и нуклеотидов, белки сигнальных каскадов,
белки биосинтеза железосерных кластеров и белки динамики и морфологии (самые
малочисленные)
Содержит кардиолипин – особый фосфолипид, делающий мембрану абсолютно
непроницаемой для всех анионов и катионов (в том числе протонов)
Транспорт необходимых веществ и неорганических ионов происходит при участии белковпереносчиков
Основная функция – разобщение матрикса и межмембранного пространства
6
7.
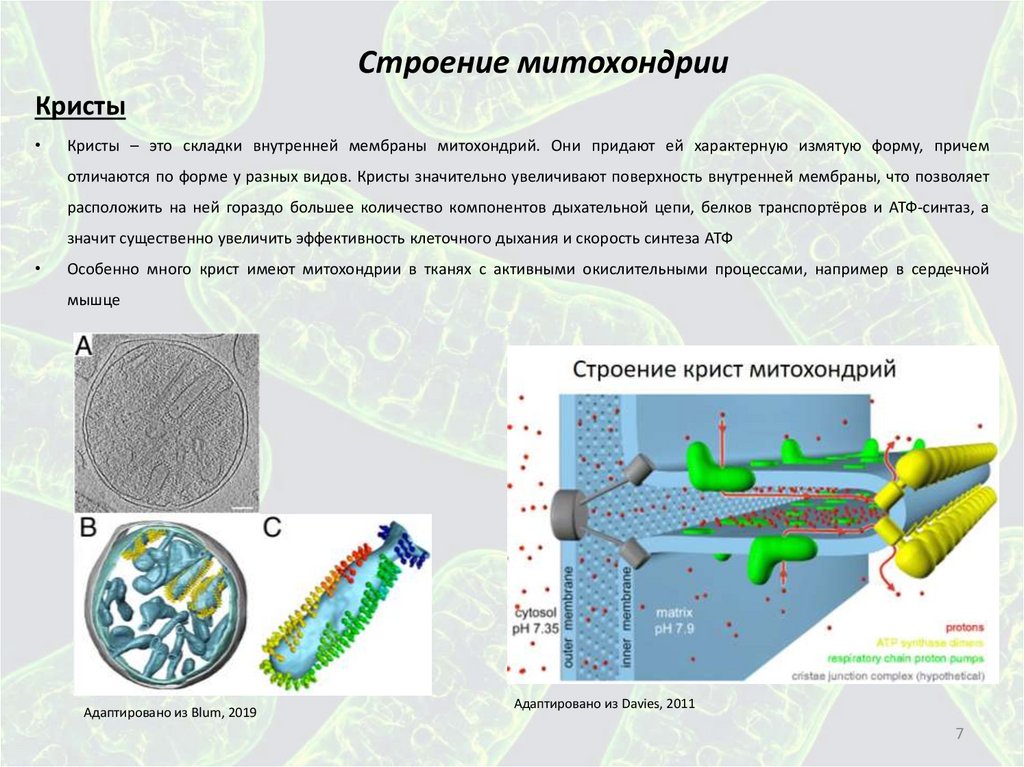
Строение митохондрииКристы
Кристы – это складки внутренней мембраны митохондрий. Они придают ей характерную измятую форму, причем
отличаются по форме у разных видов. Кристы значительно увеличивают поверхность внутренней мембраны, что позволяет
расположить на ней гораздо большее количество компонентов дыхательной цепи, белков транспортёров и АТФ-синтаз, а
значит существенно увеличить эффективность клеточного дыхания и скорость синтеза АТФ
Особенно много крист имеют митохондрии в тканях с активными окислительными процессами, например в сердечной
мышце
Адаптировано из Blum, 2019
Адаптировано из Davies, 2011
7
8.
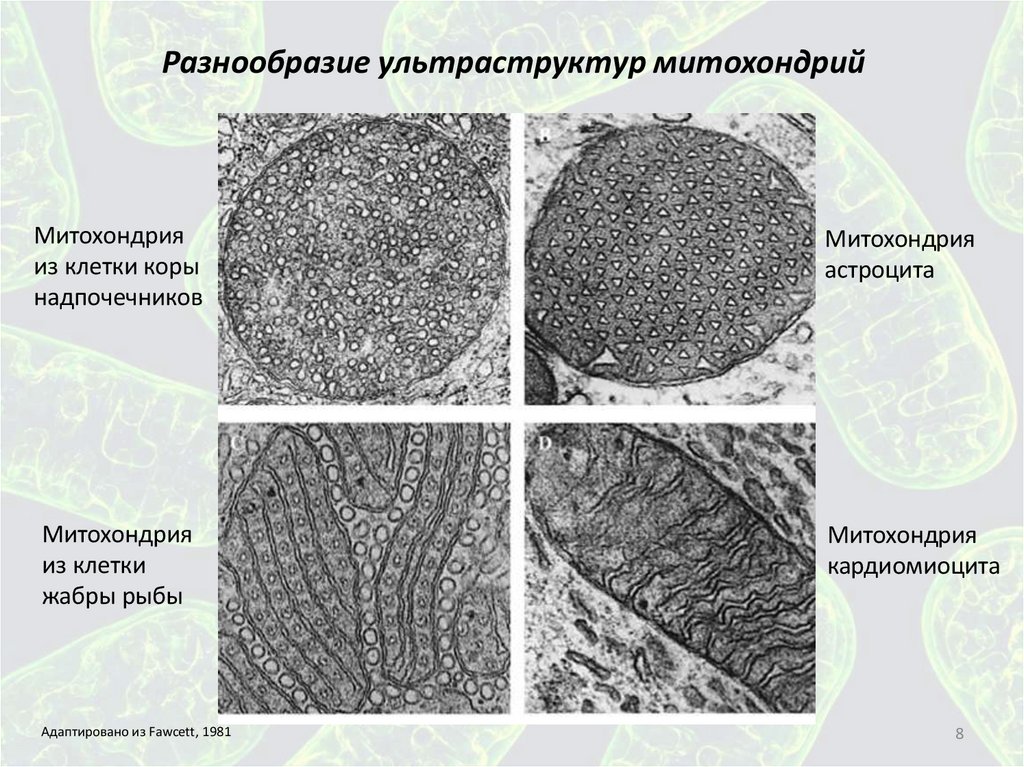
Разнообразие ультраструктур митохондрийМитохондрия
из клетки коры
надпочечников
Митохондрия
астроцита
Митохондрия
из клетки
жабры рыбы
Митохондрия
кардиомиоцита
Адаптировано из Fawcett, 1981
8
9.
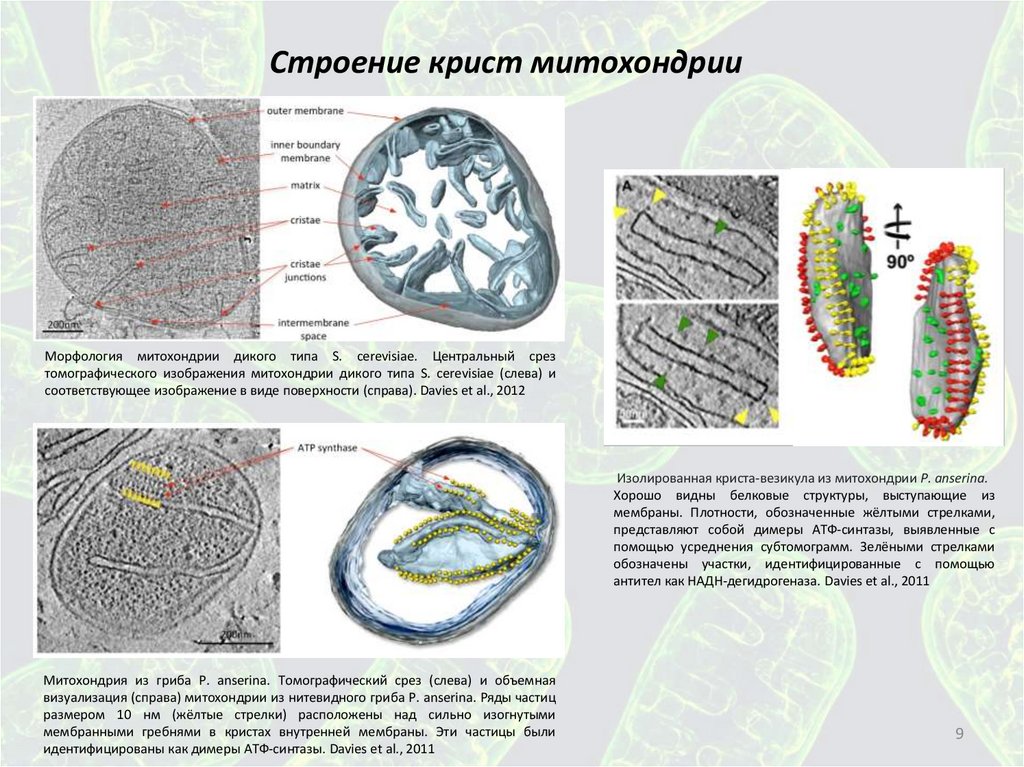
Строение крист митохондрииМорфология митохондрии дикого типа S. cerevisiae. Центральный срез
томографического изображения митохондрии дикого типа S. cerevisiae (слева) и
соответствующее изображение в виде поверхности (справа). Davies et al., 2012
Изолированная криста-везикула из митохондрии P. anserina.
Хорошо видны белковые структуры, выступающие из
мембраны. Плотности, обозначенные жёлтыми стрелками,
представляют собой димеры АТФ-синтазы, выявленные с
помощью усреднения субтомограмм. Зелёными стрелками
обозначены участки, идентифицированные с помощью
антител как НАДН-дегидрогеназа. Davies et al., 2011
Митохондрия из гриба P. anserina. Томографический срез (слева) и объемная
визуализация (справа) митохондрии из нитевидного гриба P. anserina. Ряды частиц
размером 10 нм (жёлтые стрелки) расположены над сильно изогнутыми
мембранными гребнями в кристах внутренней мембраны. Эти частицы были
идентифицированы как димеры АТФ-синтазы. Davies et al., 2011
9
10.
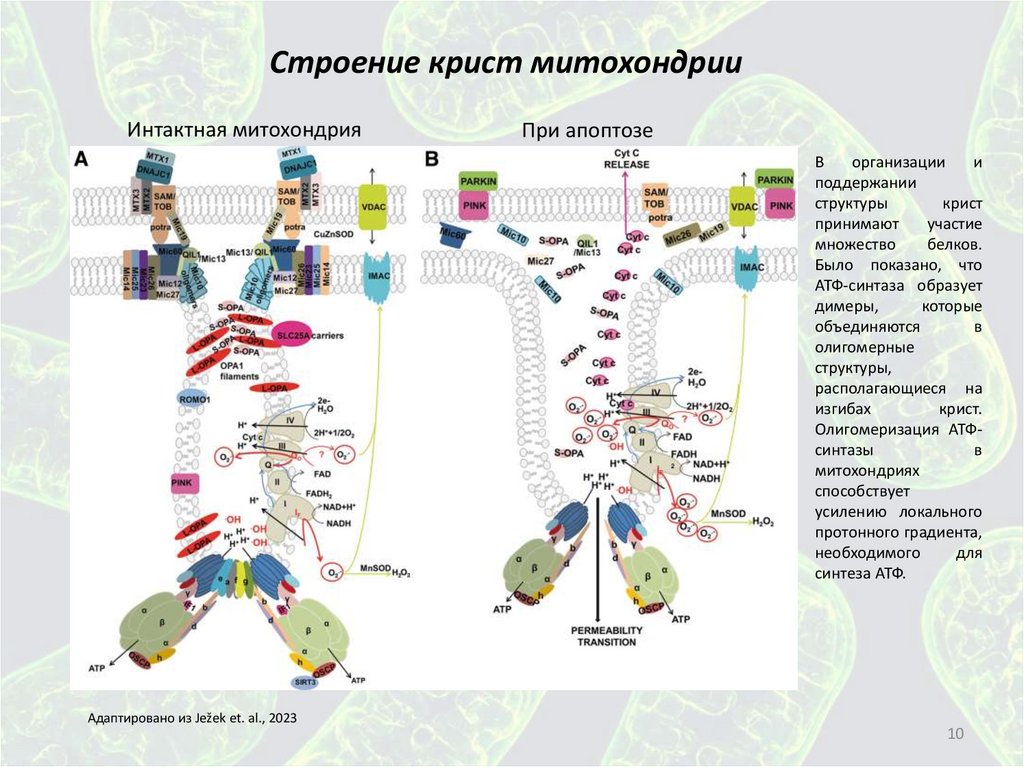
Строение крист митохондрииИнтактная митохондрия
При апоптозе
В
организации
и
поддержании
структуры
крист
принимают
участие
множество
белков.
Было показано, что
АТФ-синтаза образует
димеры,
которые
объединяются
в
олигомерные
структуры,
располагающиеся на
изгибах
крист.
Олигомеризация АТФсинтазы
в
митохондриях
способствует
усилению локального
протонного градиента,
необходимого
для
синтеза АТФ.
Адаптировано из Ježek et. al., 2023
10
11.
Строение митохондрииМежмембранное пространство
• Это пространство между наружной и внутренней мембранами митохондрии. Его
размер — 10-20 нм.
Матрикс
• Митохондриальный матрикс представляет собой тонкозернистое гомогенное
содержимое умеренной плотности, заполняющее внутренний компартмент
• Содержит тонкие собранные в клубок нити (~ 2-3 нм) и гранулы (~ 15-20 нм)
• Нити митохондрий представляют собой молекулы ДНК в составе
митохондриального нуклеоида (ДНК содержащие гранулы)
• Мелкие гранулы – митохондриальные рибосомы
• Крупные гранулы (20-40 нм) – места отложений солей магния и кальция
11
12.
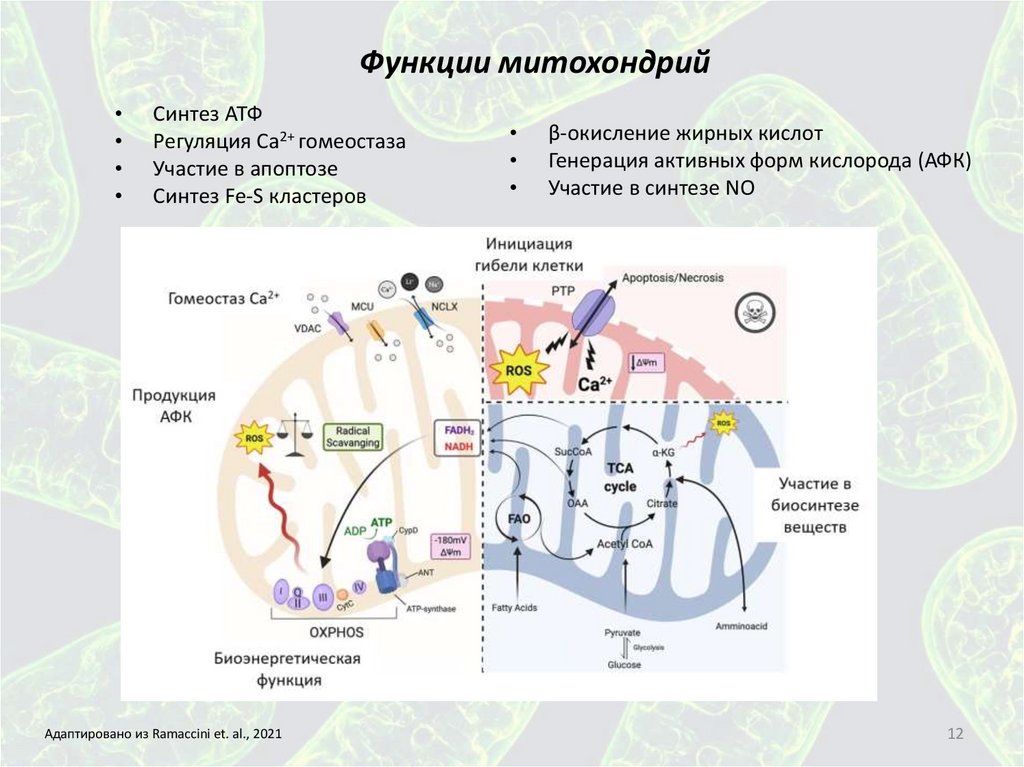
Функции митохондрийСинтез АТФ
Регуляция Са2+ гомеостаза
Участие в апоптозе
Синтез Fe-S кластеров
Адаптировано из Ramaccini et. al., 2021
β-окисление жирных кислот
Генерация активных форм кислорода (АФК)
Участие в синтезе NO
12
13.
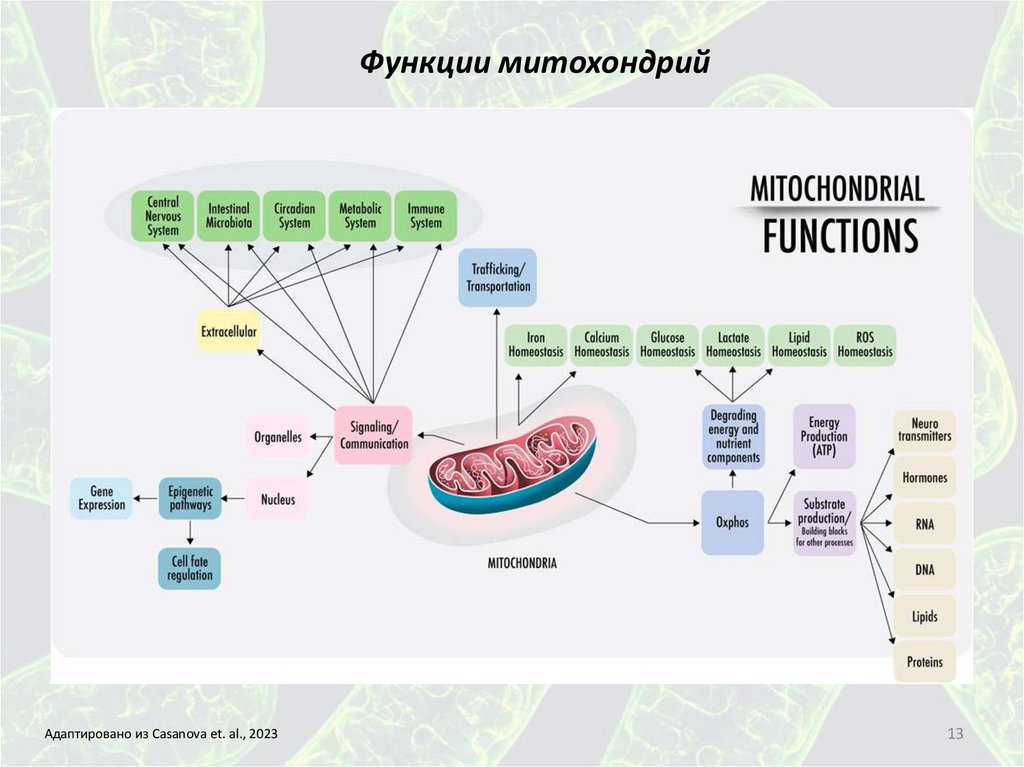
Функции митохондрийАдаптировано из Casanova et. al., 2023
13
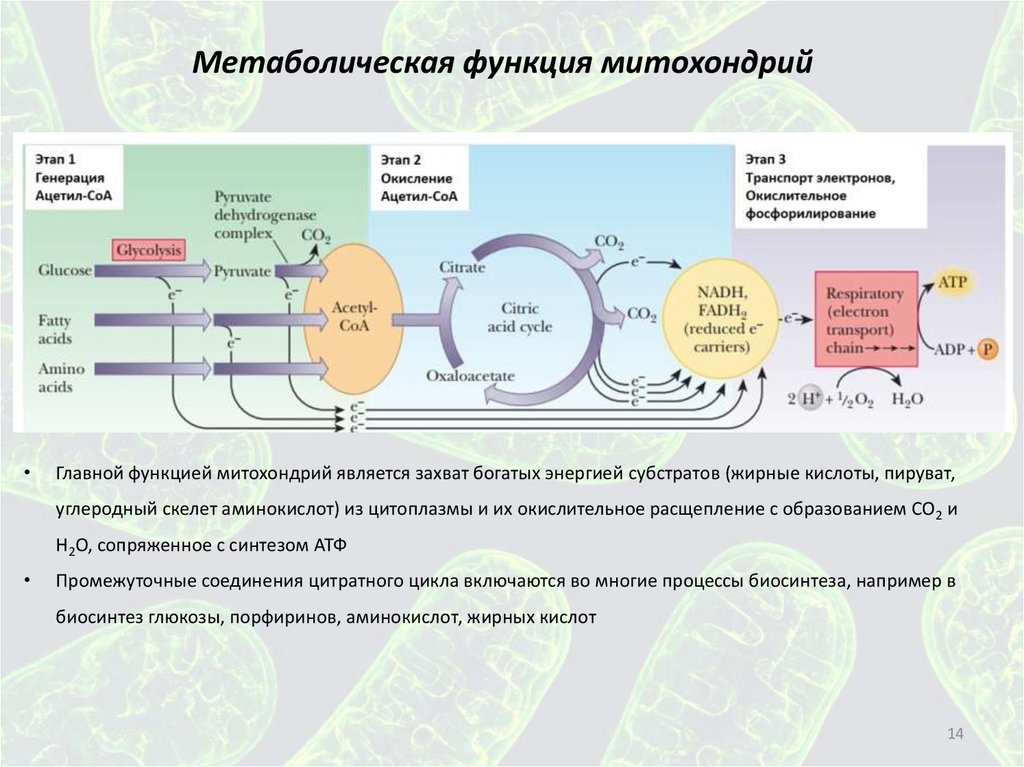
14.
Метаболическая функция митохондрийГлавной функцией митохондрий является захват богатых энергией субстратов (жирные кислоты, пируват,
углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление с образованием СО2 и
Н2О, сопряженное с синтезом АТФ
Промежуточные соединения цитратного цикла включаются во многие процессы биосинтеза, например в
биосинтез глюкозы, порфиринов, аминокислот, жирных кислот
14
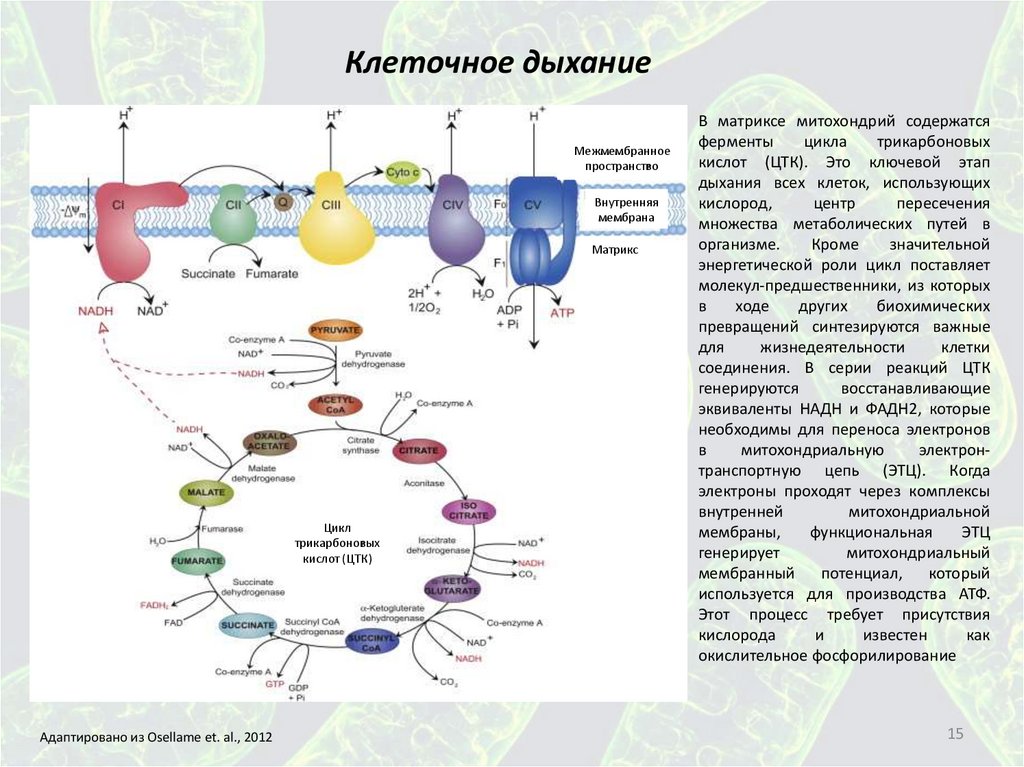
15.
Клеточное дыханиеМежмембранное
пространство
Внутренняя
мембрана
Матрикс
Цикл
трикарбоновых
кислот (ЦТК)
Адаптировано из Osellame et. al., 2012
В матриксе митохондрий содержатся
ферменты
цикла
трикарбоновых
кислот (ЦТК). Это ключевой этап
дыхания всех клеток, использующих
кислород,
центр
пересечения
множества метаболических путей в
организме.
Кроме
значительной
энергетической роли цикл поставляет
молекул-предшественники, из которых
в
ходе
других
биохимических
превращений синтезируются важные
для
жизнедеятельности
клетки
соединения. В серии реакций ЦТК
генерируются
восстанавливающие
эквиваленты НАДН и ФАДН2, которые
необходимы для переноса электронов
в
митохондриальную
электронтранспортную цепь (ЭТЦ). Когда
электроны проходят через комплексы
внутренней
митохондриальной
мембраны,
функциональная
ЭТЦ
генерирует
митохондриальный
мембранный
потенциал,
который
используется для производства АТФ.
Этот процесс требует присутствия
кислорода
и
известен
как
окислительное фосфорилирование
15
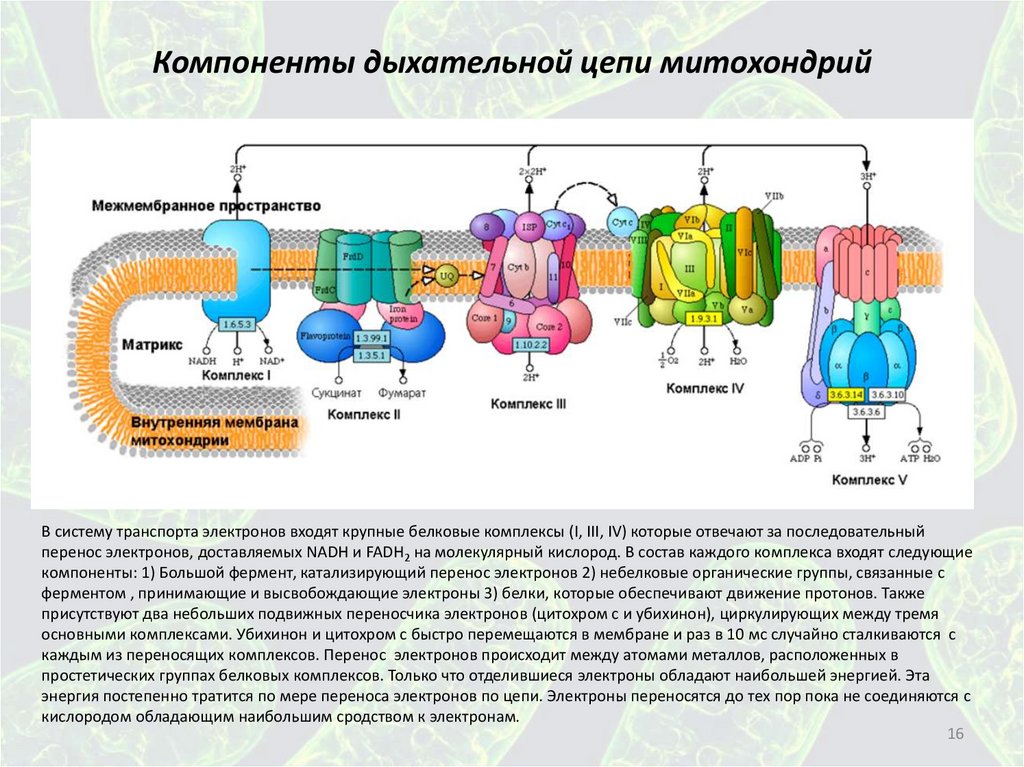
16.
Компоненты дыхательной цепи митохондрийВ систему транспорта электронов входят крупные белковые комплексы (I, III, IV) которые отвечают за последовательный
перенос электронов, доставляемых NADH и FADH2 на молекулярный кислород. В состав каждого комплекса входят следующие
компоненты: 1) Большой фермент, катализирующий перенос электронов 2) небелковые органические группы, связанные с
ферментом , принимающие и высвобождающие электроны 3) белки, которые обеспечивают движение протонов. Также
присутствуют два небольших подвижных переносчика электронов (цитохром с и убихинон), циркулирующих между тремя
основными комплексами. Убихинон и цитохром с быстро перемещаются в мембране и раз в 10 мс случайно сталкиваются с
каждым из переносящих комплексов. Перенос электронов происходит между атомами металлов, расположенных в
простетических группах белковых комплексов. Только что отделившиеся электроны обладают наибольшей энергией. Эта
энергия постепенно тратится по мере переноса электронов по цепи. Электроны переносятся до тех пор пока не соединяются с
кислородом обладающим наибольшим сродством к электронам.
16
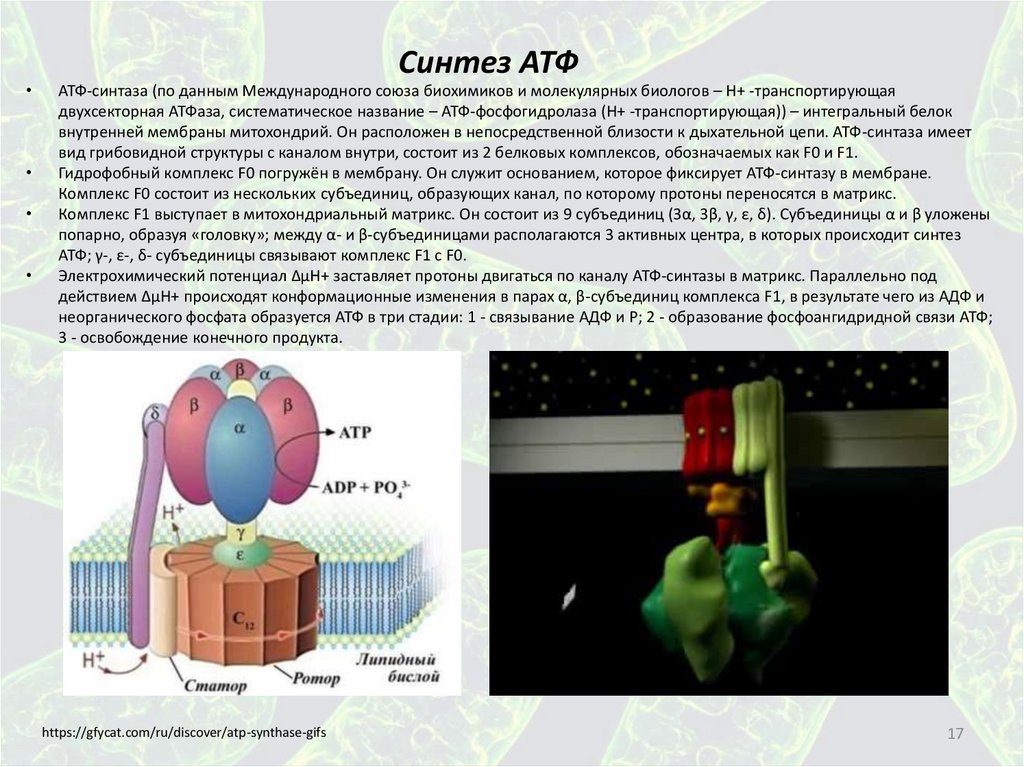
17.
Синтез АТФ
АТФ-синтаза (по данным Международного союза биохимиков и молекулярных биологов – H+ -транспортирующая
двухсекторная АТФаза, систематическое название – АТФ-фосфогидролаза (H+ -транспортирующая)) – интегральный белок
внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза имеет
вид грибовидной структуры с каналом внутри, состоит из 2 белковых комплексов, обозначаемых как F0 и F1.
Гидрофобный комплекс F0 погружён в мембрану. Он служит основанием, которое фиксирует АТФ-синтазу в мембране.
Комплекс F0 состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс.
Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, γ, ε, δ). Субъединицы α и β уложены
попарно, образуя «головку»; между α- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез
АТФ; γ-, ε-, δ- субъединицы связывают комплекс F1 с F0.
Электрохимический потенциал ΔμН+ заставляет протоны двигаться по каналу АТФ-синтазы в матрикс. Параллельно под
действием ΔμН+ происходят конформационные изменения в парах α, β-субъединиц комплекса F1, в результате чего из AДФ и
неорганического фосфата образуется АТФ в три стадии: 1 - связывание АДФ и P; 2 - образование фосфоангидридной связи АТФ;
3 - освобождение конечного продукта.
https://gfycat.com/ru/discover/atp-synthase-gifs
17
18.
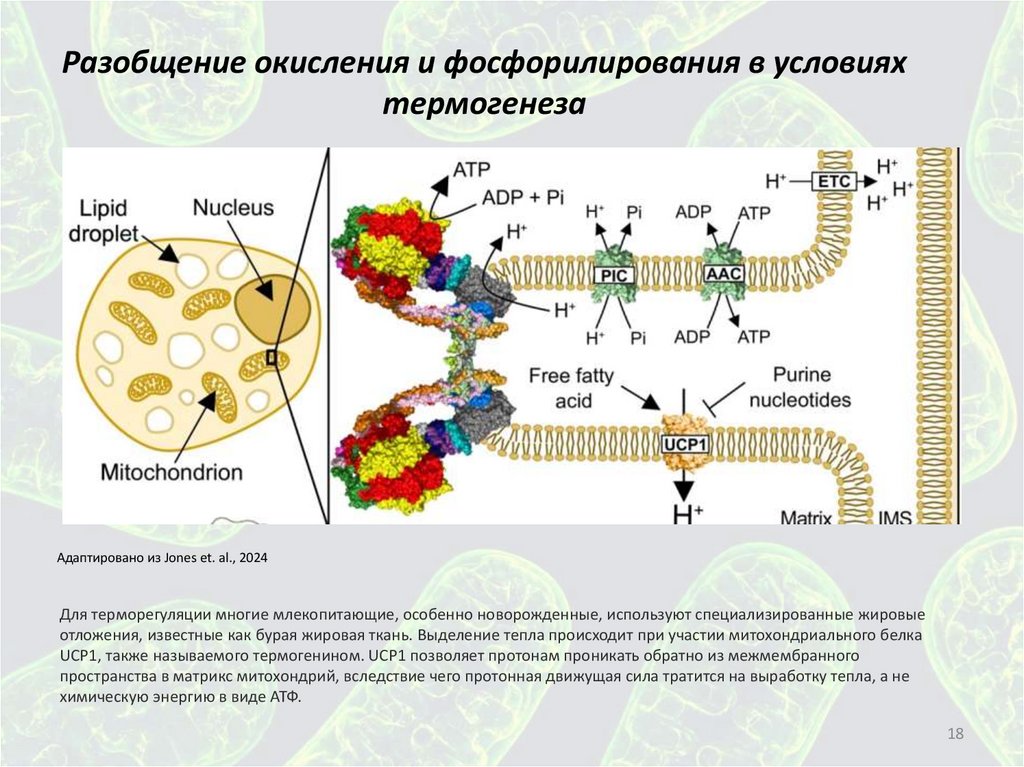
Разобщение окисления и фосфорилирования в условияхтермогенеза
Адаптировано из Jones et. al., 2024
Для терморегуляции многие млекопитающие, особенно новорожденные, используют специализированные жировые
отложения, известные как бурая жировая ткань. Выделение тепла происходит при участии митохондриального белка
UCP1, также называемого термогенином. UCP1 позволяет протонам проникать обратно из межмембранного
пространства в матрикс митохондрий, вследствие чего протонная движущая сила тратится на выработку тепла, а не
химическую энергию в виде АТФ.
18
19.
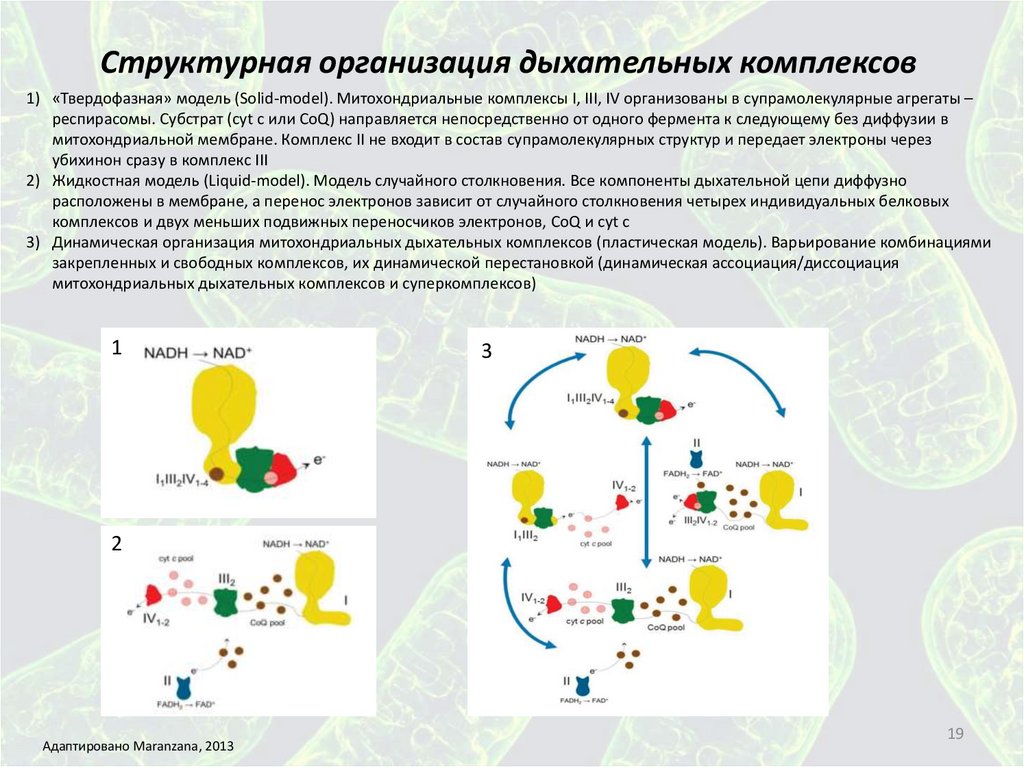
Структурная организация дыхательных комплексов1) «Твердофазная» модель (Solid-model). Митохондриальные комплексы I, III, IV организованы в супрамолекулярные агрегаты –
респирасомы. Субстрат (cyt c или CoQ) направляется непосредственно от одного фермента к следующему без диффузии в
митохондриальной мембране. Комплекс II не входит в состав супрамолекулярных структур и передает электроны через
убихинон сразу в комплекс III
2) Жидкостная модель (Liquid-model). Модель случайного столкновения. Все компоненты дыхательной цепи диффузно
расположены в мембране, а перенос электронов зависит от случайного столкновения четырех индивидуальных белковых
комплексов и двух меньших подвижных переносчиков электронов, CoQ и cyt c
3) Динамическая организация митохондриальных дыхательных комплексов (пластическая модель). Варьирование комбинациями
закрепленных и свободных комплексов, их динамической перестановкой (динамическая ассоциация/диссоциация
митохондриальных дыхательных комплексов и суперкомплексов)
1
3
2
Адаптировано Maranzana, 2013
19
20.
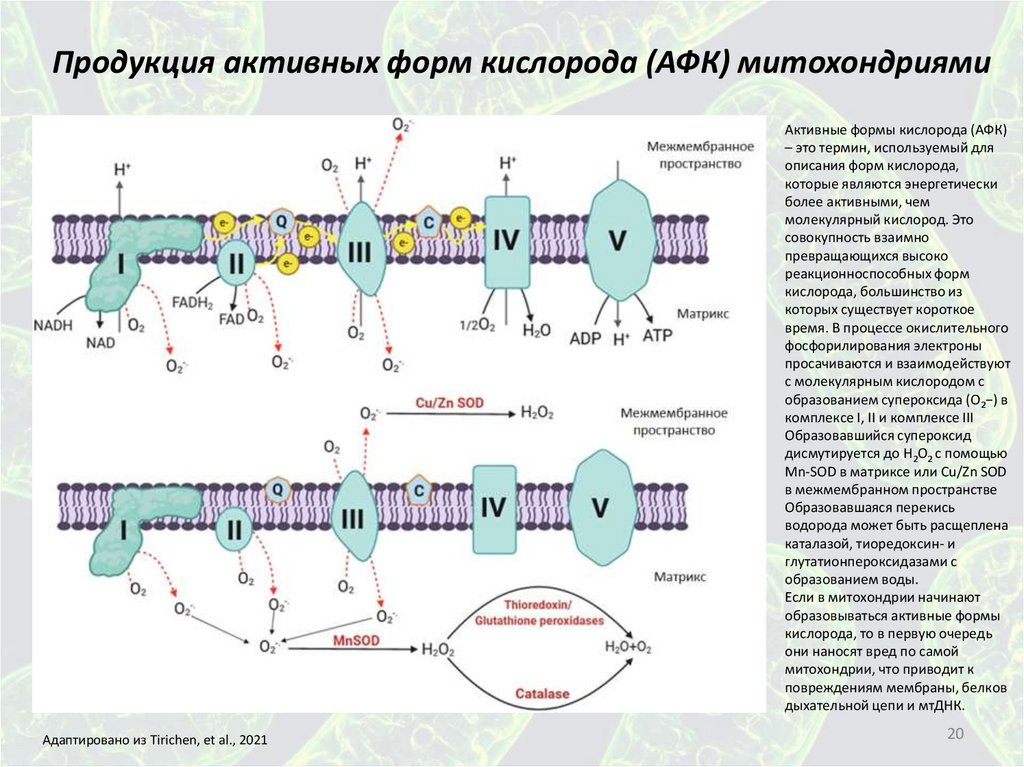
Продукция активных форм кислорода (АФК) митохондриямиАктивные формы кислорода (АФК)
– это термин, используемый для
описания форм кислорода,
которые являются энергетически
более активными, чем
молекулярный кислород. Это
совокупность взаимно
превращающихся высоко
реакционноспособных форм
кислорода, большинство из
которых существует короткое
время. В процессе окислительного
фосфорилирования электроны
просачиваются и взаимодействуют
с молекулярным кислородом с
образованием супероксида (O2−) в
комплексе I, II и комплексе III
Образовавшийся супероксид
дисмутируется до H2O2 с помощью
Mn-SOD в матриксе или Cu/Zn SOD
в межмембранном пространстве
Образовавшаяся перекись
водорода может быть расщеплена
каталазой, тиоредоксин- и
глутатионпероксидазами с
образованием воды.
Если в митохондрии начинают
образовываться активные формы
кислорода, то в первую очередь
они наносят вред по самой
митохондрии, что приводит к
повреждениям мембраны, белков
дыхательной цепи и мтДНК.
Адаптировано из Tirichen, et al., 2021
20
21.
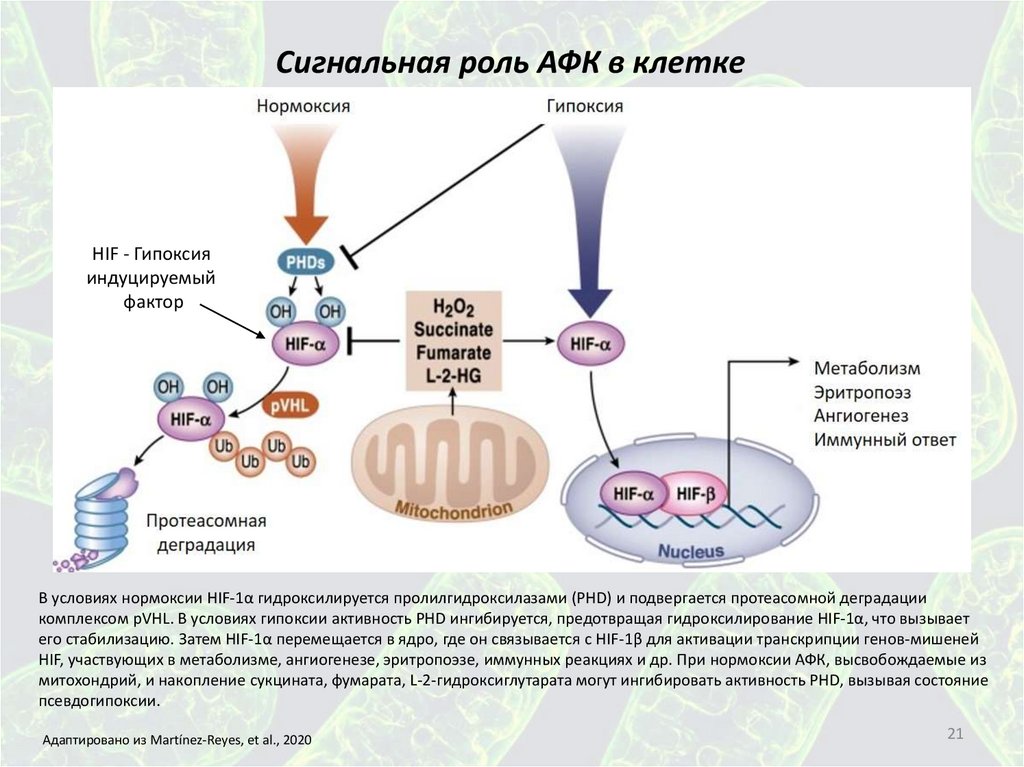
Сигнальная роль АФК в клеткеHIF - Гипоксия
индуцируемый
фактор
В условиях нормоксии HIF-1α гидроксилируется пролилгидроксилазами (PHD) и подвергается протеасомной деградации
комплексом pVHL. В условиях гипоксии активность PHD ингибируется, предотвращая гидроксилирование HIF-1α, что вызывает
его стабилизацию. Затем HIF-1α перемещается в ядро, где он связывается с HIF-1β для активации транскрипции генов-мишеней
HIF, участвующих в метаболизме, ангиогенезе, эритропоэзе, иммунных реакциях и др. При нормоксии АФК, высвобождаемые из
митохондрий, и накопление сукцината, фумарата, L-2-гидроксиглутарата могут ингибировать активность PHD, вызывая состояние
псевдогипоксии.
Адаптировано из Martínez-Reyes, et al., 2020
21
22.
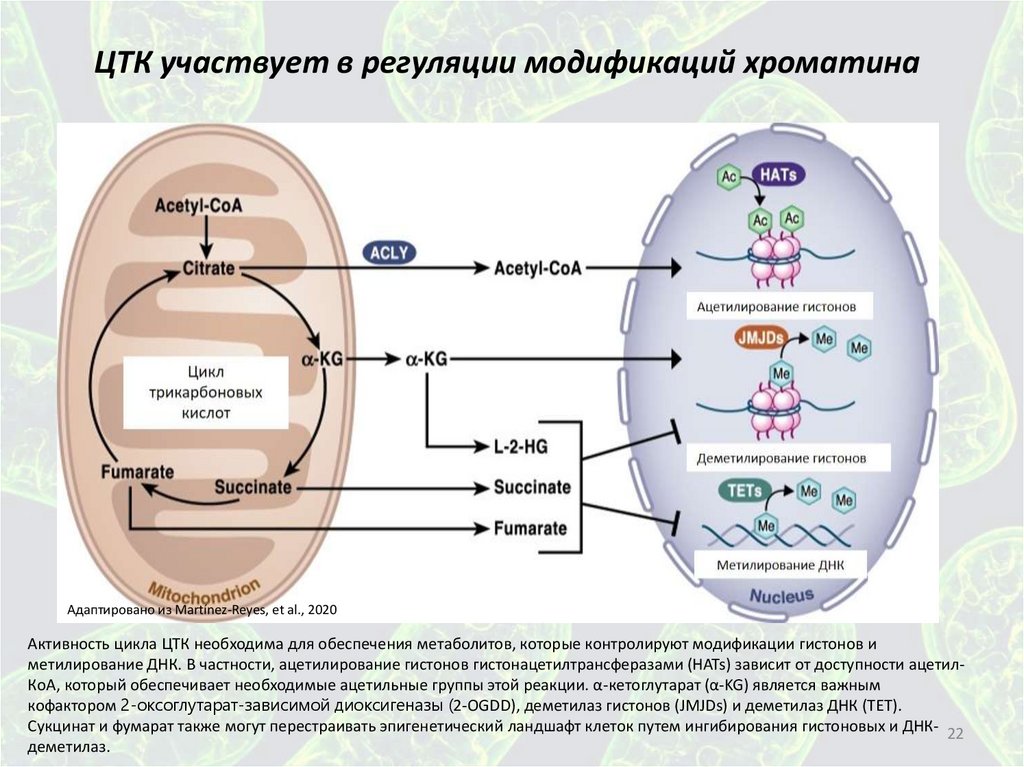
ЦТК участвует в регуляции модификаций хроматинаАдаптировано из Martínez-Reyes, et al., 2020
Активность цикла ЦТК необходима для обеспечения метаболитов, которые контролируют модификации гистонов и
метилирование ДНК. В частности, ацетилирование гистонов гистонацетилтрансферазами (HATs) зависит от доступности ацетилКоА, который обеспечивает необходимые ацетильные группы этой реакции. α-кетоглутарат (α-KG) является важным
кофактором 2-оксоглутарат-зависимой диоксигеназы (2-OGDD), деметилаз гистонов (JMJDs) и деметилаз ДНК (TET).
Сукцинат и фумарат также могут перестраивать эпигенетический ландшафт клеток путем ингибирования гистоновых и ДНК- 22
деметилаз.
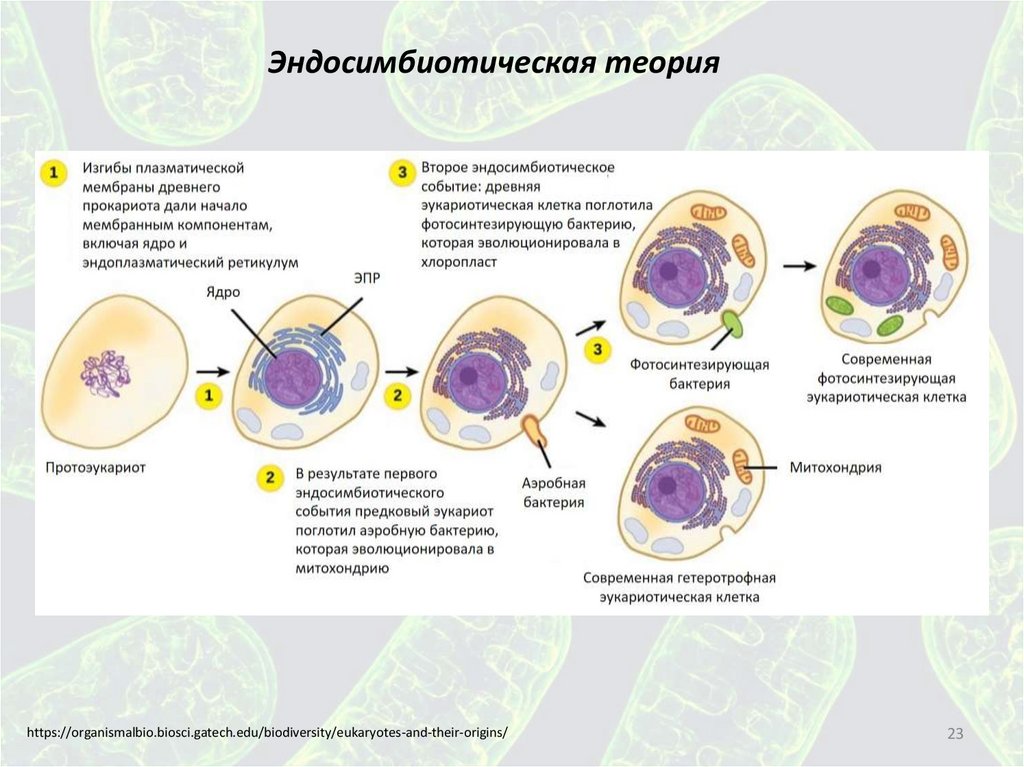
23.
Эндосимбиотическая теорияhttps://organismalbio.biosci.gatech.edu/biodiversity/eukaryotes-and-their-origins/
23
24.
Эндосимбиотическая теорияДоказательства
• Митохондрии примерно того же размера, что и прокариотические клетки
• Каждая из митохондрий имеет свою собственную ДНК, которая организована в
виде кольцевой хромосомы, как типичные прокариотические геномы. ДНК
митохондрий содержат гены, которые очень похожи на гены, обнаруженные в
прокариотических геномах
• Наличие собственного белкового синтеза
• Мелкие рибосомы прокариотического типа
• Митохондрии размножаются путем двойного деления - процесса, который
прокариоты используют для размножения. Напротив, эукариотические клетки
размножаются путем митоза
• Мембранный состав митохондрий больше похож на прокариотические
мембраны, чем на эукариотические мембраны
24
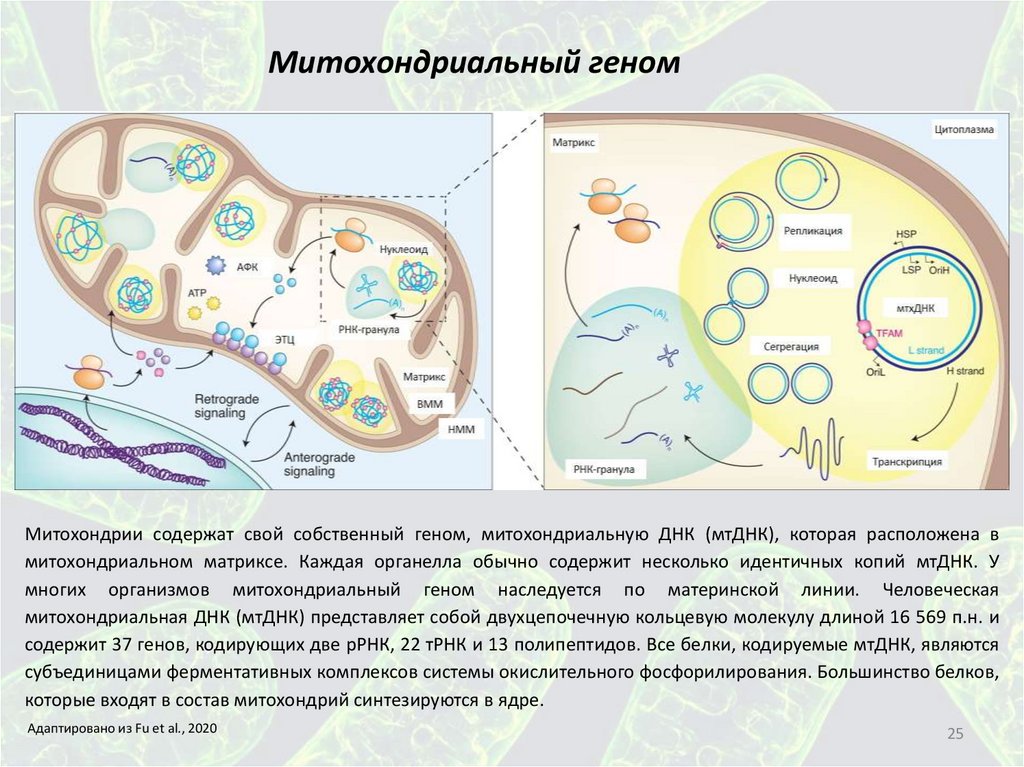
25.
Митохондриальный геномМитохондрии содержат свой собственный геном, митохондриальную ДНК (мтДНК), которая расположена в
митохондриальном матриксе. Каждая органелла обычно содержит несколько идентичных копий мтДНК. У
многих организмов митохондриальный геном наследуется по материнской линии. Человеческая
митохондриальная ДНК (мтДНК) представляет собой двухцепочечную кольцевую молекулу длиной 16 569 п.н. и
содержит 37 генов, кодирующих две рРНК, 22 тРНК и 13 полипептидов. Все белки, кодируемые мтДНК, являются
субъединицами ферментативных комплексов системы окислительного фосфорилирования. Большинство белков,
которые входят в состав митохондрий синтезируются в ядре.
Адаптировано из Fu et al., 2020
25
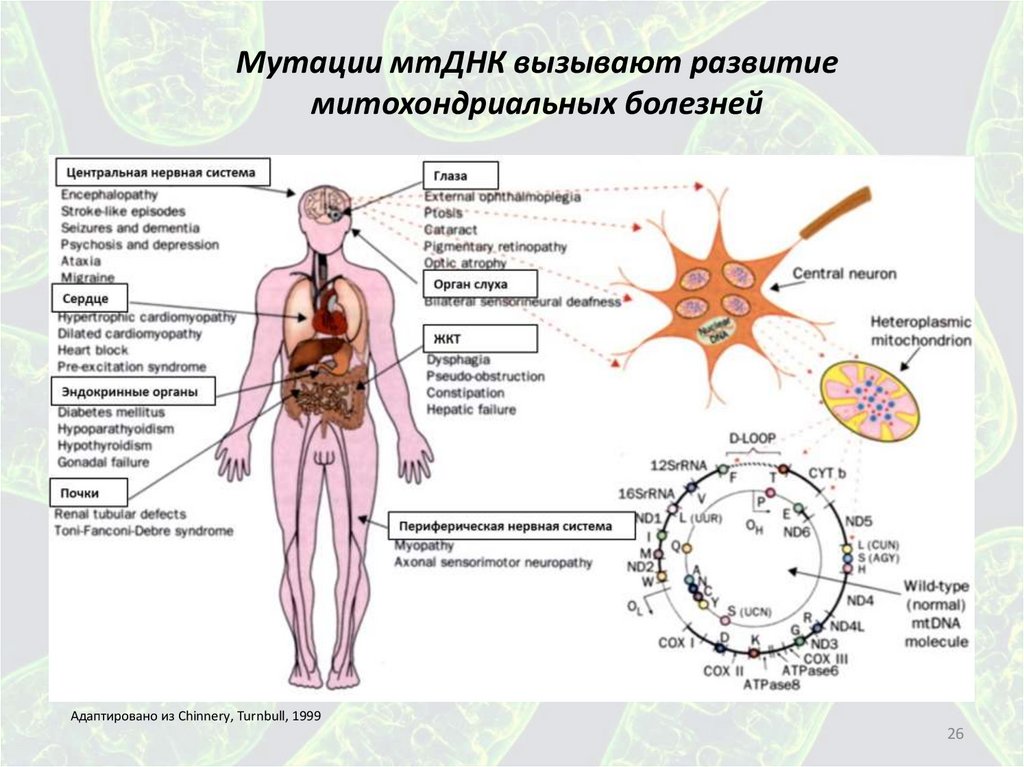
26.
Мутации мтДНК вызывают развитиемитохондриальных болезней
Адаптировано из Chinnery, Turnbull, 1999
26
27.
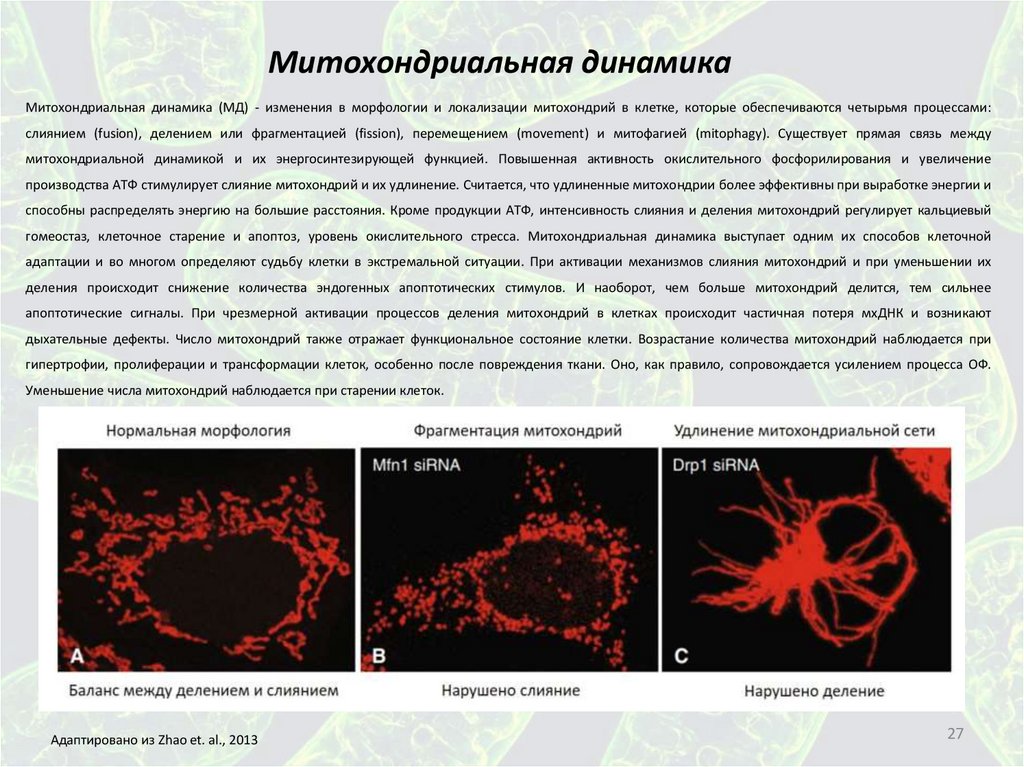
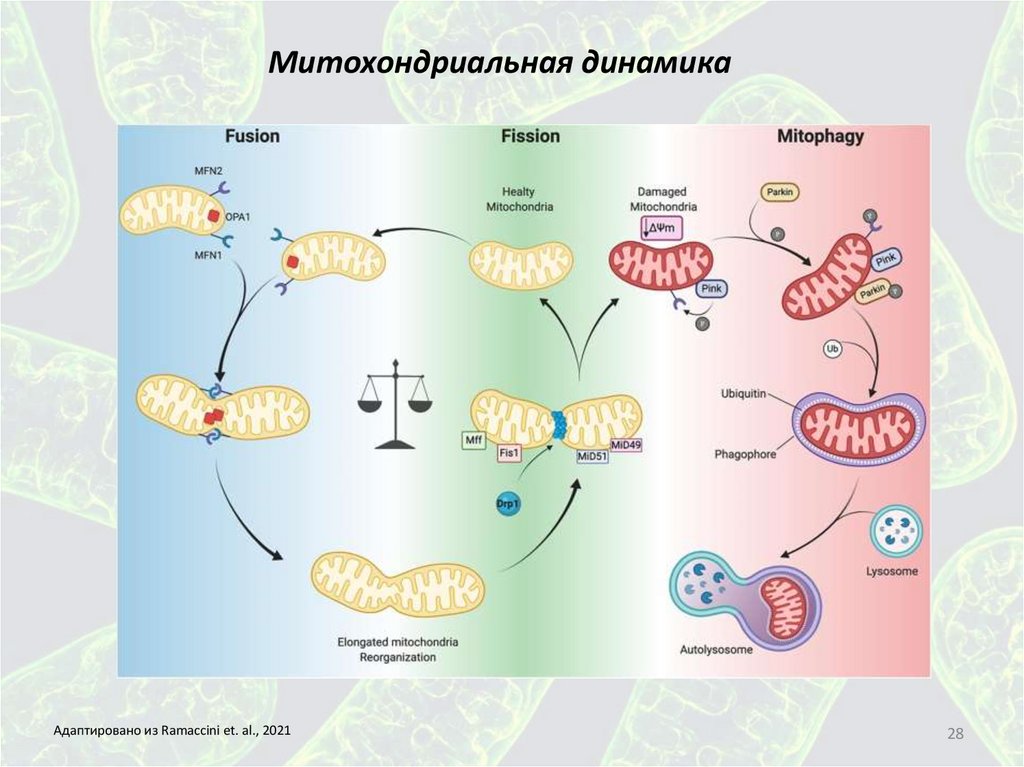
Митохондриальная динамикаМитохондриальная динамика (МД) - изменения в морфологии и локализации митохондрий в клетке, которые обеспечиваются четырьмя процессами:
слиянием (fusion), делением или фрагментацией (fission), перемещением (movement) и митофагией (mitophagy). Существует прямая связь между
митохондриальной динамикой и их энергосинтезирующей функцией. Повышенная активность окислительного фосфорилирования и увеличение
производства АТФ стимулирует слияние митохондрий и их удлинение. Считается, что удлиненные митохондрии более эффективны при выработке энергии и
способны распределять энергию на большие расстояния. Кроме продукции АТФ, интенсивность слияния и деления митохондрий регулирует кальциевый
гомеостаз, клеточное старение и апоптоз, уровень окислительного стресса. Митохондриальная динамика выступает одним их способов клеточной
адаптации и во многом определяют судьбу клетки в экстремальной ситуации. При активации механизмов слияния митохондрий и при уменьшении их
деления происходит снижение количества эндогенных апоптотических стимулов. И наоборот, чем больше митохондрий делится, тем сильнее
апоптотические сигналы. При чрезмерной активации процессов деления митохондрий в клетках происходит частичная потеря мхДНК и возникают
дыхательные дефекты. Число митохондрий также отражает функциональное состояние клетки. Возрастание количества митохондрий наблюдается при
гипертрофии, пролиферации и трансформации клеток, особенно после повреждения ткани. Оно, как правило, сопровождается усилением процесса ОФ.
Уменьшение числа митохондрий наблюдается при старении клеток.
Адаптировано из Zhao et. al., 2013
27
28.
Митохондриальная динамикаАдаптировано из Ramaccini et. al., 2021
28
29.
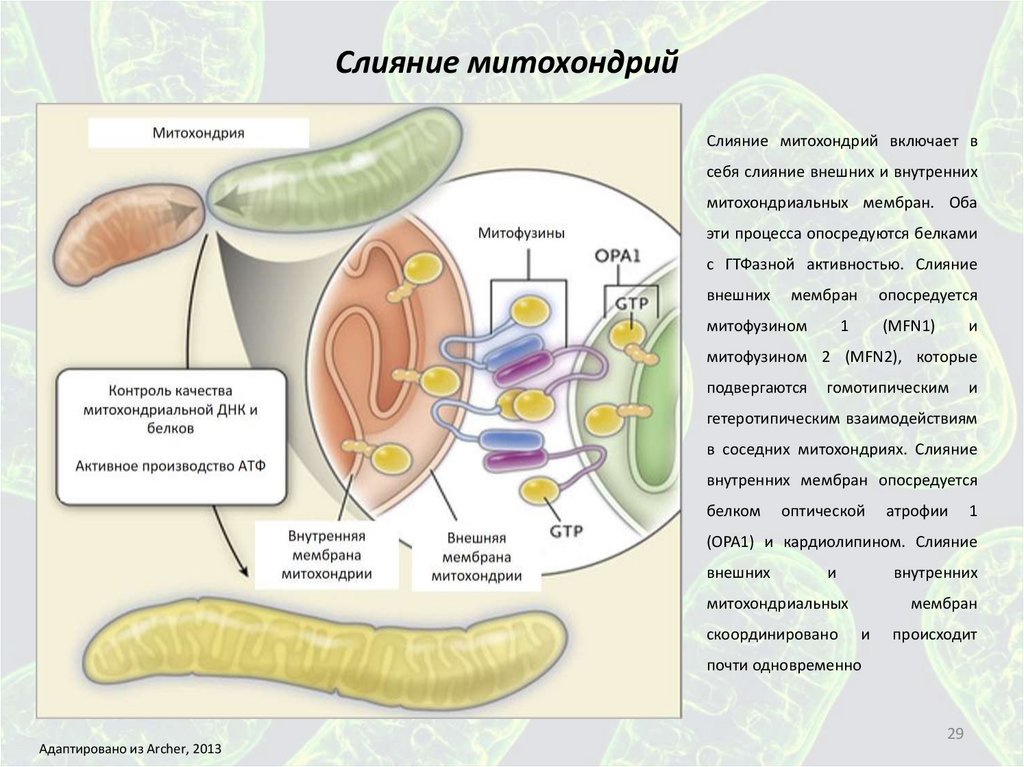
Слияние митохондрийСлияние митохондрий включает в
себя слияние внешних и внутренних
митохондриальных мембран. Оба
эти процесса опосредуются белками
с ГТФазной активностью. Слияние
внешних
мембран
митофузином
опосредуется
1
(MFN1)
и
митофузином 2 (MFN2), которые
подвергаются
гомотипическим
и
гетеротипическим взаимодействиям
в соседних митохондриях. Слияние
внутренних мембран опосредуется
белком
оптической
атрофии
1
(OPA1) и кардиолипином. Слияние
внешних
и
внутренних
митохондриальных
скоординировано
мембран
и
происходит
почти одновременно
Адаптировано из Archer, 2013
29
30.
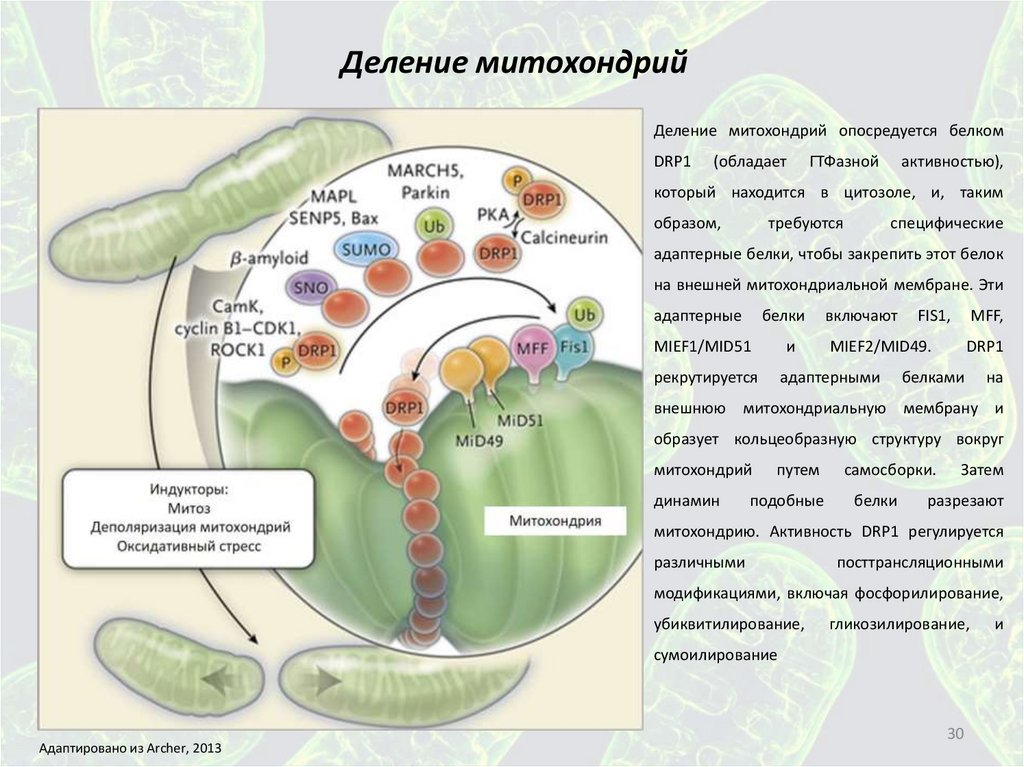
Деление митохондрийДеление митохондрий опосредуется белком
DRP1
(обладает
ГТФазной
активностью),
который находится в цитозоле, и, таким
образом,
требуются
специфические
адаптерные белки, чтобы закрепить этот белок
на внешней митохондриальной мембране. Эти
адаптерные
белки
включают
MIEF1/MID51
и
рекрутируется
адаптерными
FIS1,
MFF,
MIEF2/MID49.
DRP1
белками
на
внешнюю митохондриальную мембрану и
образует кольцеобразную структуру вокруг
митохондрий
динамин
путем
подобные
самосборки.
белки
Затем
разрезают
митохондрию. Активность DRP1 регулируется
различными
посттрансляционными
модификациями, включая фосфорилирование,
убиквитилирование,
гликозилирование,
сумоилирование
Адаптировано из Archer, 2013
30
и
31.
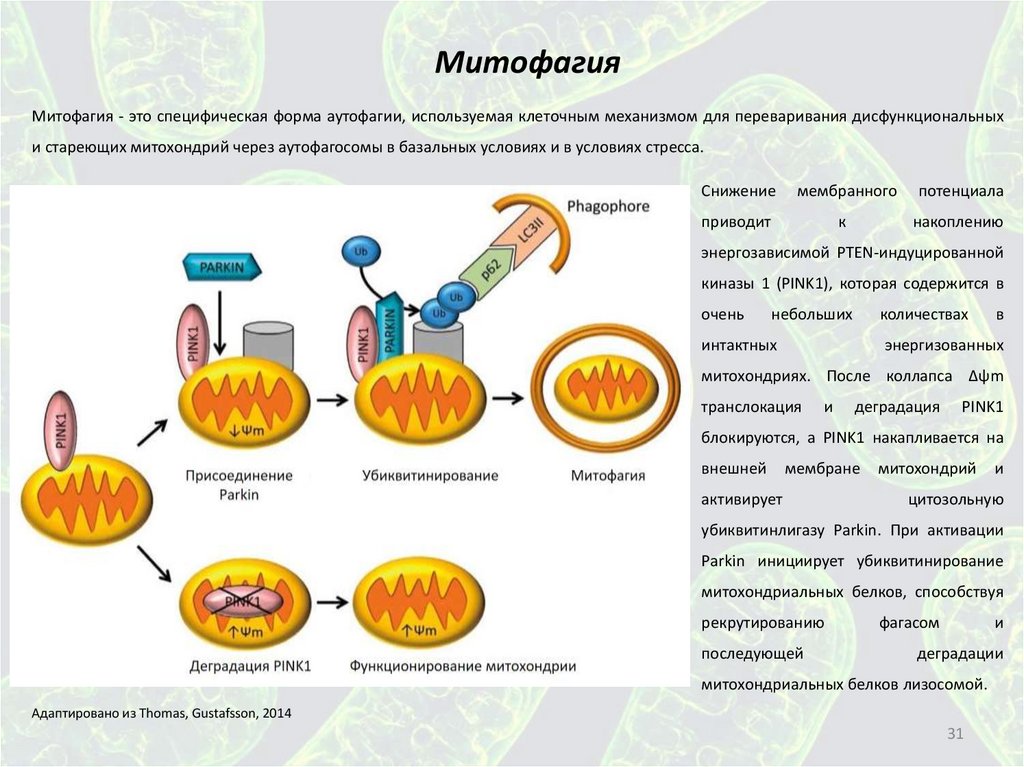
МитофагияМитофагия - это специфическая форма аутофагии, используемая клеточным механизмом для переваривания дисфункциональных
и стареющих митохондрий через аутофагосомы в базальных условиях и в условиях стресса.
Снижение
мембранного
потенциала
приводит
к
накоплению
энергозависимой PTEN-индуцированной
киназы 1 (PINK1), которая содержится в
очень
небольших
количествах
интактных
в
энергизованных
митохондриях. После коллапса Δψm
транслокация
и
деградация
PINK1
блокируются, а PINK1 накапливается на
внешней
мембране
активирует
митохондрий
и
цитозольную
убиквитинлигазу Parkin. При активации
Parkin инициирует убиквитинирование
митохондриальных белков, способствуя
рекрутированию
последующей
фагасом
и
деградации
митохондриальных белков лизосомой.
Адаптировано из Thomas, Gustafsson, 2014
31
32.
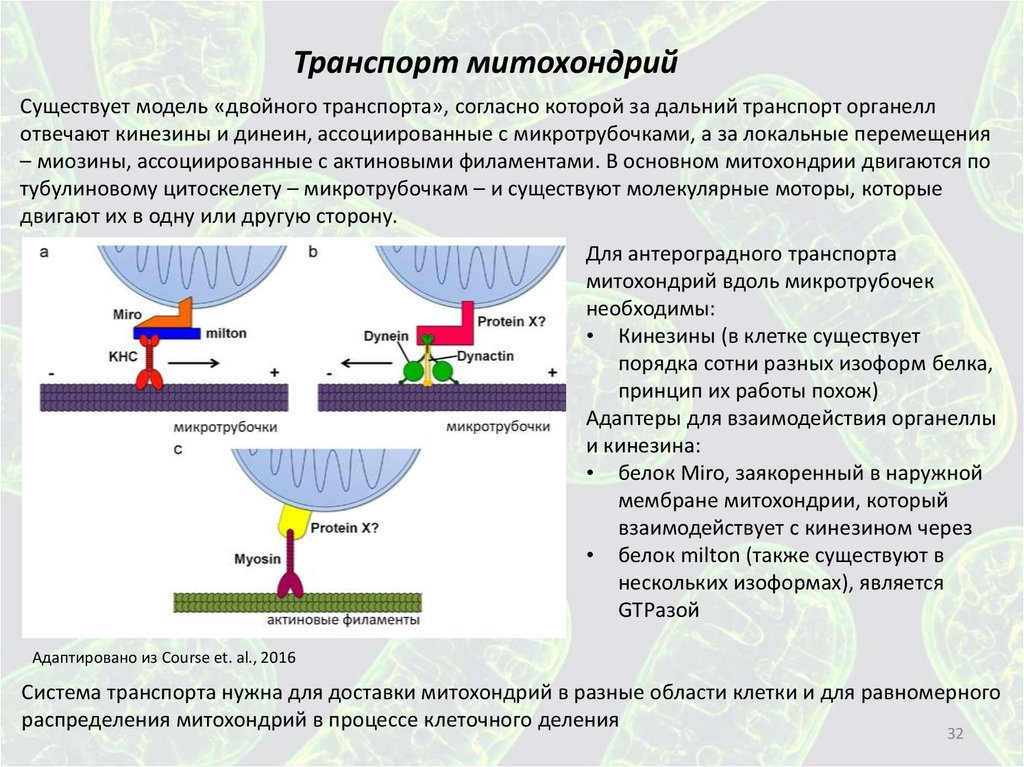
Транспорт митохондрийСуществует модель «двойного транспорта», согласно которой за дальний транспорт органелл
отвечают кинезины и динеин, ассоциированные с микротрубочками, а за локальные перемещения
– миозины, ассоциированные с актиновыми филаментами. В основном митохондрии двигаются по
тубулиновому цитоскелету – микротрубочкам – и существуют молекулярные моторы, которые
двигают их в одну или другую сторону.
Для антероградного транспорта
митохондрий вдоль микротрубочек
необходимы:
• Кинезины (в клетке существует
порядка сотни разных изоформ белка,
принцип их работы похож)
Адаптеры для взаимодействия органеллы
и кинезина:
• белок Miro, заякоренный в наружной
мембране митохондрии, который
взаимодействует с кинезином через
• белок milton (также существуют в
нескольких изоформах), является
GTPазой
Адаптировано из Course et. al., 2016
Система транспорта нужна для доставки митохондрий в разные области клетки и для равномерного
распределения митохондрий в процессе клеточного деления
32
33.
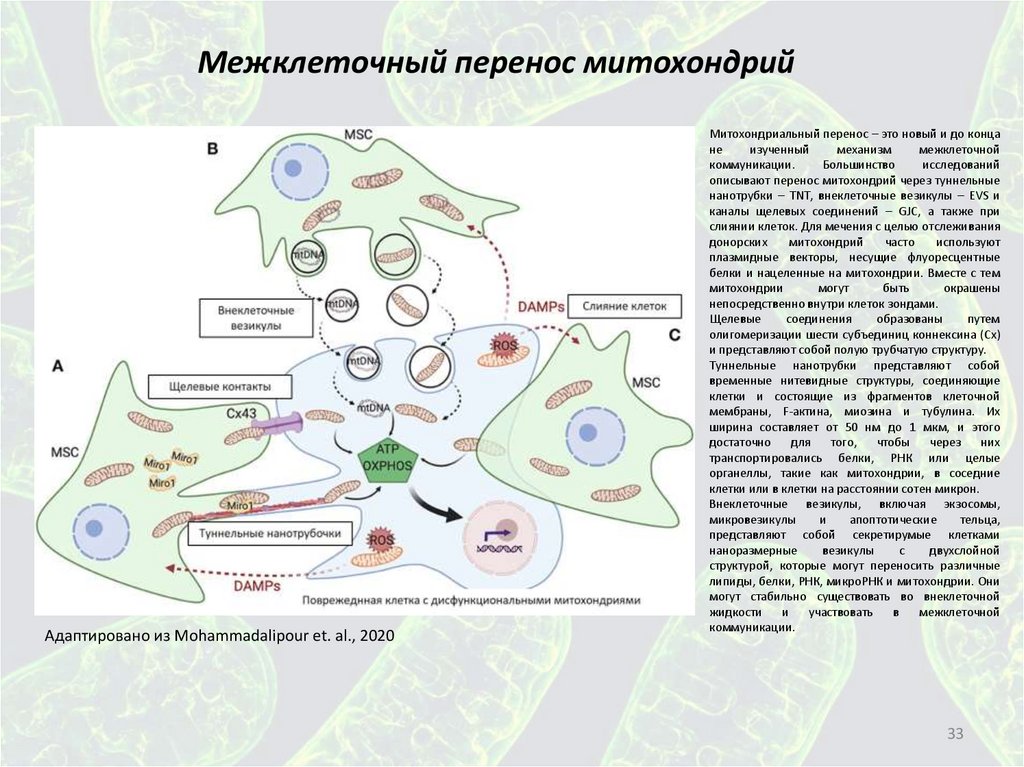
Межклеточный перенос митохондрийАдаптировано из Mohammadalipour et. al., 2020
Митохондриальный перенос – это новый и до конца
не
изученный
механизм
межклеточной
коммуникации.
Большинство
исследований
описывают перенос митохондрий через туннельные
нанотрубки – TNT, внеклеточные везикулы – EVS и
каналы щелевых соединений – GJC, а также при
слиянии клеток. Для мечения с целью отслеживания
донорских
митохондрий
часто
используют
плазмидные векторы, несущие флуоресцентные
белки и нацеленные на митохондрии. Вместе с тем
митохондрии
могут
быть
окрашены
непосредственно внутри клеток зондами.
Щелевые
соединения
образованы
путем
олигомеризации шести субъединиц коннексина (Cx)
и представляют собой полую трубчатую структуру.
Туннельные нанотрубки представляют собой
временные нитевидные структуры, соединяющие
клетки и состоящие из фрагментов клеточной
мембраны, F-актина, миозина и тубулина. Их
ширина составляет от 50 нм до 1 мкм, и этого
достаточно
для
того,
чтобы
через
них
транспортировались белки, РНК или целые
органеллы, такие как митохондрии, в соседние
клетки или в клетки на расстоянии сотен микрон.
Внеклеточные везикулы, включая экзосомы,
микровезикулы
и
апоптотические
тельца,
представляют собой секретирумые клетками
наноразмерные
везикулы
с
двухслойной
структурой, которые могут переносить различные
липиды, белки, РНК, микроРНК и митохондрии. Они
могут стабильно существовать во внеклеточной
жидкости
и
участвовать
в
межклеточной
коммуникации.
33
34.
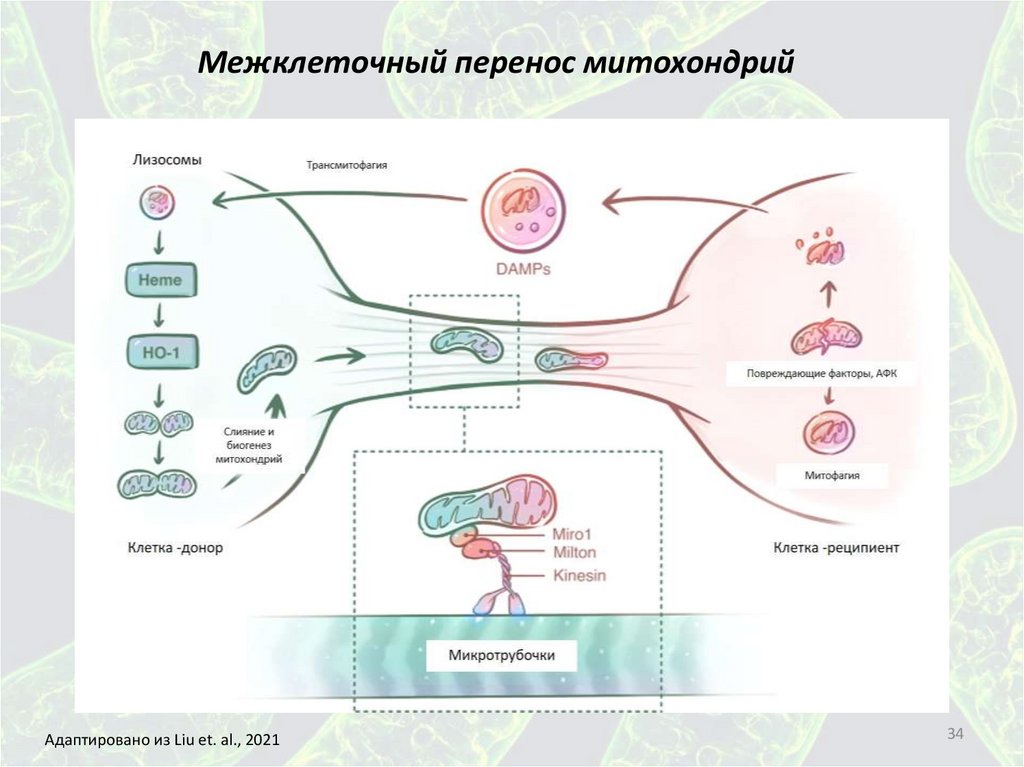
Межклеточный перенос митохондрийАдаптировано из Liu et. al., 2021
34
35.
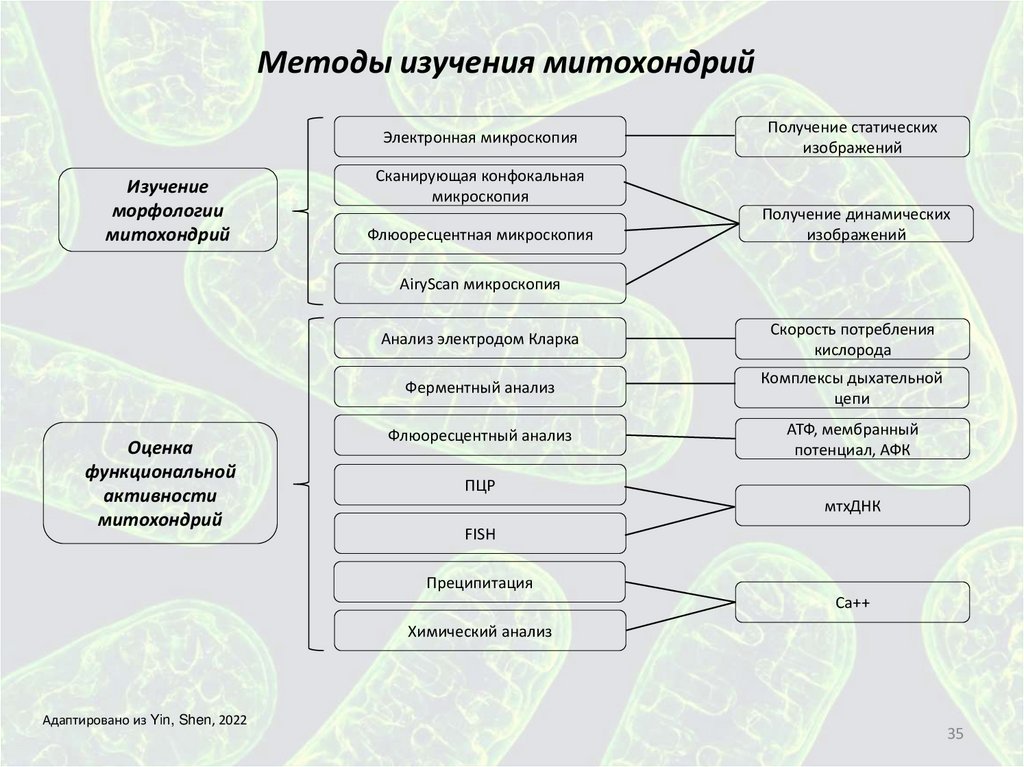
Методы изучения митохондрийЭлектронная микроскопия
Изучение
морфологии
митохондрий
Получение статических
изображений
Сканирующая конфокальная
микроскопия
Флюоресцентная микроскопия
Получение динамических
изображений
AiryScan микроскопия
Оценка
функциональной
активности
митохондрий
Анализ электродом Кларка
Скорость потребления
кислорода
Ферментный анализ
Комплексы дыхательной
цепи
Флюоресцентный анализ
АТФ, мембранный
потенциал, АФК
ПЦР
мтхДНК
FISH
Преципитация
Ca++
Химический анализ
Адаптировано из Yin, Shen, 2022
35
36.
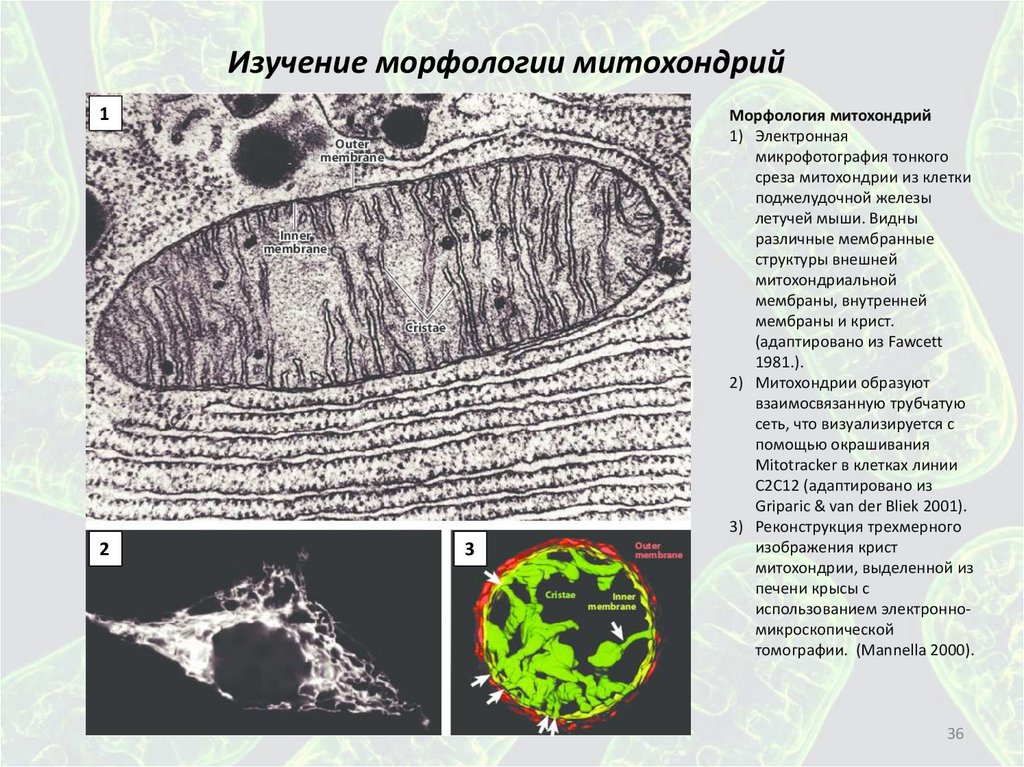
Изучение морфологии митохондрий1
2
3
Морфология митохондрий
1) Электронная
микрофотография тонкого
среза митохондрии из клетки
поджелудочной железы
летучей мыши. Видны
различные мембранные
структуры внешней
митохондриальной
мембраны, внутренней
мембраны и крист.
(адаптировано из Fawcett
1981.).
2) Митохондрии образуют
взаимосвязанную трубчатую
сеть, что визуализируется с
помощью окрашивания
Mitotracker в клетках линии
C2C12 (адаптировано из
Griparic & van der Bliek 2001).
3) Реконструкция трехмерного
изображения крист
митохондрии, выделенной из
печени крысы с
использованием электронномикроскопической
томографии. (Mannella 2000).
36
37.
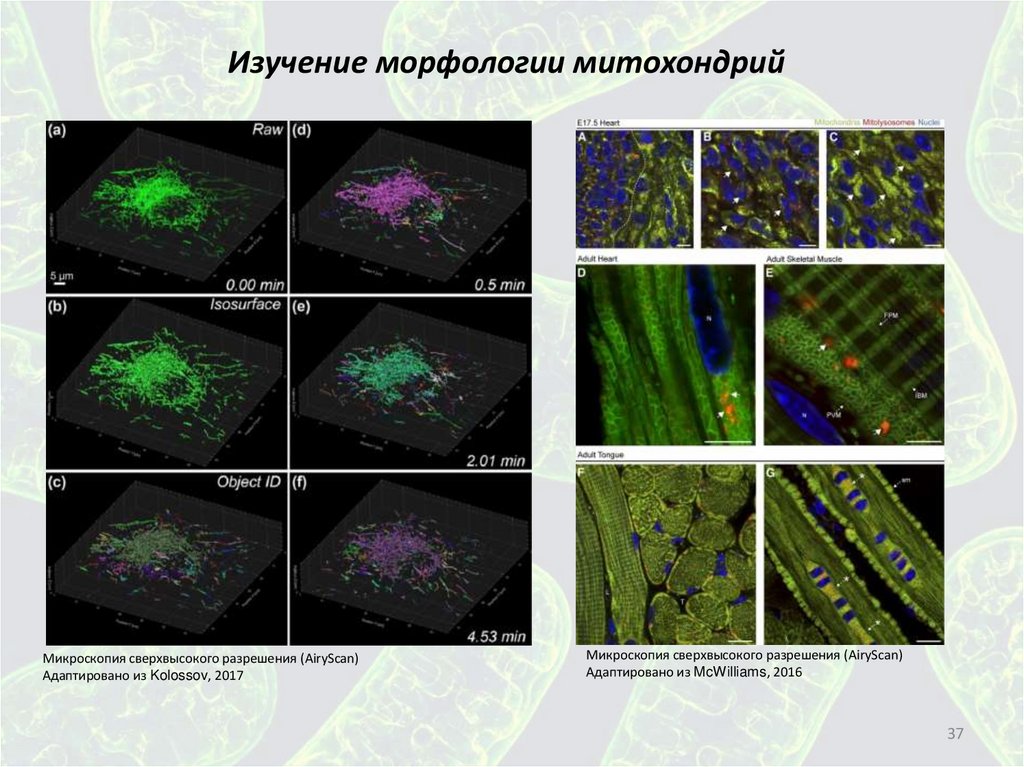
Изучение морфологии митохондрийМикроскопия сверхвысокого разрешения (AiryScan)
Адаптировано из Kolossov, 2017
Микроскопия сверхвысокого разрешения (AiryScan)
Адаптировано из McWilliams, 2016
37
38. Митохондриальный геном
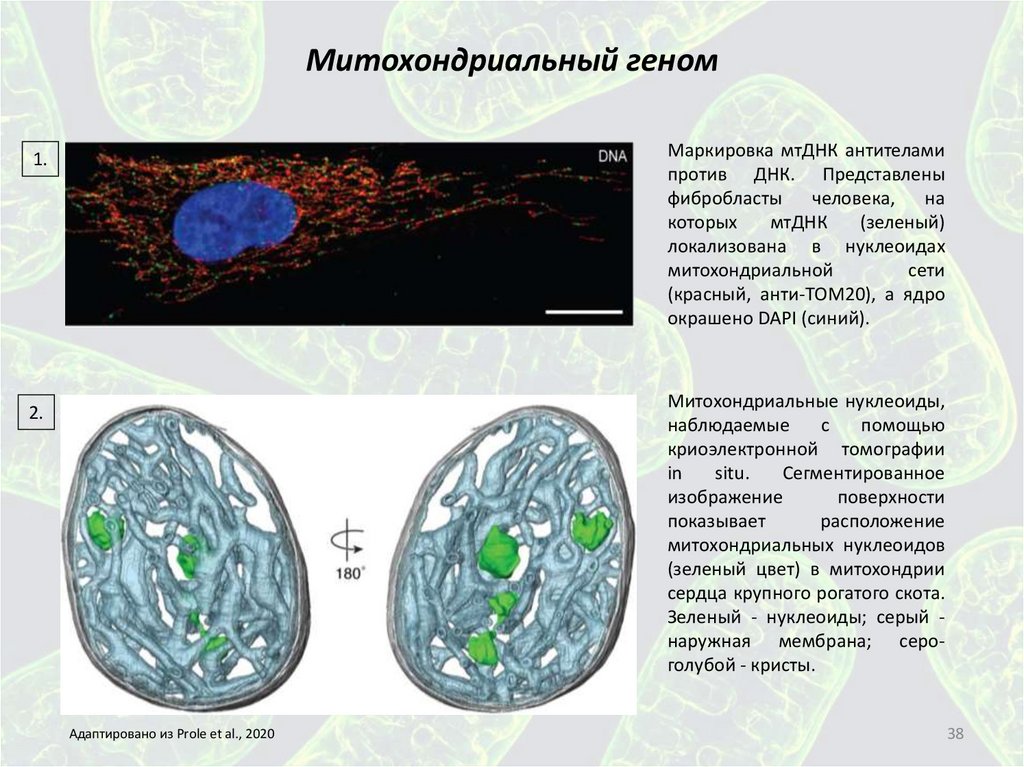
Маркировка мтДНК антителамипротив ДНК. Представлены
фибробласты человека, на
которых
мтДНК
(зеленый)
локализована в нуклеоидах
митохондриальной
сети
(красный, анти-TOM20), а ядро
окрашено DAPI (синий).
1.
Митохондриальные нуклеоиды,
наблюдаемые
с
помощью
криоэлектронной томографии
in
situ.
Сегментированное
изображение
поверхности
показывает
расположение
митохондриальных нуклеоидов
(зеленый цвет) в митохондрии
сердца крупного рогатого скота.
Зеленый - нуклеоиды; серый наружная мембрана; сероголубой - кристы.
2.
Адаптировано из Prole et al., 2020
38
39. Митохондриальная динамика
Видео демонстрирует динамический характер деления и слияния, когда фотоактивируемая митохондрия, меченная зеленымфлуоресцентным белком, делится (деление), а затем сливается с митохондрией, меченной красным флуоресцентным
белком, образуя слитую желтую митохондрию.
"Mitochondrial Dynamics — Mitochondrial Fission and Fusion in Human Diseases" , NEJM group
https://www.nejm.org/doi/full/10.1056/NEJMra1215233
39
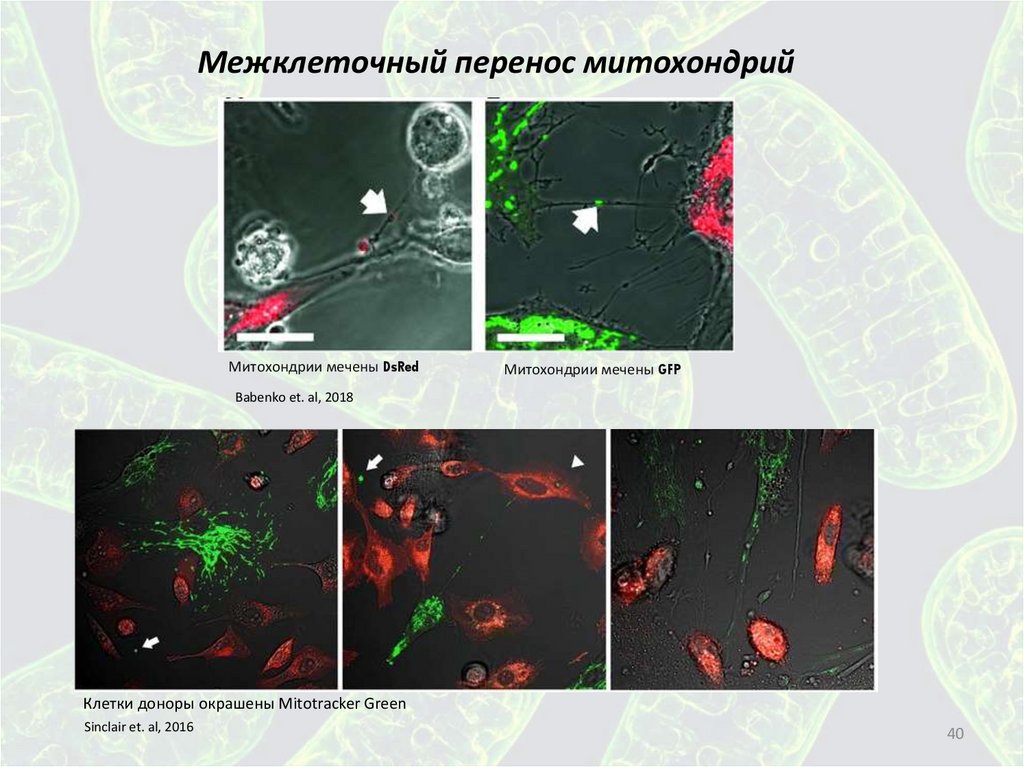
40.
Межклеточный перенос митохондрийМитохондрии мечены DsRed
Митохондрии мечены GFP
Babenko et. al, 2018
Клетки доноры окрашены Mitotracker Green
Sinclair et. al, 2016
40
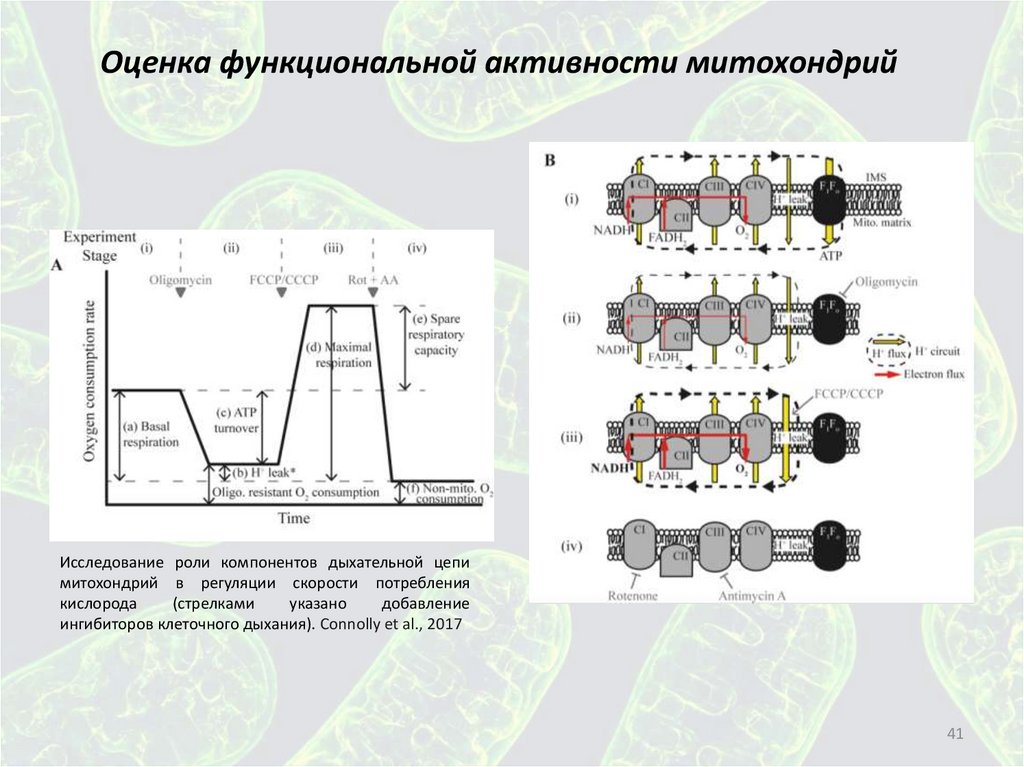
41.
Оценка функциональной активности митохондрийИсследование роли компонентов дыхательной цепи
митохондрий в регуляции скорости потребления
кислорода
(стрелками
указано
добавление
ингибиторов клеточного дыхания). Connolly et al., 2017
41
42.
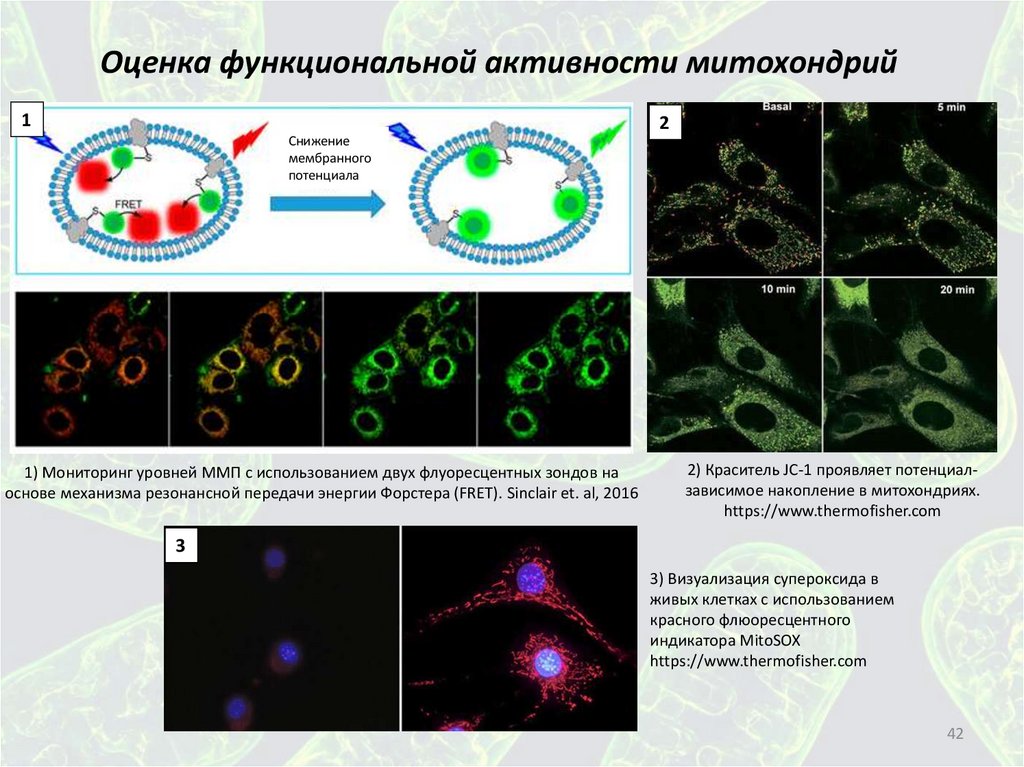
Оценка функциональной активности митохондрий1
2
Снижение
мембранного
потенциала
1) Мониторинг уровней ММП с использованием двух флуоресцентных зондов на
основе механизма резонансной передачи энергии Форстера (FRET). Sinclair et. al, 2016
2) Краситель JC-1 проявляет потенциалзависимое накопление в митохондриях.
https://www.thermofisher.com
3
3) Визуализация супероксида в
живых клетках с использованием
красного флюоресцентного
индикатора MitoSOX
https://www.thermofisher.com
42
43.
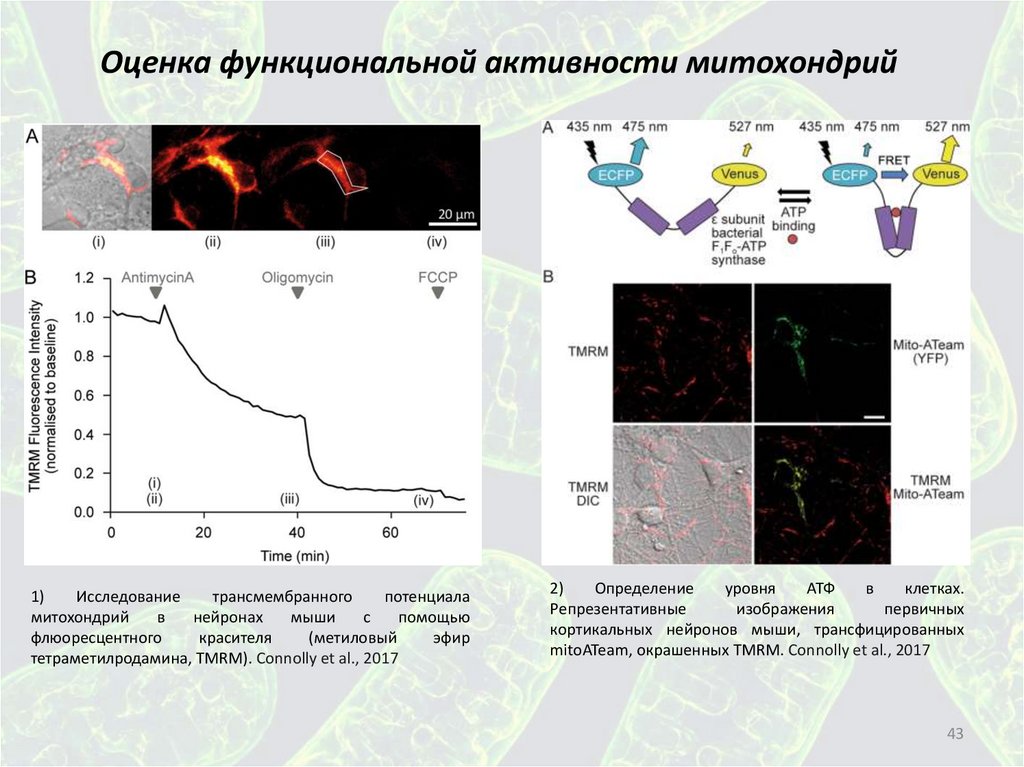
Оценка функциональной активности митохондрий1)
Исследование
трансмембранного
потенциала
митохондрий
в
нейронах
мыши
с
помощью
флюоресцентного
красителя
(метиловый
эфир
тетраметилродамина, TMRM). Connolly et al., 2017
2)
Определение
уровня
АТФ
в
клетках.
Репрезентативные
изображения
первичных
кортикальных нейронов мыши, трансфицированных
mitoATeam, окрашенных TMRM. Connolly et al., 2017
43
44.
Спасибо за внимание!44









 Биология
Биология