Похожие презентации:
Кислоты
1. Кислоты
2. ВОПРОСЫ
I. Классификация кислот.II. Свойства кислот.
3.
Кислоты – электролиты,диссоциирующие на катионы
водорода и анионы
кислотного остатка.
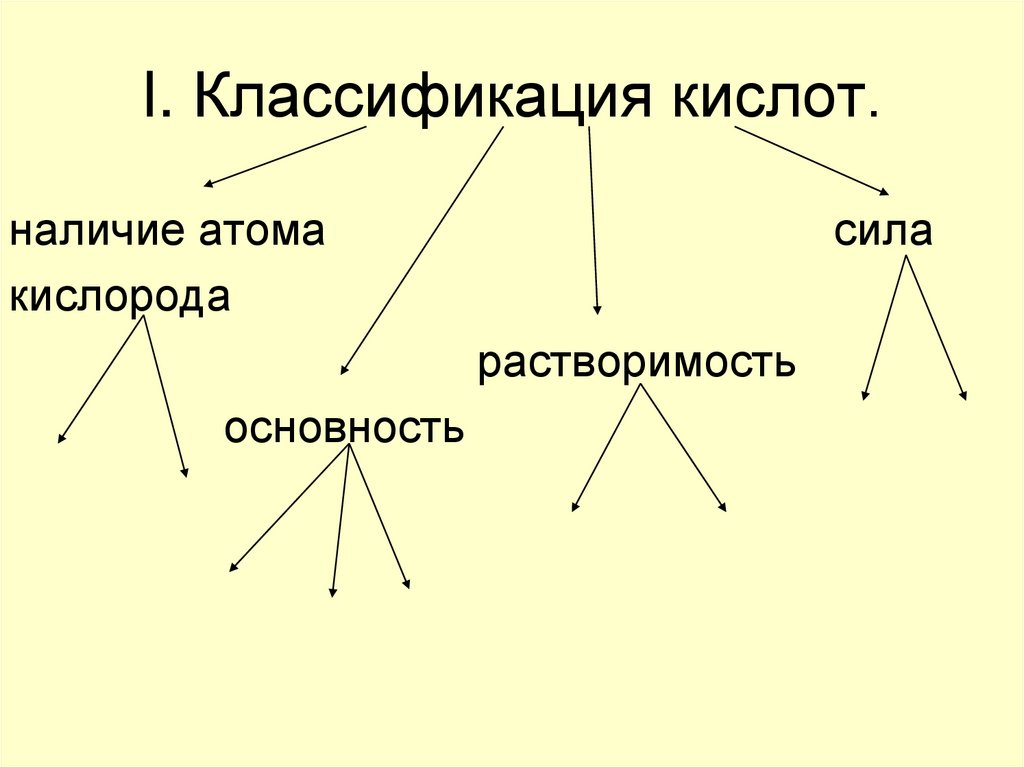
4. I. Классификация кислот.
наличие атомакислорода
сила
растворимость
основность
5.
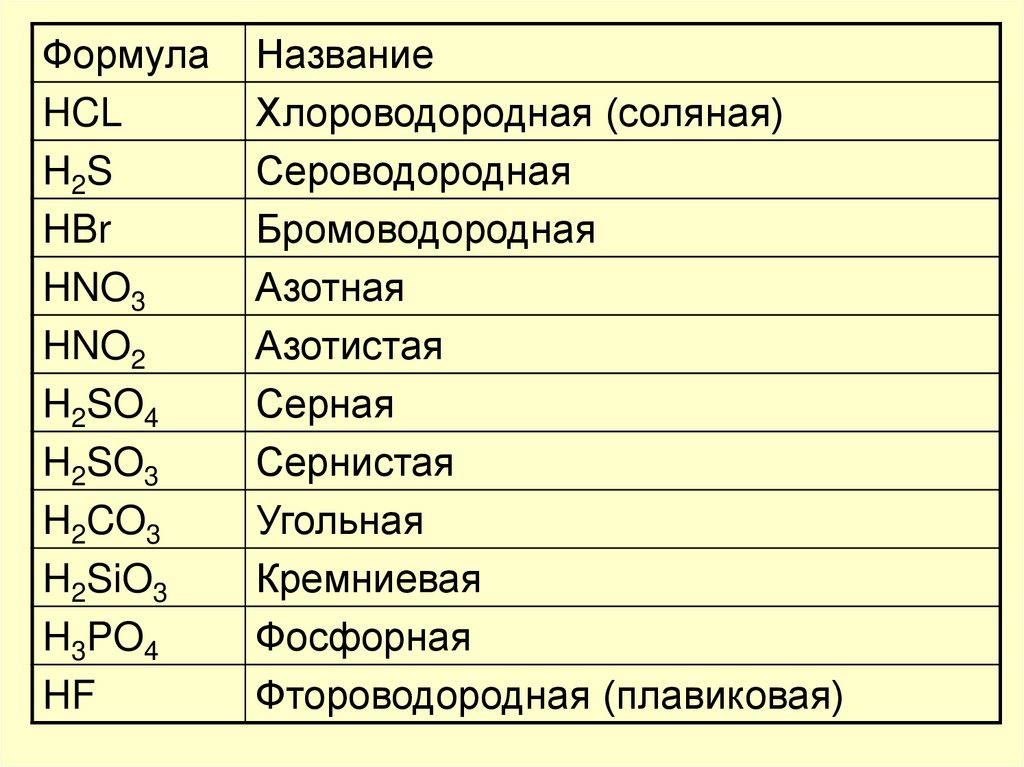
ФормулаHCL
H2S
HBr
HNO3
HNO2
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
HF
Название
Хлороводородная (соляная)
Сероводородная
Бромоводородная
Азотная
Азотистая
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Фтороводородная (плавиковая)
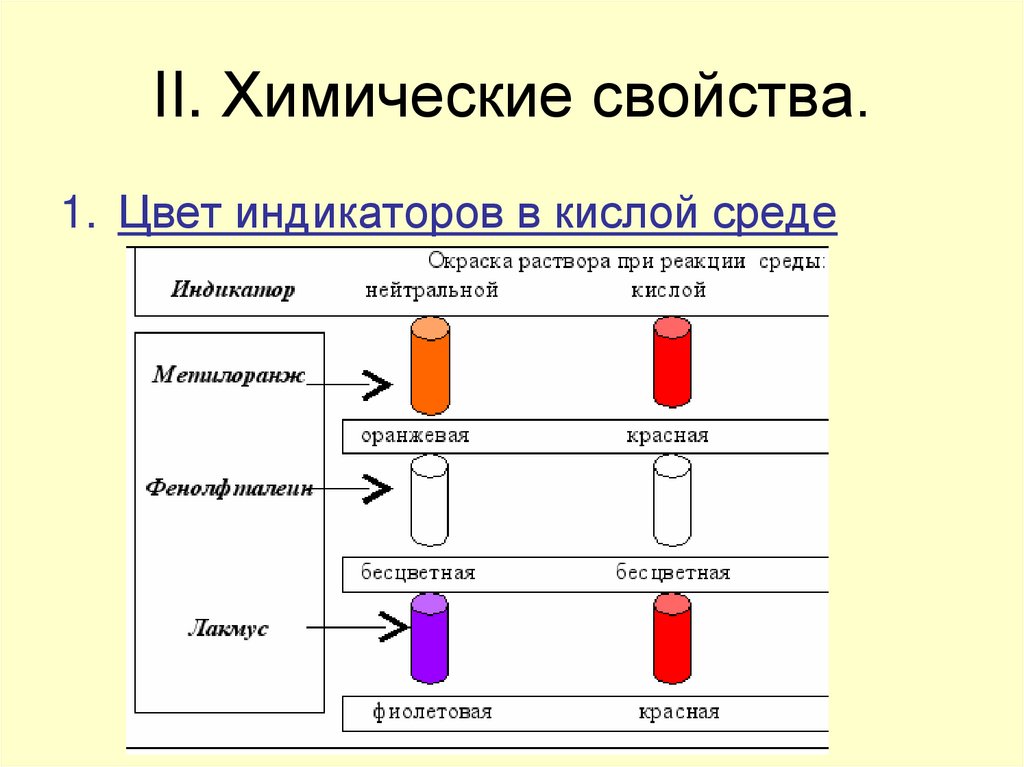
6. II. Химические свойства.
1. Цвет индикаторов в кислой среде7. 2. Взаимодействие с металлами
металл + кислота→соль + водород2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2
Реакция возможна, если:
1. Металл находится в ряду активности до водорода;
2. В результате реакции получается растворимая соль;
3. Кислота растворима .
Cu + HCl;
Al + H3PO4; Zn + H2SiO3
8. 3. Взаимодействие с основными оксидами
Основный оксид + кислота → соль + водаMgO + 2 HCl → MgCl2 + H2O
Реакция возможна, если в
результате получается
растворимая соль
9. 4. Взаимодействие с основаниями
Основание + кислота → соль + вода3 NaOH + H3PO4→ Na3PO4 + 3H2O
Реакция между щелочью и кислотой с
образованием соли и воды называется
реакцией нейтрализации.
10. 5. Взаимодействие с солями
Соль + кислота → новая кислота + новая соль3 Li2CO3 + 2 H3PO4 →2 Li3PO4 + 3 H2O + 3 CO2
Реакция возможна, если в
результате образуется осадок,
газ или слабый электролит









 Химия
Химия








