Похожие презентации:
2025г_лекция_3_Энергетика_химических_реакций_Элементы_химической
1.
ЭЛЕМЕНТЫХИМИЧЕСКОЙ
ТЕРМОДИНАМИКИ
И
ХИМИЧЕСКОГО
РАВНОВЕСИЯ
2.
Солнечная энергия – основной источникжизни.
Фотосинтез идет в автотрофных клетках.
6nCO2 + 5nH2O (C6H10O5)n + 6nO2
Для живых организмов – химическая
энергия играет основную роль.
С6Н12О6 + 6O2 6СО2 + 6Н2O + Q
3.
В гетеротрофных клетках идут процессыдиссимиляции
АТФ + H2O АДФ + Фн + H
Макроэргические соединения –
соединения богатые энергией.
Биоэнергетика – наука, изучающая
превращение энергии в организме.
4.
Химическая термодинамика – наука овзаимопревращениях теплоты и энергии,
в том числе энергии химических
процессов (середина 19 века).
Позволяет количественно рассчитывать
превращения энергии в биохимических
реакциях и предсказать их направление.
Математическая модель живых систем –
совокупность термодинамических
уравнений.
5.
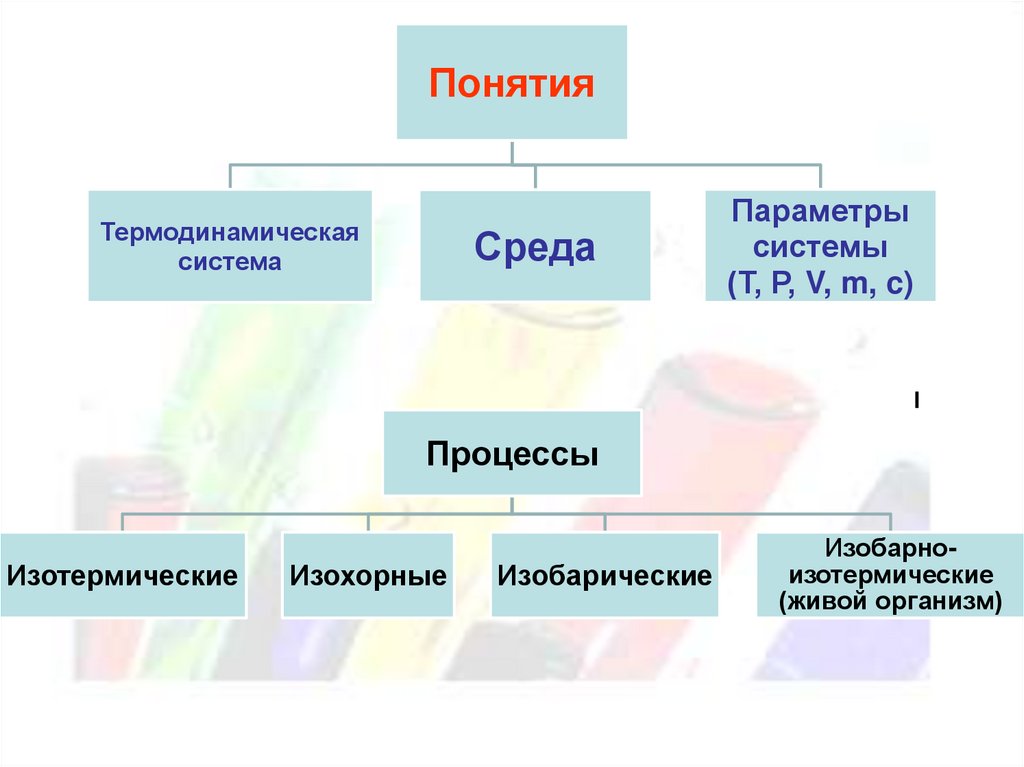
ПонятияТермодинамическая
система
Среда
Параметры
системы
(Т, Р, V, m, c)
Процессы
Изотермические
Изохорные
Изобарические
Изобарноизотермические
(живой организм)
6.
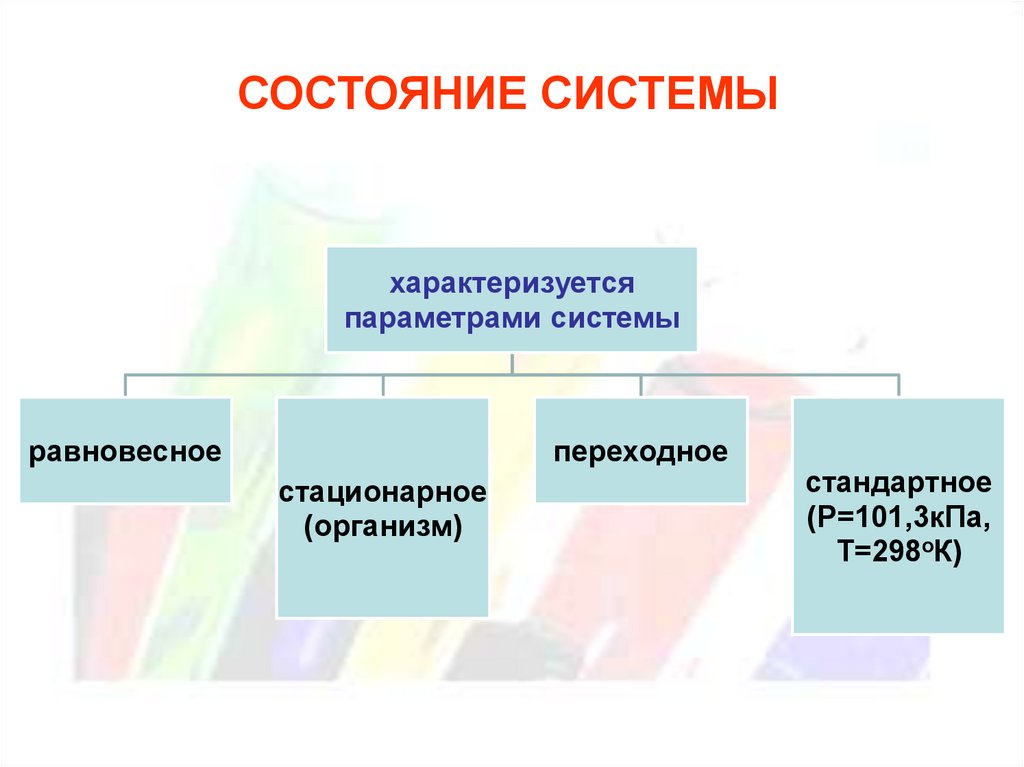
СОСТОЯНИЕ СИСТЕМЫхарактеризуется
параметрами системы
равновесное
переходное
стационарное
(организм)
стандартное
(Р=101,3кПа,
Т=298оК)
7.
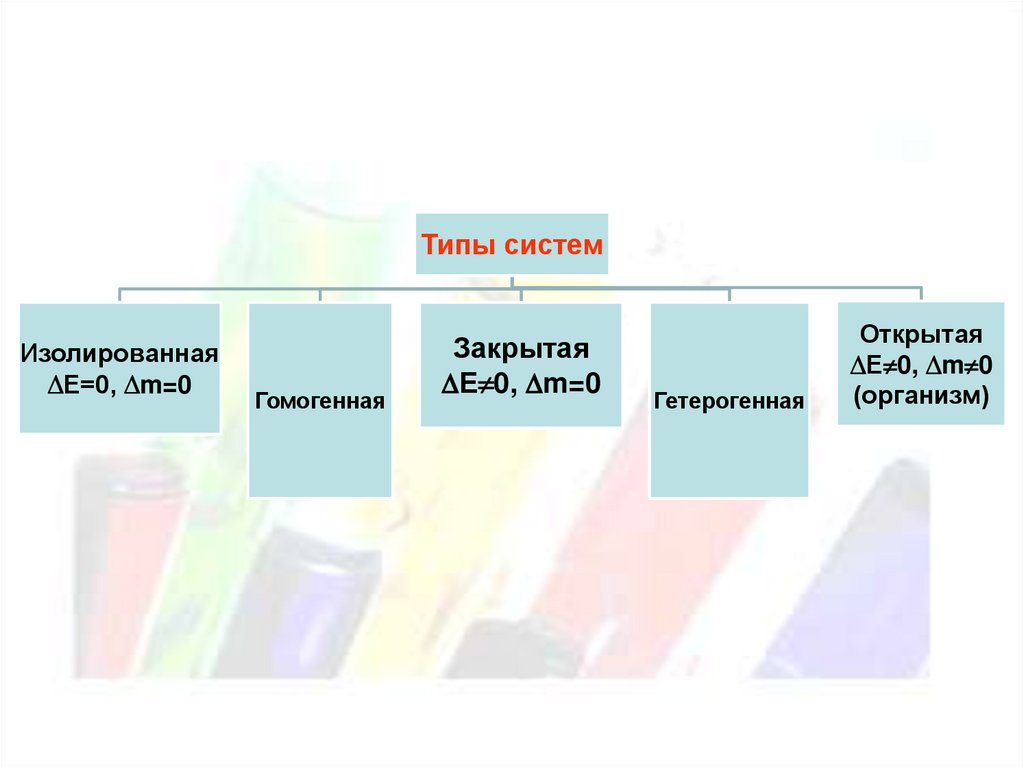
Типы системИзолированная
Е=0, m=0
Гомогенная
Закрытая
Е 0, m=0
Гетерогенная
Открытая
Е 0, m 0
(организм)
8.
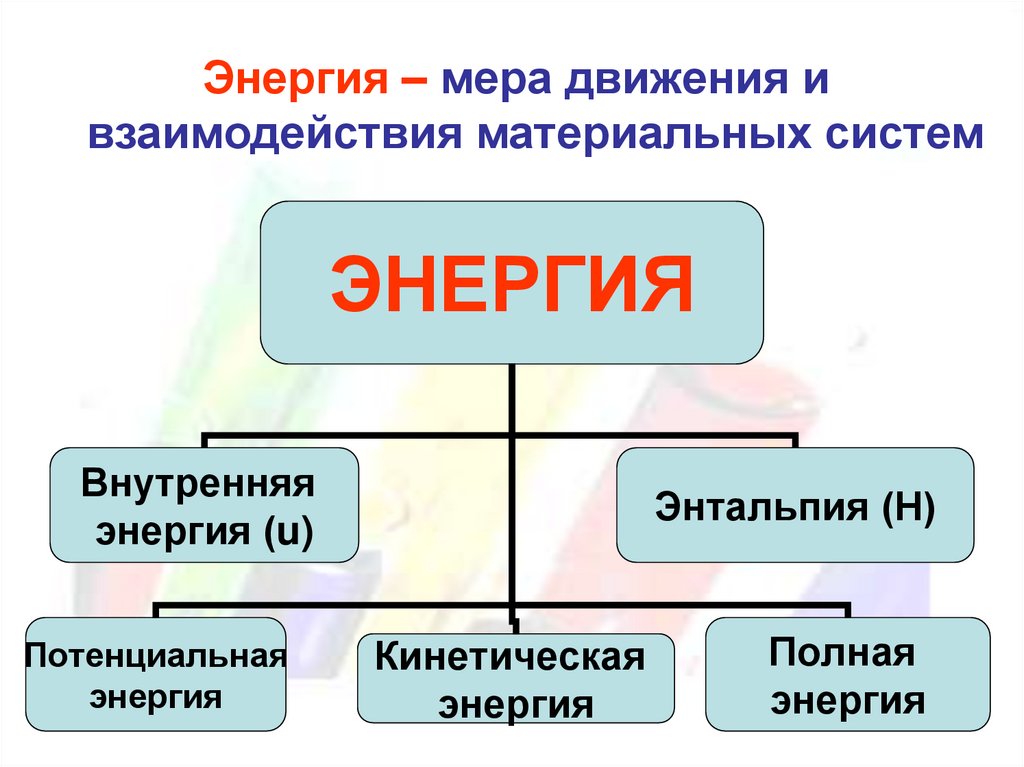
Энергия – мера движения ивзаимодействия материальных систем
ЭНЕРГИЯ
Внутренняя
энергия (u)
Потенциальная
энергия
Энтальпия (Н)
Кинетическая
энергия
Полная
энергия
9.
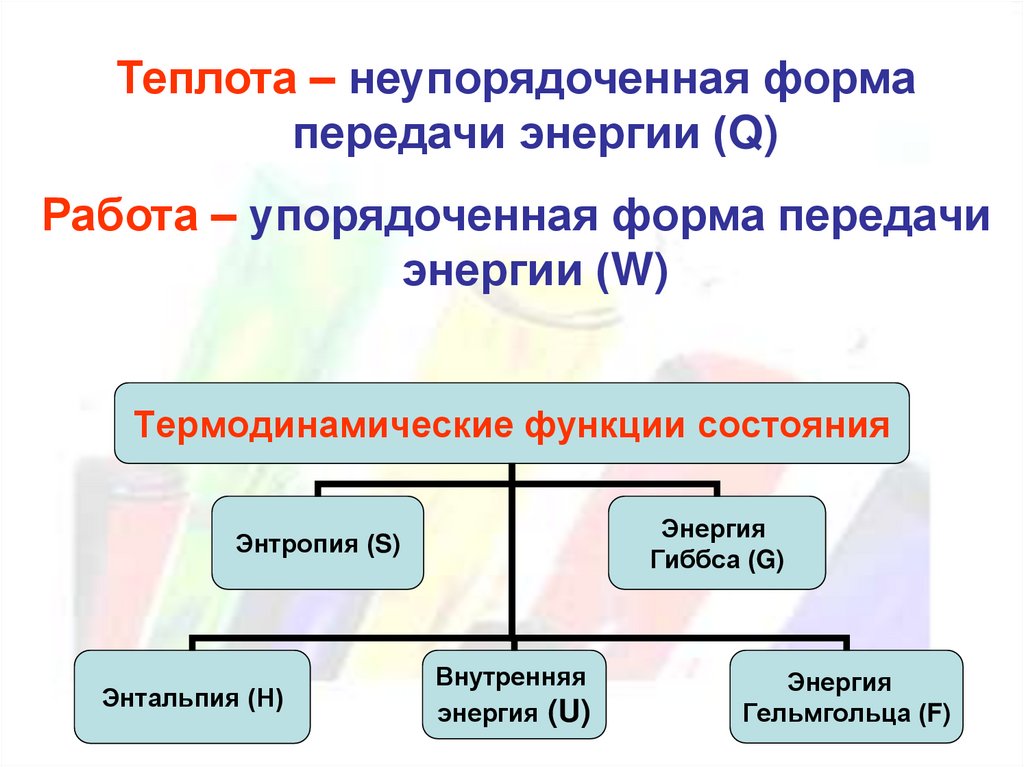
Теплота – неупорядоченная формапередачи энергии (Q)
Работа – упорядоченная форма передачи
энергии (W)
Термодинамические функции состояния
Энергия
Гиббса (G)
Энтропия (S)
Энтальпия (Н)
Внутренняя
энергия (U)
Энергия
Гельмгольца (F)
10.
I начало (закон) термодинамики(Р. Майер, Д. Джоуль, Г.Л. Гельмгольц)
Это закон сохранения энергии
1. Энергия не создается и не уничтожается.
Возможен лишь переход из одного вида в другой в
строго эквивалентных количествах
2. Внутренняя энергия изолированной системы есть
величина постоянная
3. Невозможно создать вечный двигатель, который
совершал бы работу без затраты энергии (вечный
двигатель I рода)
11.
Q = U + WДля изобарного процесса W = p V
Qp = U + p V
Энтальпия (Н): Н =- Qp, откуда
Н = U + p V
Нo – стандартная теплота реакции (n=1 моль,
Т=298о К, =101,3 кПа)
12.
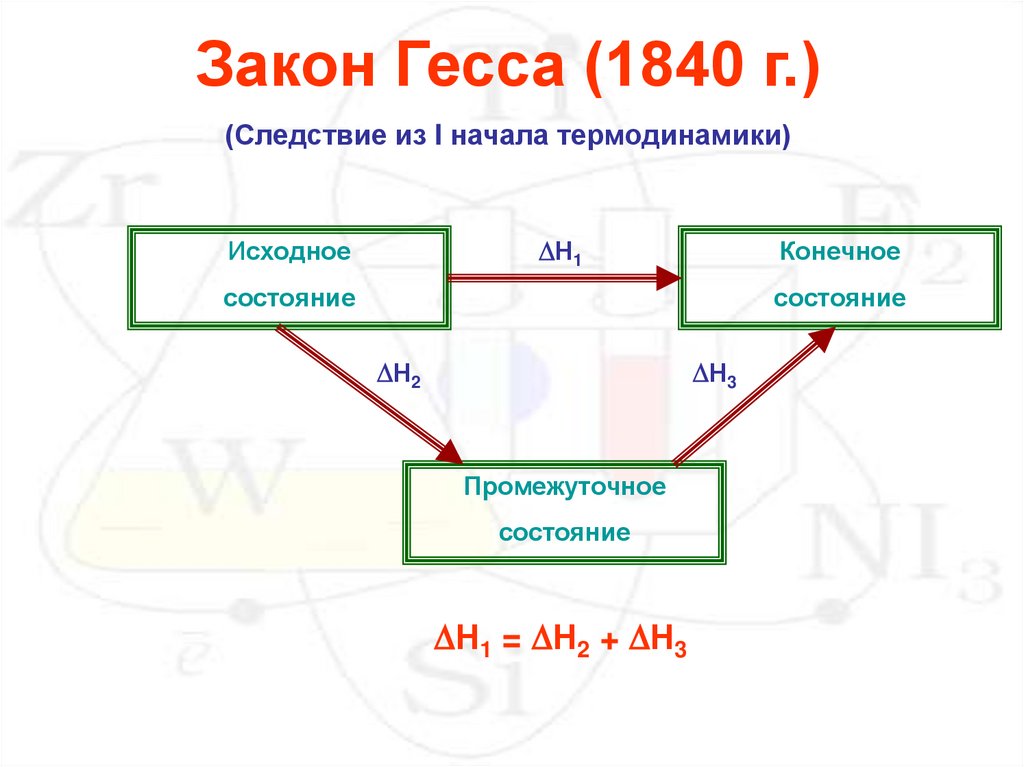
Закон Гесса (1840 г.)(Следствие из I начала термодинамики)
Н1
Исходное
Конечное
состояние
состояние
Н2
Н3
Промежуточное
состояние
Н1 = Н2 + Н3
13.
Следствие из закона Гесса(следствие из I начала термодинамики)
1. Нор-ии = m Нообр.(прод.) - n Нообр.(исх.в-в)
2. Нор-ии = m Носгор.(исх.в-в) - n Носгор.(прод.)
Понятия:
а) стандартная теплота образования.
б) стандартная теплота сгорания.
в) стандартная теплота химической реакции.
Нообразования простых веществ = 0
Носгорания конечных продуктов = 0
14.
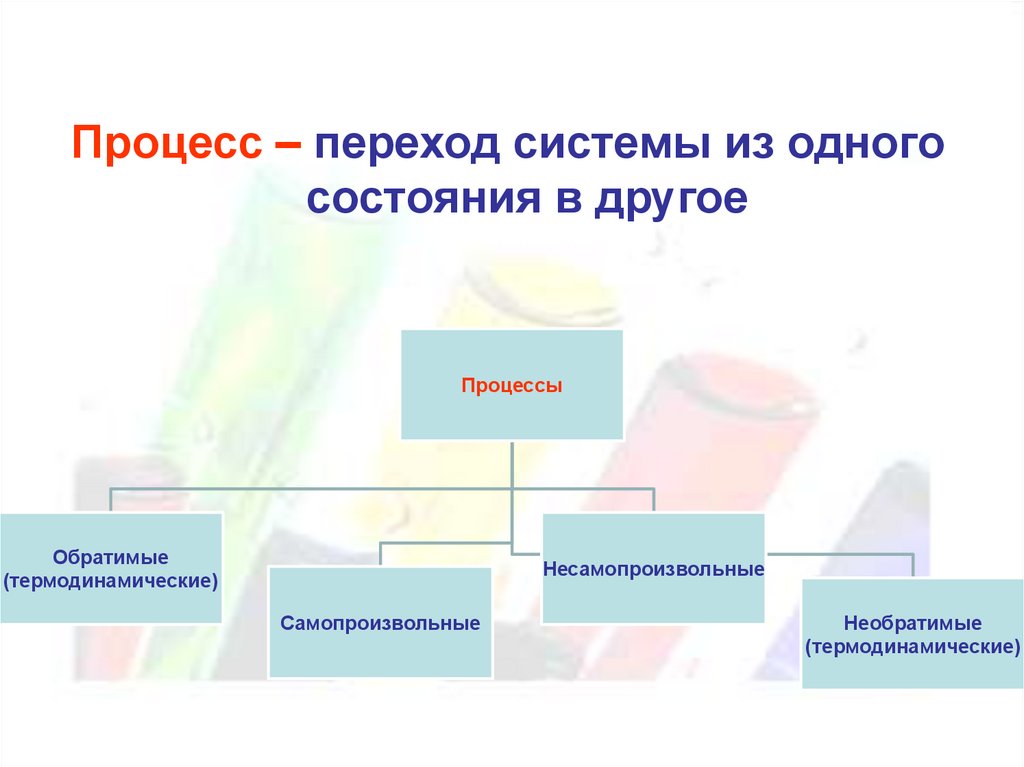
Процесс – переход системы из одногосостояния в другое
Процессы
Обратимые
(термодинамические)
Несамопроизвольные
Самопроизвольные
Необратимые
(термодинамические)
15.
Новая термодинамическая функциясостояния – энтропия (S).
Она характеризует степень неупорядоченности материи.
S = k lnW (Больцман)
W – вероятность состояния
k = R/NA
S – определяется согласно постулату М. Планка
(S при 0о К = 0)
Sор-ции = m Soпрод. - n Soисх.в-в
16.
II начало (закон) термодинамики1. Невозможен самопроизвольный переход тепла от
тела менее нагретого к телу более нагретому.
2. Невозможно превратить в работу теплоту какоголибо тела, не производя никакого другого
действия, кроме охлаждения этого тела.
3. Невозможно создать такую машину, единственным
результатом действия которой было бы получение
работы за счет теплоты окружающей среды.
17.
∆Sобр = Qобр. / Тили в общем виде
∆S ≥ Q / T,
т.е. ∆S ≥ 0
Самопроизвольно идут процессы когда
∆S > 0
В обратимых процессах ∆S = 0
Все это справедливо для изолированных
систем!
Но! Организм – открытая система!
18.
Д.У. Гиббс – новая функция состояния (G)– энергия Гиббса (изобарноизотермический потенциал)
∆G = ∆H - T∆S
Объединенное уравнение I и II началов
термодинамики
∆G < 0 – самопроизвольные процессы
∆G = 0 – обратимые процессы
19.
Для неизолированныхсистем самопроизвольное
протекание процессов
характеризуется:
1.Энтальпийным фактором (∆Н)
2.Энтропийным фактором (∆S)
20.
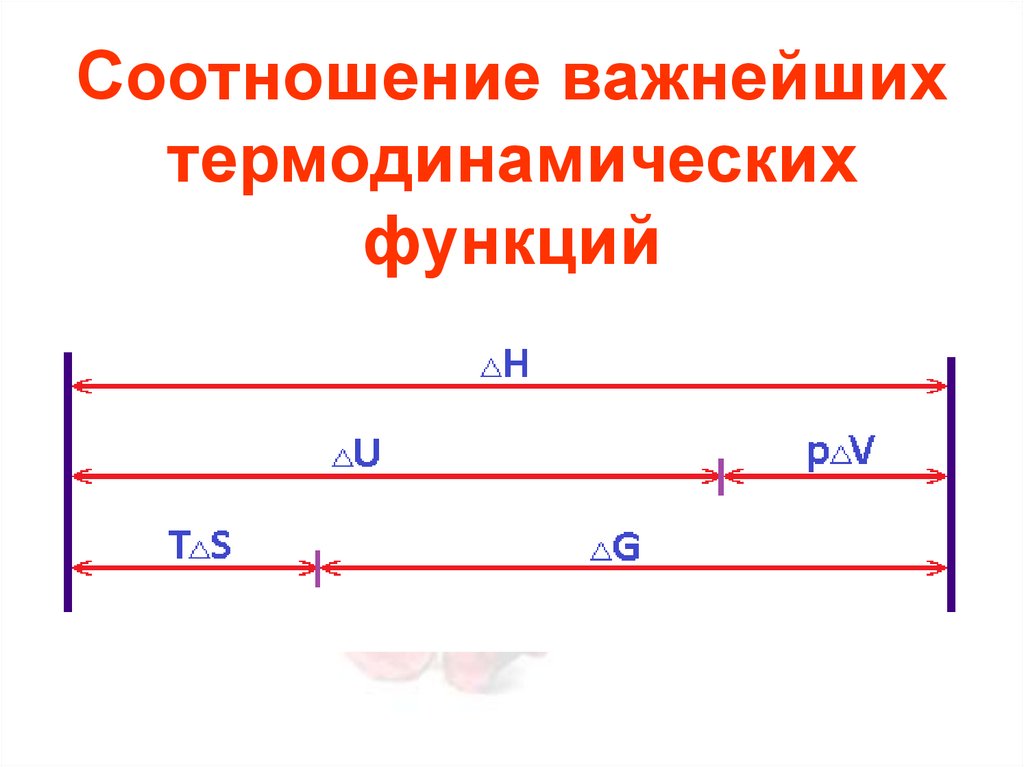
Соотношение важнейшихтермодинамических
функций
21.
В организме:Экзергонические реакции –
∆G < 0
Эндергонические реакции –
∆G > 0
22.
Принципэнергетического
сопряжения
Энергия, необходимая для
протекания эндергонических реакций,
поступает за счет осуществления
экзергонических реакций.
Интермедиат – общее вещество этих
двух реакций
23.
АТФ + Н2О ↔ АДФ + Н3РО4∆Gо = -29,2 кДж/моль
Экзергоническая реакция
С6Н12О6 + Н3РО4 ↔
↔ глюкоза-6-фосфат + Н2О
∆Gо = +13,1 кДж/моль
Эндергоническая реакция
Н3РО4 - интермедиат
24.
Обратимыми по направлениюхимическими реакциями
называются такие реакции,
которые при данных внешних
условиях могут
самопроизвольно протекать
как в прямом, так и в обратном
направлении.
25.
Н2(газ) + J2(газ) 2HJ (газ),Go = 1,6 кДж/моль
Hb(р-р) + О2(газ) НbО2(р-р),
Go = -11 кДж/моль
С6Н12О6(тв) + 6О2(газ) 6СО2(газ) + 6Н2О(ж-ть),
Go = -2880 кДж/моль
Реакции обратимы, если
| Gреакции| 10 кДж/моль
26.
Гульдберг, Вааге и Бекетов открыли закон действующихмасс (здм).
Он отражает соотношение между равновесными
концентрациями реагирующих веществ. Вытекает из II
закона термодинамики.
Для реакции:
аА + bB dD + eE
C
C
Пс =
C C
d
D
a
A
e
E
b
B
[ D] [ E ]
d
Кс
[ A] [ B]
a
e
b
27.
G р-ции = G0 +RTlnПcGо р-ции = -RTlnkc, т.к. при равновесии
Gо р-ции = 0 (стандартные условия)
С учетом этого:
Пс
G RT ln
Кс
Это уравнение изотермы химической реакции.
при Пc>Кc G>0 - в системе будет протекать обратная реакция
при Пc<Кc G<0 - в системе будет протекать прямая реакция
28.
КОНСТАНТЫ РАВНОВЕСИЯ:1) По способу выражения
а а
а) термодинамическая Ка =
а а
d
D
a
A
[ D] [ E ]
d
б) концентрационная К с
e
E
b
B
e
[ A]a [ B]b
в) для газов через давление Кр =
Р Р
Р Р
d
D
a
A
e
E
b
B
29.
2) По типу реакцииа) константа диссоциации (ионизации)
HNO2 H+ + NO2- K(HNO2)
б) константа гидролиза
NH4+ + HOH NH4OH + H+
Kгидр.
в) константа автопротолиза воды
H2O + H2O H3O+ + OH-
K(H2O)
г) константа образования (нестойкости) комплексов
Cu2+ + 4NH3 [Cu(NH3)4]2+ Kобр.
30.
Влияние температуры на величинуконстанты химического равновесия
выражается уравнением:
K 2 H 1
1
ln
K1
R T1 T2
o
К2 и К1 – константы равновесия при температурах Т2 и Т1,
соответственно;
Но – стандартная энтальпия данной реакции.
Это уравнение называют
уравнением изобары химической реакции.
31.
Принцип смещения химического равновесия был сформулирован Ле-Шательев 1884 году.
Если на систему, находящуюся в
равновесии, воздействовать извне,
изменив какое-либо из условий, то в
результате протекающих в ней
процессов равновесие начнет
смещаться в том направлении, в
котором эффект воздействия
уменьшается.
Это Т, С, Р (для газов).
! катализаторы не влияют на химическое равновесие























 Химия
Химия








