Похожие презентации:
№7_Химиялық_реакциялардың_жылу_эффектісі_және_оның_маңызы_
1. Сабақтың тақырыбы: Химиялық реакциялардың жылу эффектісі
САБАҚТЫҢ ТАҚЫРЫБЫ:ХИМИЯЛЫҚ РЕАКЦИЯЛАРДЫҢ
ЖЫЛУ ЭФФЕКТІСІ
2.
3. «Сіз білесіз бе?»
«СІЗ БІЛЕСІЗ БЕ?»4.
5.
Жылу бөлінуі немесе сіңіруідеген ұғымдар таныс па?
Қандай тақырыпта
кездестірдіңдер?
6.
Жылудыңбөлінуі
7.
Қауіпсіздіктехникасының
ережелері.
8.
Химикаттармен жұмыс істейтінмектеп оқушылары
қауіпсіздік техникасының ережелерін
қатаң сақтау керек.
9.
Заттардықыздыру.
Газ
жанарғысын
жақпас бұрын
шырпыны
жағып
дайындап
алу
керек.
10.
Зат иісін анықтау.Егер газ күйіндегі заттың иісін сезгің келсе
Оның ыдысын мұрыннан алысырақ ұстап,
аздап желпіп көру керек.
11.
Химия лабораториясы мен кабинетіндежұмыс істеудің қауіпсіздік
техникасының ережелері
☞
12.
Лабораторияда әр зат аты жазылып,белгілі орында сақталуы керек.13.
Алдымен орындалатын жұмыспен танысып алу керек.14.
Тәжірибеге қажетті заттарды мүмкіндігінше дәл мөлшерде жәнеаз етіп алу керек.Реактивтерді үнемді қолдана білу керек
15.
Қыздырып жатқан ыдыс аузына үңілуге болмайды.16.
Артық алынған реактивтің қалғанын қайтадан17.
Тәжірибеге қажетті заттарды мүмкіндігінше дәл мөлшерде жәнеаз етіп алу керек.Реактивтерді үнемді қолдана білу керек
18.
Лабораторияда және кабинетте тек таза зат пен таза ыдыс қолданылатынынүнемі есте сақтау керек
19.
Сақтық ережелерін орындамаса кез келген зат қауіпті болуы мүмкін20.
1. Реакцияның жылу эффектісі деген не?2. Экзотермиялық және эндотермиялық реакциялардың
айырмашылығы неде?
3. Химиялық реакцияның жылу эффектінің шамасы
қандай факторларға тәуелді болады?
4. Берілген реакциялардағы термохимиялық теңдеулерден
қайсысы экзотермиялық екенін анықтаңда:
а) HCI + NaOH = NACI + H2O + Q
ә) CaCO3 = CaO + CO2 – Q
5. Термохимиялық реакция теңдеуі бойынша мынадай
жылу бөлінсе: C + O2 = CO2 + 393 кДж, 2г көмір
жанғанда қандай жылу бөлінеді?
6. Егер термохимиялық реакция теңдеуі бойынша
мынадай жылу жұмсалса: 2H2O = H2 + O2 – 572 кДж,
ал 268 кДж жылу жұмсалса, қанша грамм су
ыдырайды?
21. Тапсырма №1. Тұздарды сапалық құрамы мен табиғатын сәйкестендіріңіз.
ТАПСЫРМА №1.ТҰЗДАРДЫ САПАЛЫҚ ҚҰРАМЫ МЕН
ТАБИҒАТЫН СӘЙКЕСТЕНДІРІҢІЗ.
Тұздың табиғаты
Тұз формуласы
Күшті қышқыл мен күшті негізден түзілген тұз
Li3PO4
Күшті қышқыл мен әлсіз негізден түзілген тұз
KCl
Әлсіз қышқыл мен күшті негізден түзілген тұз
CuCl2
22. Тапсырма №2.
ТАПСЫРМА №2.Теңдеулердің қайсысы эндотермиялық, қайсысы
экзотермиялық реакцияны көрсететінін анықтаңыз.
Химиялық реакция
Экзотермиялық
Эндотермиялық
2 H2+ O2= 2 H2О
С + 2H2 = CH4
СаCO3 = СаO + CO2
С + СО2 = 2СО
23.
Тапсырма №3. Саралау тапсырмалар (Кім жылдам?)1. Н2 + I2 → 2HI – 50кДж термохимиялық теңдеу бойынша 3моль сутек
реакцияға қатысса, қанша энергия бөлінетінің есептеңдер. (Жауабы:
150кДж)
2. СН4 + 2О2 → СО2 + 2Н2О+ 892кДж термохимиялық теңдеу бойынша 4кг
метан жанса, қанша жылу бөлінеді? (Жауабы: 223000кДж)
3. Мыс оттекпен әрекеттескенде, 69кДж энергия бөлінді. Егер реакцияның
термохимиялық теңдеуі мынадай болса: 2Сu +O2 → 2CuO + 276 кДж
қанша грамм мыс реакцияға түсті. (Жауабы: 16г)
4. Көлемі 67,2л (қ.ж.) азот оттекпен әрекеттескенде 542,4кДж энергия
сіңірілді. Термохимиялық реакция теңдеуін құрастырыңдар. (Жауабы:
N2 + O2 → 2NO – 180.8кДж)
24.
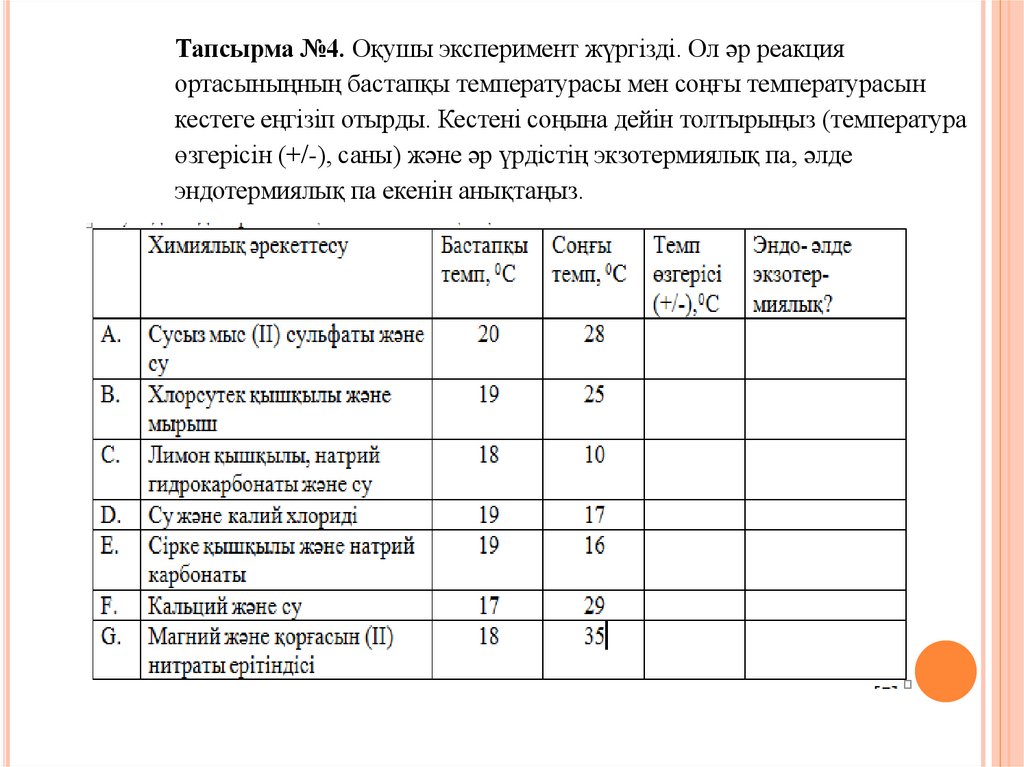
Тапсырма №4. Оқушы эксперимент жүргізді. Ол әр реакцияортасыныңның бастапқы температурасы мен соңғы температурасын
кестеге еңгізіп отырды. Кестені соңына дейін толтырыңыз (температура
өзгерісін (+/-), саны) және әр үрдістің экзотермиялық па, әлде
эндотермиялық па екенін анықтаңыз.
25.
Тапсырма №3. Сөйлемдерді аяқтаңдар................................. - энергияның бір түрінің екінші түріне
ауысуын зерттейді. Сырттан жылуды қажет ететің реакция
- ............................ реакция деп аталады. Керісінше, жылу
бөле жүретін реакция - .......................................... реакция
деп аталады. Термохимиялық теңдеу бұл реакцияға түскен
бір моль заттын ........... ................. көрсетілген теңдеу.
26. Оқушылардың өзіндік жұмысына арналған есептер.
ОҚУШЫЛАРДЫҢ ӨЗІНДІК ЖҰМЫСЫНААРНАЛҒАН ЕСЕПТЕР.
1 – деңгей
Дұрыс жауапқа сәйкес келетін әріпті жаз.
1. Экзотермиялық реакция кезінде:
А) жылу сіңіреді;
Ә) жылу бөлінбейді;
Б) жылу бөлінеді;
В) ешқандай өзгеріс болмайды.
Жауабы: _____
2. Эндотермиялық реакция кезінде:
А) жылу сіңіреді;
Ә) жылу бөлінбейді;
Б) жылу бөлінеді;
В) ешқандай өзгеріс болмайды.
Жауабы: _____
27.
3. Химиялық реакцияларда бөлінетін немесе сіңірілетін энергияның мөлшері қандайқұралмен өлшенеді:
А) электрометр;
Ә) калориметр;
Б) вольтметр;
В) амперметр.
Жауабы: _____
4. Химиялық реакциялар кезінде бөлінетін немесе сіңіретін жылу мөлшері қалай
аталады:
А) химиялық реакция;
Ә) химиялық реакция теңдеуі;
Б) реакцияның жылу эффектісі;
В) экзотермиялық реация.
Жауабы: _____
5. Реакцияның жылу эффектісі көрсетілген химиялық реакциялар қалай аталады:
А) термохимиялық теңдеулер;
Ә) эндотермиялық реакциялар;
Б) химиялық реакция;
В) реакцияның жылу эффектісі.
Жауабы: _____
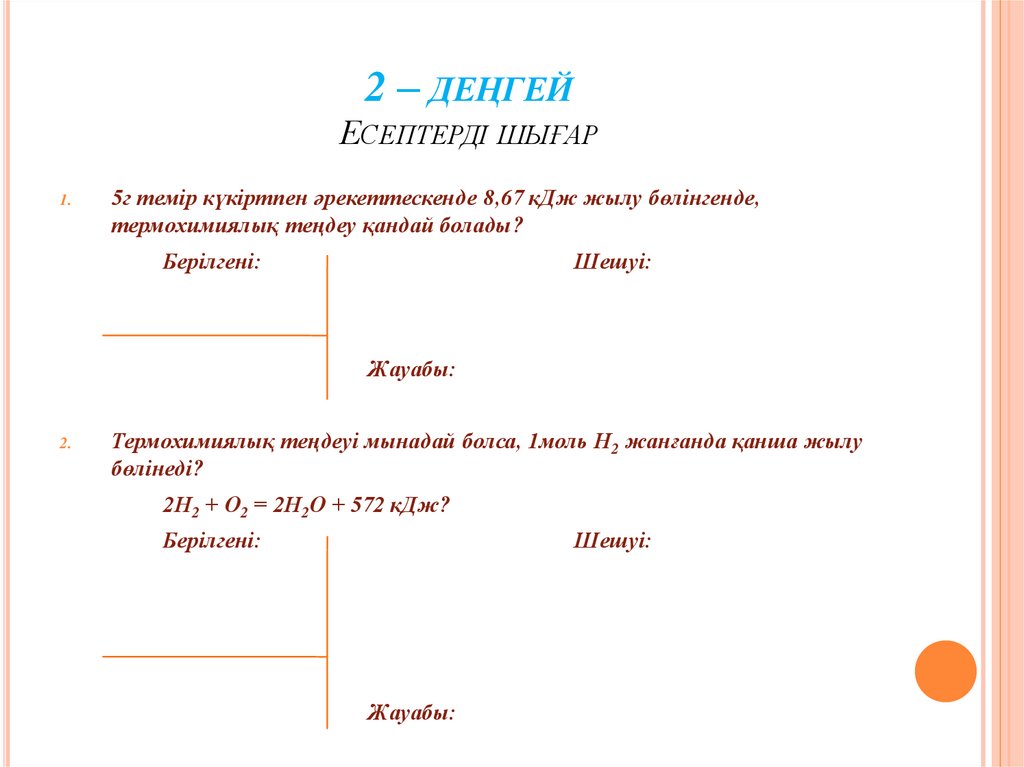
28. 2 – деңгей Есептерді шығар
2 – ДЕҢГЕЙЕСЕПТЕРДІ ШЫҒАР
1.
5г темір күкіртпен әрекеттескенде 8,67 кДж жылу бөлінгенде,
термохимиялық теңдеу қандай болады?
Берілгені:
Шешуі:
Жауабы:
2.
Термохимиялық теңдеуі мынадай болса, 1моль Н2 жанғанда қанша жылу
бөлінеді?
2Н2 + О2 = 2Н2О + 572 кДж?
Берілгені:
Шешуі:
Жауабы:
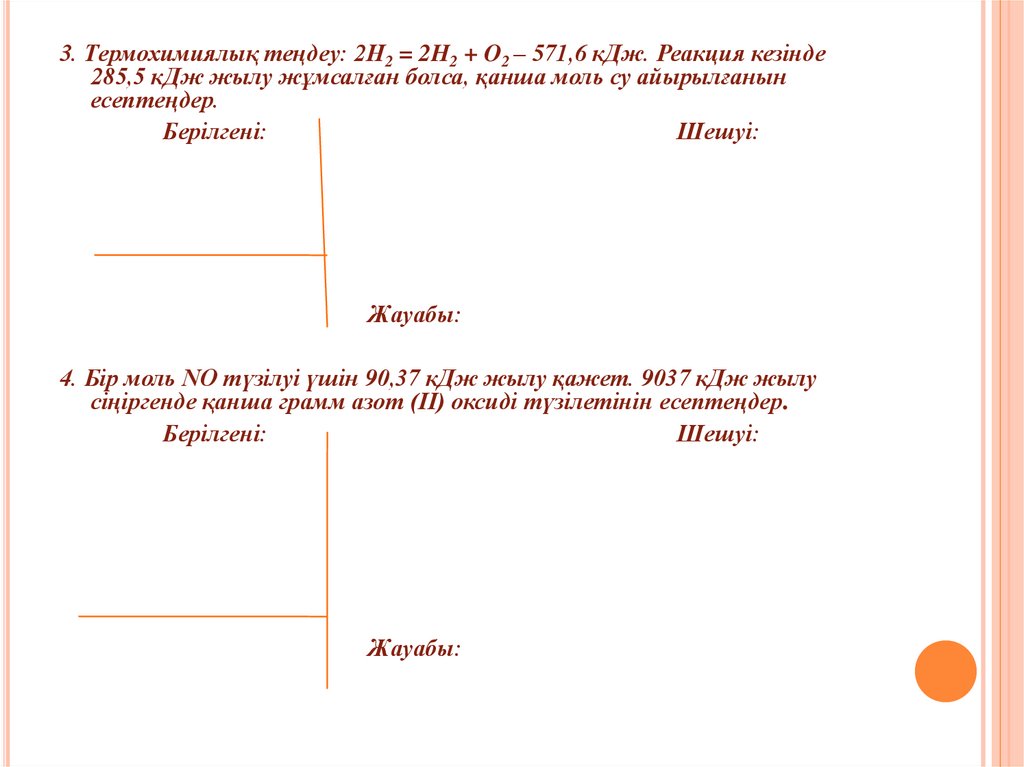
29.
3. Термохимиялық теңдеу: 2H2 = 2H2 + O2 – 571,6 кДж. Реакция кезінде285,5 кДж жылу жұмсалған болса, қанша моль су айырылғанын
есептеңдер.
Берілгені:
Шешуі:
Жауабы:
4. Бір моль NO түзілуі үшін 90,37 кДж жылу қажет. 9037 кДж жылу
сіңіргенде қанша грамм азот (ІІ) оксиді түзілетінін есептеңдер.
Берілгені:
Шешуі:
Жауабы:
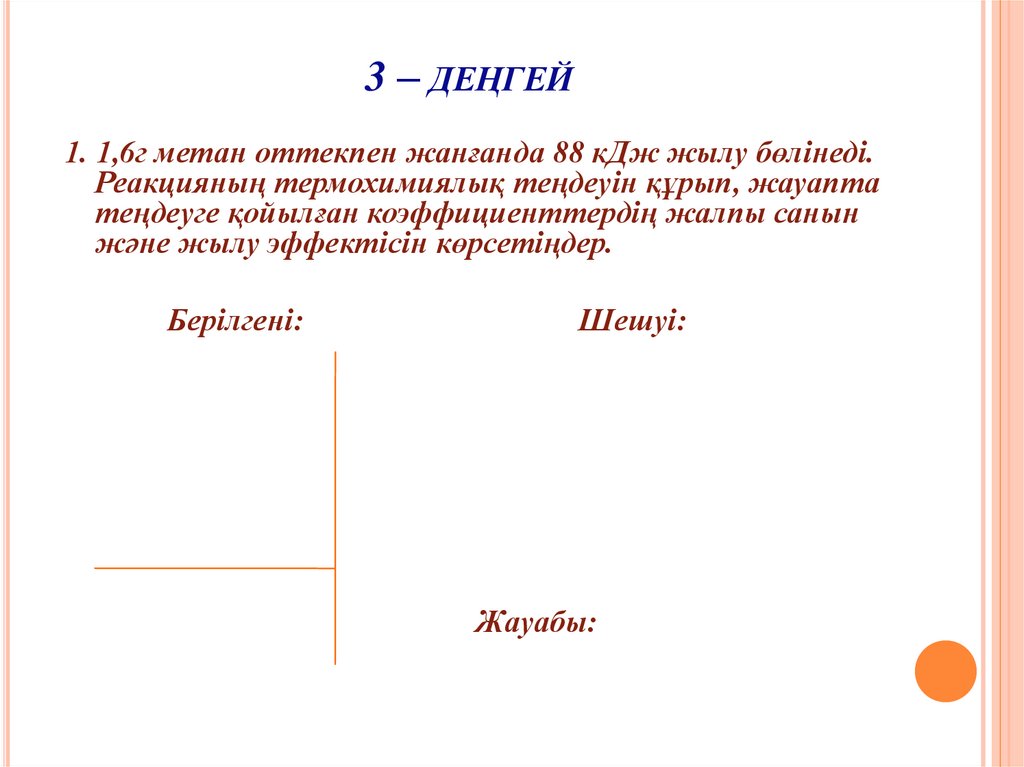
30. 3 – деңгей
3 – ДЕҢГЕЙ1. 1,6г метан оттекпен жанғанда 88 кДж жылу бөлінеді.
Реакцияның термохимиялық теңдеуін құрып, жауапта
теңдеуге қойылған коэффициенттердің жалпы санын
және жылу эффектісін көрсетіңдер.
Берілгені:
Шешуі:
Жауабы: