Похожие презентации:
Химиялық формула
1. Қайталау 8 cынып
2.
Химиялық формула –заттың құрамын химиялық элемент таңбалары жәнеиндекстері көмегімен шартты түрде бейнелеу.
Индекс - затттың құрамындағы элементтердің атом санын көрсетеді.
Коэффициент - бір-бірімен бойланыспаған бөлшектер санын көрсетеді.
Химиялық формула
Коэффициент
Индекс
Осы заңның негізінде химиялық формулалар, коэффициенттері мен
математикалық символдарды пайдаланып химиялық реакциялар
теңестіріледі.
3.
4.
Зат массасының сақталу заңы - реакцияғақатысқан
заттардың
массасы
реакция
нәтижесінде түзілген заттардың массасына
тең болады.
Химиялық теңдеулер – химиялық реакциялардың
теңдеулері деп химиялық таңбалар мен формулаларды
қолданып заттардың өзара әрекеттесуін шартты
түрде жазуды айтамыз.
5.
Химиялық теңдеудің сол жағына әрекеттесушізаттардың формуласын, ал оң жағына жаңадан
түзілген
заттардың
формуласын
жазады.
Әрекеттесуші заттар – реакцияға кіріскен
реакцияласушы заттар не қысқаша реагенттер деп
аталады. Сол сияқты жаңадан түзілген заттар
реакциядан шыққан заттар немесе өнімдер деп
аталады.
6. Зат массасының сақталу заңының ашылуы
Роберт Бойль1673г.
М. В. Ломоносов
1756г.
Антуан Лавуазье
1789г.
7.
Реакцияның жүруі үшін қажет жағдайды бағдаршаның үстіне жазып көрсетеді: қыздыру,
жоғарғы қысым , жарық
, қосымша заттардың қатысуы
.
Егер реакция өнімі газ болса, оның формуласының жанына жоғары қарай бағытталған бағдарша
қойылады , ал егер тұнба түзілсе,- бағдарша төмен қарай бағытталады . Егер реагент пен реакция
өнімі де газ немесе тұнба болған жағдайда тігінен қойылатын бағдаршалар қойылмайды. Кей жағдайда
реагент пен реакция өнімінің астына заттың аталуы жазылады.
Мысал:
Бор
сөндірілмеген әк
көмірқышқыл газ
8. Теңдеу бойынша қандай мәліметтер алуға болады
1) Сапалық және сандық кұрамы туралы мәлімет(қандай заттар және қаншасы реакцияға түседі,
кандай заттар және қандай мөлшерде түзіледі).
2) Реакцияға катысқан жөне оның нәтижесінде түзілген
зат мөлшерлерінің қатынасын табуға болады
3) Осы заттардын массаларының катынастарын табуға
болады.
4) Химиялық реакцияның түрі
5) Реакцияның жүру жағдайы
9. Коэффициенттер қою ережелері: 1. Коэффициенттерді орналастырып қою үшін құрамы жағынан ең күрделі қосылыстардаң бастау қажет және ол жұмы
Коэффициенттер қою ережелері:1. Коэффициенттерді орналастырып қою үшін құрамы жағынан ең
күрделі қосылыстардаң бастау қажет және ол жұмысты келесі
реттілікпен орындау керек:
а) металл атомдарының санын теңестіру,
б) қышқыл қалдықтарын (бейметалл атомдары),
в) сутек атомдарын,
г) оттек атомдарын.
2. Егер оттек атомдары теңдеудің сол жағында да оң жағында да
бірдей болса , онда коэффициенттер дұрыс анықталды.
Осыдаң кейін бағдаршаның орнына тең белгісін қоямыз.
3. Химиялық реакция теңдеуіндегі коэффициенттердің ортақ бөлгіші
болмау керек.
10.
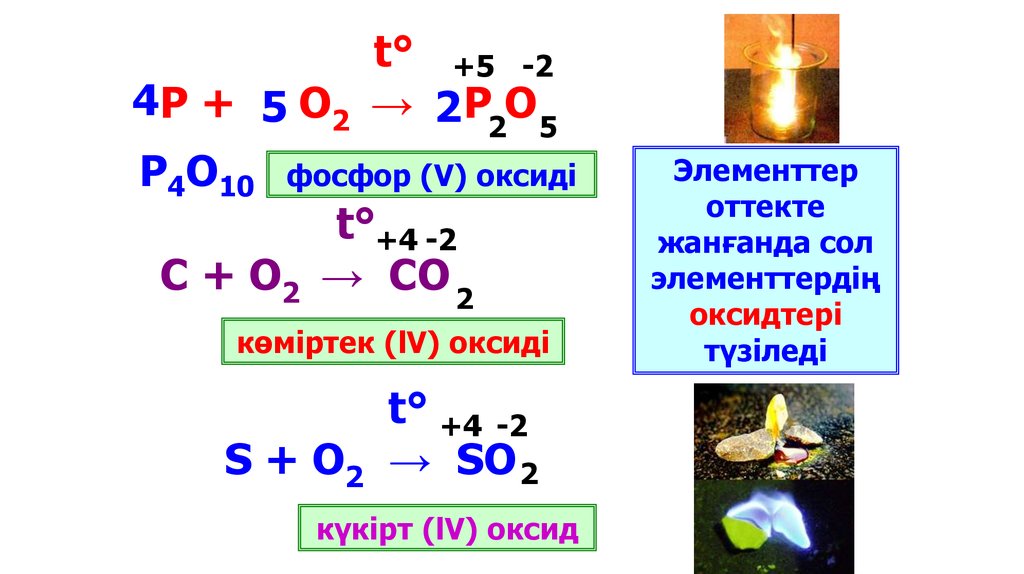
t° +3-2
4 Al +3 O2 → 2 Al O
2
3
алюминий
оксиді
t°
3Fe + 2O2 → Fe3O4
темір (ll, lll)
оксиді
11.
t° +5 -24 Р + 5 О2 → 2 Р О
2 5
P4O10
фосфор (V) оксиді
t°+4 -2
С + О2 → СО 2
көміртек (lV) оксиді
S + O2
t° +4 -2
→ SO 2
күкірт (lV) оксид
Элементтер
оттекте
жанғанда сол
элементтердің
оксидтері
түзіледі
12.
Химиялық реакция теңдеуін құрастыруҮш кезеңді қамтиды:
1. Бастапқыда реакцияға қатысқан(сол жақ) және реакция
нәтижесінде түзген өнімнің (оң жақ) реакция теңдеуі
төмендегідей:
Р + O2 Р2O5
2. Химиялық реакция теңдеуіндегі сол және оң бөлігіндегі
атомдар саны тең болу үшін коэффициенттерді қоямыз:
4Р + 5O2 2 Р2O5
3. Химиялық реакция теңдеуіндегі сол және оң бөлігіндегі
атомдар санын тексеру:
4 Р + 10 O = 4 Р және 10 O
13.
Химиялық теңдеулер бойынша есептеулер(алгаритмі)
Химиялық
теңдеулер
бойынша
есептеулер
(стехиометриялық есептеулер) зат массасының сақталу
заңына негізделген.
Мысал 1
Массасы 100г кальций карбонатын қыздырған кезде 56г
кальций оксиді түзілді. Бөлінген көмірқышқыл газының
массасын есептеңіз.
Шығару жолы: СаСО3=СаО + СО2
Егер реакция нәтижесінде 56 г кальций оксиді түзілсе,
онда түзілген газдың массасы мынаған тең:
100г -56г = 44г.
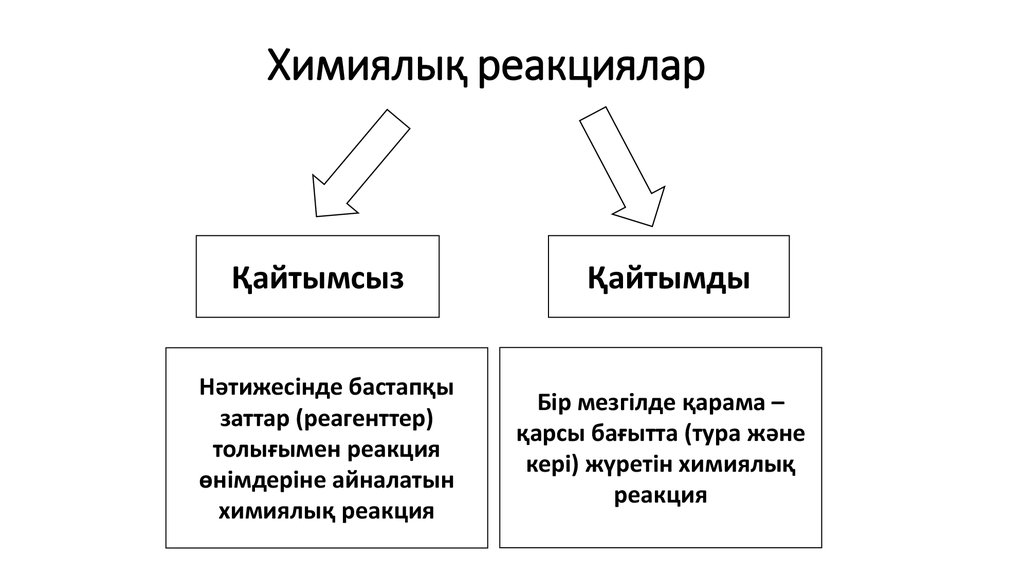
14. Химиялық реакциялар
ҚайтымсызНәтижесінде бастапқы
заттар (реагенттер)
толығымен реакция
өнімдеріне айналатын
химиялық реакция
Қайтымды
Бір мезгілде қарама –
қарсы бағытта (тура және
кері) жүретін химиялық
реакция
15.
жану1. Тұнбаның түсуі
2. Газ бөліну
3. Өте аз диссоцияланатын заттар
п.б. Н2О
Кейбір
қосылыстардың
ыдырауы
16.
Смоль/л
Бастапқы заттардың
Концентрациясының
өзгеруі
Қайтымды реакция
H2+І2↔2HІ;
Өнімдердің
концентрациясыны
ң
өзгеруі
t (сек)
17.
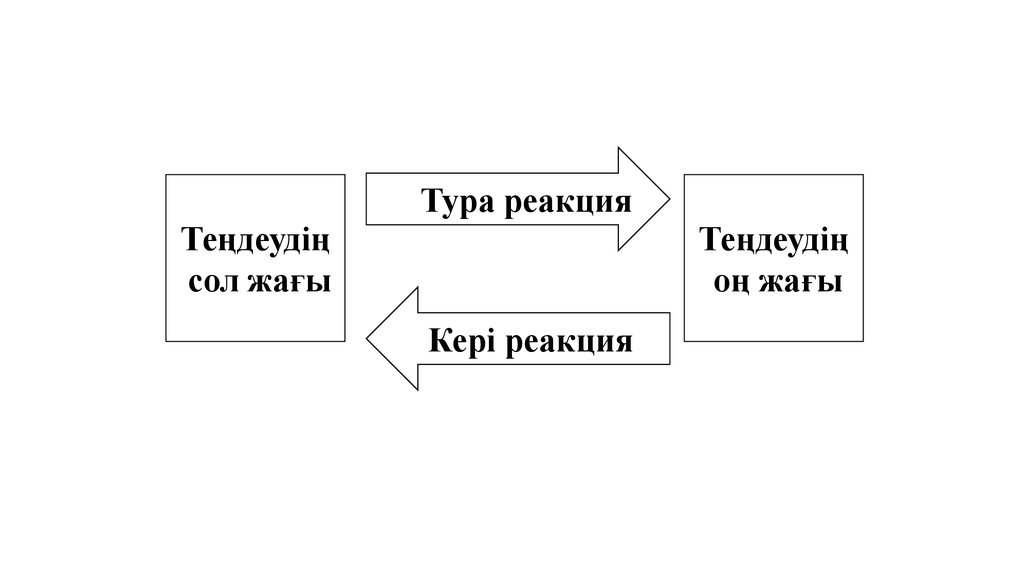
Тура реакцияТеңдеудің
сол жағы
Теңдеудің
оң жағы
Кері реакция
18. Қайтымсыз реакциялар
АgNO3 + NaCl → AgCl↓+NaNO32LiOH + H2SO4 → Li2SO4+2H2O
K2CO3 + 2HCl → 2KCl + CO2↑+ H2O
19. Қайтымды реакциялар
N2 + 3H2 ↔ 2NH3N2 + O2 ↔ 2NO
FeCl3 + 3KCNS ↔ Fe(CNS)3+ 3KCl
сары
түссіз
қызыл
түссіз
20.
Al2O3 + 6HCl = 2AlCl3 + 3H2ON2 + 3H2 ↔ 2NH3
СО + 2Н2 ↔ СН3ОН
3NaOH + H3РО4 = Na3РО4 + 3H2O
Na2SO4 + BaCl2 = BaSО4↓ + 2NaCl
N2 + O2 ↔ 2NO
2SO2 + O2 ↔ 2SO3
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
H2 + S ↔ H2 S
NaCl + AgNO3 = NaNО3 + AgCl↓
С + СО2 ↔ 2СО
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
21.
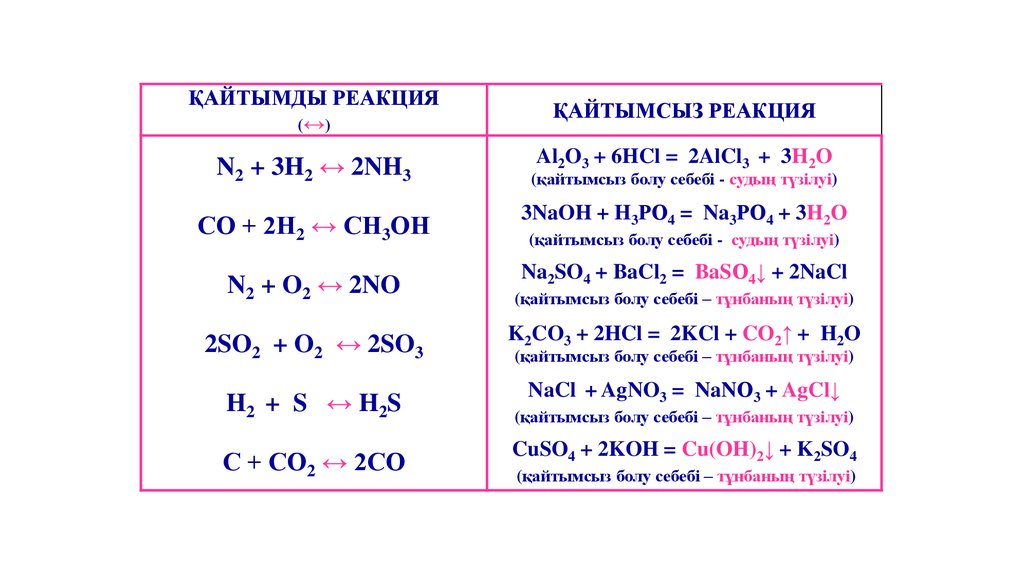
ҚАЙТЫМДЫ РЕАКЦИЯ(↔)
ҚАЙТЫМСЫЗ РЕАКЦИЯ
N2 + 3H2 ↔ 2NH3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
(қайтымсыз болу себебі - судың түзілуі)
СО + 2Н2 ↔ СН3ОН
3NaOH + H3РО4 = Na3РО4 + 3H2O
N2 + O2 ↔ 2NO
Na2SO4 + BaCl2 = BaSО4↓ + 2NaCl
(қайтымсыз болу себебі - судың түзілуі)
(қайтымсыз болу себебі – тұнбаның түзілуі)
2SO2 + O2 ↔ 2SO3
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
H2 + S ↔ H2S
NaCl + AgNO3 = NaNО3 + AgCl↓
С + СО2 ↔ 2СО
(қайтымсыз болу себебі – тұнбаның түзілуі)
(қайтымсыз болу себебі – тұнбаның түзілуі)
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
(қайтымсыз болу себебі – тұнбаның түзілуі)
22. Кез-келген қайтымды реакция реакция үшін бастапқы сәтте әрекеттесуші массалар заңына сәйкес тура реакцияның жылдамдығы нөлге тең. Уақыт ө
Кез-келген қайтымды реакция реакцияүшін бастапқы сәтте әрекеттесуші
массалар заңына сәйкес тура реакцияның
жылдамдығы нөлге тең. Уақыт өте келе
бастапқы заттардың концентрациялары
кемиді., кері реакциялардың жылдамдығы
артады. Ерте ме, кешпе реакцияның
жылдамдықтары теңесетін кез болады, ол
кезде жүйеде тепе-теңдік орнайды.
23. Химиялық тепе-теңдік
Тура және кері реакциялардыңжылдамдықтары тең болғандағы
жүйенің күйін химиялық тепе-теңдік деп
атайды.
24. Ле -Шателье принципі
химиялық тепе –теңдіктетұрған жүйе күйіне сыртқы
факторлардың біреуімен(
қысым, температура ,
концентрация ) әсер етсек,
тепе – теңдік сол факторды
әлсірету бағытына қарай
ығысады.
Анри Луи Ле Шателье (1850–1936)
25.
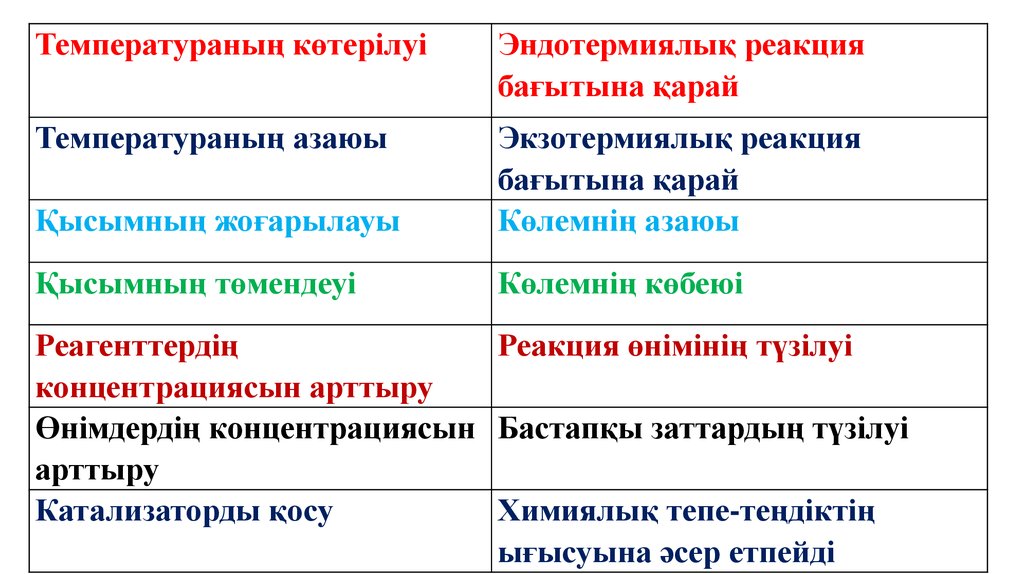
Химиялық тепе-теңдіктіңығысуына әсер етуші факторлар
Температура
Концентрация
Қысым
26.
Температураның көтерілуіЭндотермиялық реакция
бағытына қарай
Температураның азаюы
Қысымның жоғарылауы
Экзотермиялық реакция
бағытына қарай
Көлемнің азаюы
Қысымның төмендеуі
Көлемнің көбеюі
Реагенттердің
Реакция өнімінің түзілуі
концентрациясын арттыру
Өнімдердің концентрациясын Бастапқы заттардың түзілуі
арттыру
Катализаторды қосу
Химиялық тепе-теңдіктің
ығысуына әсер етпейді
27.
Қайтымды реакцияларФакторлар әсері
N2 + 3H2 ↔ 2NH3 + Q
P↑
t↓
[N2]↓
H2 + I2 ↔ 2HI - Q
P↓
t↓
[I2]↑
C 3 H6 + H 2 ↔ C 3 H8
P↑
[C3H8] ↑
Тепе-теңдіктің ығысуы
28.
29. Тура және кері реакцияның жылдамдық қатынастарының қатынасы да тұрақты болады және оны осы реакцияның тепе-теңдік константасы (тұрақтысы)
(К) деп атайдыaA+bB=cC+dD,
K=k1/k2.
K = [C]c[D]d/[A]a[B]b
30.
N2 + 3H2 ↔ 2NH3Химиялық кинетиканың заңы бойынша тура және кері реакциялардың
жылдамдықтарын былай жазуға болады:
U1 = K1*[N2][H3]3
U2 = K2*[ NH3]2
Химиялық тепе-теңдік кезінде тура және кері реакциялардың
жылдамдықтары өзара тең болғандықтан теңдеуді былай жазуға
болады:
K1*[N2][H3]3 = K2*[ NH3]2 немесе K1/ K2 = - [ NH3]2/[N2][H3]3
31.
Егер Кр ˃ 1, онда Vтура ˃Vкері , егер Кр ˂1 , онда Vтура ˂ Vкері32.
Есеп 1. Белгілі бір температурада тепе-теңдікконцентрациясы жүйеде 2CO (г) + O2 (г)
2CO2(г)былай
өзгерді: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] =
0,16 моль/л. Осы температурадағы тепе-теңдік
константасын және бастапқы CO және O2
концентрациясын анықтаңыз
33.
.2CO(г).
2CO(г) + O2(г)
34.
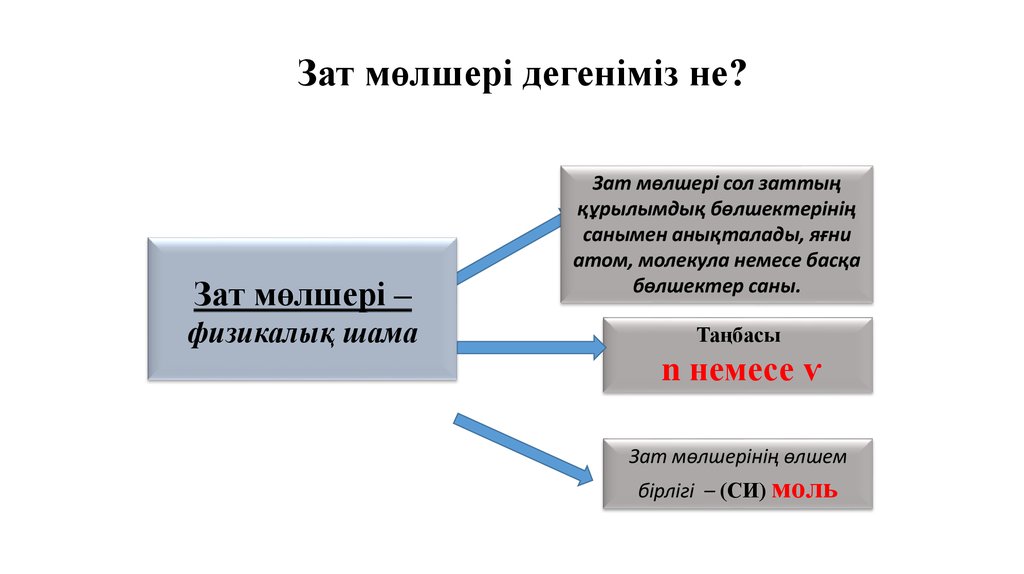
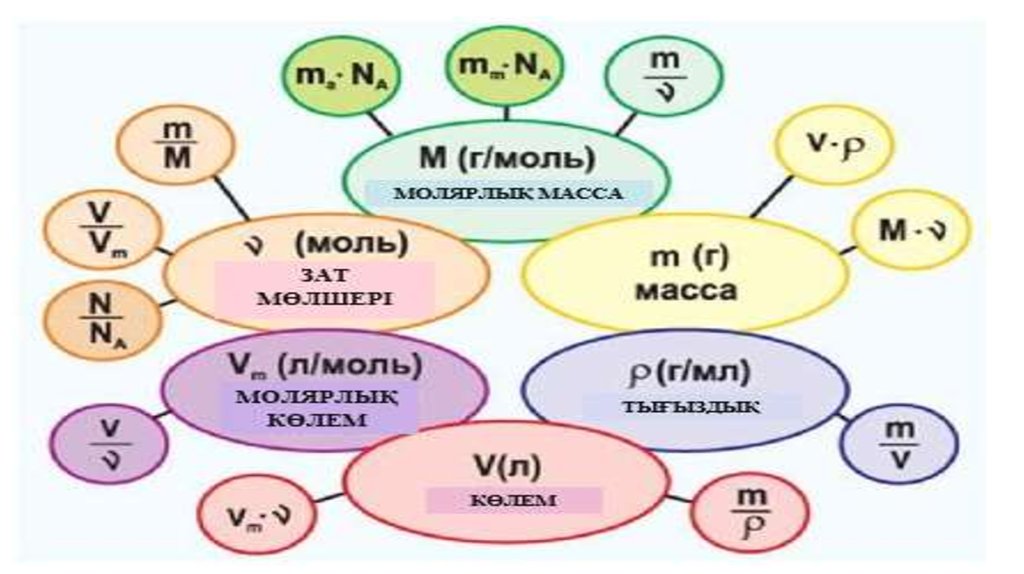
Зат мөлшері дегеніміз не?Зат мөлшері –
физикалық шама
Зат мөлшері сол заттың
құрылымдық бөлшектерінің
санымен анықталады, яғни
атом, молекула немесе басқа
бөлшектер саны.
Таңбасы
n немесе ѵ
Зат мөлшерінің өлшем
бірлігі – (СИ) моль
35. Моль дегеніміз не?
• Моль – берілген заттың құрылымдықбөлшектері 12г көміртегіндегі атом санына
сәйкес келетін зат мөлшері. ν (ню) әрпімен
белгіленеді, құрылымдық бөлшектер саны
Na әрпімен белгіленеді.
36. Заттың керекті мөлшерін қалай өлшеп алуға болады?
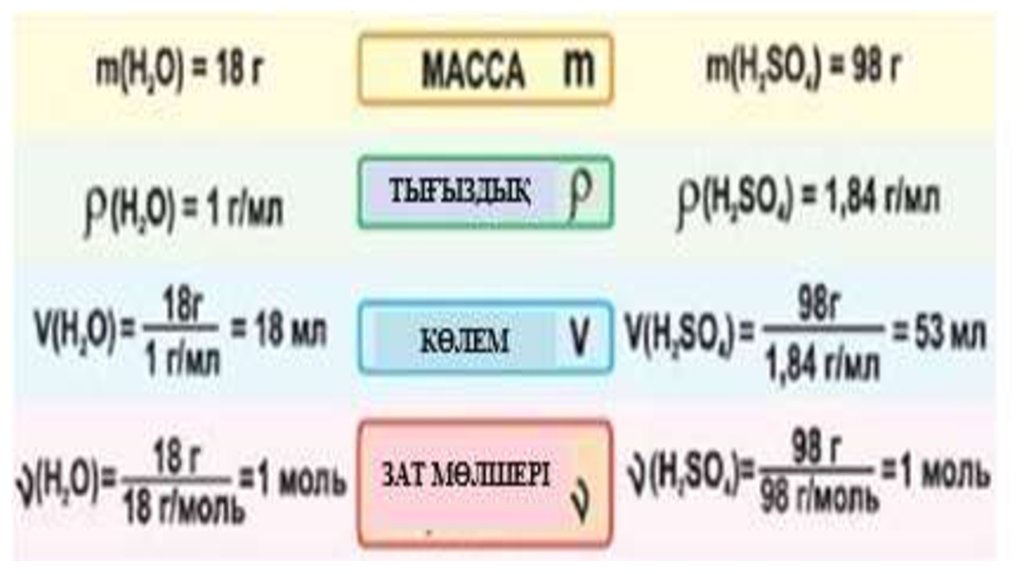
• Зат мөлшерін моль арқылы өрнектеген сияқты молярлық массазат массасын грамм арқылы көрсетеді. Демек, «Заттың
молярлық массасы М зат массасының зат мөлшеріне
қатынасына тең шама»
М=m / ν
• Мысалы:
1) M(H2)= 2 г/моль;
• 2) M(O2) =32 г/моль; 3) M(H2O) =18 г/моль
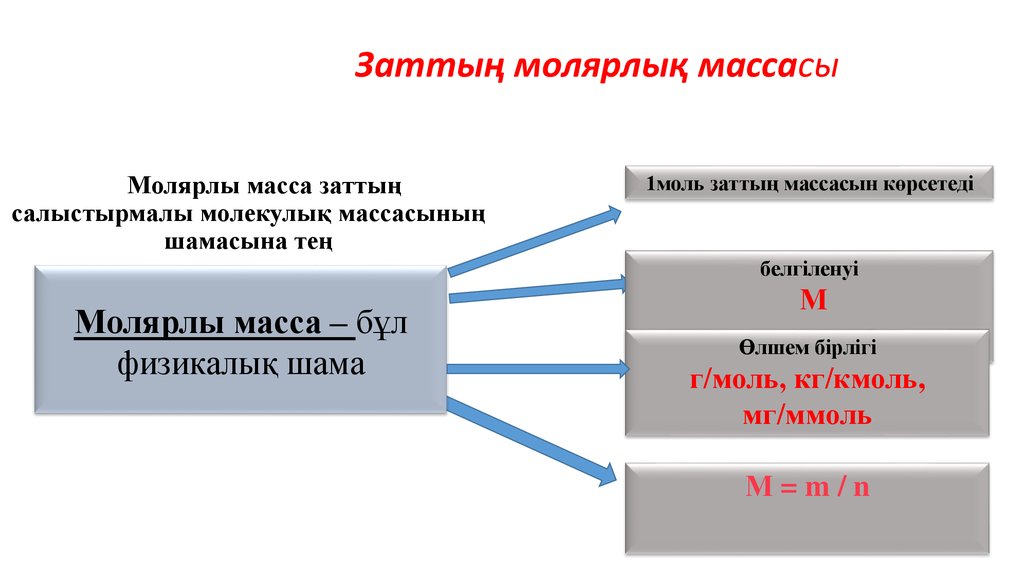
37. Молярлы масса заттың салыстырмалы молекулық массасының шамасына тең
Заттың молярлық массасыМолярлы масса заттың
салыстырмалы молекулық массасының
шамасына тең
1моль заттың массасын көрсетеді
белгіленуі
Молярлы масса – бұл
физикалық шама
М
Өлшем бірлігі
г/моль, кг/кмоль,
мг/ммоль
М=m/n
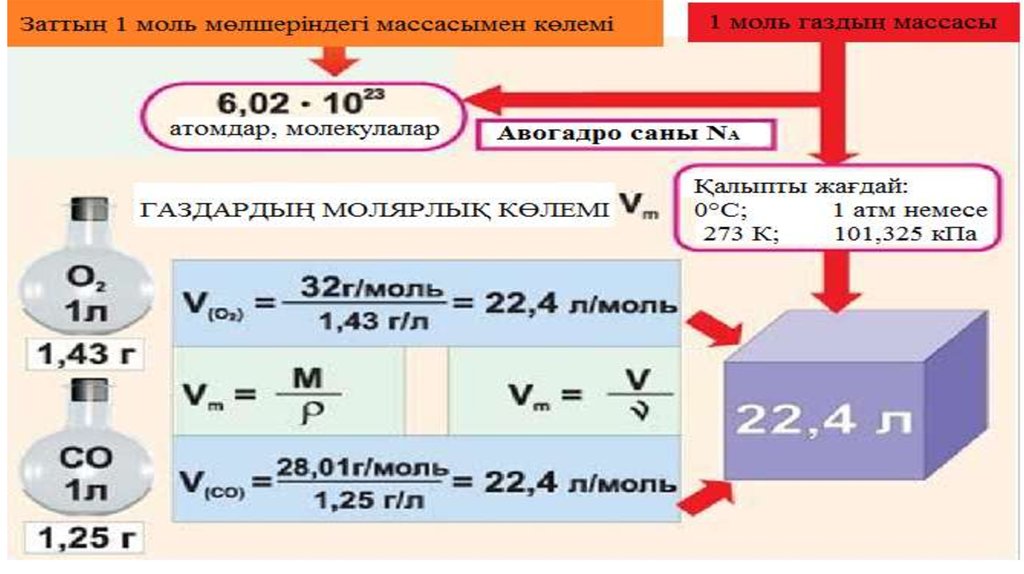
38. Авагадро саны
• Зат мөлшері мен бөлшек (атом, молекула т.б) сандары арасындабайланыс,
ѵ = N / NA
Формуласы арқылы өрнекеледі. Мұндағы N – бөлшек саны, NA –
Авагадро тұрақтысы,
NА = 6,02∙1023 молекула, атом, құрылымдық бөлшек
Мысалы: 2,5 моль зат SO2 6,02∙1023 молекула құрайды, 15,05*1023
атом құрайды (өйткені 1 атом S және 2 атом O2 бар)
39. Зат мөлшері ұғымын қолданып есептер шығару
Зат мөлшеріЗат мөлшері ұғымын қолданып есептер шығару
m n M
m
n
M
40.
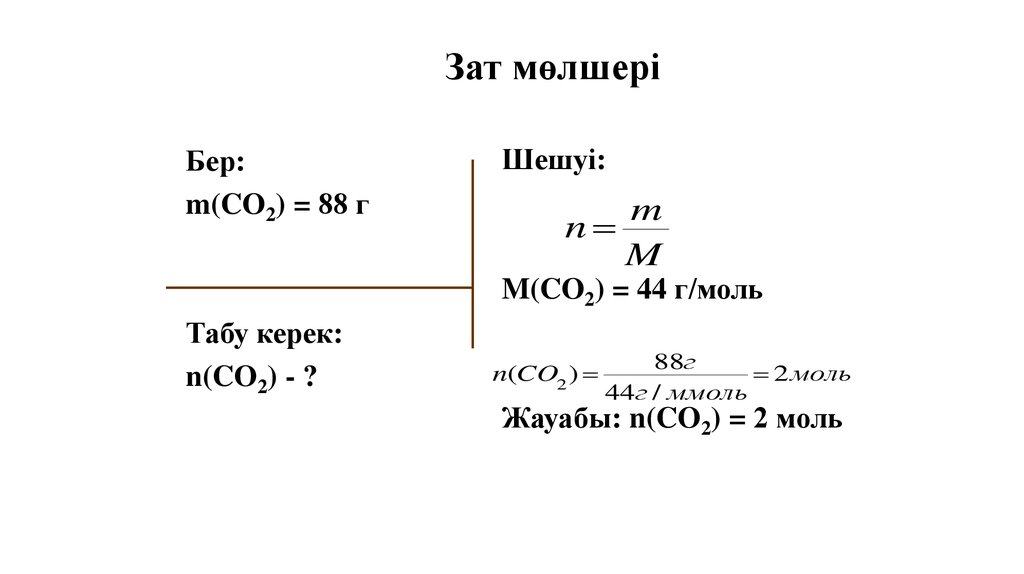
Зат мөлшеріБер:
m(CO2) = 88 г
Шешуі:
m
n
M
M(CO2) = 44 г/моль
Табу керек:
n(CO2) - ?
n(CO2 )
88г
2 моль
44г / ммоль
Жауабы: n(CO2) = 2 моль
41.
Зат мөлшеріБер:
n(N2) = 10 моль
Табу керек:
m (N2) - ?
Шешуі:
m n M
M (N2)= 28 г/моль
m (N2)=10 моль*28 г/моль
= 280 г
Жауабы: m (N2)= 280г
42.
Зат мөлшеріБер:
m (S) = 6,2 г
Шешуі:
m
n
M
n(S )
Табу керек:
n (S) - ?
6,2г
0,2 моль
32г / моль
M(S) = 32 г/кмоль
Жауабы: n (S) =0,2 моль
43. Газдың молярлық көлемі:
Газдың мольдік көлемі – берілген газ көлемініңоның химиялық зат мөлшеріне қатынасына тең
шама
V
Vm
n
44. Авогадро заңының салдары: Әртүрлі газдардың бірдей молекулалар саны бірдей қысымда және температурада бірдей көлемді алады.
Авогадро заңыныңсалдары:
Әртүрлі газдардың бірдей
молекулалар саны бірдей
Қалыпты жағдайда кез
қысымда және температурада
келген газдың мольдік бірдей көлемді алады.
көлемі:
V
22,4дм
Vm
n
1моль
3
22,4дм / моль.
3




































 Химия
Химия








