Похожие презентации:
Термодинамика и теплопередача. Внутренняя энергия
1. Термодинамика и теплопередача
Лекция 22. Внутренняя энергия:
Кинетическая энергияПотенциальная энергия
Энергия электронных оболочек атомов
Внутриядерная энергия
Две последние в большинстве теплоэнергетических
процессах остаются неизменными.
3. Внутренняя энергия, U [Дж]
энергия хаотического движения молекул иатомов, включающую энергию
поступательного, вращательного и
колебательного движений как
молекулярного, так и внутримолекулярного,
а так же потенциальную энергию сил
взаимодействия между молекулами
4. Удельная внутренняя энергия, u
u U / M[Дж/кг]
Внутренняя энергия функция состояния тела и может быть
представлена в виде функции двух любых независимых
параметров:
u 1 ( p,V )
u 2 ( p, T )
u 3 (T ,V )
Изменение внутренней энергии:
2
u du u 2 u1
1
5. Теплота
Теплота, Q – представляет собойпереданное от одного тела к другому
определенное количество энергии
хаотического молекулярного и
внутримолекулярного движения
+ Q – подводимая теплота
- Q – отводимая теплота
6. Работа
Работа, L [Дж] – в термодинамикеназывается процесс превращения одного
вида энергии в другой, при котором
энергия одного вида уменьшается, а
энергия другого вида увеличивается.
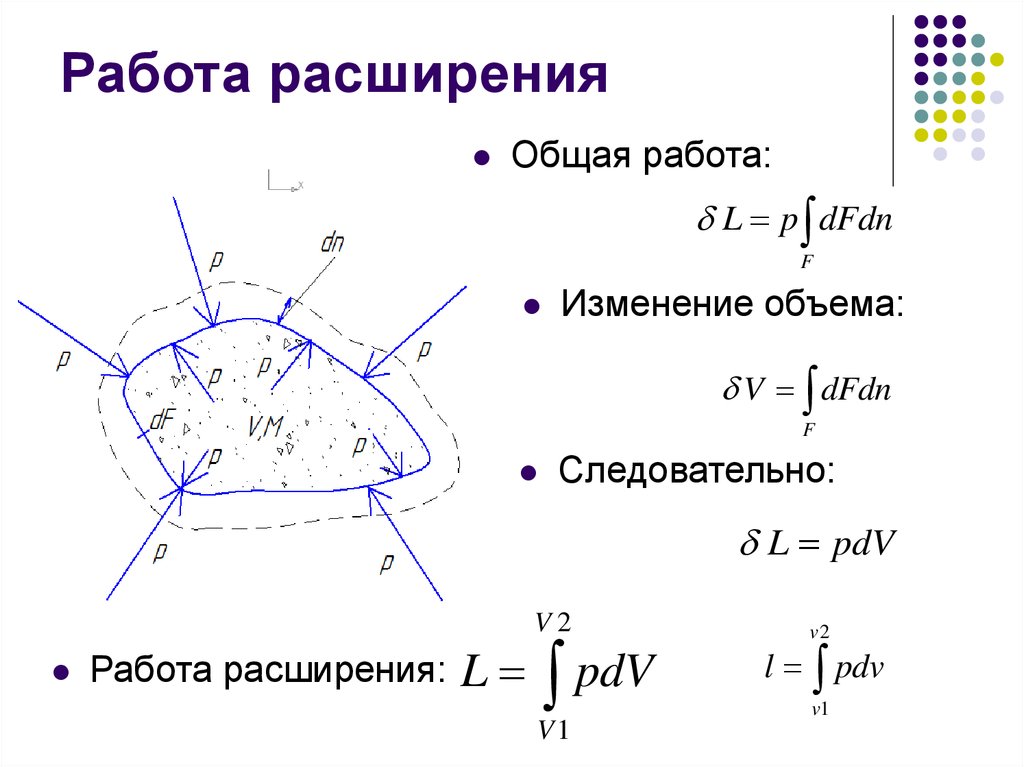
7. Работа расширения
Масса МОбъем V
Площадь поверхности F
Элементарный элемент оболочки dF
Сила pdF
Элементарная работа pdFdn
8. Работа расширения
Общая работа:L p dFdn
F
Изменение объема:
V dFdn
F
Следовательно:
L pdV
V2
Работа расширения:
L
pdV
V1
v2
l pdv
v1
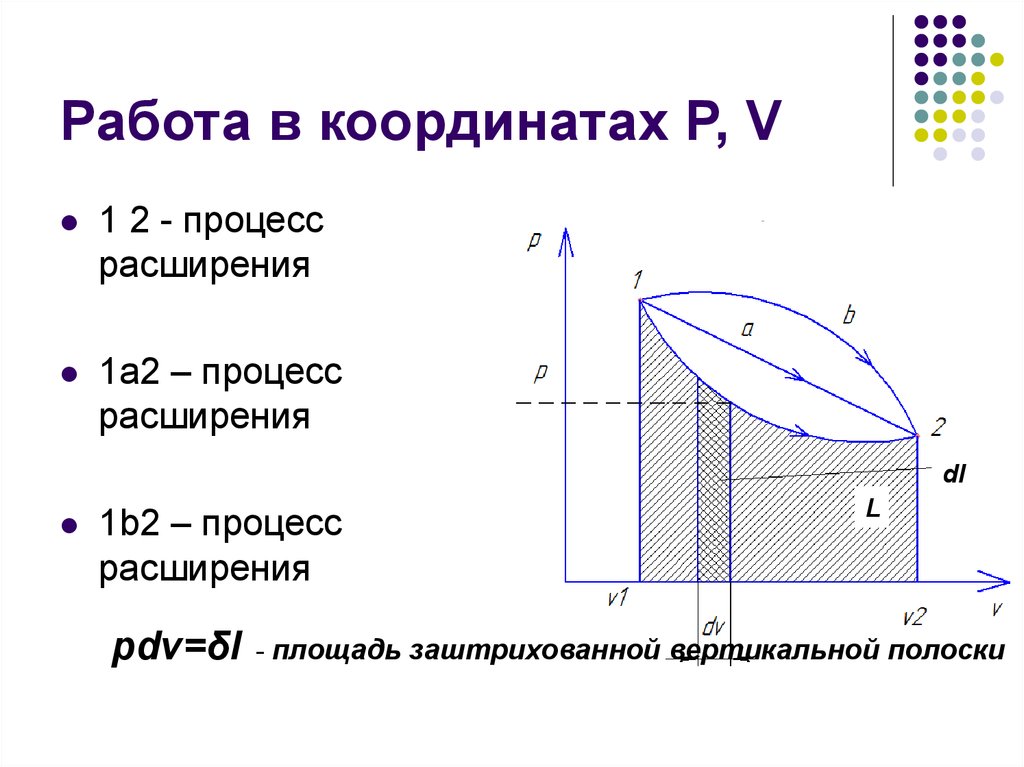
9. Работа в координатах Р, V
1 2 - процессрасширения
1а2 – процесс
расширения
dl
1b2 – процесс
расширения
pdv=δl
L
- площадь заштрихованной вертикальной полоски
10. Энтальпия
H U pVЭнтальпия, Н [Дж] - термодинамический потенциал,
характеризующий состояние термодинамической
системы. Энергия, которая доступна для
преобразования в теплоту при постоянном давлении.
Энтальпия – функция состояния:
h 1 ( p, v)
h 2 (v,T )
h 3 ( p, T )
11. Энтальпия
Удельная энтальпия – энтальпия системысодержащий 1 кг вещества h [Дж/кг]:
h u pv
Изменение энтальпии в любом
процессе определяется только
начальным и конечным состояниями
тела и не зависит от характера
процесса
12.
Уравнение первого начала термодинамики:q du pdv
С учетом очевидного соотношения:
pdv d ( pv) vdp
Может быть записано в виде:
q d (u pv) vdp или q dh vdp
Если давление системы сохраняется неизменным:
q p dh
q p h2 h1
или
t2
h h2 h1 c p dT
t1
13. Теплоемкость
Теплоемкость, с [Дж/кг*град] – количествотепла, которое нужно повести единице
тела для повышения его температуры на
10С в данном процессе.
С Q / dТ
T2
q cdT
T1
14. Теплоемкость в зависимости от единицы количества вещества:
Удельная массовая теплоемкость, с[Дж/кг*К];
Удельная объемная теплоемкость, с/
[Дж/м3*К];
Удельная мольная теплоемкость, см,
[Дж/кмоль*К]
с
с/
Н
с
с
/
с
15. Массовая теплоемкость
Изобарная теплоемкость: с р q p / dTИзохорная теплоемкость: сv qv / dT
Отношение теплоемкостей:
с р k c v
c
p
c
v k
Уравнение Майера:
ср
сv
k
с р сv R
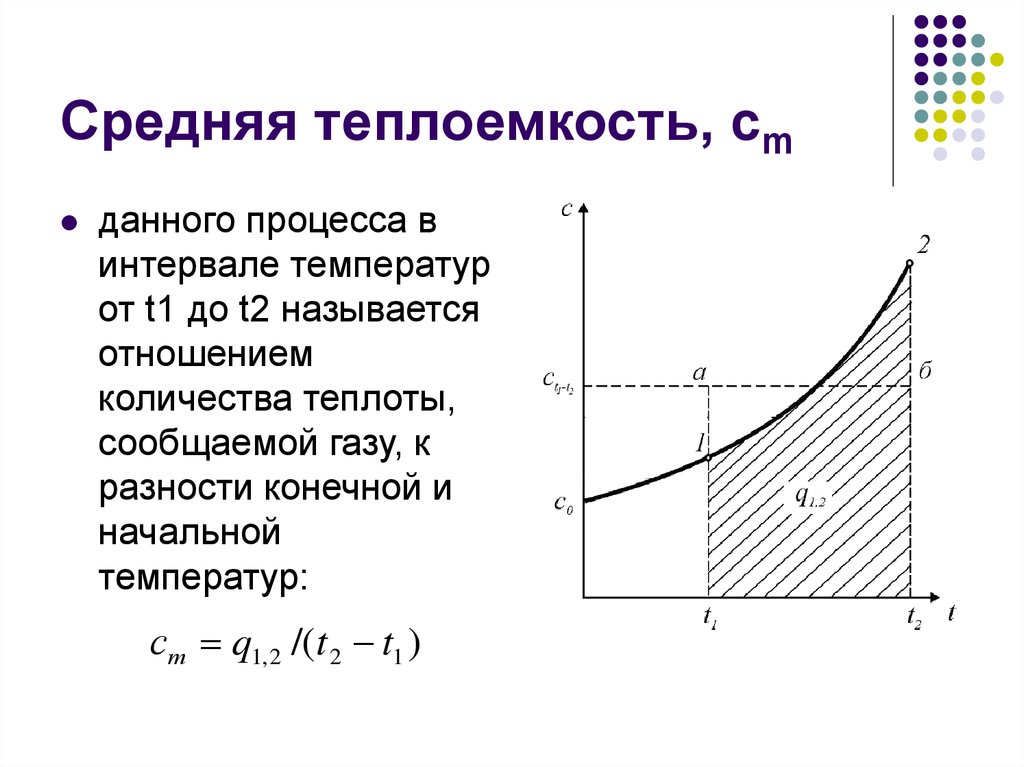
16. Средняя теплоемкость, сm
данного процесса винтервале температур
от t1 до t2 называется
отношением
количества теплоты,
сообщаемой газу, к
разности конечной и
начальной
температур:
ст q1, 2 /(t 2 t1 )
17. Истинная теплоемкость
Истинная теплоемкость соответствуетбесконечно малому интервалу
температур.
с q / dT


![Внутренняя энергия, U [Дж] Внутренняя энергия, U [Дж]](https://cf.ppt-online.org/files/slide/y/yrtafV7GPwTu34ZN56Sh8JUisg1md0cKpjozbq/slide-2.jpg)











 Физика
Физика








