Похожие презентации:
Лекция 1-2 ТД и кинетика
1.
Кафедра медицинской ифармацевтической химии
ХИМИЯ
Осипова Алла Вячеславовна
к.х.н., доцент
1
2.
«Термодинамика химическихпроцессов. Химическая кинетика и
катализ"
2
3.
ТЕРМОДИНАМИКАизучает законы превращения энергии из одной формы в другую в
различных процессах.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
изучает превращение различных форм энергии в результате
химических реакций.
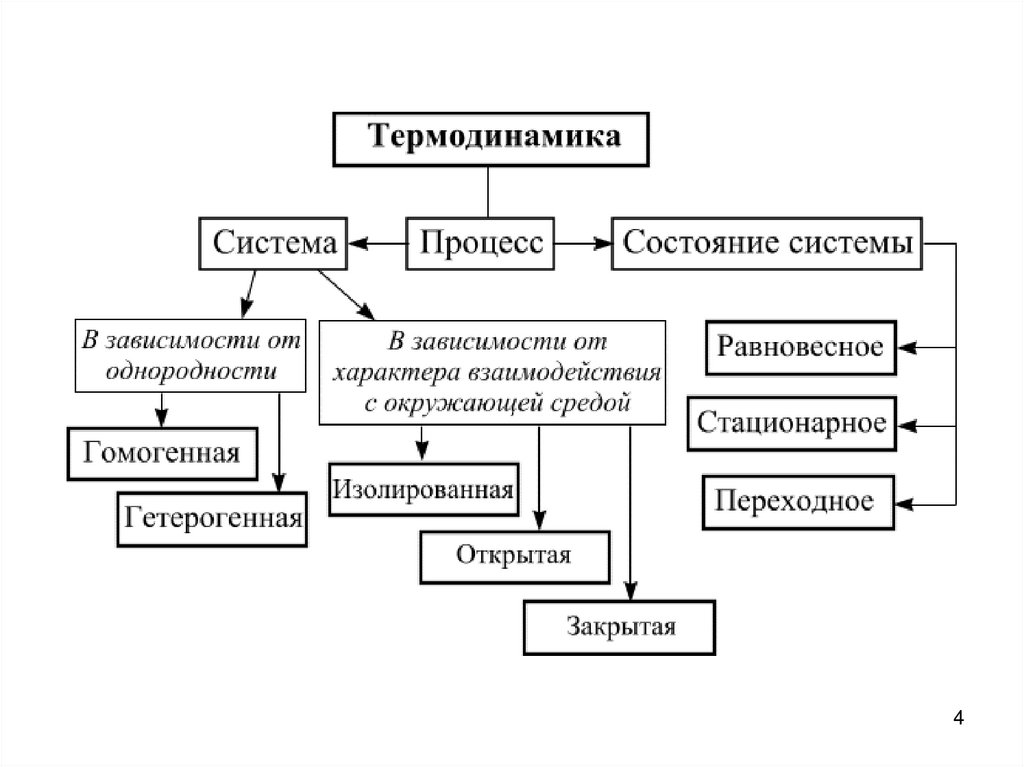
Система тело или группа взаимодействующих тел, фактически или
мысленно выделяемых из окружающей среды.
3
4.
45.
Системы в термодинамике(в зависимости от однородности):
1. Гомогенная – однородная система, в которой нет частей,
различающихся
по
свойствам
и
разделенных
поверхностями раздела (нет границы раздела фаз).
2. Гетерогенная– разнородная система, состоящая из двух
или более частей, отличающихся по свойствам, между
которыми есть поверхность раздела, где свойства резко
меняются (граница раздела фаз присутствует).
Фаза – часть системы, которая имеет одинаковые свойства и
ограничена границей раздела.
5
6.
Системы в термодинамике(в зависимости от характера взаимодействия с
окружающей средой):
1. Открытые – обмен веществом и энергией
2. Закрытые (замкнутые) – обмен только энергией
3. Изолированные – нет обмена ни веществом, ни энергией
6
7.
Состояния системы1.
Термодинамически равновесное – постоянство всех
свойств во времени в любой точке системы и отсутствие
потоков вещества и энергии в системе (не происходит
видимых изменений).
2. Стационарные – постоянство свойств во времени, которое
поддерживается за счет непрерывного обмена веществом
и энергией между системой и окружающей средой
(видимых изменений нет, но есть обмен веществом и
энергией).
3. Переходное – изменение свойств системы во времени.
7
8.
Энергия (Е, кДж/моль)– количественная мера различныхформ движения и взаимодействия всех видов материи.
8
9.
Внутренняя энергия (U)– это сумма потенциальной энергии взаимодействия всех
частиц тела между собой и кинетической энергии их движения
Теплота (Q) –
энергетическая мера хаотического движения молекул
процессе взаимодействия системы с окружающей средой.
в
Мерой интенсивности движения молекул является температура.
Работа (A) –
энергетическая мера направленного движения молекул в
процессе взаимодействия системы с окружающей средой.
9
10.
I закон термодинамики1. Если к закрытой системе подводить тепло, энергия будет
расходоваться на увеличение внутренней энергии и
совершение работы:
Q U p V
2. В изолированной системе ∆U = 0;
3. Энергия не исчезает и не возникает из ничего, а только
превращается из одной формы в другую в строго
эквивалентных количествах
Следствием I закона термодинамики является закон Гесса
10
11.
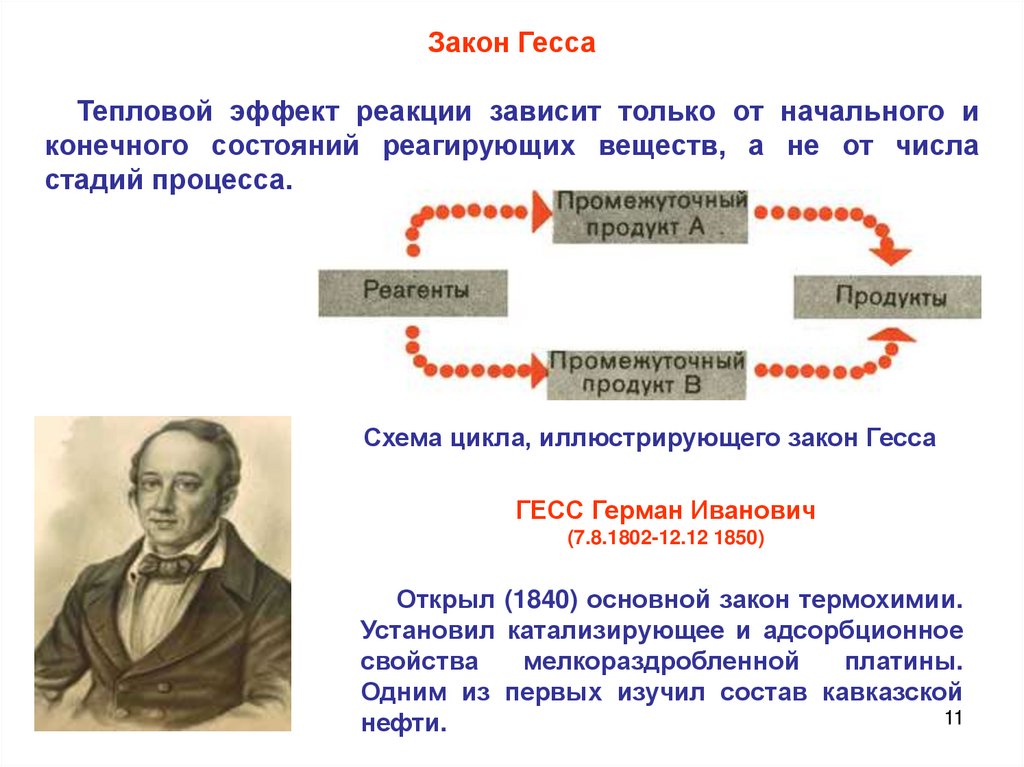
Закон ГессаТепловой эффект реакции зависит только от начального и
конечного состояний реагирующих веществ, а не от числа
стадий процесса.
Схема цикла, иллюстрирующего закон Гесса
ГЕСС Герман Иванович
(7.8.1802-12.12 1850)
Открыл (1840) основной закон термохимии.
Установил катализирующее и адсорбционное
свойства
мелкораздробленной
платины.
Одним из первых изучил состав кавказской
11
нефти.
12.
Термодинамическая функция состояния— функция, зависящая от нескольких независимых параметров,
которые определяют состояние термодинамической системы.
К термодинамическим функциям состояния относятся:
1. Внутренняя энергия - U
2. Энтальпия - H
3. Энтропия - S
4. Свободная энергия Гиббса - G
12
13.
Следствия из закона Гесса:1. Тепловой эффект реакции при стандартных условиях равен
разности между суммой теплот образования продуктов реакции и
суммой теплот образования исходных веществ, умноженных на
соответствующие коэффициенты в реакции
ΔH реакции 298 ni H
o
обр 298( конечн .)
ni H
o
обр 298( исх.)
Теплота образования химического соединения – это тепловой
эффект реакции образования 1 моль химического соединения из
чистых простых веществ, находящихся в равновесном состоянии при
стандартных условиях.
Стандартные условия – это давление 101.325 кПа (1 атм) и
фиксированная температура (обычно – 2980 К)
13
14.
Подавляющее большинство органических соединенийнельзя синтезировать непосредственно из простых веществ и
одновременно
определить
теплоту
образования
этих
соединений.
Поэтому за основу для расчета берут экспериментально
легко определяемые теплоты (энтальпии) сгорания.
2. Тепловой эффект реакции при стандартных условиях
равен разности между суммой теплот сгорания исходных
веществ и суммой теплот сгорания продуктов реакции,
умноженных на соответствующие стехиометрические
коэффициенты:
o
o
ΔH реакции 298 ni H сгор
n
H
i сгор.298( конечн.)
. 298( исх.)
14
15.
Значение стандартных теплот образования и сгорания,средние теплоемкости для некоторых веществ в газовом состоянии
Молекулярная
формула
HI
CH4
CO2
CO
H2
H0обр 298
26.04
-74.85
-393.51
-110.5
0
H0cг 298
802.32
0
283.00
241.84
Молекулярная
формула
H2O
C6H6
Cl2
CHCl3
HCl
H0обр 298
H0cг 298
-242.76
83.76
0
100.4
92.3
0
3298.4
Помним, что стандартная теплота образования простых
веществ равна нулю!
H о (H 2 , Cl2 ) 0
Стандартная теплота сгорания оксидов также равна нулю!
Hо (СO2 , H 2O) 0
15
16.
Первый закон термодинамики позволяет рассчитатьэнергетический баланс химического процесса.
Пример1
Рассчитайте тепловой эффект реакции
CH4 (г) + СО2 (г) = 2СО (г) + 2Н2
по стандартным теплотам образования.
, H
110.5 , H
0
H обр
. ( CH 4 ) 74.85
0
H обр
. ( CO )
0
обр. ( CO2 )
391.51
0
обр. ( H 2 )
,
0
H обр 2 0обр. 298(CO ) 2 0обр. 298( H 2 ) 0обр. 298(CH 4 ) 0обр. 298(CO2 )
2·110.5 ( 74.85 391.51) 247.39 кДж / моль
( реакция эндотермическая )
16
17.
Пример 2Рассчитайте тепловой эффект реакции
C6H6 + 7.5O2=6CO2(г)+3H2O(ж),
по стандартным теплотам сгорания
Решение:
H сгор 0сгор (C6 H 6 ) 6 0сгор (CO2 ) 3 0сгор ( H 2O ) 3273 0 0
3273 кДж / моль
17
18.
В основе научной диетологии лежит согласование режима питания(калорийности потребляемой человеком пищи) с расходом энергии,
который зависит в первую очередь от характера выполняемой
работы.
18
19.
1920.
Суточная потребность человека в энергии1) при легкой работе в сидячем положении:
канцелярские работники, секретари, портные, мастера точной
механики - 2000-2800 ккал ( 8400-11700 кДж )
2) при умеренной и напряженной мышечной работе:
лаборанты, врачи, почтальоны, столяры, токари, трактористы,
учащиеся, студенты - 3000-3600 ккал 12500-15100 кДж )
3) при тяжелом физическом труде:
литейщики, каменщики, кузнецы, плотники, пахари –
4000- 5000 ккал (16700-20900 кДж )
4) при особо тяжелом труде - ручная косьба,
спортсмены - до 7200 ккал ( 30100 кДж )
20
21.
Возможность самопроизвольного протекания реакцийБертло и Томсон сформулировали принцип, согласно которому
самопроизвольно протекает экзотермическая реакция (∆Н < 0).
Однако, процесс растворения поваренной соли в воде
происходит самопроизвольно и с поглощением тепла.
Для прогнозирования возможности и направления процессов
необходимо ввести еще одну функцию, которая должна
отвечать двум требованиям:
быть функцией состояния (не зависеть от пути реализации)
для всех самопроизвольных процессов изменение
этой функции должно иметь один и тот же знак.
21
22.
Энтропия – SЭнтропи́я (от древнегреческого ἐντροπία — поворот, превращение) —
мера беспорядка системы, состоящей из многих элементов.
Понятие энтропии впервые было введено Клаузиусом
в термодинамике в 1865 году
КЛАУЗИУС,
РУДОЛЬФ
ЮЛИУС ЭМАНУЭЛЬ
(1822–1888).
Немецкий физик. Главные работы Клаузиуса посвящены
основам термодинамики и кинетической теории газов.
1850 году получил соотношение между теплотой и
работой (первое начало термодинамики).
В том же году (одновременно с У.Томсоном) дал первую
формулировку второго начала термодинамики: «Теплота
не может сама собою перейти от более холодного тела к
более теплому».
В 1865 ввел понятие энтропии, показав, что изменение
энтропии определяет направление, в котором протекает
данный процесс.
Высказал идею «тепловой смерти» Вселенной,
распространив на нее принцип возрастания энтропии.
Ошибочность этой идеи доказал впоследствии
Л.Больцман
Ввел понятие средней длины свободного пробега
молекул, вычислил ее величину, что в дальнейшем
22
позволило оценить размер молекул.
23.
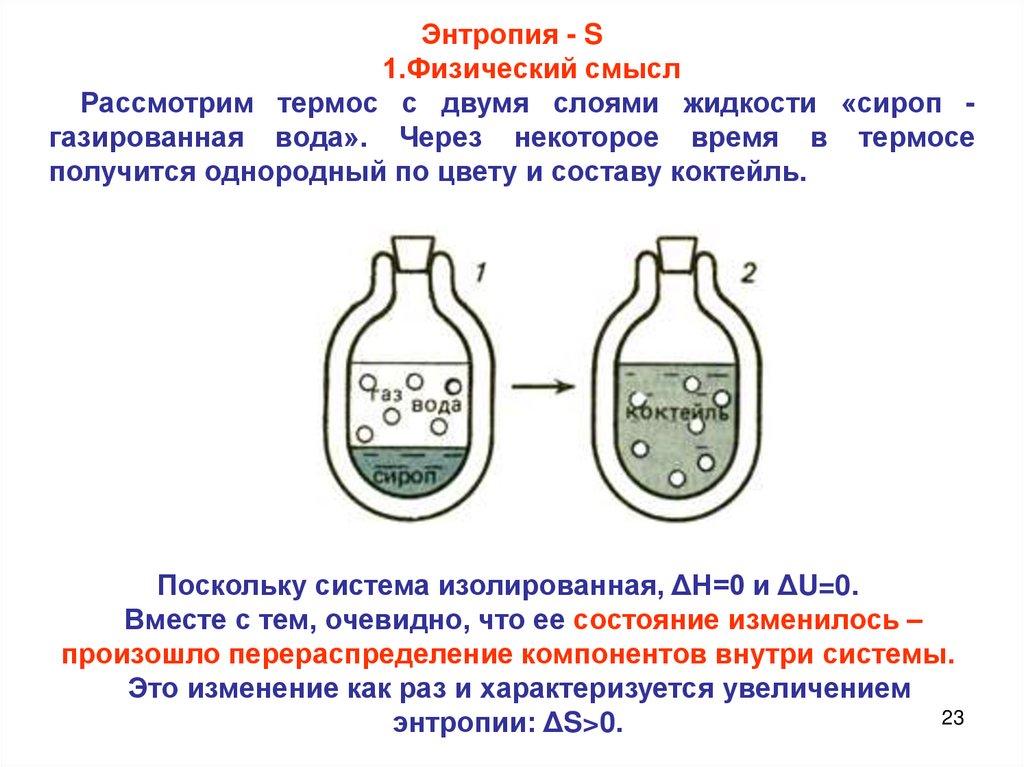
Энтропия - S1.Физический смысл
Рассмотрим термос с двумя слоями жидкости «сироп газированная вода». Через некоторое время в термосе
получится однородный по цвету и составу коктейль.
Поскольку система изолированная, ΔН=0 и ΔU=0.
Вместе с тем, очевидно, что ее состояние изменилось –
произошло перераспределение компонентов внутри системы.
Это изменение как раз и характеризуется увеличением
23
энтропии: ΔS>0.
24.
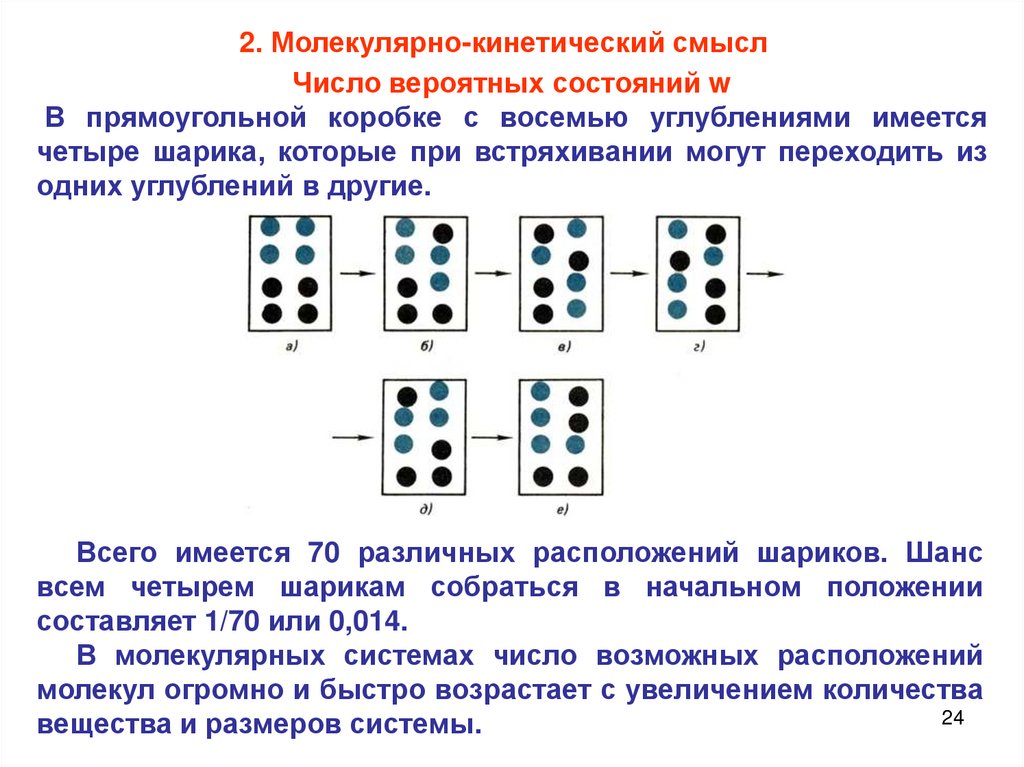
2. Молекулярно-кинетический смыслЧисло вероятных состояний w
В прямоугольной коробке с восемью углублениями имеется
четыре шарика, которые при встряхивании могут переходить из
одних углублений в другие.
Всего имеется 70 различных расположений шариков. Шанс
всем четырем шарикам собраться в начальном положении
составляет 1/70 или 0,014.
В молекулярных системах число возможных расположений
молекул огромно и быстро возрастает с увеличением количества
24
вещества и размеров системы.
25.
Чем большим числом микрочастиц представленарассматриваемая макросистема, тем больше вариантов
распределения этих частиц, тем выше значение энтропии.
Энтропия (S) есть
мера вероятности пребывания системы
в данном состоянии, или мера неупорядоченности системы!
Без постороннего вмешательства невозможен ни
один процесс, результатом которого является
повышение порядка, то есть уменьшение энтропии!
25
26.
Уравнение Больцмана( связь энтропии с числом вероятных состояний )
R – универсальная газовая
постоянная (8,314 Дж/(моль·К)
R
S
ln
NA
Na – постоянная Авогадро (6,02·1023)
S k log
(формулу он завещал выбить
на своей могильной плите).
Людвиг Больцман
(20.02.1844 – 05.09.1906)
ω - число вероятных состояний
системы
Окончил Венский университет в 1867 г.
Занимал профессорские должности в
университетах Вены, Граца, Мюнхена и
Лейпцига. В 1870 году вывел знаменитое
выражение
для
энтропии
(меры
беспорядка) термодинамической системы
через
логарифм
числа
возможных
состояний
26
27.
Могила Больцмана в Вене с бюстом и формулой энтропииS k log
27
28.
3. Термодинамический смыслПонятие об энтропии как термодинамической функции
состояния для обратимых процессов было выведено
Р.Клаузиусом:
В обратимых изотермических процессах изменение энтропии
равняется тепловому эффекту процесса, деленному на
абсолютную температуру.
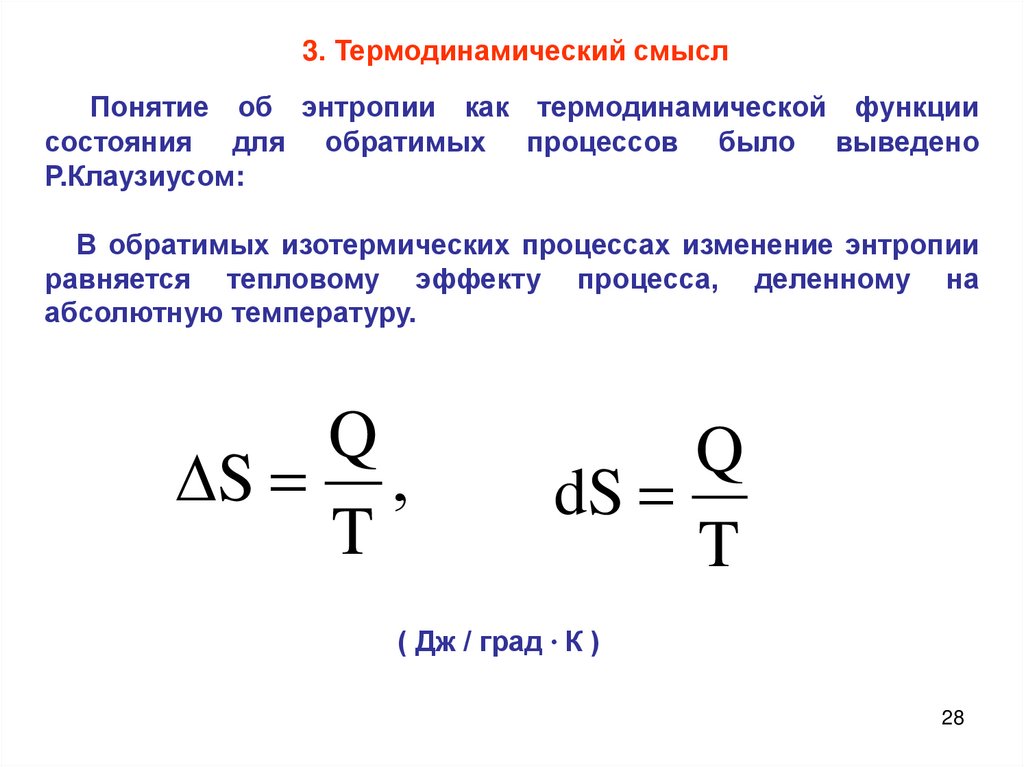
Q
S ,
T
Q
dS
T
( Дж / град ∙ К )
28
29.
Изменение энтропии в обратимом изотермическом процессезависит только от начального и конечного состояний и не зависит
от пути перехода, следовательно, энтропия также относится к
функциям состояния!
Примером может служить медленное
таяние льда в термосе с водой при 273о К
(0оС), для чего к 18 г льда (1моль)
необходимо подвести 6000 Дж теплоты.
Энтропия в системе лед - вода
возрастет на 6000:273 = 22 Дж/К.
Аналогично для образования 1 моль
льда придется отвести 6000 Дж теплоты,
при этом
ΔS = - 22 Дж/К.
29
30.
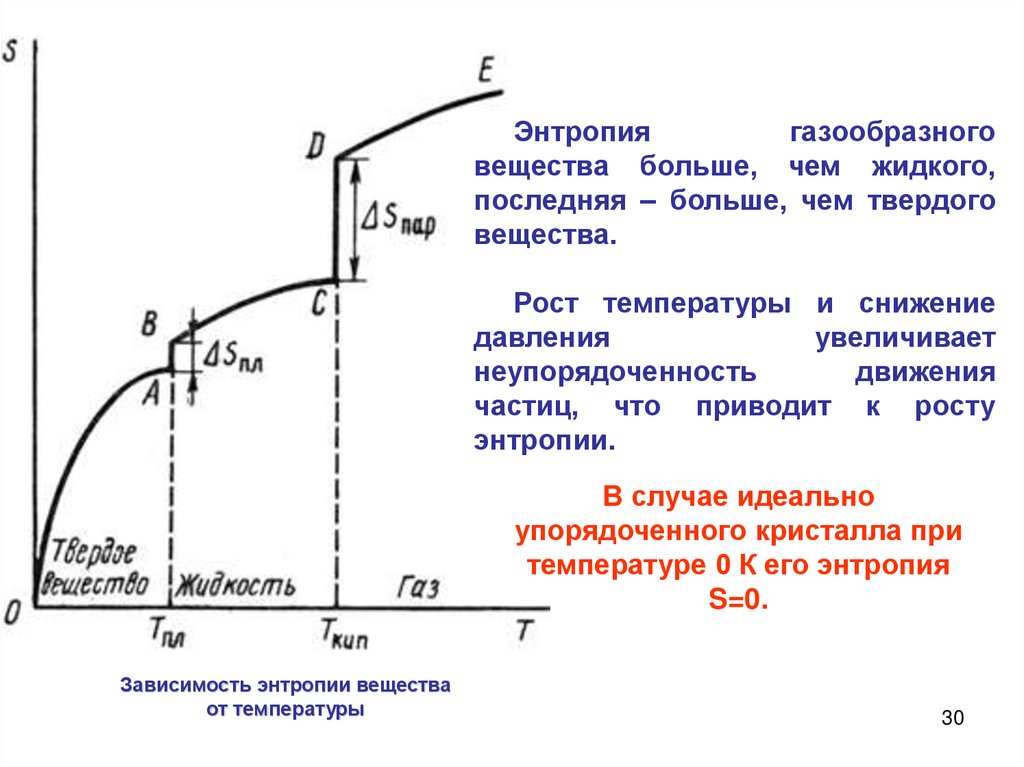
Энтропиягазообразного
вещества больше, чем жидкого,
последняя – больше, чем твердого
вещества.
Рост температуры и снижение
давления
увеличивает
неупорядоченность
движения
частиц, что приводит к росту
энтропии.
В случае идеально
упорядоченного кристалла при
температуре 0 К его энтропия
S=0.
Зависимость энтропии вещества
от температуры
30
31.
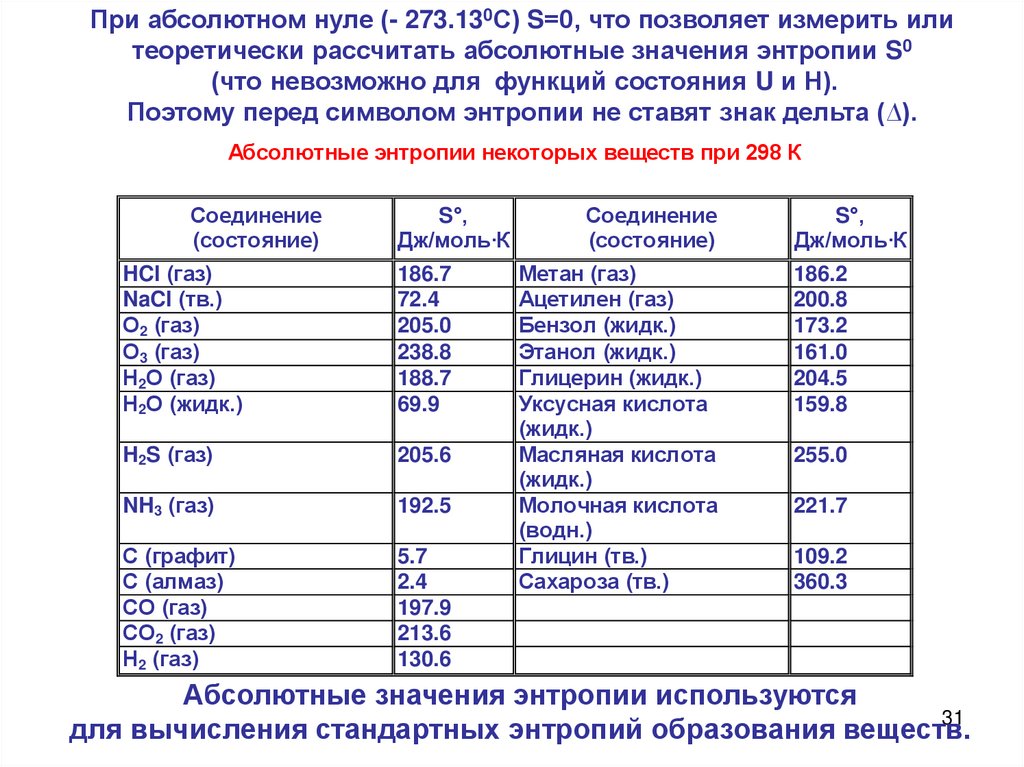
При абсолютном нуле (- 273.130С) S=0, что позволяет измерить илитеоретически рассчитать абсолютные значения энтропии S0
(что невозможно для функций состояния U и Н).
Поэтому перед символом энтропии не ставят знак дельта (∆).
Абсолютные энтропии некоторых веществ при 298 К
Соединение
(состояние)
S°,
Дж/моль·К
HCl (газ)
NaCl (тв.)
О2 (газ)
О3 (газ)
Н2О (газ)
Н2О (жидк.)
186.7
72.4
205.0
238.8
188.7
69.9
H2S (газ)
205.6
NH3 (газ)
192.5
С (графит)
С (алмаз)
СО (газ)
СО2 (газ)
Н2 (газ)
5.7
2.4
197.9
213.6
130.6
Соединение
(состояние)
Метан (газ)
Ацетилен (газ)
Бензол (жидк.)
Этанол (жидк.)
Глицерин (жидк.)
Уксусная кислота
(жидк.)
Масляная кислота
(жидк.)
Молочная кислота
(водн.)
Глицин (тв.)
Сахароза (тв.)
S°,
Дж/моль·К
186.2
200.8
173.2
161.0
204.5
159.8
255.0
221.7
109.2
360.3
Абсолютные значения энтропии используются
31
для вычисления стандартных энтропий образования веществ.
32.
Энтропия образования вещества (ΔS°образ) - разность междусуммами абсолютных энтропий продуктов реакции (S°np.) и
абсолютных энтропий реагирующих веществ (S°pear).
ΔS образования 298 ni S 298( продукты.) ni S 298(исх.)
o
o
Задача
Определить энтропию образования этанола из элементов
(пользуясь табличными данными).
2С + 3Н2 + 0.5О2 С2Н5ОН.
Подстановка значений Sо из таблицы дает:
ΔS°образ.. = 161.0- ( 2·5.7 + 3·130.6 + 0.5·205.0 ) = – 344.7 Дж/моль·К.
32
33.
Критерии самопроизвольного протекания процессаЭнтальпийный фактор (ΔН)
характеризует стремление
системы к упорядочиванию, поскольку процесс сопровождается
уменьшением внутренней энергии.
Энтропийный фактор (∆S) - отражает тенденцию к
разупорядочиванию, поскольку такое состояние наиболее
вероятно.
Для того, чтобы действие этих двух факторов было
сопоставимым, необходима одинаковая размерность величин !!!,
для чего ∆S, измеряемое в Дж/(моль·К), необходимо умножить на
абсолютную температуру.
33
34.
T∆S– характеризует ту часть энергии, которую нельзя превратить в
работу (связанная энергия), и отражает стремление системы к
максимуму беспорядка
Выражение T∆S имеет глубокий смысл, поскольку увеличение и
энтропии, и температуры приводит к усилению в системе
беспорядка.
34
35.
Функцией, учитывающей оба фактора и противоположность втенденции их изменения является энергия Гиббса G
(изобарно-изотермический потенциал):
G = H - TS
∆G = ∆ H - T∆S
ГИББС Джозайя Уиллард
(11.02.1839-28.04.1903)
Один из основоположников термодинамики.
Разработал (1875–1878) теорию
термодинамических потенциалов. Предложил
(1878) графическое изображение состояния
трехкомпонентной системы (треугольник
Гиббса). Заложил основы термодинамики
поверхностных явлений и электрохимических
процессов, ввел понятие адсорбции.
35
36.
Факторы, определяющие ходизобарно- изотермического процесса
( Р и Т – постоянны)
(помним, что +Q = - ∆H)
G H T S
ΔH
–
ΔS
+
–
–
+
+
+
–
Возможность самопроизвольного процесса
Процесс идет самопроизвольно при любой температуре
Процесс может идти самопроизвольно при низких
температурах
Процесс может идти самопроизвольно при высоких
температурах
Процесс не идет самопроизвольно ни при какой температуре
36
37.
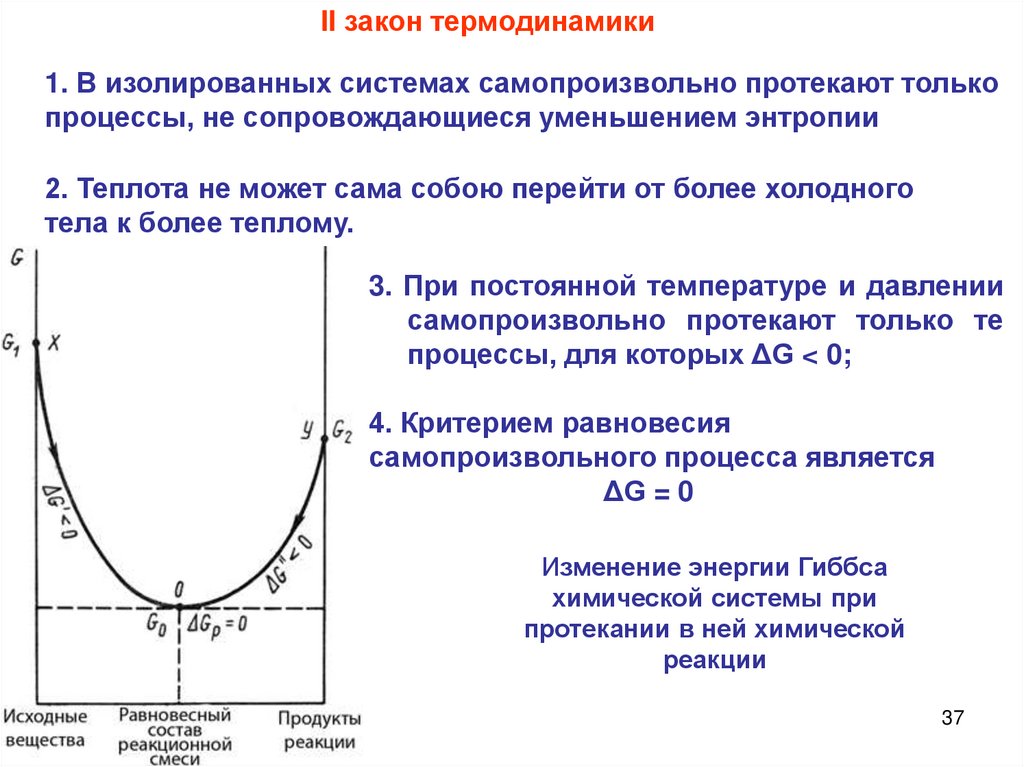
II закон термодинамики1. В изолированных системах самопроизвольно протекают только
процессы, не сопровождающиеся уменьшением энтропии
2. Теплота не может сама собою перейти от более холодного
тела к более теплому.
3. При постоянной температуре и давлении
самопроизвольно протекают только те
процессы, для которых ΔG < 0;
4. Критерием равновесия
самопроизвольного процесса является
ΔG = 0
Изменение энергии Гиббса
химической системы при
протекании в ней химической
реакции
37
38.
Так как энергия Гиббса есть функция состояния, к ней такжеприменим закон Гесса:
ΔG реакции 298 ni G 298( конечн .) ni G 298(исх.)
o
o
38
39.
Особенности термодинамики биохимических поцессов.1. Большинство биохимических реакций в организме –
обратимы и протекают многостадийно.
2. Биологическое развитие организма возможно только в
системе, находящейся в стационарном (постоянство
термодинамических величин, скоростей поступления и
удаления веществ и энергии), но … далеком от равновесия
состоянии!!!
39
40.
3. Живые организмы поддерживают присущую имупорядоченность за счет увеличения энтропии внешней среды
(поступающие с низким значением энтропии белки, углеводы,
полисахариды превращаются в Н2О,СО2,NН3 и выводятся из
организма).
Изменение энтропии (человек +окружающая среда) в
стационарном состоянии равно сумме изменения энтропии
организма и среды:
∆S общ = ∆Sчел.+ ∆Sсреды
Жизнь - постоянная борьба против тенденции к возрастанию
энтропии.
Живые организмы выбрали «наименьшее зло» - стационарное
состояние, котором возрастание энтропии минимально. 40
41.
Принцип ПригожинаВ открытой системе в стационарном
состоянии прирост энтропии в единицу
времени ∆S / ∆t принимает минимальное
положительное значение
Пригожин Илья Романович
Бельгийский химик, родился в Москве 25 января 1917 года.
В 1921 году семья эмигрировала из России.
Нобелевская премия (1977год) «за работы по термодинамике необратимых
процессов». Эта работа открыла для термодинамики «новые связи и создала
теории, устраняющие разрывы между химическим, биологическим и
социальным полями научных исследований». Исследования Пригожина
отличает элегантность и прозрачность, поэтому ученого заслуженно
41
называют «поэтом термодинамики»
42.
4. Реализация принципа энергетического сопряжения:Эндэргонические реакции (∆G>0 –процесс самопроизвольно не
идет!!!) сопряжены с экзэргоническими (∆G<0 – критерий
самопроизвольного протекания процесса)
Глюкоза + Фруктоза → Сахароза + Н2О
∆G= + 20.9 кДж/моль
Глюкоза + Фруктоза + АТФ → Сахароза + АДФ + Фосфаты
∆G= - 29.2 кДж/моль
42
43.
Термодинамические особенности открытых систем для живогоорганизма ( постоянство кислотно-основного, гетерогенного,
лигандообменного баланса) объясняют его устойчивость,
позволяющую ему в течение многих лет сохранять
работоспособность, а также относительное постоянство
внутренней среды – гомеостаза.
43
44. В основе гомеостаза организма находятся следующие химические и физико-химические балансы:
Кислотно-основной
Окислительно-восстановительный
Металло-лигандный
Гидрофильно-липофильный
Водно-электролитный
44
45.
"Химическая кинетика и катализ"45
46. Химические реакции протекают с разными скоростями:
Химические реакцииразными скоростями:
1) Быстро протекающие
(взрывы, биохимические
реакции)
протекают
с
2) Медленно протекающие
(ржавление, ферментация
вина)
47.
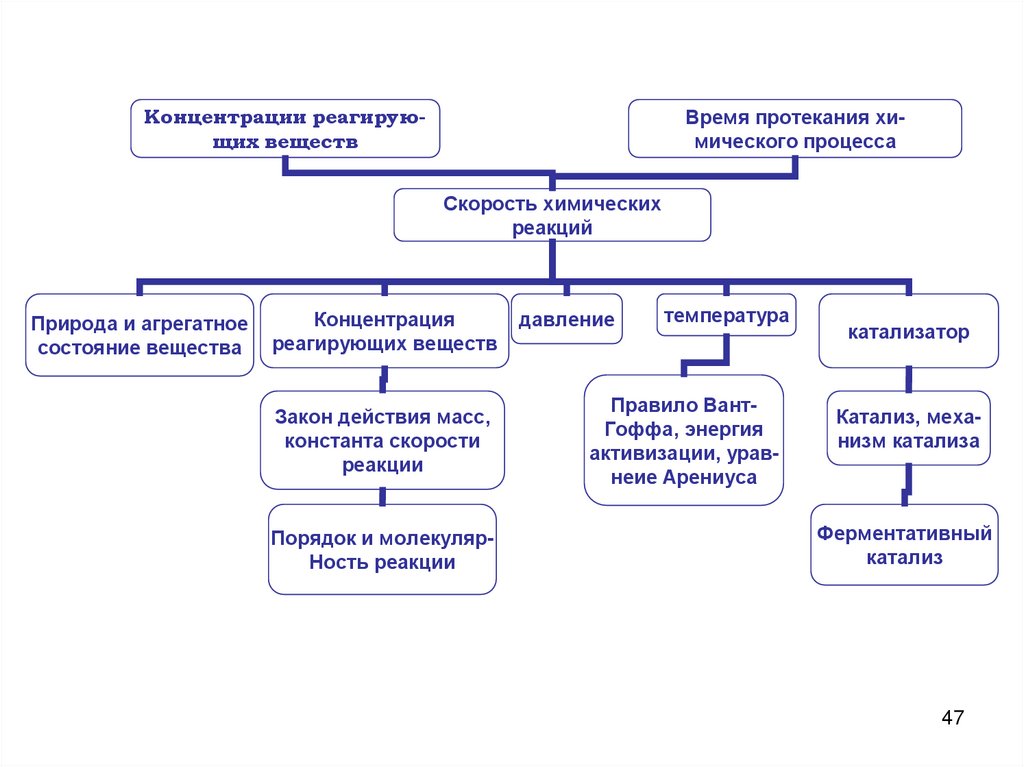
Концентрации реагирующих веществВремя протекания химического процесса
Скорость химических
реакций
Природа и агрегатное
состояние вещества
Концентрация
реагирующих веществ
Закон действия масс,
константа скорости
реакции
Порядок и молекулярНость реакции
давление
температура
Правило ВантГоффа, энергия
активизации, уравнеие Арениуса
катализатор
Катализ, механизм катализа
Ферментативный
катализ
47
48.
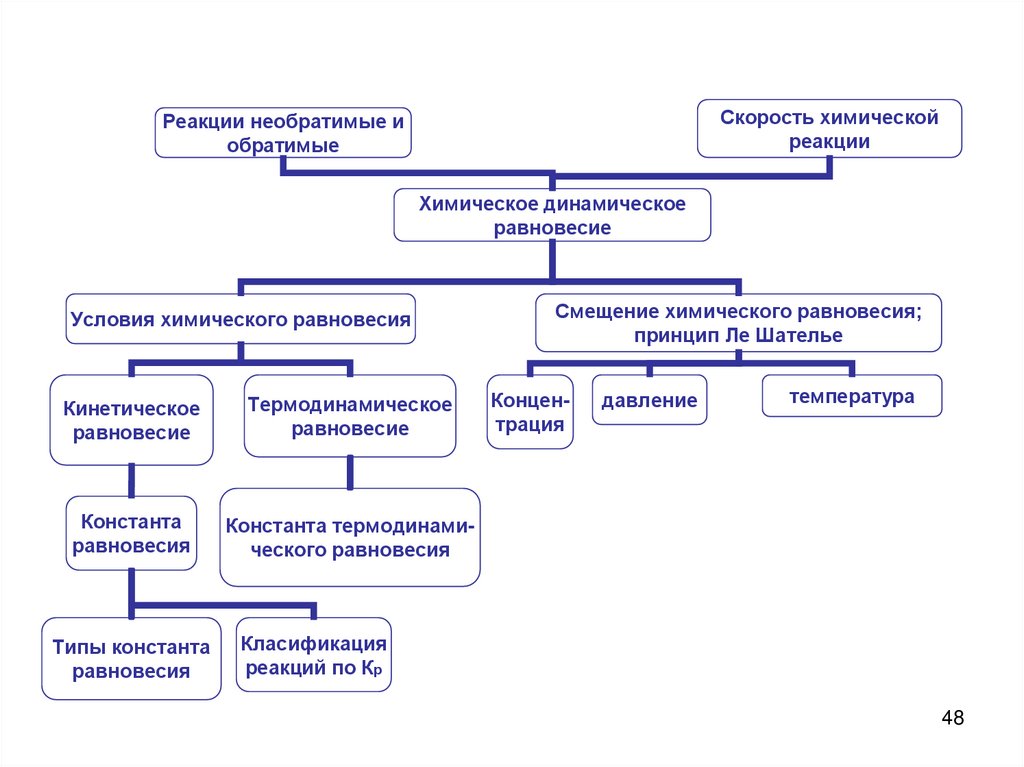
Скорость химическойреакции
Реакции необратимые и
обратимые
Химическое динамическое
равновесие
Условия химического равновесия
Кинетическое
равновесие
Термодинамическое
равновесие
Константа
равновесия
Константа термодинамического равновесия
Типы константа
равновесия
Смещение химического равновесия;
принцип Ле Шателье
Концентрация
давление
температура
Класификация
реакций по Кр
48
49.
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗХимическая кинетика - учение о скорости химических реакций и
зависимости ее от различных факторов - природы и концентрации
реагирующих веществ, давления, температуры, катализаторов.
Взрыв тысячные доли
секунды
Ржавчина - несколько часов
Антрацит сотни,
тысячи лет.
Управление химическим процессом является главной задачей
49
химической кинетики.
50.
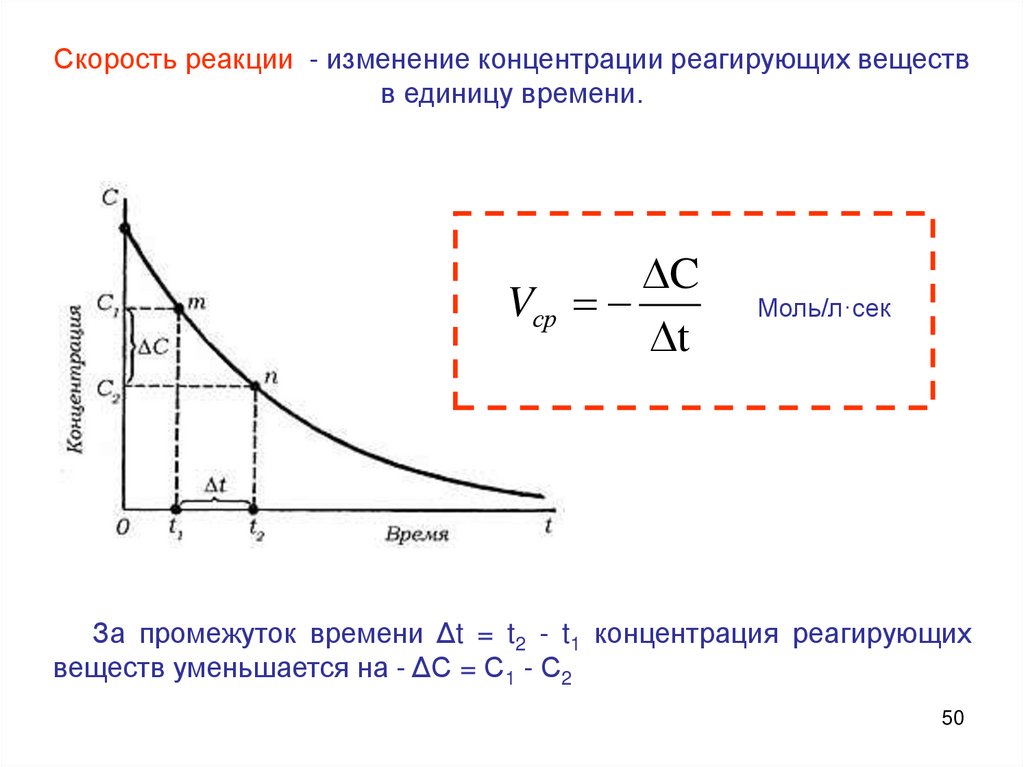
Скорость реакции - изменение концентрации реагирующих веществв единицу времени.
C
Vср
t
Моль/л·сек
За промежуток времени Δt = t2 - t1 концентрация реагирующих
веществ уменьшается на - ΔС = С1 - С2
50
51.
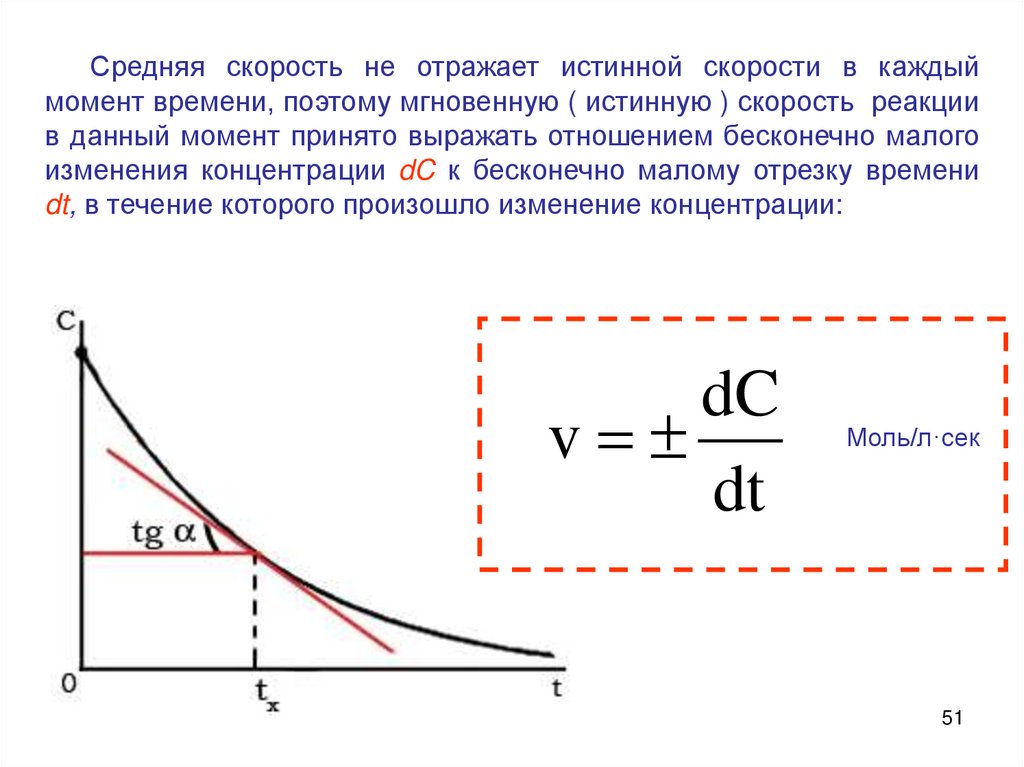
Средняя скорость не отражает истинной скорости в каждыймомент времени, поэтому мгновенную ( истинную ) скорость реакции
в данный момент принято выражать отношением бесконечно малого
изменения концентрации dC к бесконечно малому отрезку времени
dt, в течение которого произошло изменение концентрации:
dC
v
dt
Моль/л·сек
51
52.
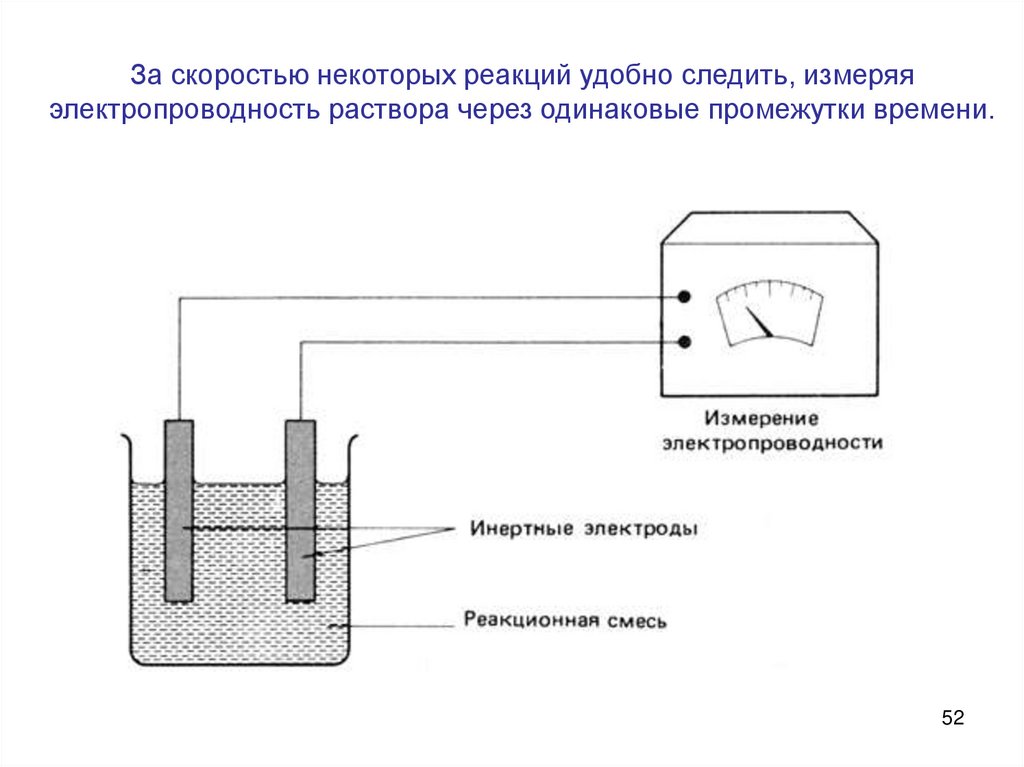
За скоростью некоторых реакций удобно следить, измеряяэлектропроводность раствора через одинаковые промежутки времени.
52
53.
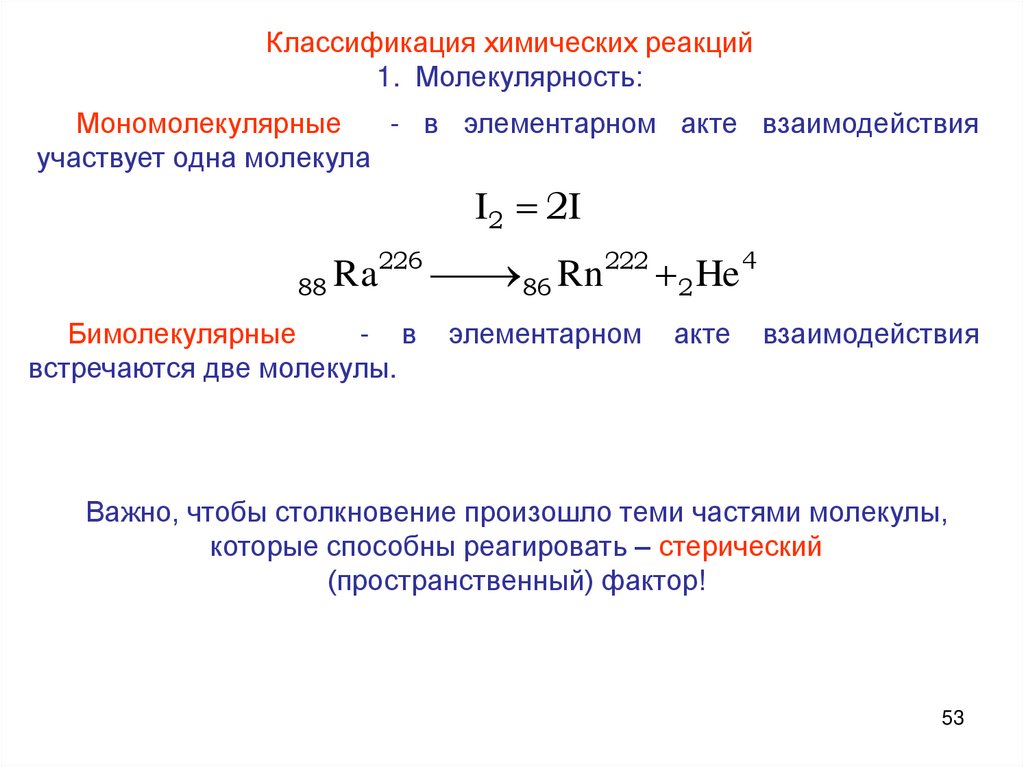
Классификация химических реакций1. Молекулярность:
Мономолекулярные
- в элементарном акте взаимодействия
участвует одна молекула
I2 2I
226
222
4
Ra
Rn
He
88
86
2
Бимолекулярные
- в
встречаются две молекулы.
элементарном
акте
взаимодействия
Важно, чтобы столкновение произошло теми частями молекулы,
которые способны реагировать – стерический
(пространственный) фактор!
53
54.
Влияние стерического фактора при взаимодействии Н2 и I2H 2 I2 2HI
Тримолекулярные –
в элементарном акте взаимодействия участвуют три молекулы.
2NO O2 2NO 2
Одновременная встреча в элементарном акте трех молекул
случается довольно редко.
Реально реакции протекают через две и большее число
промежуточных стадий моно- или бимолекулярных реакций.
54
55.
Скорость реакции, в целом, определяется лимитирующей стадией самой медленной стадией реакции.55
56.
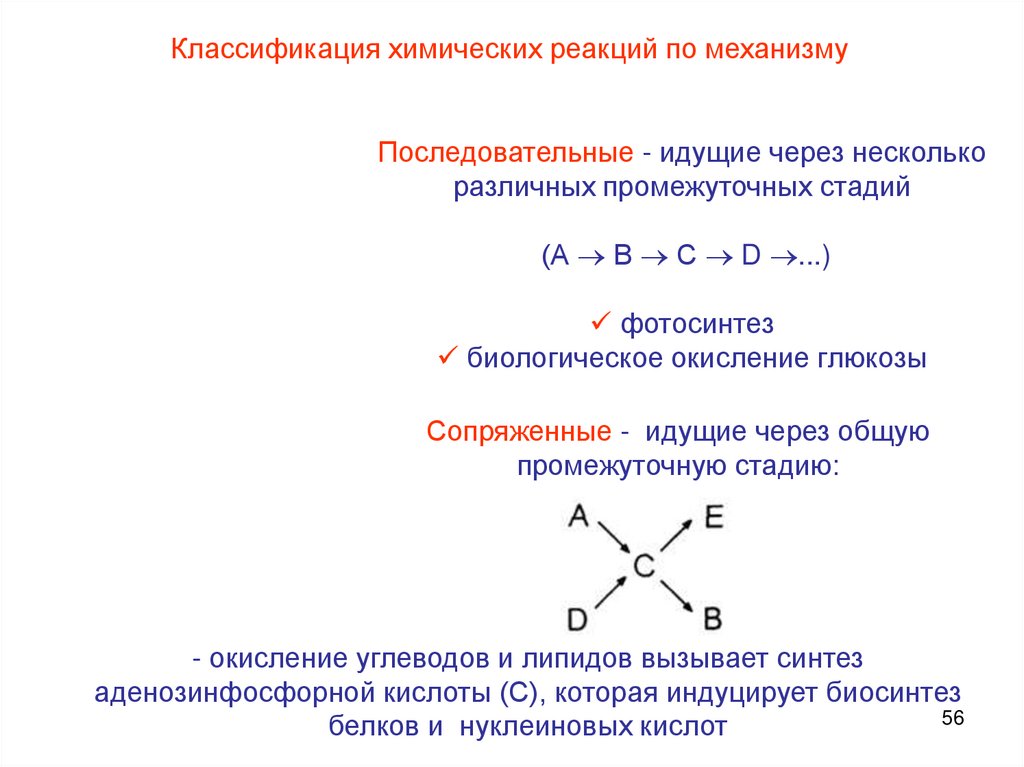
Классификация химических реакций по механизмуПоследовательные - идущие через несколько
различных промежуточных стадий
(А В С D ...)
фотосинтез
биологическое окисление глюкозы
Сопряженные - идущие через общую
промежуточную стадию:
- окисление углеводов и липидов вызывает синтез
аденозинфосфорной кислоты (С), которая индуцирует биосинтез
56
белков и нуклеиновых кислот
57.
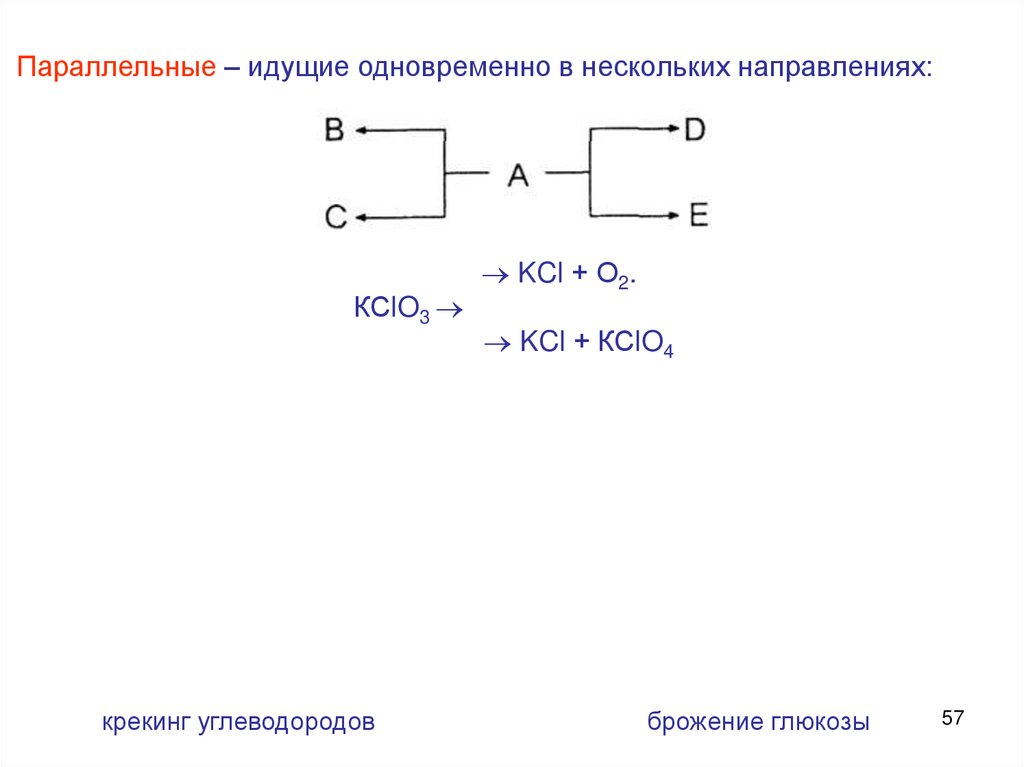
Параллельные – идущие одновременно в нескольких направлениях:КСlO3
крекинг углеводородов
KCl + О2.
KCl + КСlO4
брожение глюкозы
57
58.
Цепные - стадии превращенияисходных соединений в продукты
многократно повторяются:
Cl2 Cl Cl
Cl H 2 HCl H
H Cl2 HCl Cl
Cl Cl Cl2 (обрыв цепи)
H H H 2 (обрыв цепи)
Окончил Петроградский университет в 1917 году.
Разработанная им теория цепных реакций позволила
управлять
химическими
процессами:
ускорять,
замедлять, подавлять вовсе, обрывать на любой
Николай Семенов
желаемой стадии.
(15.04.1896 -25.09.1986)
Нобелевская премия (1956 г.).
58
59.
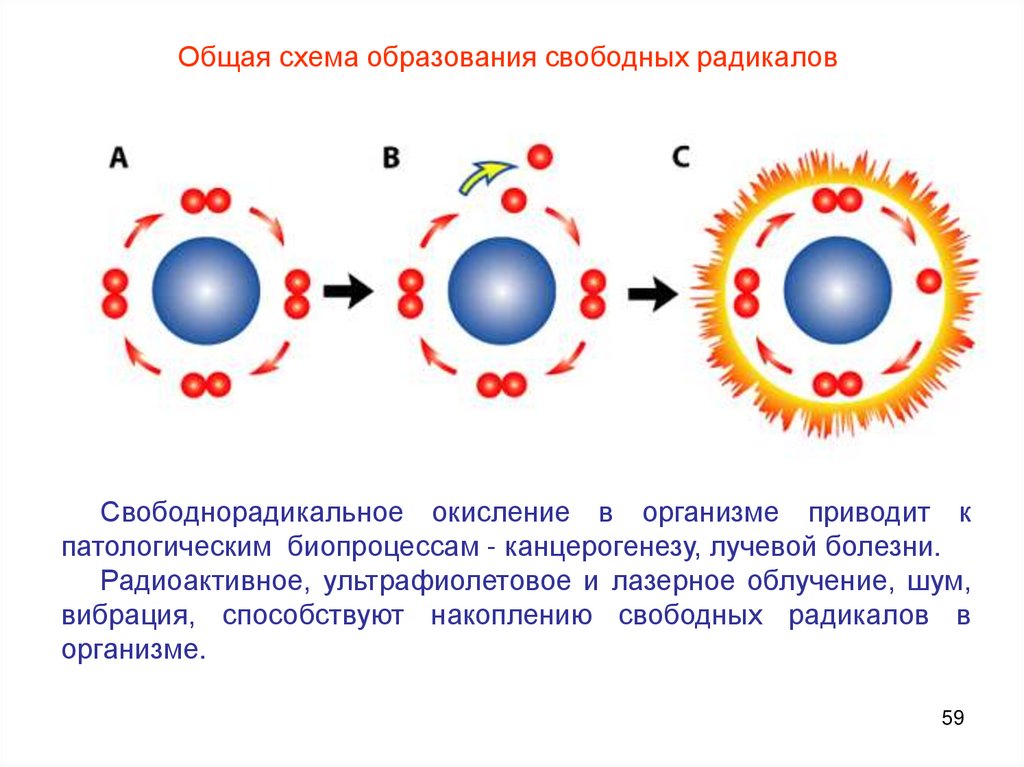
Общая схема образования свободных радикаловСвободнорадикальное окисление в организме приводит к
патологическим биопроцессам - канцерогенезу, лучевой болезни.
Радиоактивное, ультрафиолетовое и лазерное облучение, шум,
вибрация, способствуют накоплению свободных радикалов в
организме.
59
60.
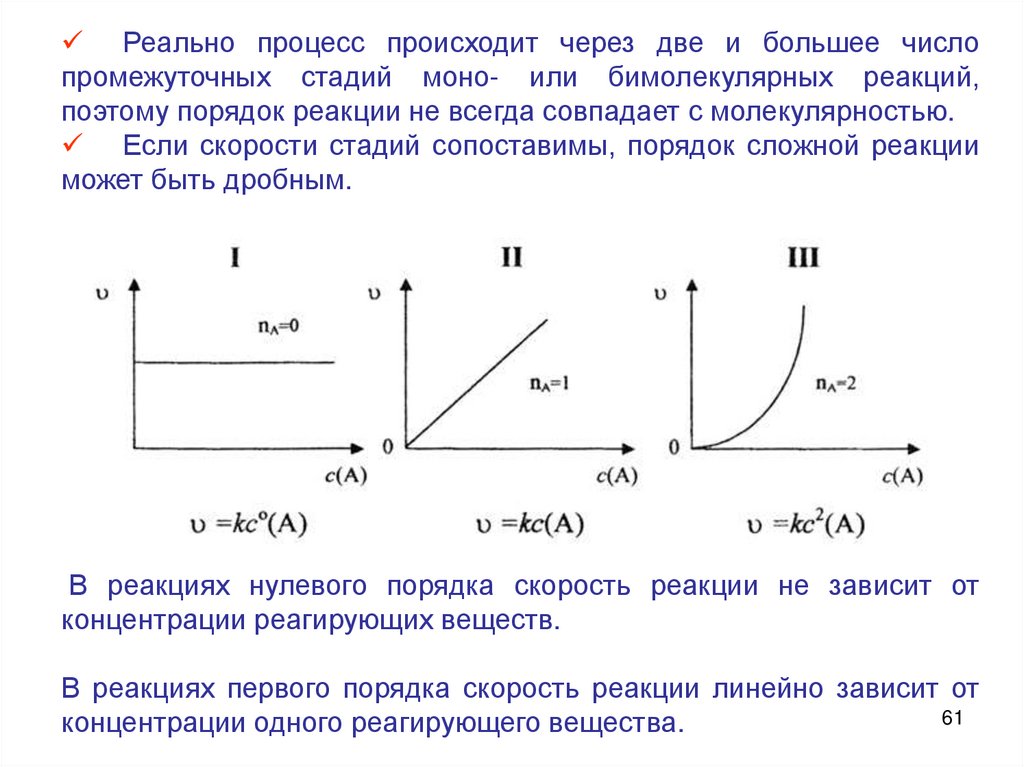
Порядок реакцииПорядок реакции - сумма показателей степеней, с которыми
концентрации реагентов входят в экспериментально найденное
кинетическое уравнение
n1A n 2B n 3C n 4 D
n = n1 + n2
Стехиометрическое уравнение реакции описывает процесс в целом
и не отражает истинного механизма реакции.
60
61.
Реально процесс происходит через две и большее числопромежуточных стадий моно- или бимолекулярных реакций,
поэтому порядок реакции не всегда совпадает с молекулярностью.
Если скорости стадий сопоставимы, порядок сложной реакции
может быть дробным.
В реакциях нулевого порядка скорость реакции не зависит от
концентрации реагирующих веществ.
В реакциях первого порядка скорость реакции линейно зависит от
61
концентрации одного реагирующего вещества.
62.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬГОМОГЕННЫХ РЕАКЦИЙ
природа реагирующих веществ
концентрация реагентов
температура
катализатор
62
63.
ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВСкорость химической реакции зависит от природы
химических соединений, подобно тому, как скорость
физических процессов определяется свойствами
веществ. Например, скорость истечения жидкостей
зависит от их вязкости.
63
64.
Реакции между молекулами протекают обычномедленно, между ионами и радикалами – быстро:
H Cl
HCl
очень быстро
AgNO3( р р ) KCl( р р ) AgCl KNO3
быстро
H 2 ( газ) Сl2 ( газ)
2HCl
медленно
Fe( тв) 2HCl( раствор)
FeCl2 H 2
медленно
С( тв) О2 ( газ)
СО2
медленно
Природу реагирующих веществ учитывает
константа скорости реакции k
64
65.
Влияние концентрации реагентовСкорость химической реакции зависит от концентрации
реагирующих веществ - чем выше концентрация, тем больше
скорость реакции, что связано с увеличением числа
эффективных соударений молекул.
65
66.
Закон действия масс(ЗДМ)
Скорость
гомогенной
реакции
при
постоянной температуре пропорциональна
произведению
молярных
концентраций
реагирующих веществ, возведенных в
степени,
численно
равные
их
стехиометрическим коэффициентам.
ГУЛЬДБЕРГ
Като Максимилиан
(2.08.1836-14.1.1902)
Основные научные
работы –
в области химической
кинетики и
термодинамики.
aA bB dD fF
v k[A] [B]
a
b
k - константа скорости
химической реакции
66
67.
v k[A] [B]a
b
k - константа скорости химической реакции
(удельная скорость реакции) численно равна скорости
химической реакции при концентрациях всех реагирующих
веществ, равных 1 моль/л и зависит от:
природы реагирующих веществ
температуры
катализатора
k не зависит от концентрации реагирующих веществ!
67
68.
Скорость образования желтого осадка Аs2S3 при пропускании H2Sчерез растворы тиосульфата и арсената натрия разных исходных
концентраций
С1 > С2
68
69.
Концентрации твердых веществ в гетерогенных системах невходят в выражение константы химического равновесия, так как
они учитываются величинами константы скорости гетерогенной
реакции:
CaCO3 (тв)
СaO(тв) CO 2 (г)
v k - реакция нулевого порядка
v k[CO2 ] - реакция первого порядка
69
70.
Вместе с тем, чем больше поверхность соприкосновения, тембыстрее протекает реакция. Поверхность твердых веществ может
быть увеличена путем их измельчения, а для растворимых веществ путем их растворения.
70
71.
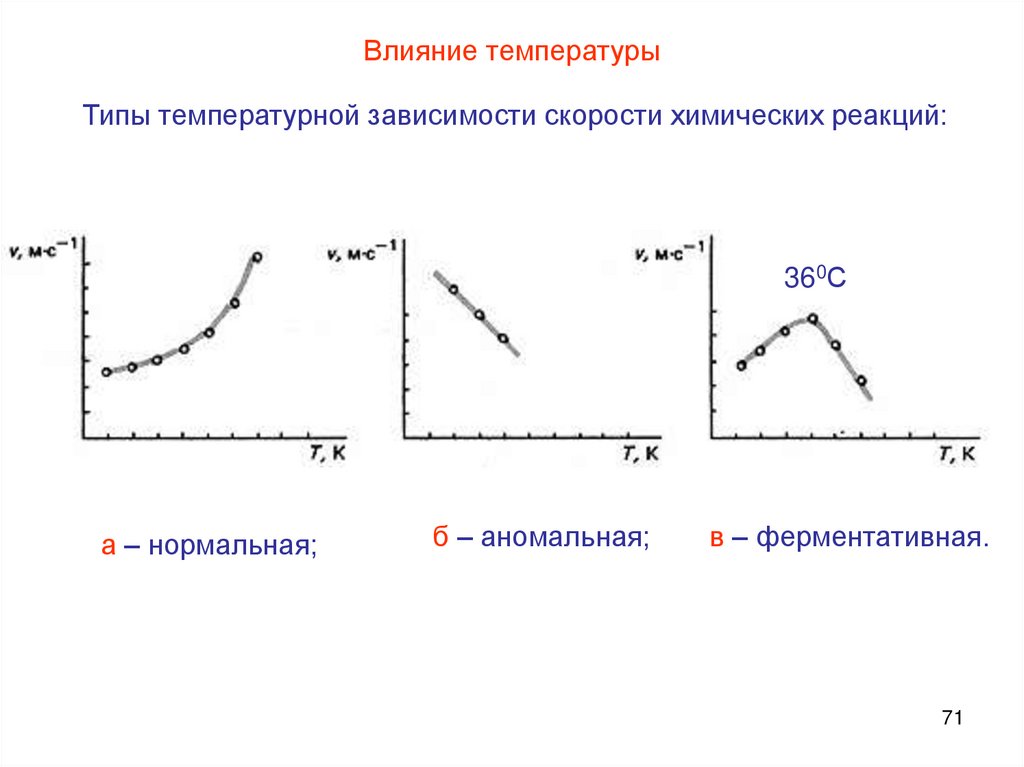
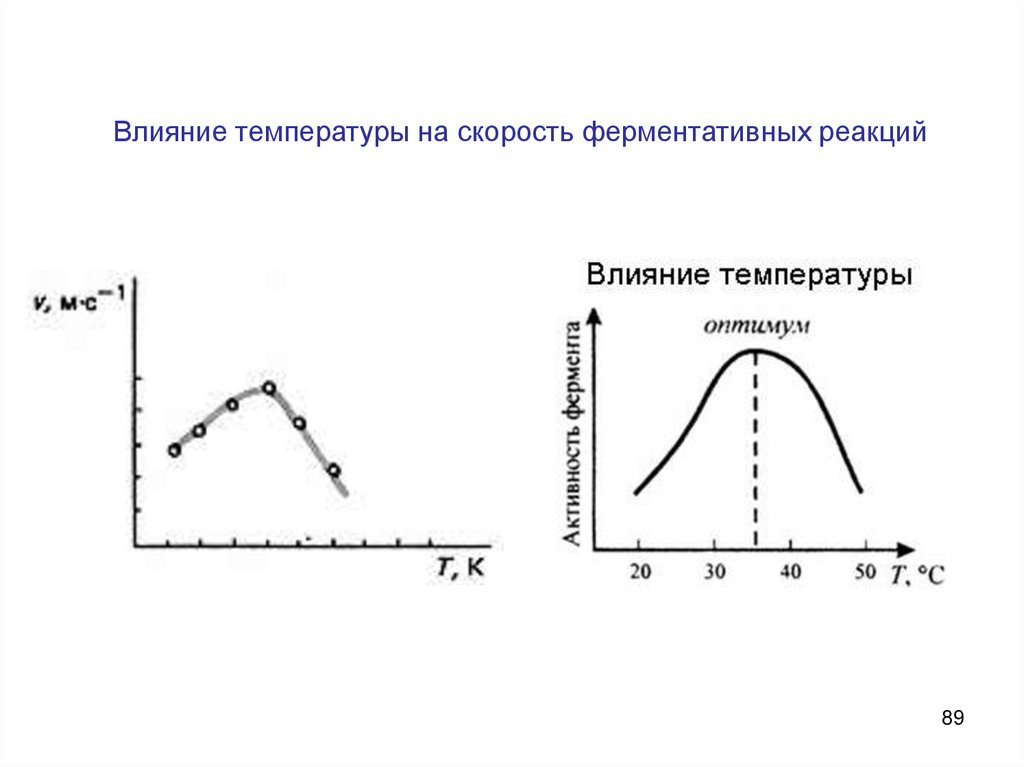
Влияние температурыТипы температурной зависимости скорости химических реакций:
360С
а – нормальная;
б – аномальная;
в – ферментативная.
71
72.
Закон Вант-ГоффаЯкоб Вант-Гофф
(30.08.1852 –
1.03.1911)
v 2 v1 ·
T2 T1
10
В отличие от большинства химиков своего времени, Вант-Гофф имел
основательную математическую подготовку. Она пригодилась ученому, когда он
взялся за сложную задачу изучения скорости реакций и условий, влияющих на
химическое равновесие.
В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии,
которая была ему присуждена «в знак признания огромной важности открытия им
законов химической динамики и осмотического давления в растворах».
Его теоретические работы внесли существенный вклад в развитие учения о
химической кинетике, химическом равновесии, о свойствах растворов. Создал
оригинальный метод вычисления химического сродства, разработал основы
72
стереохимии.
73.
В 1845 году Георг Кольбесинтезировал уксусную кислоту
Невольно большую роль в популяризации новых взглядов Вант-Гоффа
принадлежала профессору Г. Кольбе из Лейпцига. В резкой форме он высказал
свои замечания по поводу статьи голландского ученого: "Какой-то доктор Я.Г.
Вант-Гофф из Ветеринарного института в Утрехте, видимо, не имеет вкуса к
точным химическим исследованиям. Ему значительно удобнее воссесть на
Пегаса (вероятно, взятого напрокат в Ветеринарном институте) и провозгласить
в своей "Химии в пространстве", что, как ему показалось во время смелого
полета к химическому Парнасу, атомы расположены в межпланетном
пространстве". Естественно, каждого, кто прочел эту резкую отповедь,
73
заинтересовала
теория
Вант-Гоффа.
Так
началось
ее
быстрое
распространение в научном мире.
74.
Закон Вант-ГоффаПри повышении температуры на 10° скорость
химической реакции возрастает в два-четыре раза.
v 2 v1 ·
T2 T1
10
Температурный коэффициент
изменяется от 2 до 4.
Для биохимических реакций = 7-9.
Если повысить температуру на 100°, то скорость
реакции увеличится в 1024 раза:
v 2 v1 · 2 1024
10
74
75.
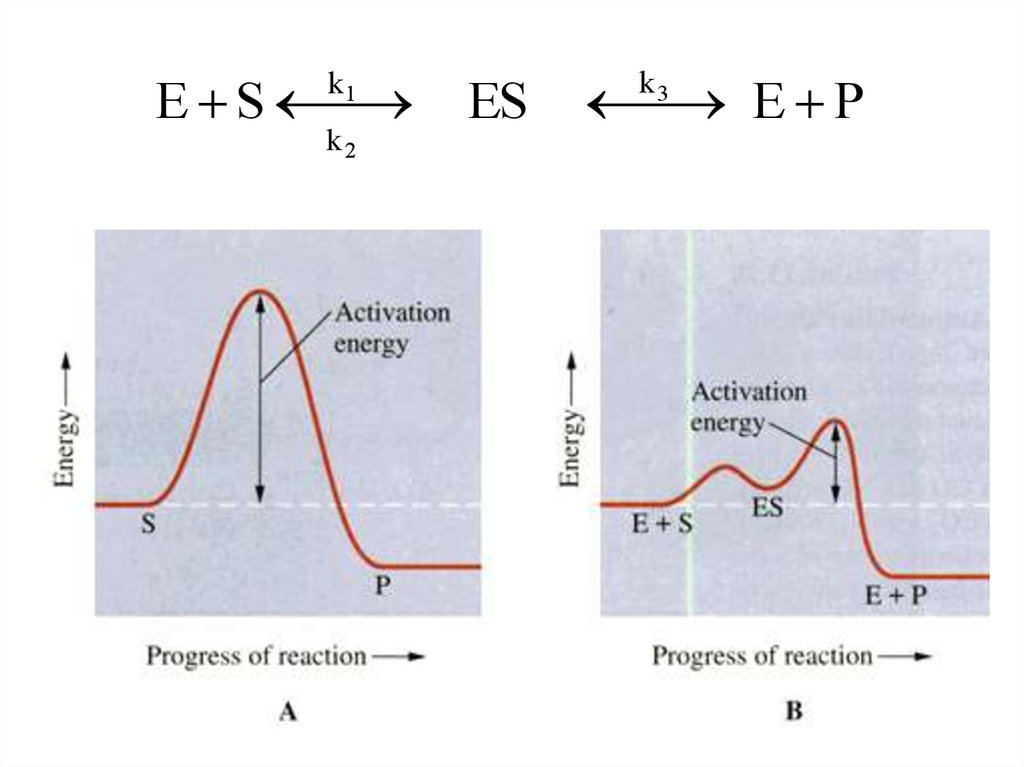
Рост скорости реакции с температурой объясняется тем, что невсякое столкновение приводит к химическому превращению.
Для осуществления реакции необходимо, чтобы молекулы
обладали запасом энергии, достаточным для расшатывания тех
связей, которые перестраиваются в ходе реакции (энергией
активации Еа)
75
76.
Уравнение АррениусаK Аo ·e
Сванте Аррениус
(19.02.1859-2.10.1927)
В 1889 году впервые
ввел понятие «энергия активации»;
вывел
уравнение
зависимости
скорости
реакции
от
чистоты
столкновения молекул, температуры
и энергии активации;
Нобелевская премия за 1903 г.
E
RT
E — энергия активации
К
—
константа
скорости
реакции при обычных условиях
Ао — число эффективных
столкновений за 1 сек в единице
объема
76
77.
Графический способ нахождения Ea и Ao из уравнения АррениусаK Аo ·e
E
RT
E
ln K ln А o
RT
B lnАo
E
tgα
R
Математический способ нахождения Ea из уравнения Аррениуса
Ea 1 1
k2
ln
k1
R T2 T1
77
78.
Влияние катализатораКатализаторы - вещества, увеличивающие скорость химических
реакций
Ингибиторы - вещества, замедляющие скорость химических реакций
Положительный катализатор ускоряет
реакцию, отрицательный замедляет ее.
78
79.
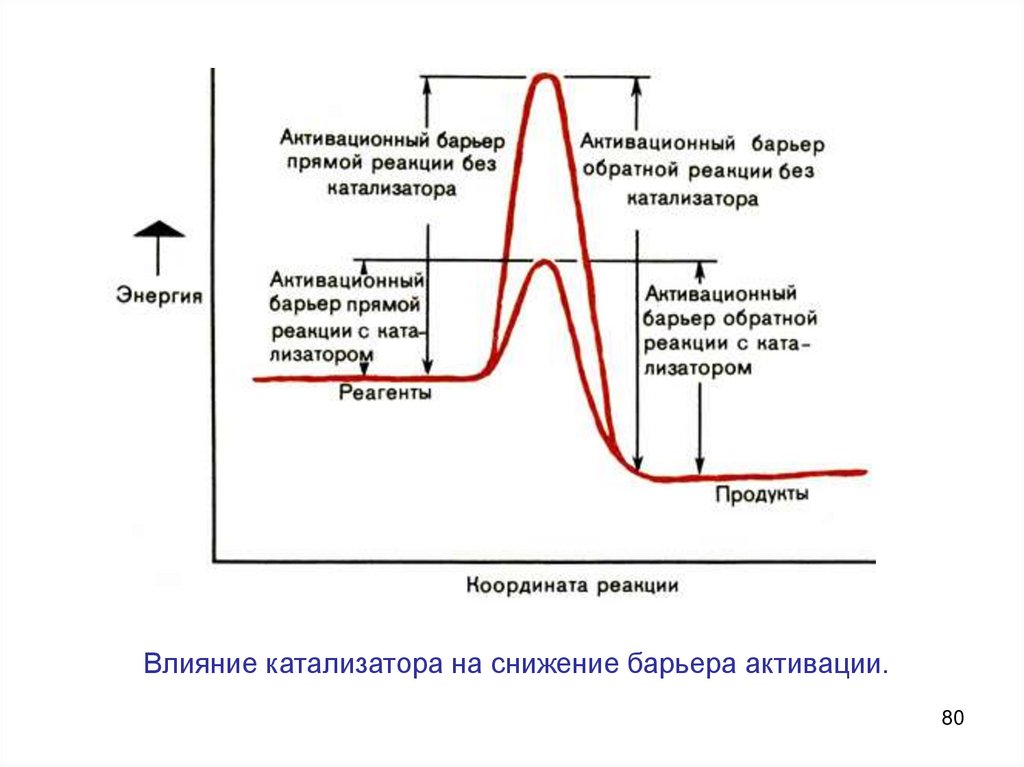
Катализатор понижает энергетический барьер, его могутпреодолеть и молекулы, обладающие малой энергией
Роль катализатора заключается в понижении энергии
активации данной реакции за счет того, что он создает
новый путь ее протекания.
79
80.
Влияние катализатора на снижение барьера активации.80
81.
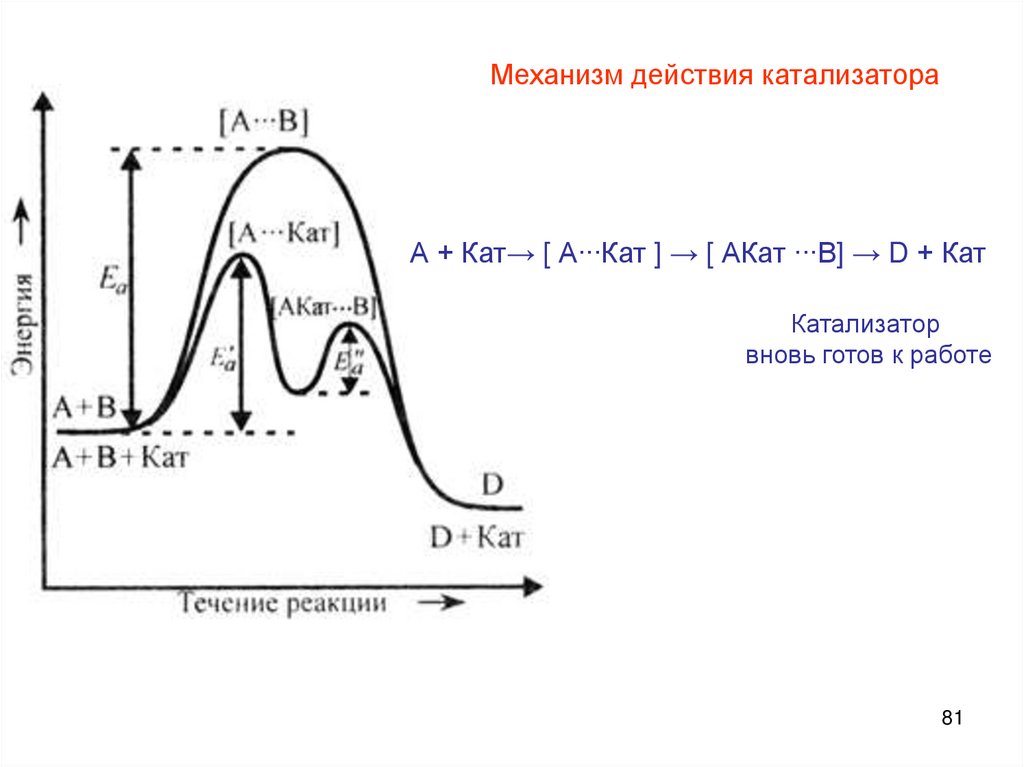
Механизм действия катализатораА + Кат→ [ А∙∙∙Кат ] → [ АКат ∙∙∙В] → D + Кат
Катализатор
вновь готов к работе
81
82.
Из одного вещества можно получить различные продуктыв зависимости от катализатора
82
83.
Ферментативный катализФерменты (энзимы) –
белковые молекулы, которые катализируют химические реакции в
живых системах
Отличия от химического катализа
1. Высокая каталитическая активность, в миллионы раз
превосходящая активность химических катализаторов:
1 моль сахарозы способен расщепить за 1 сек 1000 моль
свекловичного сахара
1 г пепсина расщепляет 50 кг яичного белка
1 г кристаллического ренина свертывает 72 т молока
1 г пероксидазы проявляет активность при разбавлении в 500 000
кг
воды.
83
84.
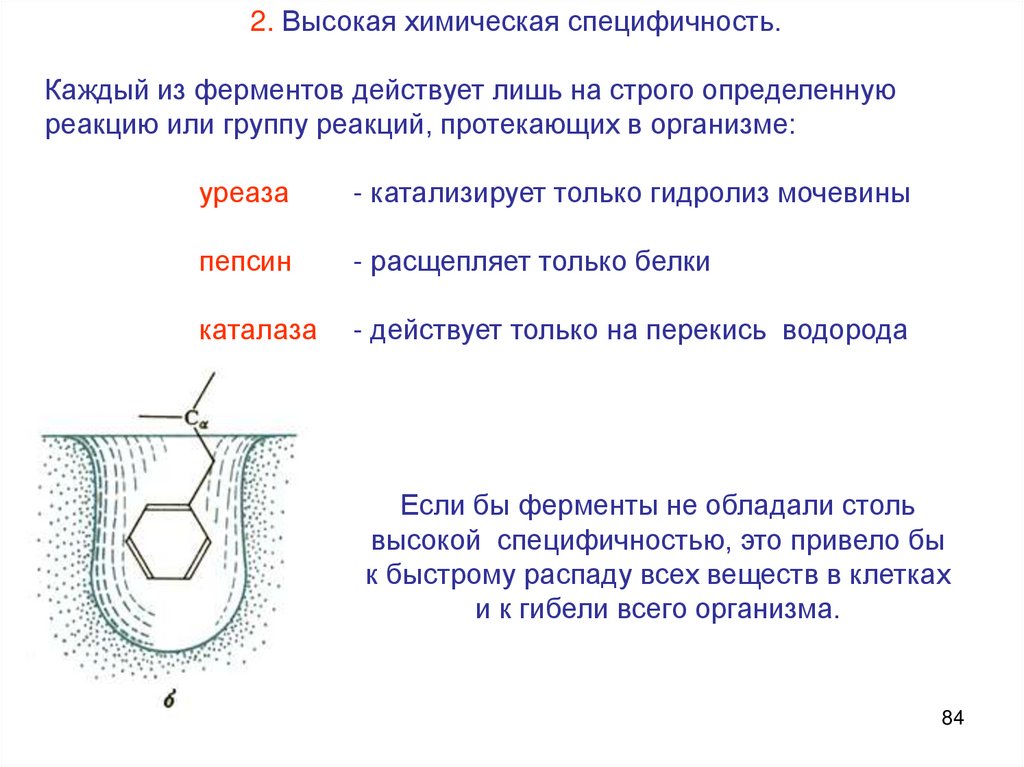
2. Высокая химическая специфичность.Каждый из ферментов действует лишь на строго определенную
реакцию или группу реакций, протекающих в организме:
уреаза
- катализирует только гидролиз мочевины
пепсин
- расщепляет только белки
каталаза
- действует только на перекись водорода
Если бы ферменты не обладали столь
высокой специфичностью, это привело бы
к быстрому распаду всех веществ в клетках
и к гибели всего организма.
84
85.
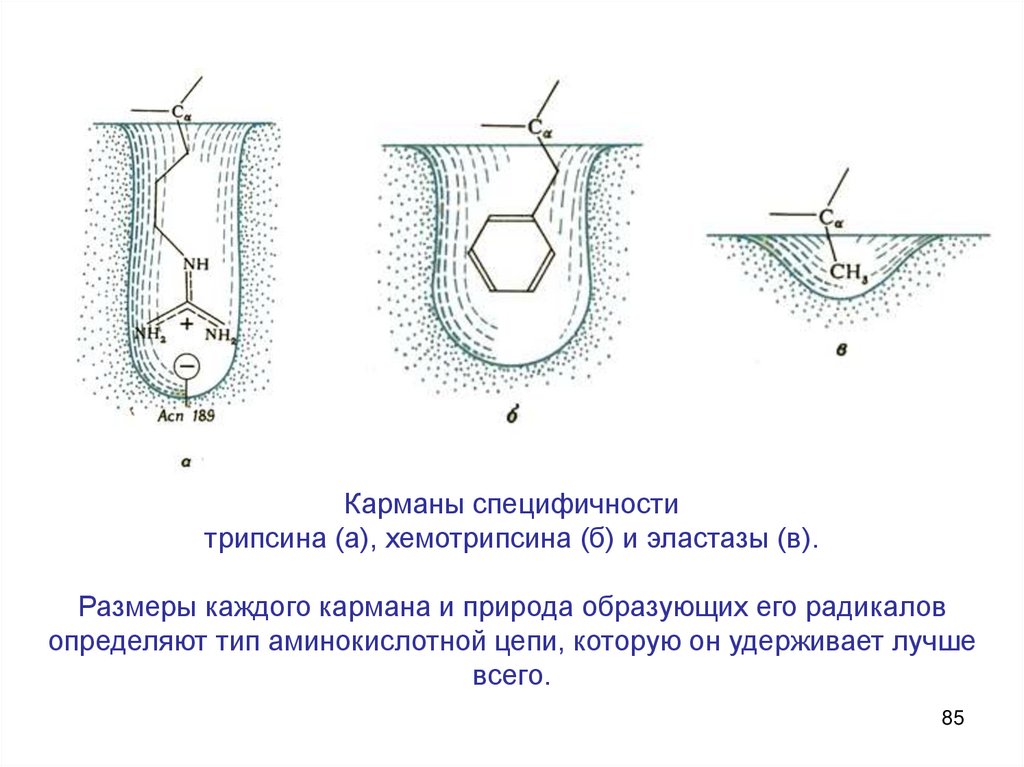
Карманы специфичноститрипсина (а), хемотрипсина (б) и эластазы (в).
Размеры каждого кармана и природа образующих его радикалов
определяют тип аминокислотной цепи, которую он удерживает лучше
всего.
85
86.
В организме человека одновременнофункционирует около
1000 различных ферментов.
86
87.
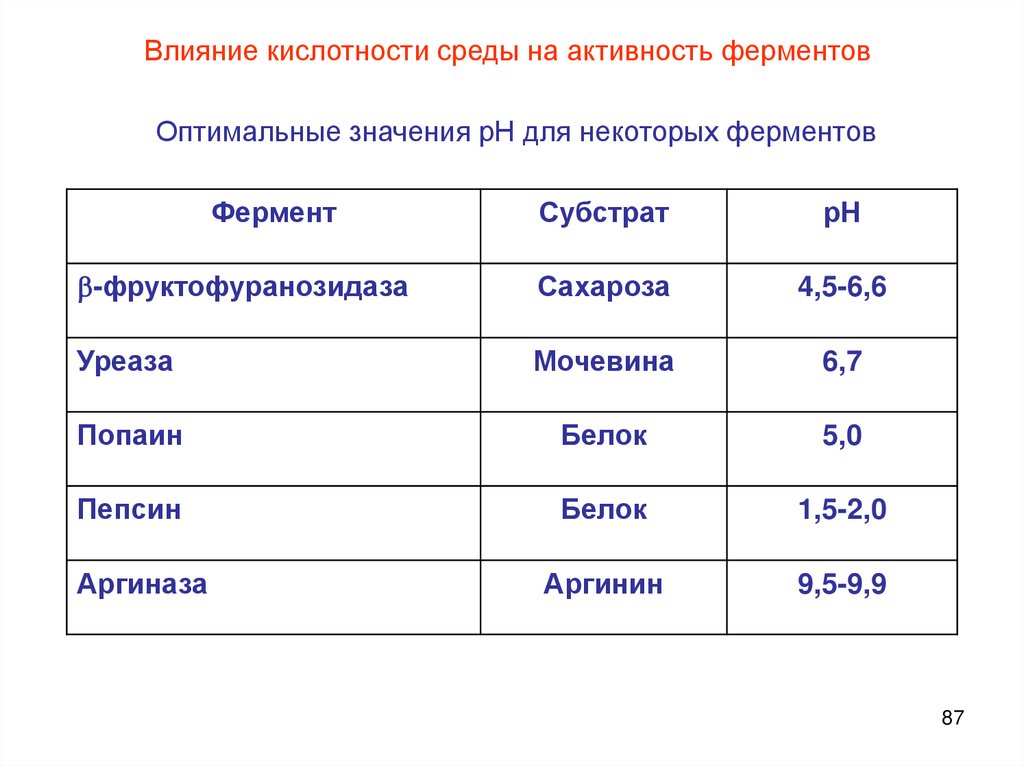
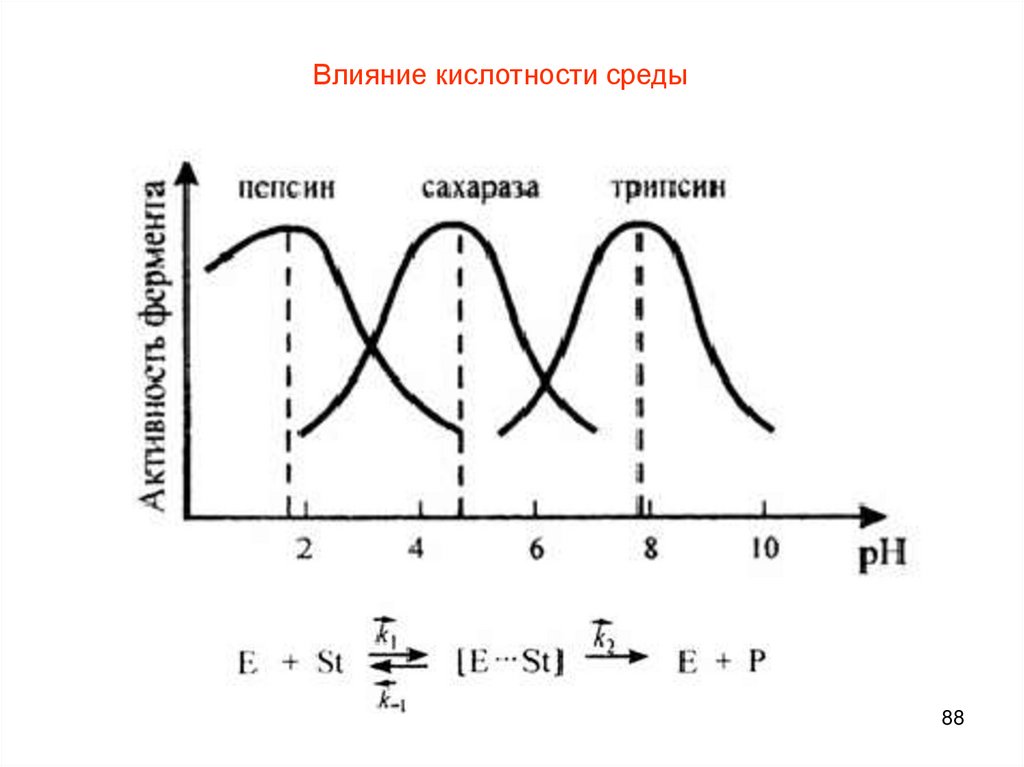
Влияние кислотности среды на активность ферментовОптимальные значения рН для некоторых ферментов
Фермент
Субстрат
рН
-фруктофуранозидаза
Сахароза
4,5-6,6
Уреаза
Мочевина
6,7
Попаин
Белок
5,0
Пепсин
Белок
1,5-2,0
Аргиназа
Аргинин
9,5-9,9
87
88.
Влияние кислотности среды88
89.
Влияние температуры на скорость ферментативных реакций89
90.
Изменение теплоемкости воды в зависимости от температуры90
91.
Влияние концентрации фермента на скорость реакцийСхема ферментативного процесса
E S
k1
k2
ES
E P
k3
Е – фермент (энзим)
S – субстрат
ES – фермент-субстратный комплекс
P – продукт реакции
k1 , k2 , k3 – константы скоростей реакций
91
92.
E Sk1
k2
ES
E P
k3
92
93.
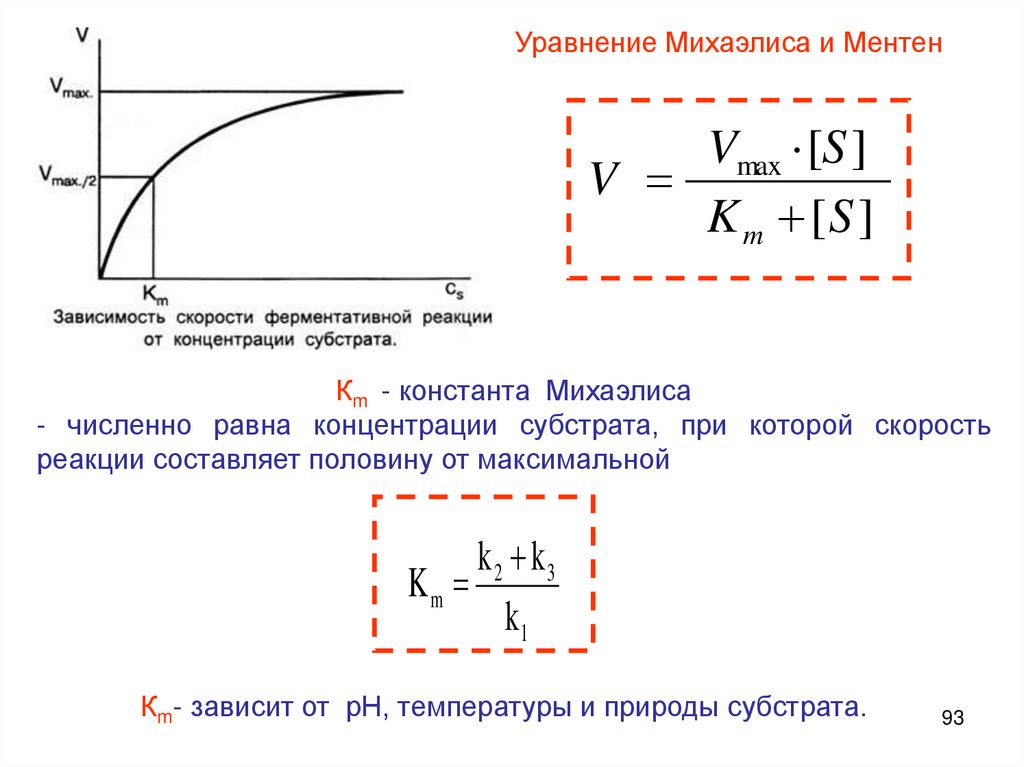
Уравнение Михаэлиса и МентенVmax ·[S ]
V
K m [S ]
Кm - константа Михаэлиса
- численно равна концентрации субстрата, при которой скорость
реакции составляет половину от максимальной
k2 k3
Km
k1
Кm- зависит от рН, температуры и природы субстрата.
93
94.
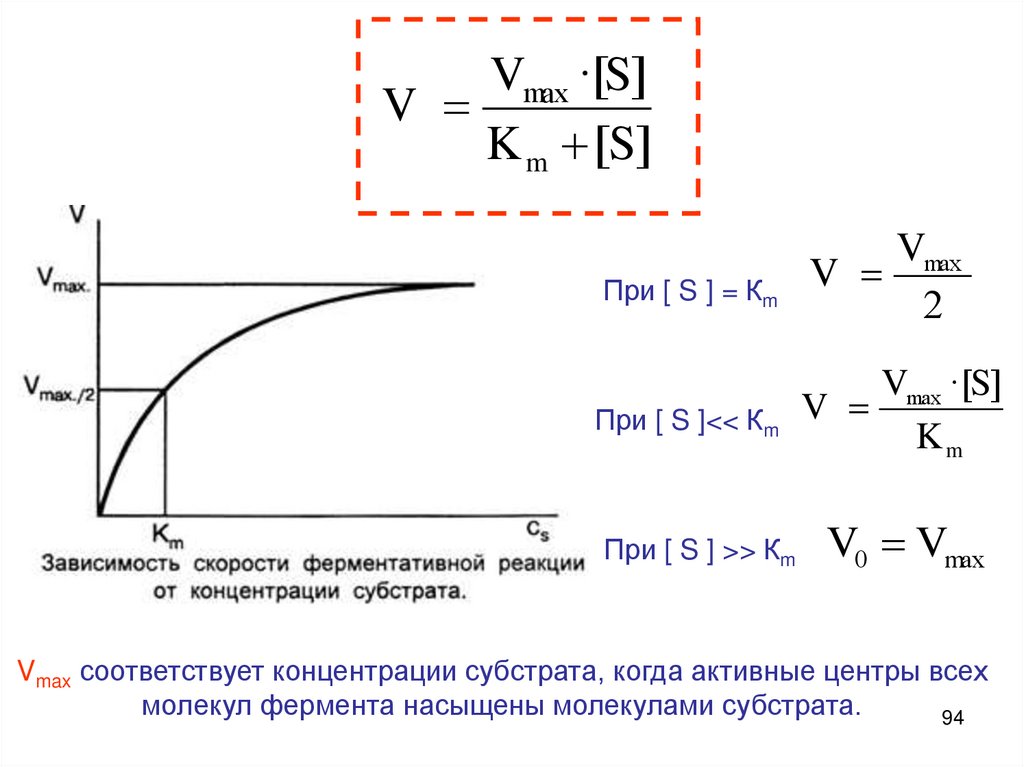
Vmax ·[S]V
K m [S]
При [ S ] = Кm
Vmax
V
2
Vmax ·[S]
При [ S ]<< Кm V
Km
При [ S ] >> Кm
V0 Vmax
Vmax соответствует концентрации субстрата, когда активные центры всех
молекул фермента насыщены молекулами субстрата.
94
95.
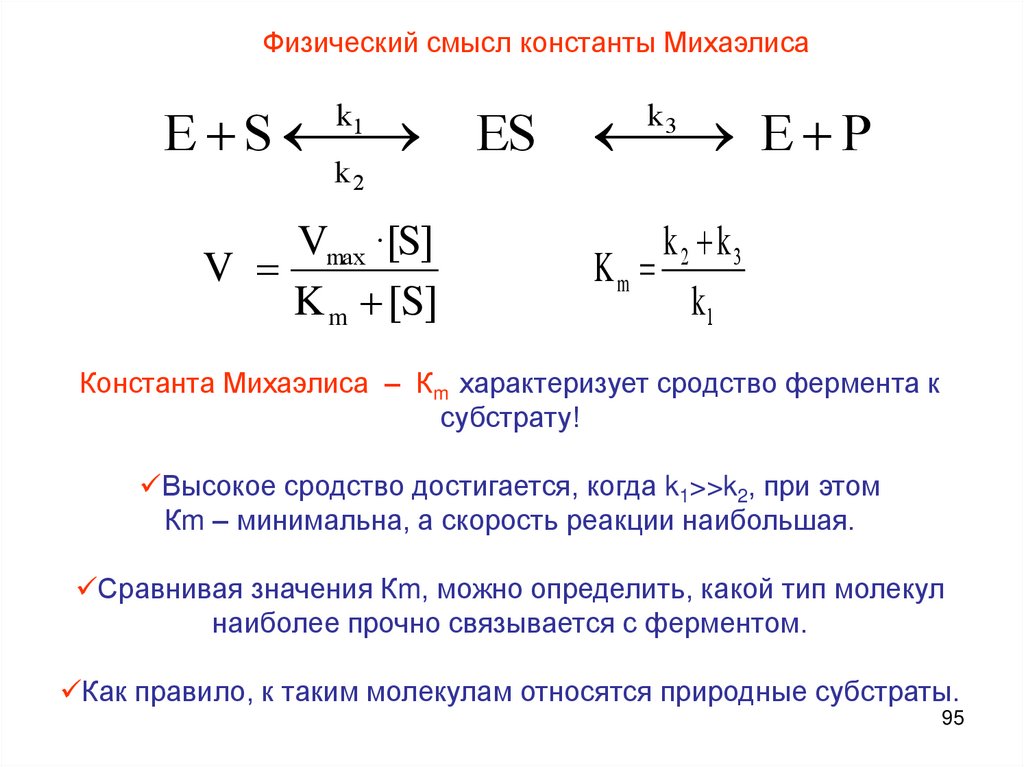
Физический смысл константы МихаэлисаE S
k1
k2
Vmax ·[S]
V
K m [S]
ES
E P
k3
k2 k3
Km
k1
Константа Михаэлиса – Кm характеризует сродство фермента к
субстрату!
Высокое сродство достигается, когда k1>>k2, при этом
Кm – минимальна, а скорость реакции наибольшая.
Сравнивая значения Кm, можно определить, какой тип молекул
наиболее прочно связывается с ферментом.
Как правило, к таким молекулам относятся природные субстраты.
95
96.
Значение ферментативных реакцийПрименение ферментов в качестве
лекарственных препаратов;
Разработка методов диагностики с
помощью ферментов;
Производство антибиотиков;
Синтез
оксии
гидролиз крахмала;
аминокислот,
Изготовление
кисломолочных
продуктов,
сыра,
алкогольных
напитков, обработка фруктов и
овощей;
96
97.
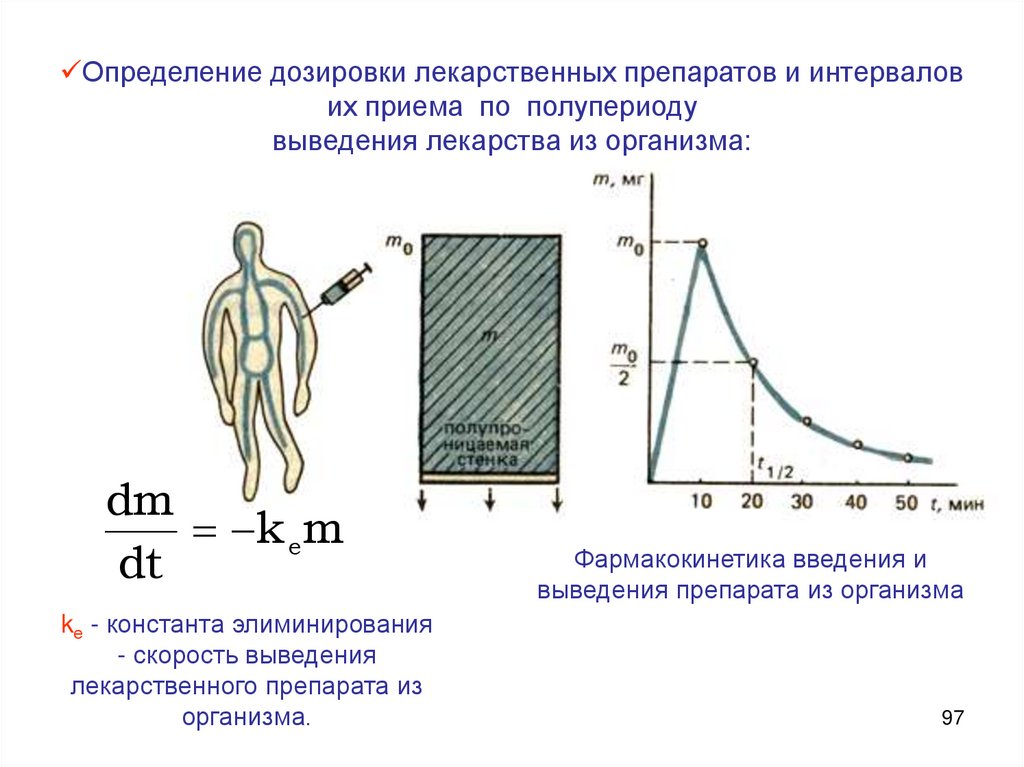
Определение дозировки лекарственных препаратов и интервалових приема по полупериоду
выведения лекарства из организма:
dm
k e m
dt
kе - константа элиминирования
- скорость выведения
лекарственного препарата из
организма.
Фармакокинетика введения и
выведения препарата из организма
97
98.
Использование иммобилизованных ферментов дляаналитических целей и в методах очистки биологических жидкостей
Низкая стабильность ферментов к денатурирующему действию
среды (Тo, рН) и значительное снижение их активности при выделении
в чистом виде привела к необходимости отделения ферментов от
продуктов реакции.
Иммобилизация – физико-химический процесс присоединения
ферментов к полимерным матрицам (производные целлюлозы,
полисахариды, полимеры акриламида, стекла силикагели, угли)
М
COOH + H2N
Ф
М
CONH
Ф
98
99.
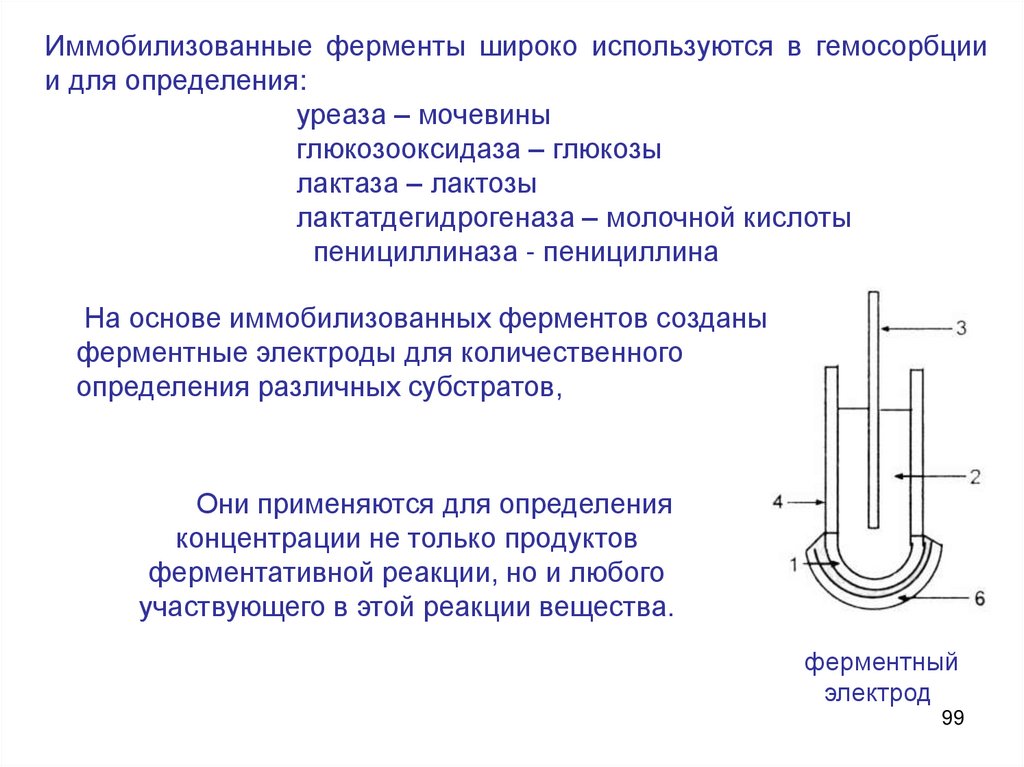
Иммобилизованные ферменты широко используются в гемосорбциии для определения:
уреаза – мочевины
глюкозооксидаза – глюкозы
лактаза – лактозы
лактатдегидрогеназа – молочной кислоты
пенициллиназа - пенициллина
На основе иммобилизованных ферментов созданы
ферментные электроды для количественного
определения различных субстратов,
Они применяются для определения
концентрации не только продуктов
ферментативной реакции, но и любого
участвующего в этой реакции вещества.
ферментный
электрод
99
100.
Химическое равновесиеУсловия химического равновесия
Смещение химического равновесия;
принцип Ле Шателье
Концентрация
давление
температура
100
101.
Вывод константы химического равновесияaA bB dD fF
В состоянии химического равновесия:
v v
a b d f
k[A] [B] k[D] [F]
ГУЛЬДБЕРГ
Като Максимилиан
(2.08.1836-14.1.1902)
d
f
k [D] [F]
K равн
a
b
k [A ] [B]
101
102.
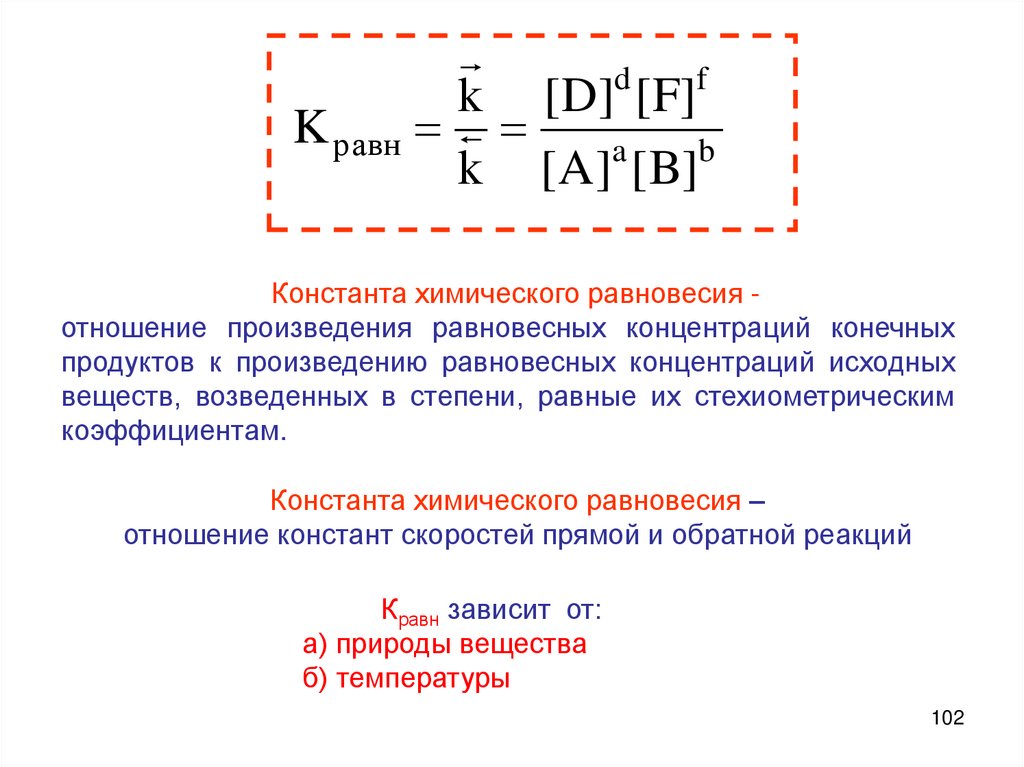
df
k [D] [F]
K равн
a
b
k [A ] [B]
Константа химического равновесия отношение произведения равновесных концентраций конечных
продуктов к произведению равновесных концентраций исходных
веществ, возведенных в степени, равные их стехиометрическим
коэффициентам.
Константа химического равновесия –
отношение констант скоростей прямой и обратной реакций
Кравн зависит от:
а) природы вещества
б) температуры
102
103.
Смещение химического равновесия.(Принцип Ле Шателье)
Занимался исследованием процессов
воспламенения,
горения,
взрывов
и
детонации.
Нашел
условия
синтеза
аммиака (1901), рудничного газа.
В 1884 году сформулировал общий закон
смещения химического равновесия.
Анри Ле-Шателье
(8.10.1850 – 17.09.1936)
Принцип Ле Шателье
Если на систему, находящуюся
в состоянии равновесия
оказывается внешнее воздействие, равновесие смещается в таком
направлении, чтобы свести к минимуму влияние этого воздействия.
103
104.
Студенты Сорбонны, слушавшие лекции Ле-Шателье в 19071908 годах, так записывали в своих конспектах: "Изменениелюбого фактора, могущего влиять на состояние
химического равновесия системы веществ, вызывает в ней
реакцию, стремящуюся противодействовать производимому
изменению. Повышение температуры вызывает реакцию,
стремящуюся понизить температуру, то есть идущую с
поглощением тепла. Увеличение давления вызывает
реакцию, стремящуюся вызвать уменьшение давления, то
есть сопровождающуюся уменьшением объема...".
Будущий открыватель знаменитого принципа был широко
образованным и эрудированным человеком. Много
времени он посвятил изучению религии и древних языков.
В возрасте 27 лет Ле-Шателье стал профессором.
К сожалению, Ле-Шателье не был удостоен Нобелевской премии. Причина
заключалась в том, что первоначально премия присуждалась только авторам
работ, выполненных или получивших признание в год получения премии.
Важнейшие работы Ле Шателье были выполнены задолго до 1901 года, когда
104
состоялось первое присуждение Нобелевских премий.
105.
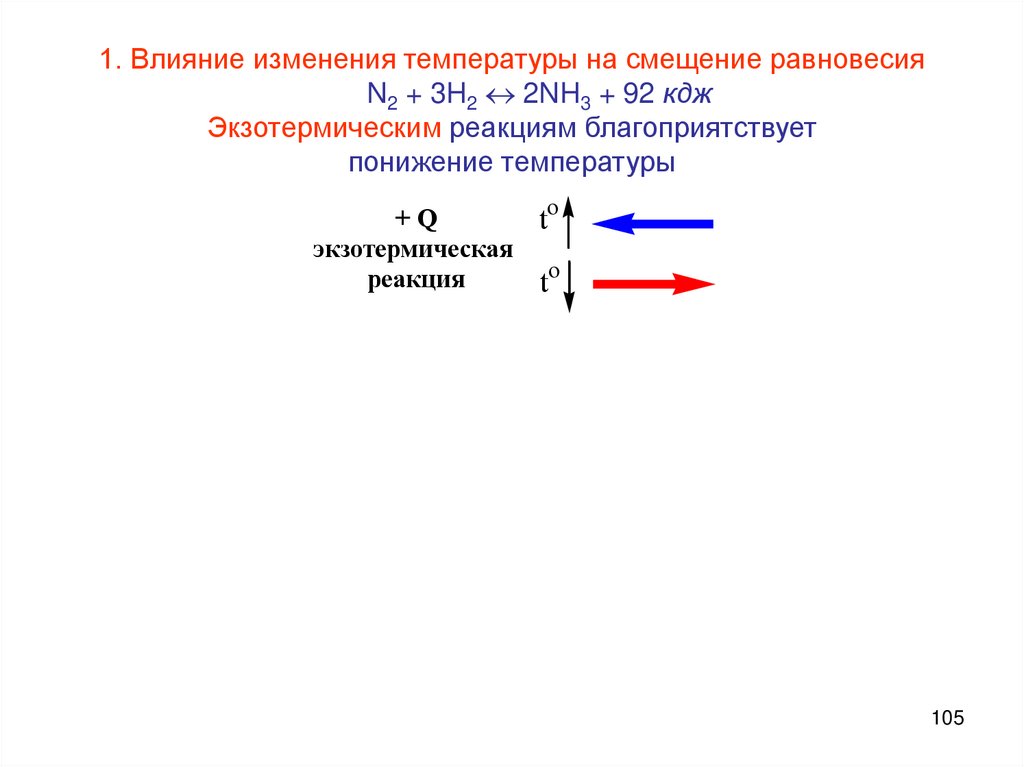
1. Влияние изменения температуры на смещение равновесияN2 + 3H2 2NH3 + 92 кдж
Экзотермическим реакциям благоприятствует
понижение температуры
+Q
экзотермическая
реакция
to
to
105
106.
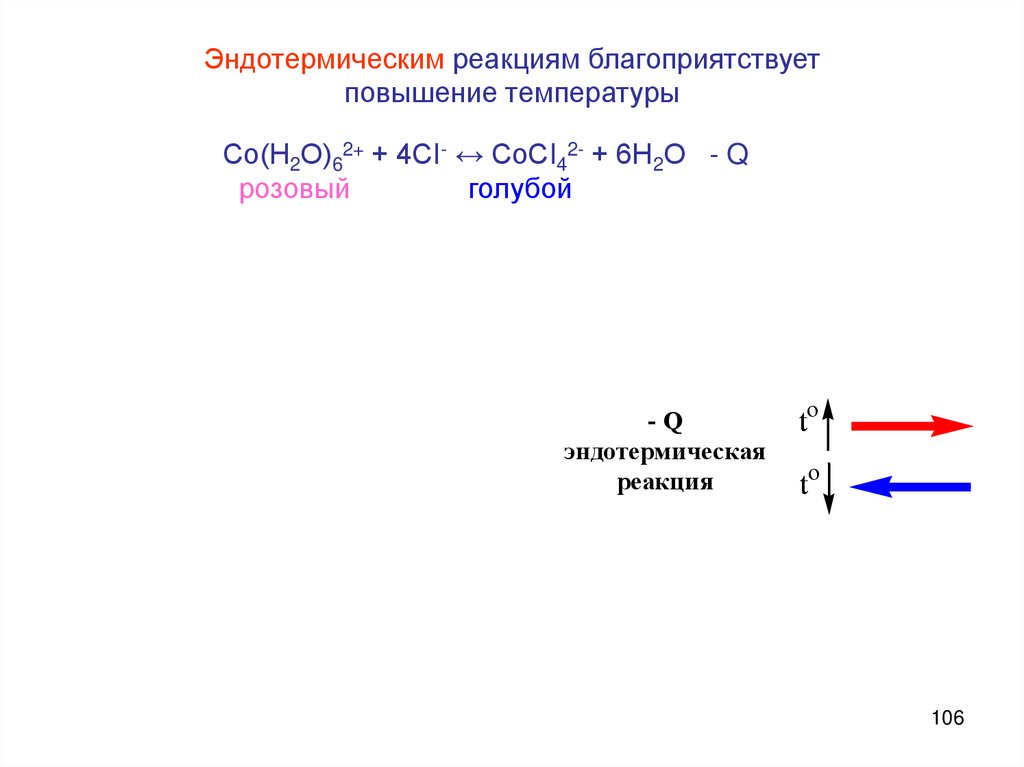
Эндотермическим реакциям благоприятствуетповышение температуры
Со(Н2О)62+ + 4СI- ↔ СоСI42- + 6Н2О - Q
розовый
голубой
-Q
эндотермическая
реакция
to
to
106
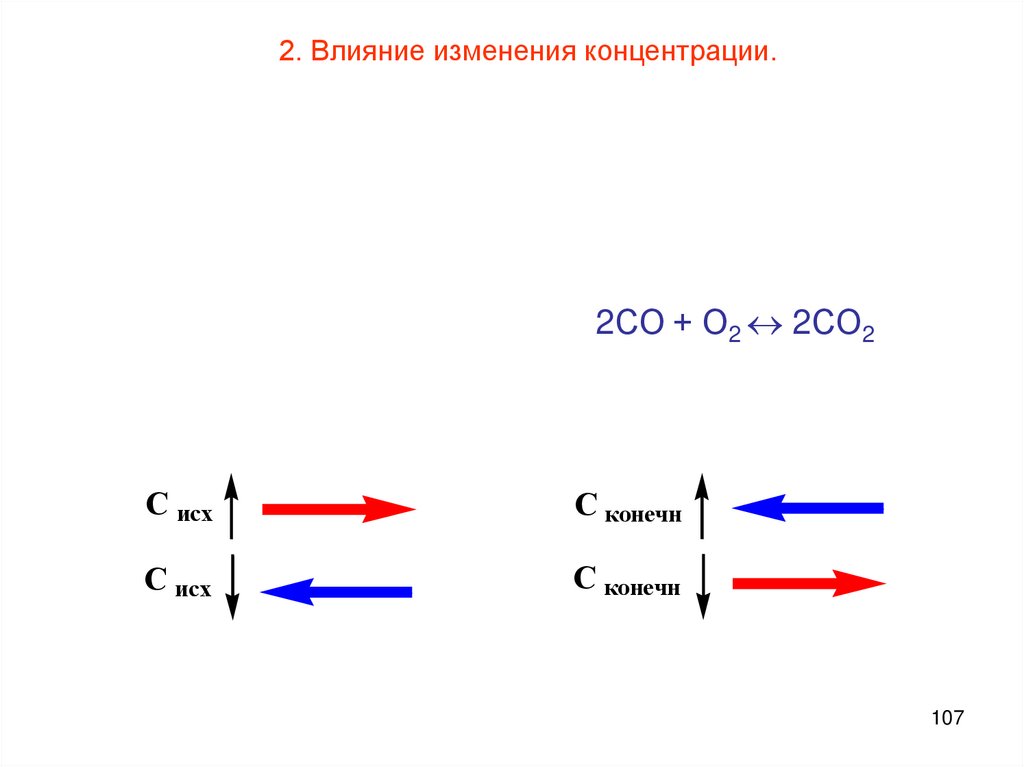
107.
2. Влияние изменения концентрации.2СО + О2 2СО2
C исх
C конечн
C исх
C конечн
107
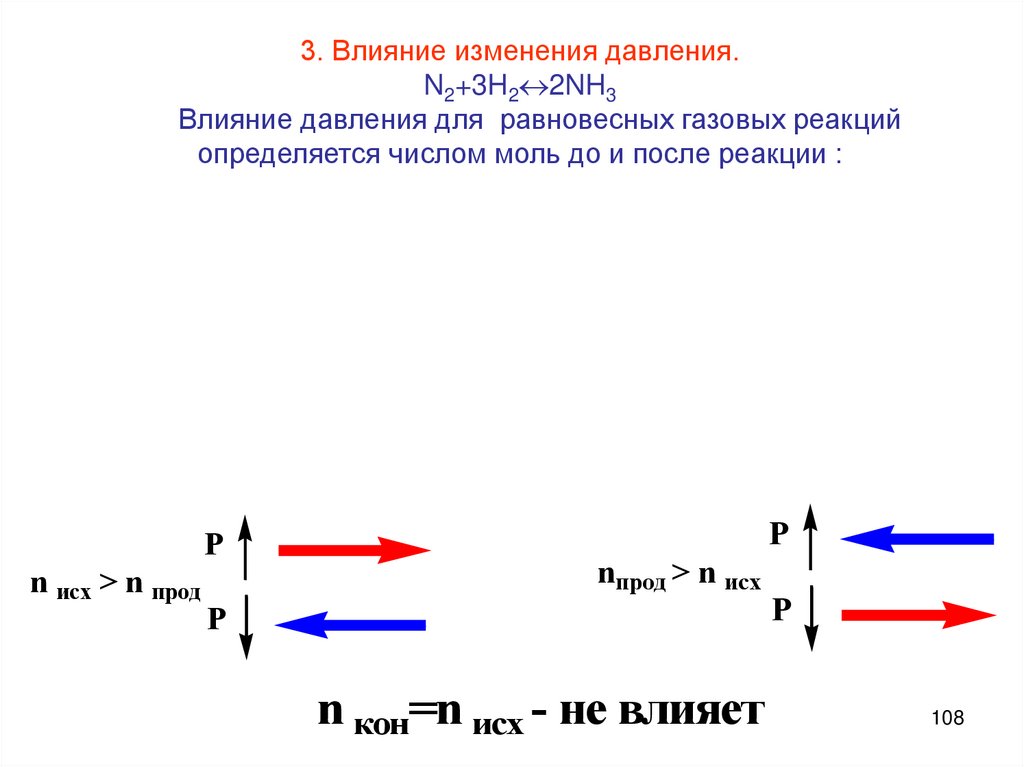
108.
3. Влияние изменения давления.N2+3H2 2NH3
Влияние давления для равновесных газовых реакций
определяется числом моль до и после реакции :
P
n исх > n прод
P
nпрод > n исх
P
n кон=n исх - не влияет
P
108
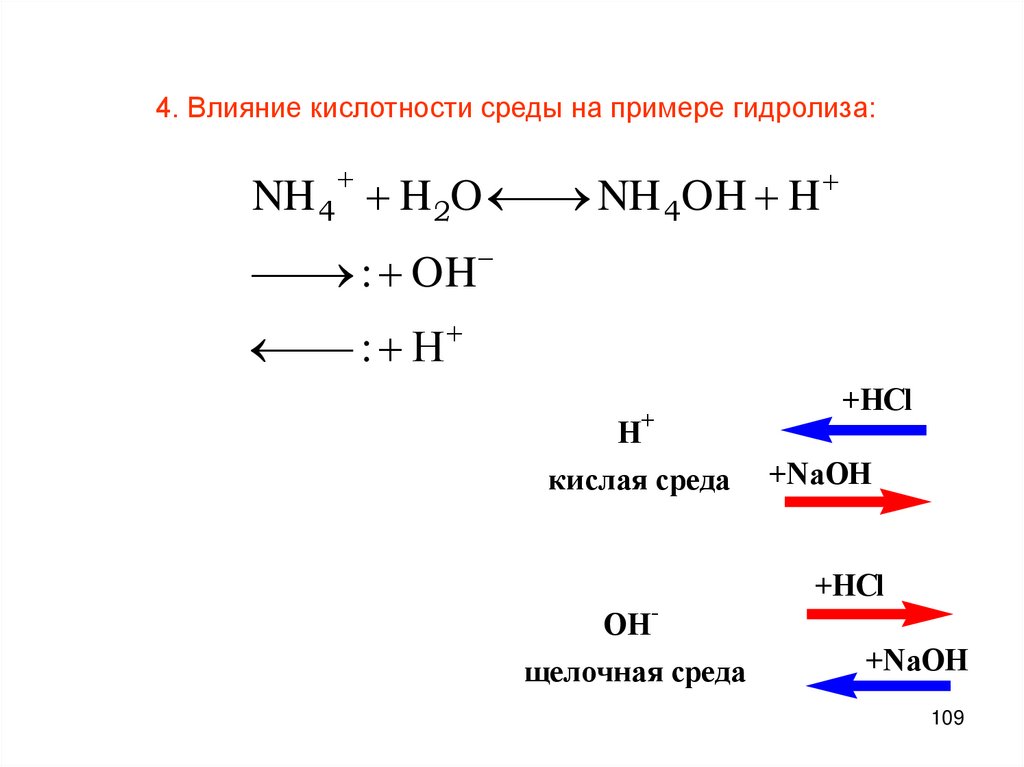
109.
4. Влияние кислотности среды на примере гидролиза:NH 4 H 2O
NH 4OH H
: OH
: H
H
+
кислая среда
OHщелочная среда
+HCl
+NaOH
+HCl
+NaOH
109






































































 Химия
Химия








