Похожие презентации:
Лекция 7-8 Буферные растворы. ПР
1.
Кафедра медицинской ифармацевтической химии
Лекция
«Буферные растворы»
1
2.
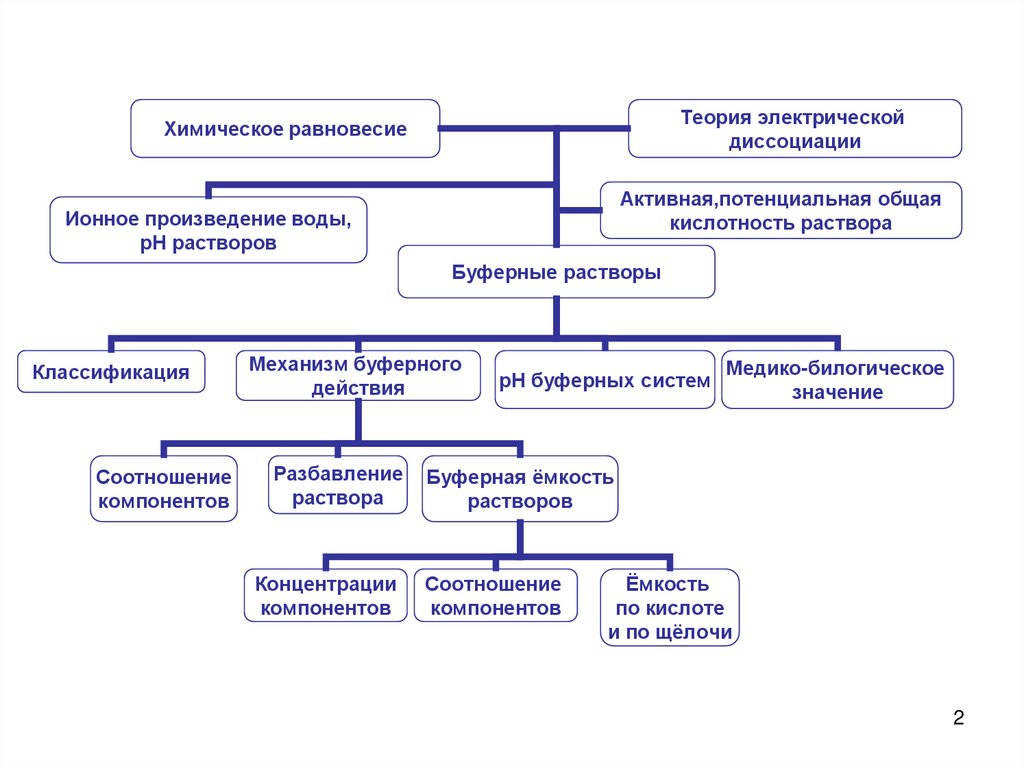
Теория электрическойдиссоциации
Химическое равновесие
Активная,потенциальная общая
кислотность раствора
Ионное произведение воды,
рН растворов
Буферные растворы
Классификация
Соотношение
компонентов
Механизм буферного
действия
Разбавление
раствора
Концентрации
компонентов
рН буферных систем
Медико-билогическое
значение
Буферная ёмкость
растворов
Соотношение
компонентов
Ёмкость
по кислоте
и по щёлочи
2
3.
Теории кислот и оснований3
4.
1. По Аррениусу:Кислоты
электролиты,
диссоциирующие
в
растворах
с
образованием ионов Н+;
Основания
электролиты,
диссоциирующие
в
растворах
с
образованием гидроксид-ионов ОН-;
Амфолиты
(амфотерные
Сванте Аррениус
гидроксиды)
электролиты,
(19.02.1859 - 02.10.1927)
диссоциирующие
в
растворах
с
образованием как водород-ионов Н+,
Нобелевская премия по
химии «как факт признания так и гидроксид-ионов ОН
особого значения его
теории электролитической
диссоциации для развития
химии».
4
5.
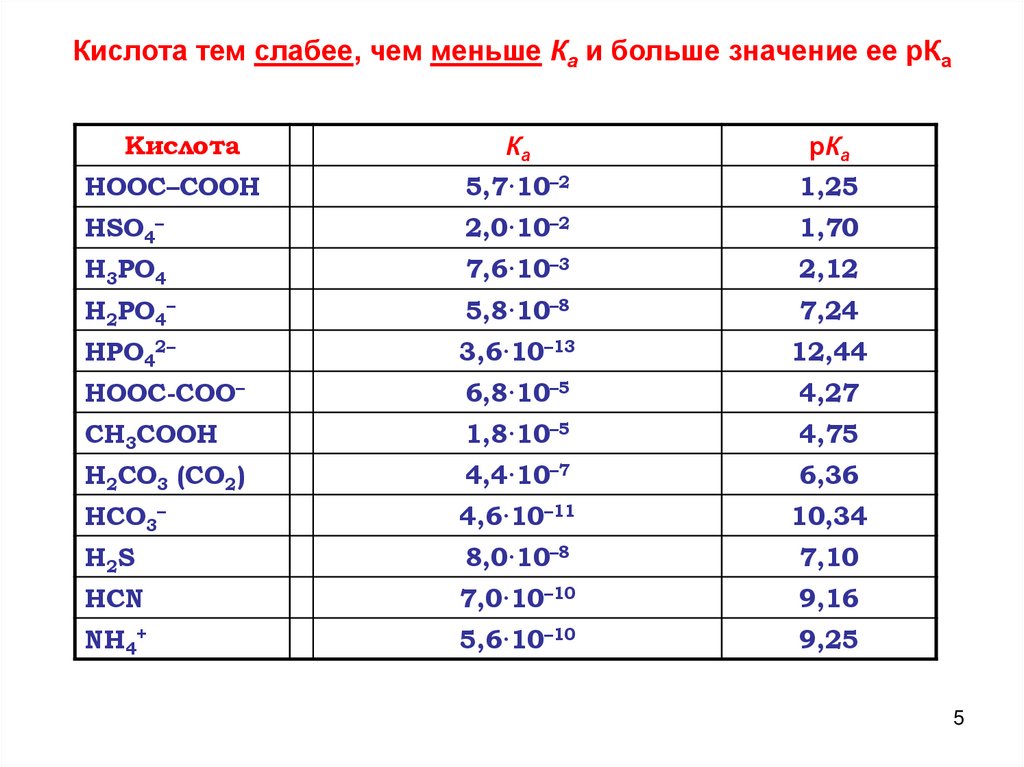
Кислота тем слабее, чем меньше Ка и больше значение ее рКаКислота
Ка
рКа
НООС–СООН
5,7·10–2
1,25
HSO4–
2,0·10–2
1,70
Н3РО4
7,6·10–3
2,12
Н2РО4–
5,8·10–8
7,24
HPO42–
3,6·10–13
12,44
HOOC-COO–
6,8·10–5
4,27
СН3СООН
1,8·10–5
4,75
Н2СО3 (СО2)
4,4·10–7
6,36
HCO3–
4,6·10–11
10,34
H2S
8,0·10–8
7,10
HCN
7,0·10–10
9,16
NH4+
5,6·10–10
9,25
5
6.
НедостаткиМногие электролиты, содержащие водород, в одном
растворителе диссоциируют как кислоты, в других – как основания.
в воде – слабая кислота:
CН3СООН
CH3COOH ↔ CH3COO- + H+
в жидком HF – основание:
HF + CH3COOH ↔ CH3COOH2+ + FИсследования подобного типа реакций и в особенности
реакций, протекающих в неводных растворителях, привело к
созданию более общих теорий кислот и оснований.
6
7.
2. По Брёнстеду и Лоури:Кислота (донор
протонов)
- вещество,
молекулярные частицы
или ионы которого,
способны
отдавать протоны
БРЁНСТЕД Йоханнес
ЛОУРИ Томас Мартин
(22.11.1879 – 17.12.1947) (26.10.1874 – 02.11.1936)
Основание (акцептор
протонов)
- вещество,
молекулярные частицы
или ионы которого,
способны присоединять
протоны
7
8.
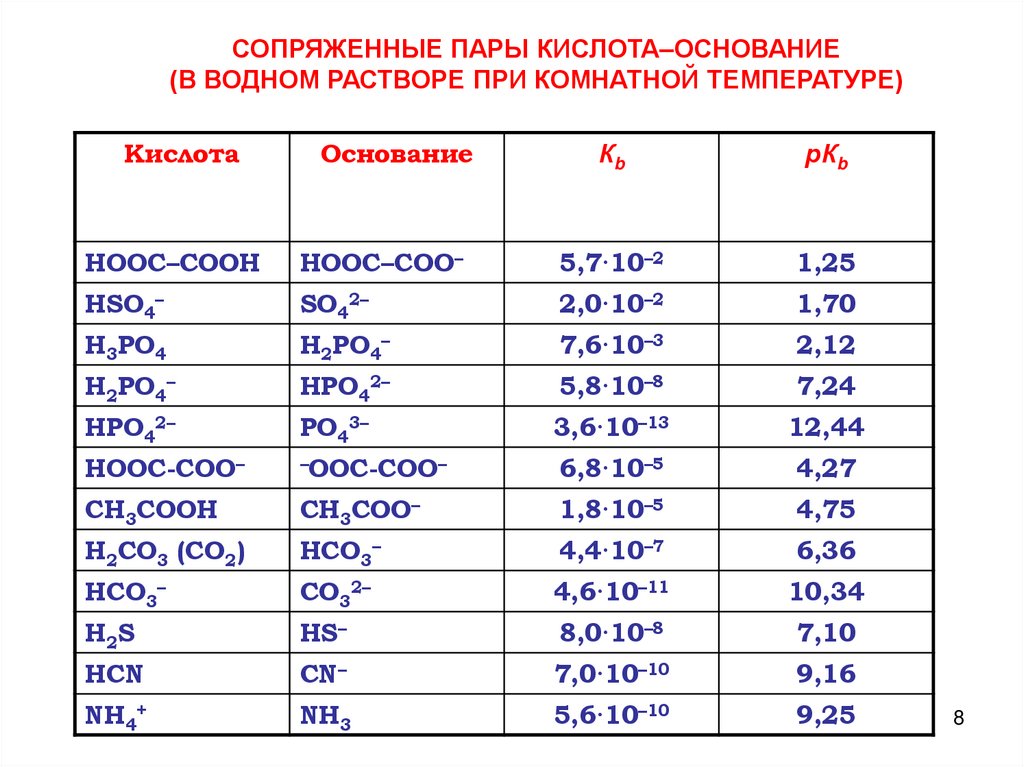
СОПРЯЖЕННЫЕ ПАРЫ КИСЛОТА–ОСНОВАНИЕ(В ВОДНОМ РАСТВОРЕ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ)
Кислота
Основание
Кb
рКb
НООС–СООН
НООС–СОО–
5,7·10–2
1,25
HSO4–
SO42–
2,0·10–2
1,70
Н3РО4
H2PO4–
7,6·10–3
2,12
Н2РО4–
НРO42–
5,8·10–8
7,24
HPO42–
PO43–
3,6·10–13
12,44
HOOC-COO–
–OOC-COO–
6,8·10–5
4,27
СН3СООН
СН3СОО–
1,8·10–5
4,75
Н2СО3 (СО2)
НСО3–
4,4·10–7
6,36
HCO3–
CO32–
4,6·10–11
10,34
H2S
HS–
8,0·10–8
7,10
HCN
CN–
7,0·10–10
9,16
NH4+
NH3
5,6·10–10
9,25
8
9.
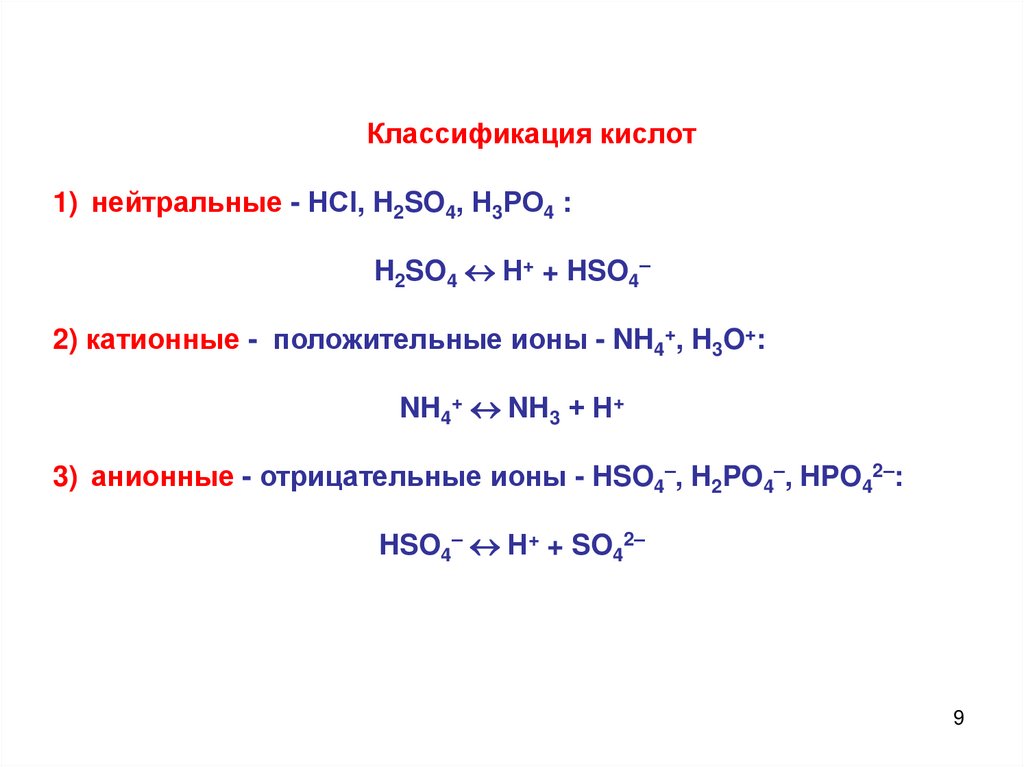
Классификация кислот1) нейтральные - НСl, H2SO4, Н3РО4 :
H2SO4 Н+ + HSO4–
2) катионные - положительные ионы - NH4+, H3O+:
NH4+ NH3 + Н+
3) анионные - отрицательные ионы - HSO4–, H2PO4–, HPO42–:
HSO4– Н+ + SO42–
9
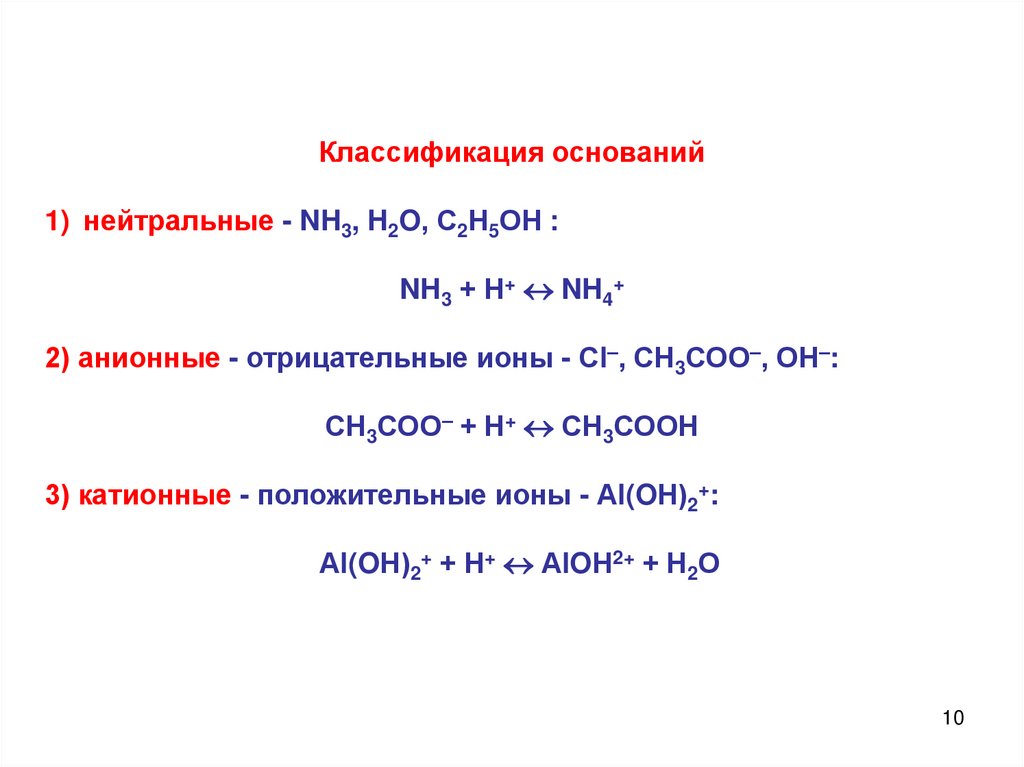
10.
Классификация оснований1) нейтральные - NH3, H2O, С2Н5ОН :
NH3 + Н+ NH4+
2) анионные - отрицательные ионы - Сl–, СН3СОО–, ОН–:
СН3СОО– + Н+ СН3СООН
3) катионные - положительные ионы - Аl(OН)2+:
Аl(OН)2+ + Н+ АlOН2+ + Н2О
10
11.
Вода, жидкий аммиак и анионы многоосновных кислот,которые могут быть и донорами и акцепторами протонов,
являются амфолитами.
Кислота1
Основание
Кислота2
Основание
2
1
1. H3O+
+
OH–
H2O
+
H2O
2 H2O
+
HCl
H3O+
+
Cl–
3. H2O
+
NH3
NH4+
+
OH–
4. H2O
+
CO32–
HCO3–
+
OH–
5. H2O
+
HCO3–
H2CO3
+
OH–
Во второй реакции вода выступает в качестве основания,
в третьей – в качестве кислоты.
11
12.
3. По ЛьюисуКислота - вещество, принимающее
электронные
пары
–
акцептор
электронов;
Основание
вещество,
поставляющее
электроны
для
образования химической связи – донор
электронов.
ЛЬЮИС Гилберт Ньютон
(23.10 1875–23.03 1946)
Во время первой мировой
войны – полковник Военнохимической службы США
(разрабатывал
способы
защиты
от
отравляющих
газов).
12
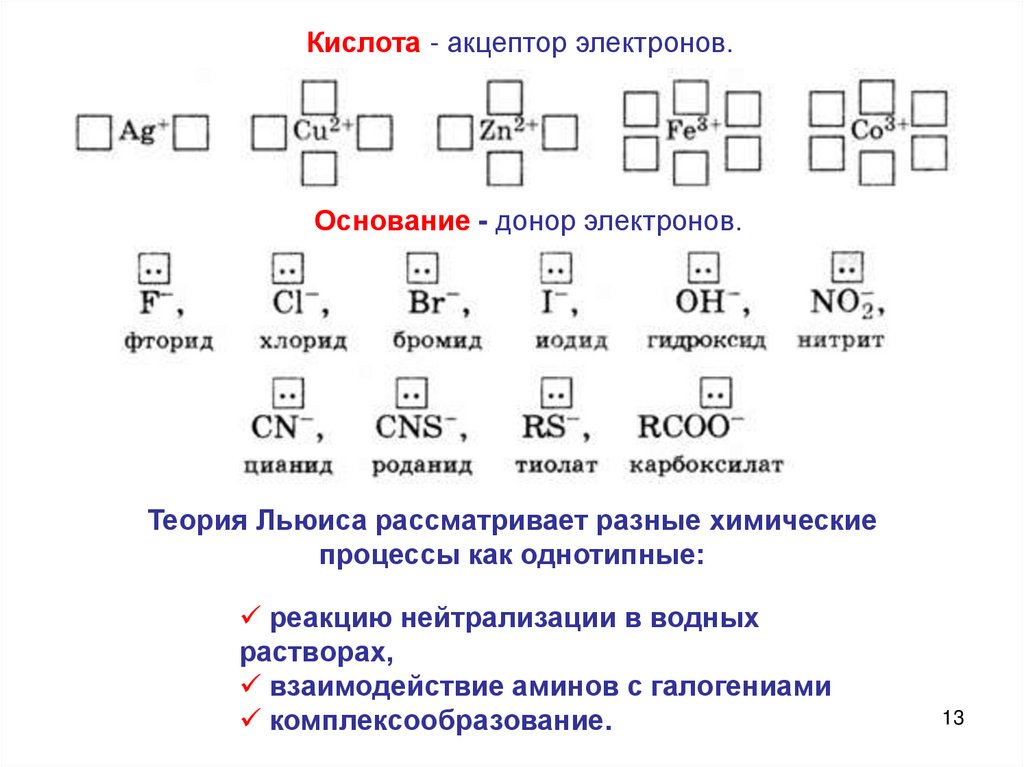
13.
Кислота - акцептор электронов.Основание - донор электронов.
Теория Льюиса рассматривает разные химические
процессы как однотипные:
реакцию нейтрализации в водных
растворах,
взаимодействие аминов с галогениами
комплексообразование.
13
14.
Значение постоянства кислотности жидких среддля жизнедеятельности человеческого организма :
Ионы водорода оказывают каталитическое действие на многие
биохимические превращения;
Ферменты и гормоны проявляют биологическую активность
только в строго определенном интервале значений рН;
Минимальные изменения концентрации ионов водорода в
крови и межтканевых жидкостях ощутимо влияют на величину
осмотического давления;
Необходимость в приготовлении буферных растворов
введения в организм, и моделирования биопроцессов.
для
14
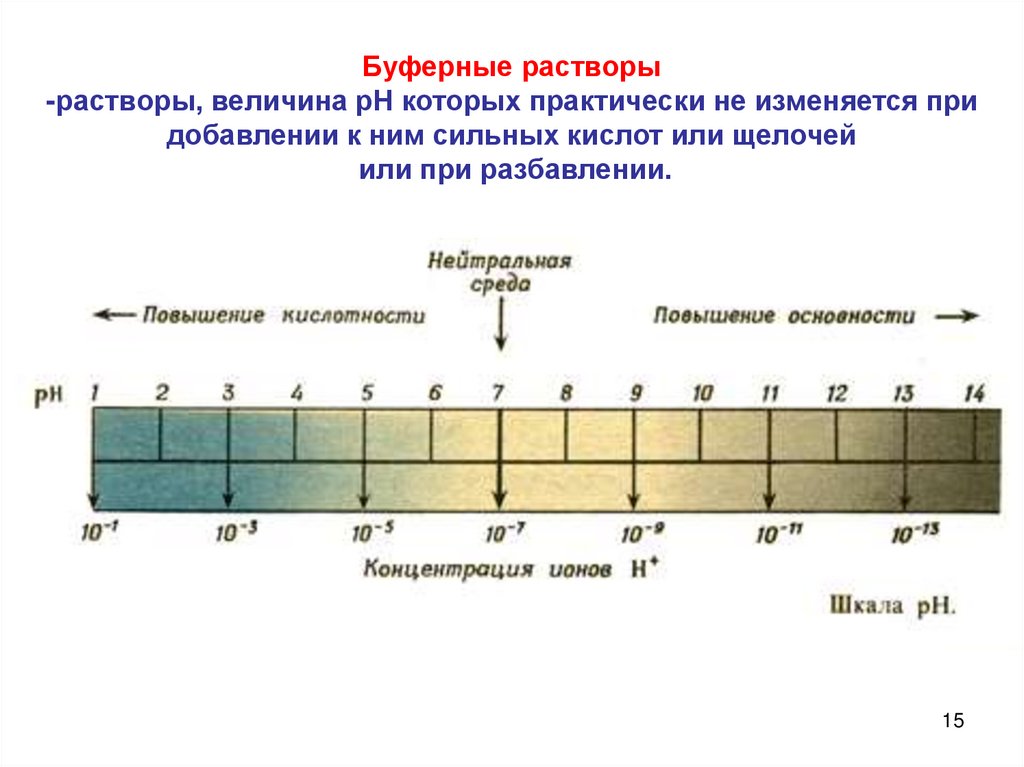
15.
Буферные растворы-растворы, величина рН которых практически не изменяется при
добавлении к ним сильных кислот или щелочей
или при разбавлении.
15
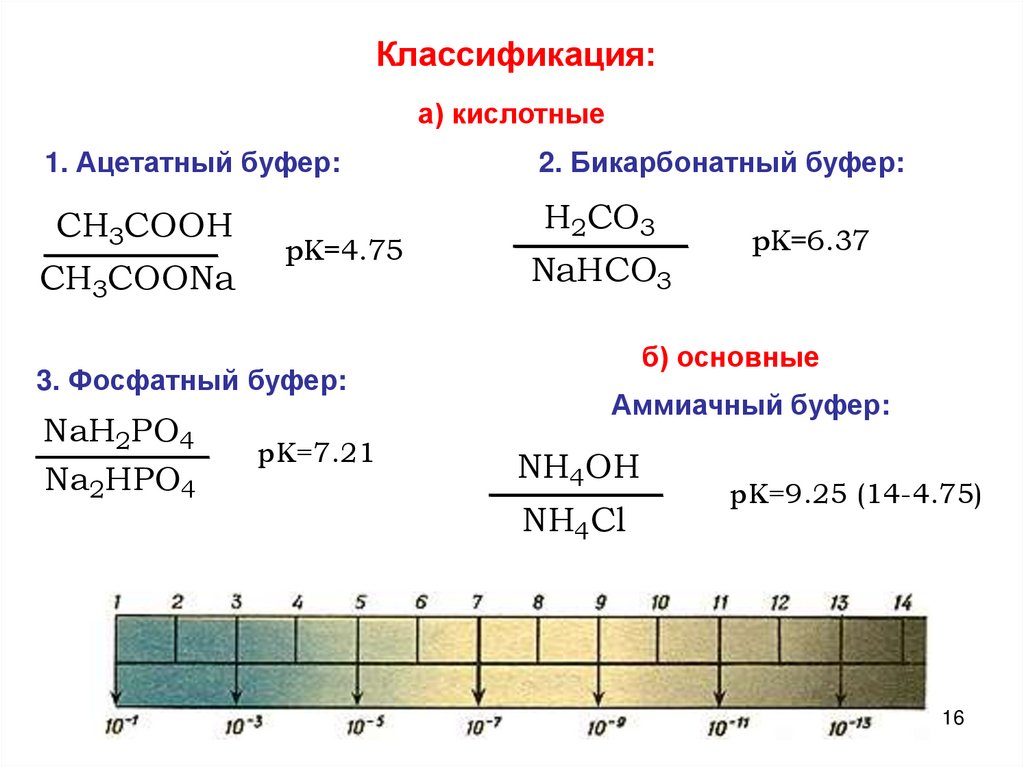
16.
Классификация:а) кислотные
1. Ацетатный буфер:
2. Бикарбонатный буфер:
CH3COOH
H2CO3
CH3COONa
pK=4.75
3. Фосфатный буфер:
NaH2PO4
Na2HPO4
pK=7.21
NaHCO3
pK=6.37
б) основные
Аммиачный буфер:
NH4OH
NH4Cl
pK=9.25 (14-4.75)
16
17.
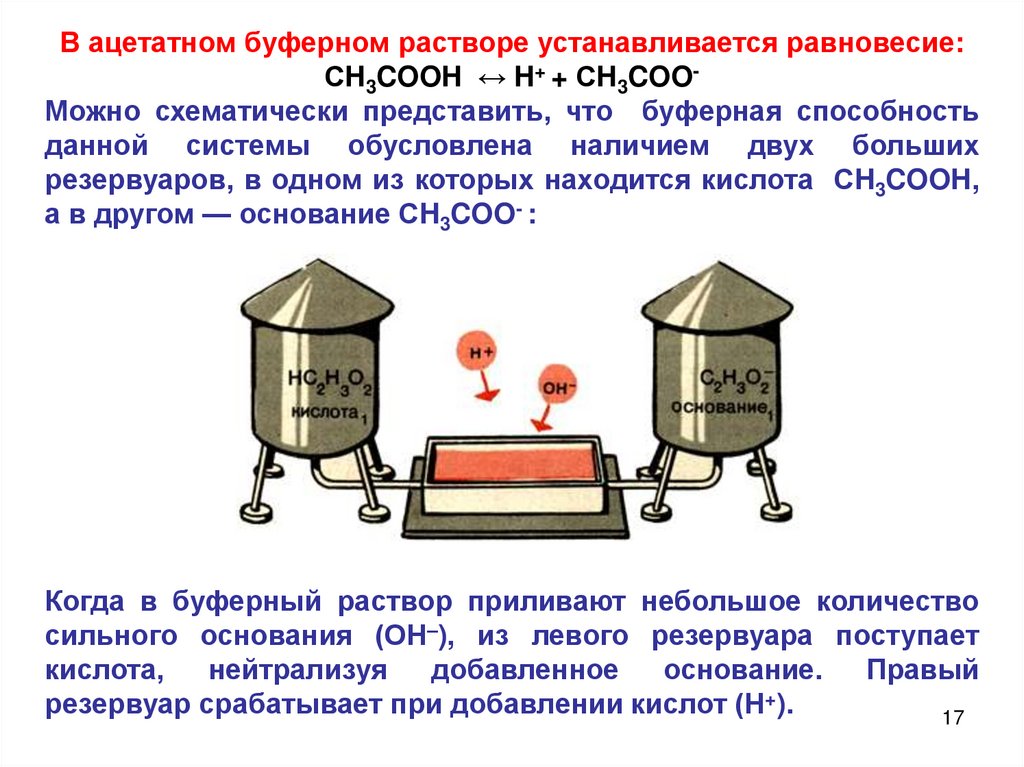
В ацетатном буферном растворе устанавливается равновесие:СH3COOH ↔ H+ + СH3COOМожно схематически представить, что буферная способность
данной системы обусловлена наличием двух больших
резервуаров, в одном из которых находится кислота СH3COOH,
а в другом — основание СH3COO- :
Когда в буферный раствор приливают небольшое количество
сильного основания (ОН–), из левого резервуара поступает
кислота,
нейтрализуя
добавленное
основание.
Правый
резервуар срабатывает при добавлении кислот (Н+).
17
18.
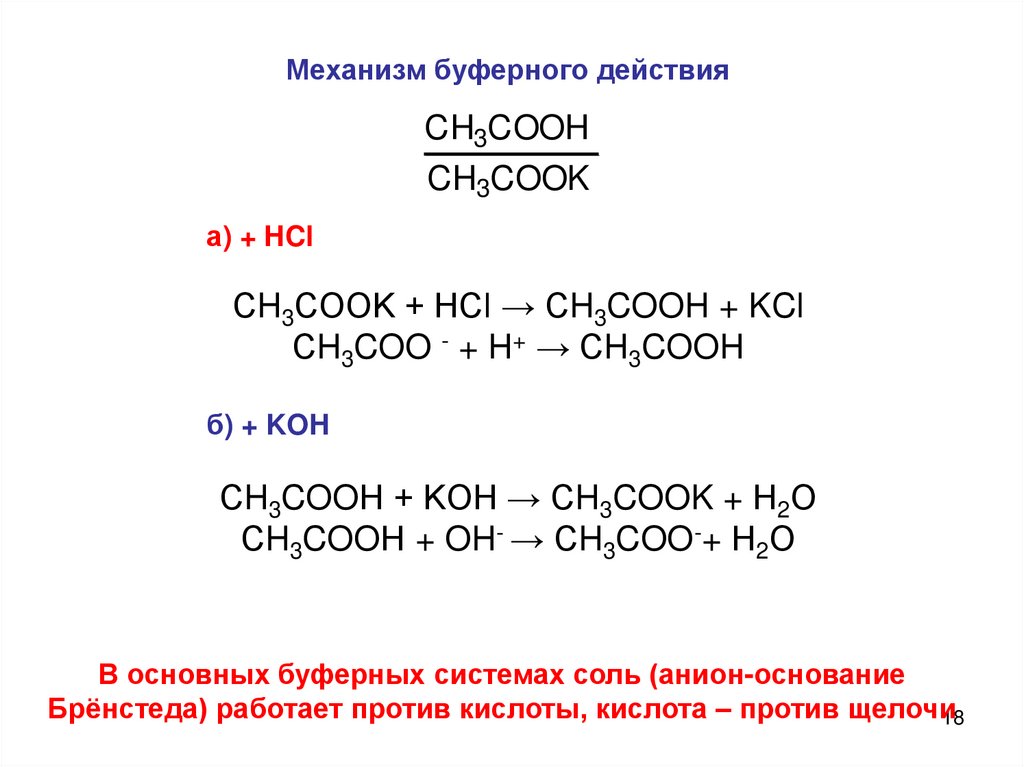
Механизм буферного действияCH3COOH
CH3COOK
а) + HCl
СH3COOK + HCl → СH3COOH + KCl
СH3COO - + H+ → СH3COOH
б) + KOH
СH3COOН + KOH → СH3COOK + Н2О
СH3COOН + OH- → СH3COO-+ Н2О
В основных буферных системах соль (анион-основание
Брёнстеда) работает против кислоты, кислота – против щелочи
18
19.
Добавим 1 каплю (0,05 мл) 1н НСl к 1л воды(безбуферный раствор, рН=7)
и рассчитаем изменение рН:
1000 мл – 1 моль H+
0,05 мл - х
1 капля
V 0.05 мл
х = 0,05/1000 = 5·10-5 моль
рН = - lg 5·10-5 = 4,6
Изменение рН составит 7- 4.6 = 2.4 единицы
За сутки организм человека
вырабатывает ~ 30 л 1 н НСl
(600000 капель!), а изменение рН на 0.6
единиц приводит к летальному исходу!
Вывод!
Буферные системы крови обладают колоссальной буферной
емкостью!
19
20.
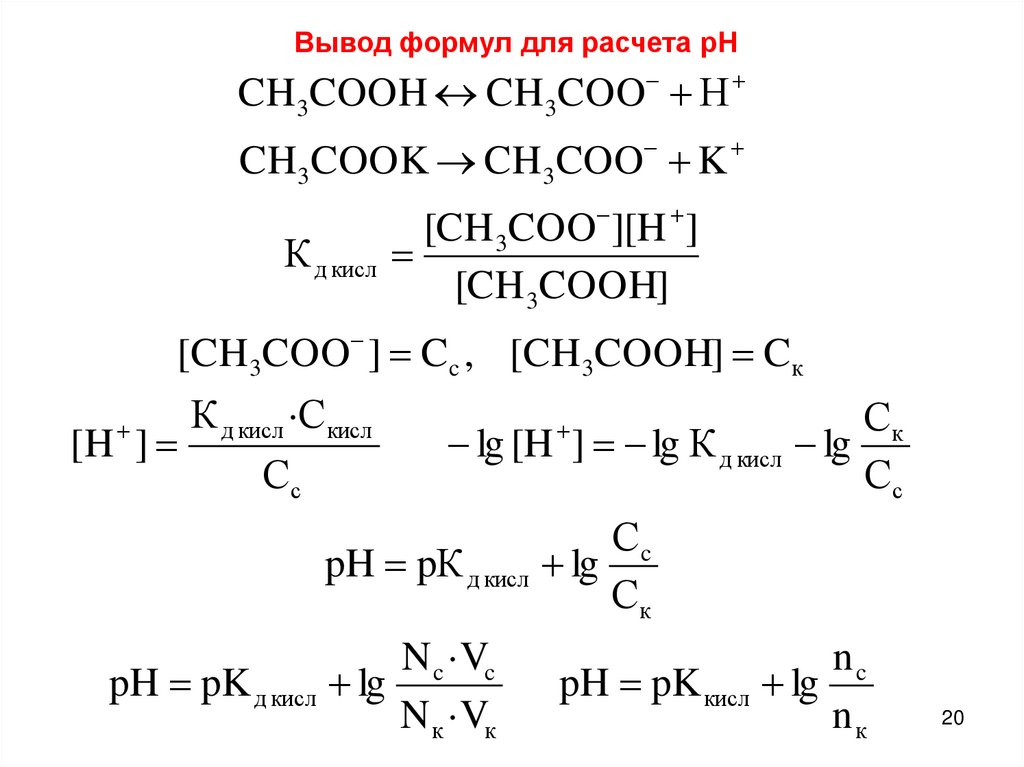
Вывод формул для расчета рНCH 3COOH CH3COO Н
CH3COOK CH3COO K
[CH 3COO ][H ]
К д кисл
[CH 3COOH]
[CH3COO ] C c , [CH3COOH] C к
К д кисл ·С кисл
[H ]
Сс
Ск
lg [H ] lg К д кисл lg
Сс
Сc
pH pК д кисл lg
Ск
N c ·Vc
pH pK д кисл lg
N к ·Vк
nc
pH pK кисл lg
nк
20
21.
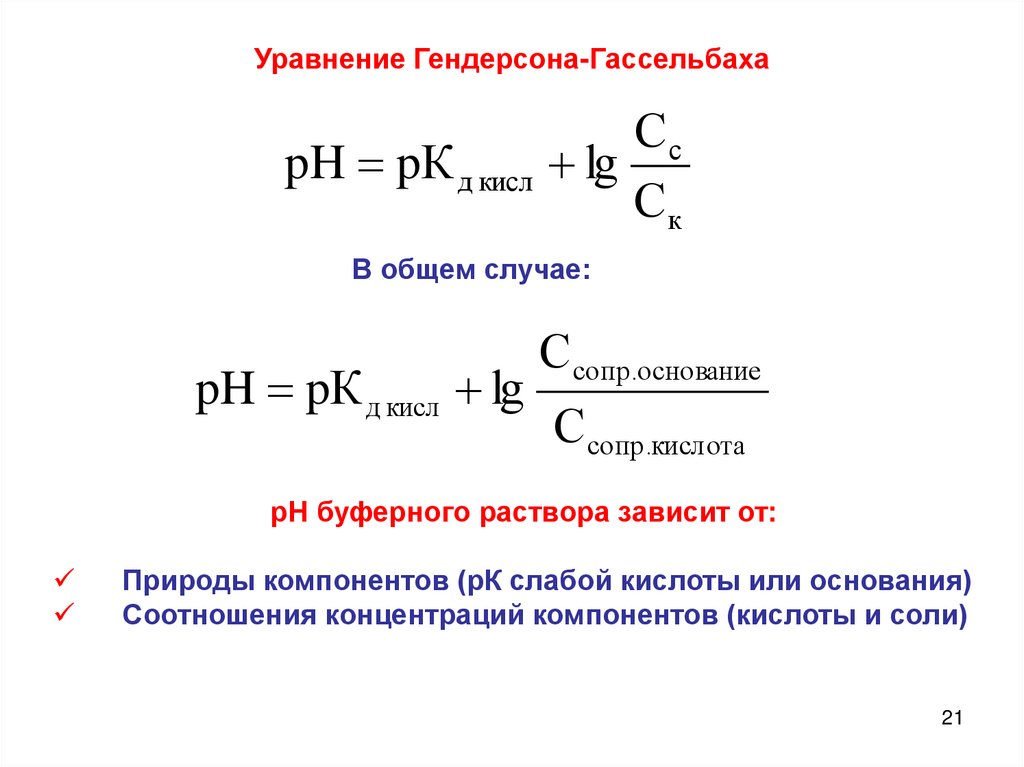
Уравнение Гендерсона-ГассельбахаСc
pH pК д кисл lg
Ск
В общем случае:
pH pК д кисл lg
Сcопр.основание
Ссопр.кислота
рН буферного раствора зависит от:
Природы компонентов (рК слабой кислоты или основания)
Соотношения концентраций компонентов (кислоты и соли)
21
22.
Для основного буферного раствора:Cосн
pH 14 pKд осн lg
Сс
Уравнение нельзя применять :
если концентрации компонентов отличаются более чем в 100
раз;
если кислота (основание) слишком сильные - рКа<3 (нельзя
пренебрегать диссоциацией);
если кислота (основание) слишком слабые - рКа>11 (нельзя
пренебрегать гидролизом ).
22
23.
Понятие «идеального» буферного раствора.Соотношение компонентов 1:1
рН = рК
Одинаково хорошо противостоят как
добавлению кислоты, так и
добавлению щелочи
23
24.
Влияние разбавления на рН буферного раствора(незначительно)
ацетатный буферный раствор
Концентрация
(моль/л)
рН
0,1
0,01
0,001
4,62
4,67
4,74
24
25.
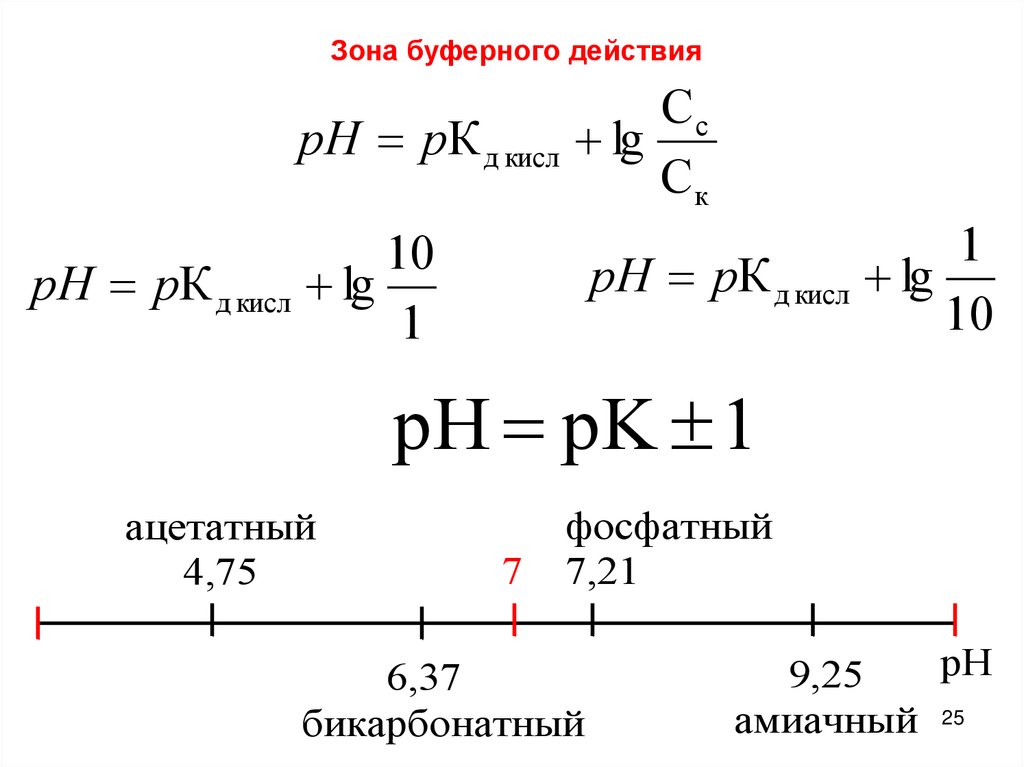
Зона буферного действияСc
pH pК д кисл lg
Ск
1
pH pК д кисл lg
10
10
pH pК д кисл lg
1
pH pK 1
ацетатный
4,75
7
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный 25
26.
Приготовление буферных растворов с заданным значением рНЗадача. Приготовить раствор с рН = 7,36.
Выбираем фосфатный буфер, поскольку
рН попадает в зону действия 6.21 – 8.21
ацетатный
4,75
7
NaH 2 PO4
Na 2 HPO4
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный
Необходимо изменить соотношение компонентов в пользу соли
(значение рН находится в более щелочной области, чем рК)
26
27.
Рассчитаем, во сколько раз концентрация соли должна быть больше:[ Na 2HPO4 ]
7,36 7,21 lg
[ NaH 2PO4 ]
[соль]
0,15 lg
[кислота]
[соль]
[ Na 2 HPO 4 ]
1,41
0.15
10
[кислота ] [ NaH 2 PO 4 ]
1
27
28.
Буферная ёмкостьВ – число моль сильной кислоты или щелочи, которое нужно
добавить к 1 л буферной системы, чтобы изменить рН на единицу
C эл ·Vэл
B
pH·Vбуф
28
29.
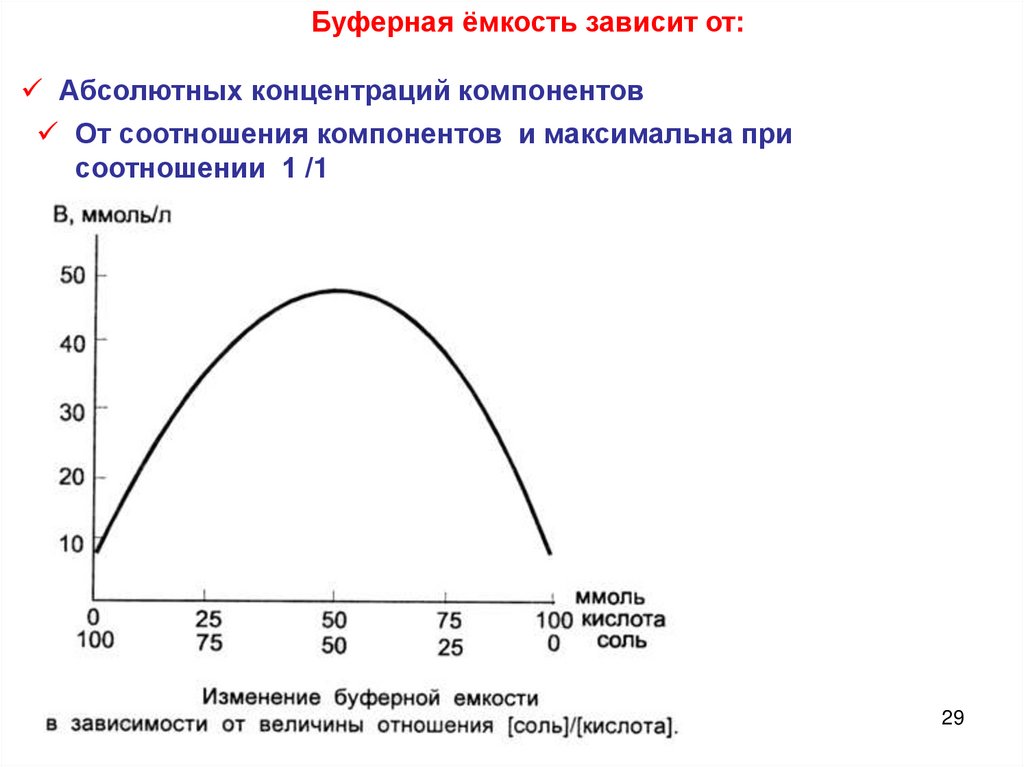
Буферная ёмкость зависит от:Абсолютных концентраций компонентов
От соотношения компонентов и максимальна при
соотношении 1 /1
29
30.
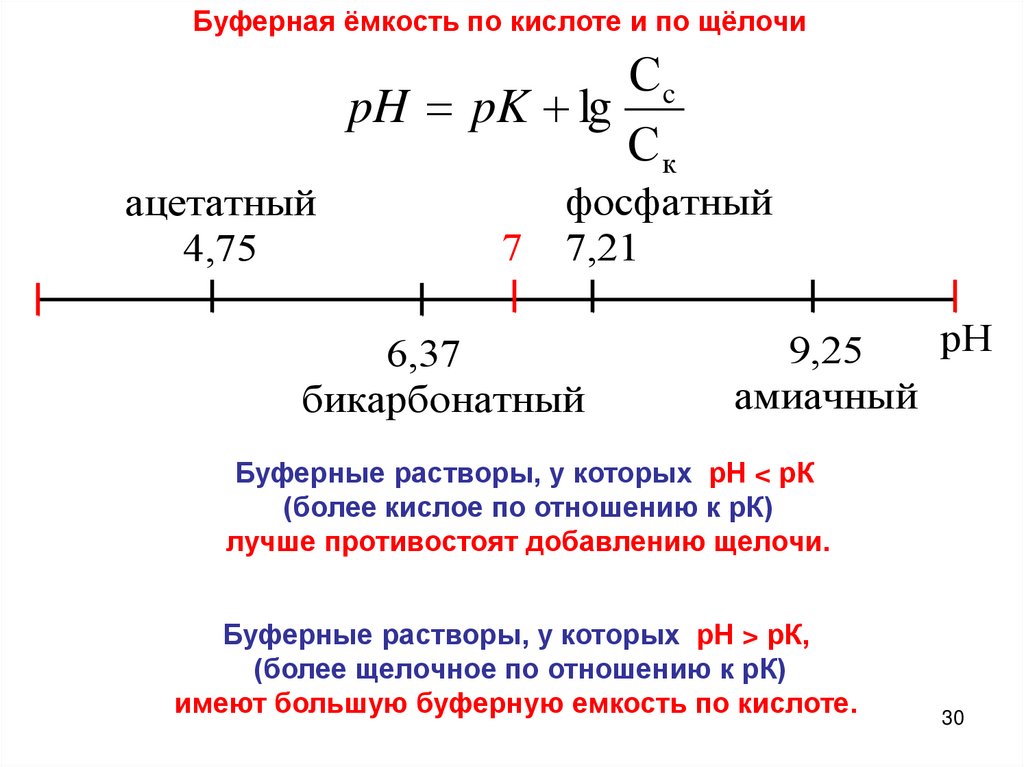
Буферная ёмкость по кислоте и по щёлочиСc
pH pK lg
Ск
ацетатный
4,75
7
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный
Буферные растворы, у которых рН < рК
(более кислое по отношению к рК)
лучше противостоят добавлению щелочи.
Буферные растворы, у которых рН > рК,
(более щелочное по отношению к рК)
имеют большую буферную емкость по кислоте.
30
31.
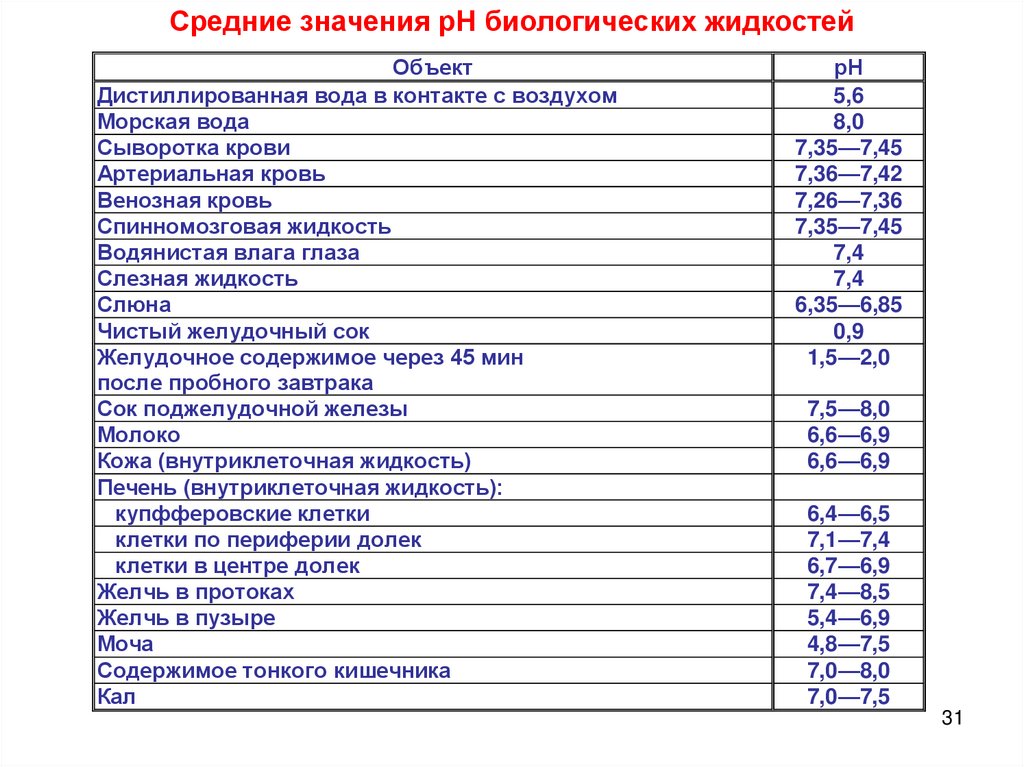
Средние значения рН биологических жидкостейОбъект
Дистиллированная вода в контакте с воздухом
Морская вода
Сыворотка крови
Артериальная кровь
Венозная кровь
Спинномозговая жидкость
Водянистая влага глаза
Слезная жидкость
Слюна
Чистый желудочный сок
Желудочное содержимое через 45 мин
после пробного завтрака
Сок поджелудочной железы
Молоко
Кожа (внутриклеточная жидкость)
Печень (внутриклеточная жидкость):
купфферовские клетки
клетки по периферии долек
клетки в центре долек
Желчь в протоках
Желчь в пузыре
Моча
Содержимое тонкого кишечника
Кал
рН
5,6
8,0
7,35—7,45
7,36—7,42
7,26—7,36
7,35—7,45
7,4
7,4
6,35—6,85
0,9
1,5—2,0
7,5—8,0
6,6—6,9
6,6—6,9
6,4—6,5
7,1—7,4
6,7—6,9
7,4—8,5
5,4—6,9
4,8—7,5
7,0—8,0
7,0—7,5
31
32.
Буферные системы кровиИз кишечника и тканей в кровь при обмене веществ постоянно
поступают различные кислоты: угольная, молочная, масляная…
и, в меньшей степени, основания: аммиак, креатин.
Благодаря наличию буферных систем, рН крови остается
постоянным
7.4 ± 0.04
В организме человека в спокойном состоянии ежесуточно
образуется количество кислоты, эквивалентное ≈ 30 л 1 н НСI !!!!
32
33.
Защитные функции по поддержанию постоянства рНвыполняют 4 буферные системы:
Бикарбонатная
Фосфатная
Белковая
Гемоглобиновая
33
34.
I. Бикарбонатная буферная система:HCO3
H 2CO3
K 4,37·10
7
pK 6,37
С учётом растворенного СО2 (37oС)
HCO3
CO2 H 2CO3
K 7,76·10 7
pK 6,11
34
35.
Уравнение Гендерсона-Гассельбаха(для расчета рН крови)
pH 6,11 lg
[HCO3 ]
pСO2
рСО2 – альвеолярное давление
(парциальное давление СО2 воздуха, находящегося
в равновесии с кровью)
35
36.
Расчёт рН крови[HCO3 ] 23,9 ммоль / л
·pCO2 0,03·40 мм рт.столба 1,2
23,9
pHкрови 6,11 lg
7,4
1,2
20
pHкрови 6,11 lg
7,4
1
Поскольку [НСО3–]:[СО2]=20:1, а HCO3- работает
против кислоты, бикарбонатная система имеет
буферную емкость по кислоте значительно больше
буферной емкости по основанию. Это отвечает
36
особенностям метаболизма организма.
37.
Механизм действия бикарбонатной буферной системыПри увеличении в крови концентрации ионов Н+ происходит
выделение СO2, который выводится из организма в процессе
дыхания через легкие:
H+ + HCO3– H2CO3 CO2 + H2O
При поступлении в кровь оснований, они связываются
угольной кислотой, и равновесие смещается в сторону
образования НСО3–:
OH– + H2CO3 HCO3– + H2O
Нарушение кислотно-основного равновесия в организме
компенсируется бикарбонатной буферной системы (за 10-15 мин).
Соотношение [НСО3–]/[Н2СО3] изменяется и приходит в норму за
счет легочной вентиляции в течение 10-18 часов.
Бикарбонатный буфер - основной буферной системой плазмы
крови и содержится также в эритроцитах, межклеточной жидкости
37
и в почечной ткани.
38.
II. Фосфатная буферная система:Фосфатная буферная система содержится как в
крови, так и в клеточной жидкости других
тканей, особенно почек и пищеварительных
желез
К2НРО4 и КН2РО4 - в клетках
Na2HPO4 и NaH2PO4- в плазме крови и межклеточной
жидкости
Фосфатная буферная система также имеет буферную
емкость по кислоте больше, чем по основанию.
Уравнение буферного действия:
2
[НРO 4 ]
рН 6,8 lg
[H 2 PO 4 ]
В норме отношение форм [НРО42–]/[H2PO4–]=4:1.
38
39.
Механизм действияПри увеличении ионов Н+ во внутриклеточной жидкости, в
результате
переработки
мясной
пищи
образующийся
избыточный дигидрофосфат выводится почками. рН мочи
уменьшается.
H+ + HPO42– H2PO4–
При употреблении растительной пищи в организме
накапливаются основания. Они нейтрализуются ионами Н2РО4-,
и образующийся дигидрофосфат выводится почками. рН мочи
повышается:
OH– + H2PO4– HPO42– + H2O
В отличие от гидрокарбонатной, фосфатная система более
«консервативна». Избыточные продукты нейтрализации
выводятся через почки и полное восстановление отношения
39
[НРО42–]/[H2PO4–] происходит только через 2-3 суток.
40.
Выведение тех или иных компонентовфосфатной буферной системы с мочой, в
зависимости от перерабатываемой пищи,
объясняет широкий интервал значений рН мочи
( 4,8 до 7,5. )
40
41.
III. Белковая буферная система:NH2-Pt-COOH
NH2 -Pt-COONa
Белки составляют 20% массы клеток и тканей,
поэтому белковая буферная система является одной из
мощных буферных систем организма.
В результате ионизации аминогрупп и карбоксильных
групп белки существуют в водных растворах в виде
биполярного иона R±:
NH2–Pt–СООН (R) NH3+–Pt–COO– (R±)
рI (ИЭТ)
– изоэлектрическая точка белка – значение рН, при
котором молекула белка, в целом, электронейтральна
41
42.
Механизм действияПри
добавлении
сильной
кислоты
протон
присоединяется к -СОO–- группе с образованием
катиона R+:
NH 3 Pt COO H NH 3 Pt COOH
При добавлении
щелочи группа NH3+ отдает
протон, и образует анион R–:
NH 3 Pt COO OH NH 2 Pt COO H 2O
42
43.
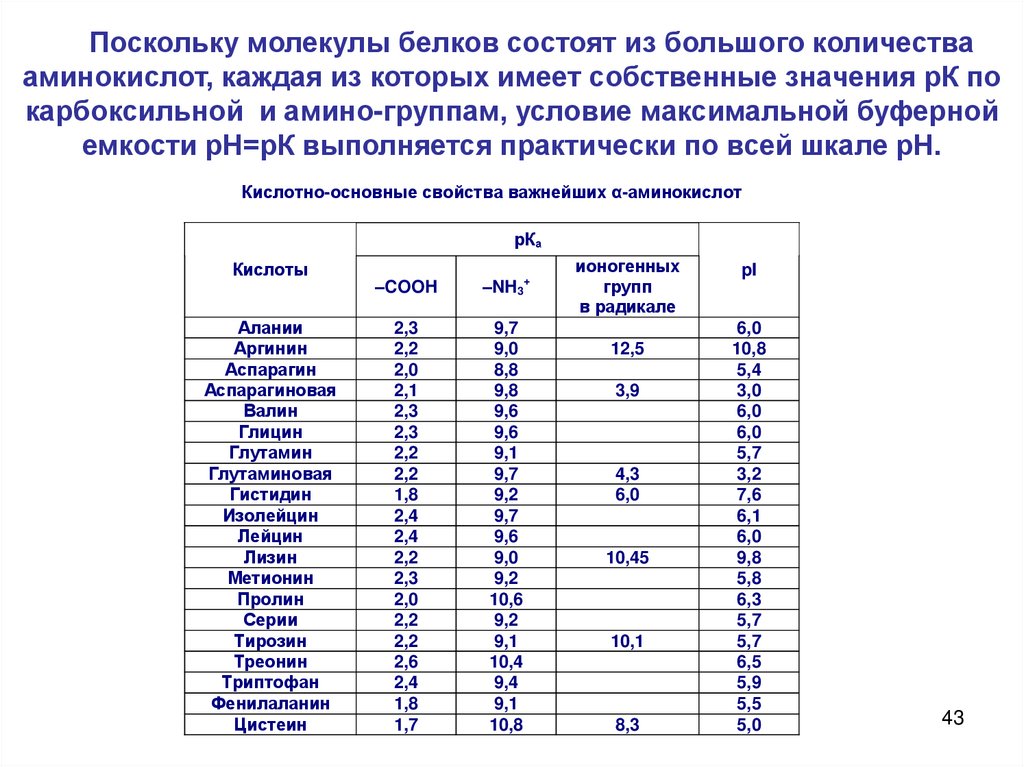
Поскольку молекулы белков состоят из большого количествааминокислот, каждая из которых имеет собственные значения рК по
карбоксильной и амино-группам, условие максимальной буферной
емкости рН=рК выполняется практически по всей шкале рН.
Кислотно-основные свойства важнейших α-аминокислот
рКа
Кислоты
Алании
Аргинин
Аспарагин
Аспарагиновая
Валин
Глицин
Глутамин
Глутаминовая
Гистидин
Изолейцин
Лейцин
Лизин
Метионин
Пролин
Серии
Тирозин
Треонин
Триптофан
Фенилаланин
Цистеин
–COOH
–NH3+
2,3
2,2
2,0
2,1
2,3
2,3
2,2
2,2
1,8
2,4
2,4
2,2
2,3
2,0
2,2
2,2
2,6
2,4
1,8
1,7
9,7
9,0
8,8
9,8
9,6
9,6
9,1
9,7
9,2
9,7
9,6
9,0
9,2
10,6
9,2
9,1
10,4
9,4
9,1
10,8
ионогенных
групп
в радикале
12,5
3,9
4,3
6,0
10,45
10,1
8,3
pI
6,0
10,8
5,4
3,0
6,0
6,0
5,7
3,2
7,6
6,1
6,0
9,8
5,8
6,3
5,7
5,7
6,5
5,9
5,5
5,0
43
44.
Белковая буферная системаподдерживает постоянство рН в
клетках и тканях, причем:
R+ в средах с рН<6,
R- в средах с рН>6.
В крови работает
анионный белковый буфер.
Попадающие на кожу человека небольшие количества
кислоты или щелочи довольно быстро нейтрализуются
белковой буферной системой
44
45.
IV. Гемоглобиновая буферная система:Гемоглобиновая
H-Hb
K-Hb
венозная кровь
рН = 7.32 – 7.36
Оксигемоглобиновая
HHbО2
К-HbО2
артериальная кровь
рН = 7.42 – 7.46
~ 35 % общего буферного
действия крови
~ 63-75 % общего
буферного действия
в эритроцитах
45
46.
Оксигемоглобин более сильная кислота, чем гемоглобин!HHb H Hb
HHbO 2 H HbO 2
pK 8,2
pK 6,95
В легких идет процесс оксигенации:
H Hb О 2 H НbО 2
pK 8.2
pK 6.95
среда должна стать более кислой, но бикарбонат-ион
взаимодействует с оксигемоглобином и кислотность среды
восстанавливается:
HCO3- + H-HbO2 → HbO2- + H2O + CO2↑
46
47.
В тканях отдаётся кислород и поглощается СО2HbO 2 Hb O 2
СО 2 Н 2 О Н 2 СО3
H Hb О2 H Hb О2
pK 6.95
pK 8.2
Среда должна стать более щелочной, но в реакцию вступает более
сильная угольная кислота, образуя бикарбонат-ион, который
является основным компонентом щелочного резерва крови.
Hb - H 2 CO3 H - Hb HCO 3
pK 8,2
-
47
48.
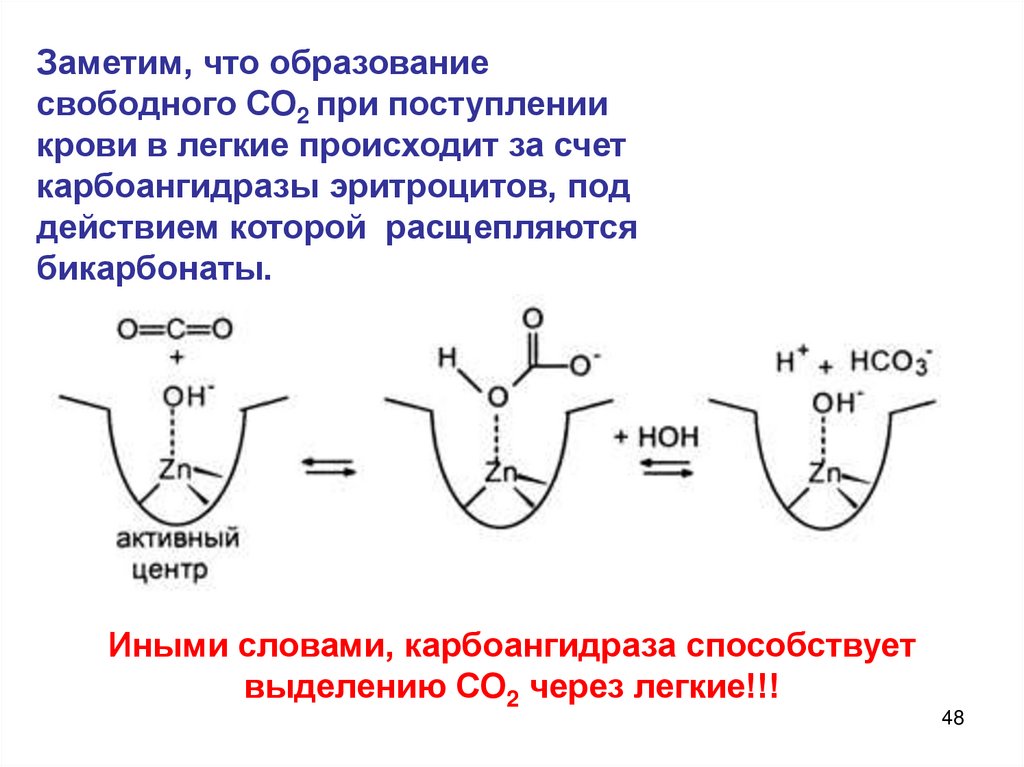
Заметим, что образованиесвободного СО2 при поступлении
крови в легкие происходит за счет
карбоангидразы эритроцитов, под
действием которой расщепляются
бикарбонаты.
Иными словами, карбоангидраза способствует
выделению СО2 через легкие!!!
48
49.
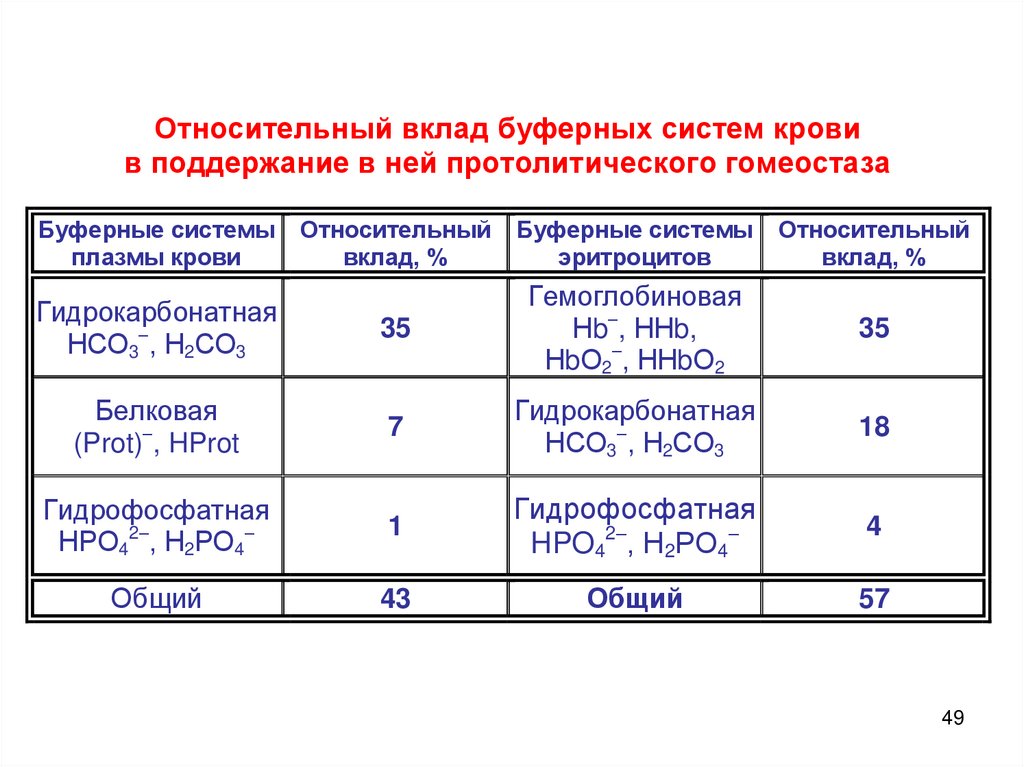
Относительный вклад буферных систем кровив поддержание в ней протолитического гомеостаза
Буферные системы
плазмы крови
Относительный
вклад, %
Буферные системы
эритроцитов
Относительный
вклад, %
Гидрокарбонатная
НСО3–, Н2СО3
35
Гемоглобиновая
Нb–, ННb,
НbО2–, ННbО2
35
Белковая
(Prot)–, HProt
7
Гидрокарбонатная
НСО3–, Н2СО3
18
Гидрофосфатная
НРО42–, Н2РО4–
1
Гидрофосфатная
HPO42–, Н2РО4–
4
Общий
43
Общий
57
49
50.
Все буферные системы организма обладаютбольшей буферной емкостью по кислоте, чем по
основанию,
( поскольку характеризуются соотношением):
1 : 4 < [акцептор протона]/[донор протона] < 1 : 20
Это соотношение находится в соответствии с особенностями
метаболизма человеческого организма, образующего больше
кислотных продуктов, чем основных.
Именно
поэтому
очень
важным
показателем
для
физиологических сред является буферная емкость Вк по
кислоте.
При заболеваниях органов дыхания, кровообращения,
печени, желудка, почек, при отравлениях, голодании, диабете,
ожоговой болезни может наблюдаться уменьшение или
увеличение Вк по сравнению с нормой.
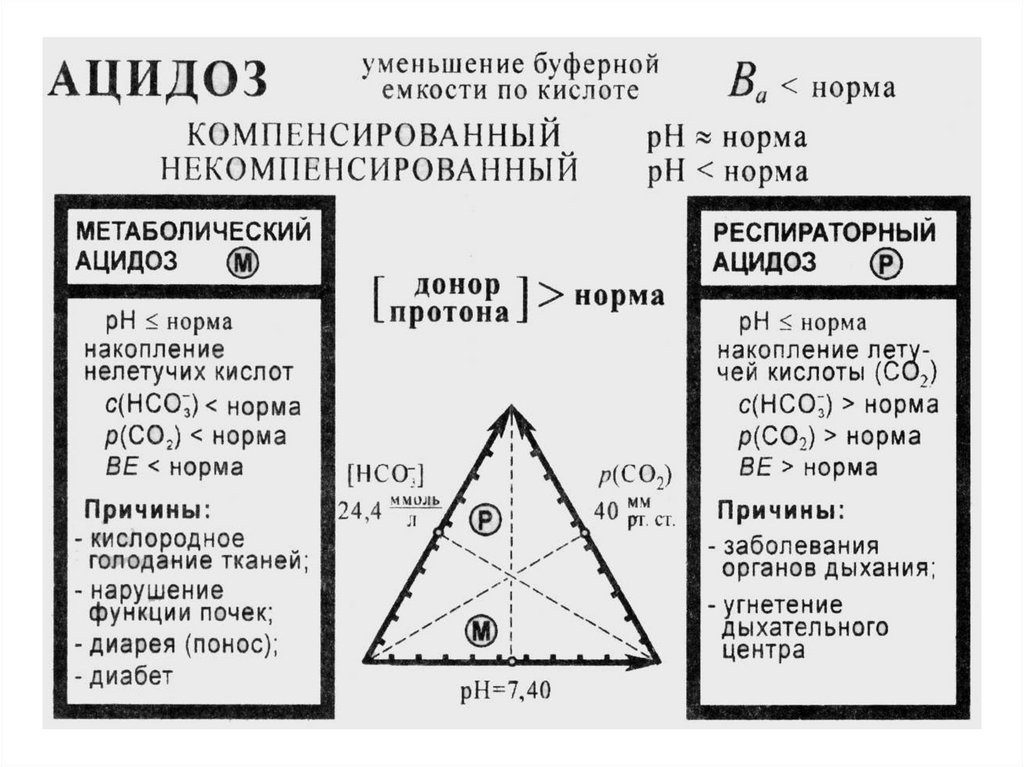
Возникают патологические явления: ацидоз и алкалоз.
50
51.
Ацидоз– накопление в организме кислых продуктов
уменьшение рН крови в сравнении с нормой
(уменьшение кислотной буферной емкости в
сравнении с нормой)
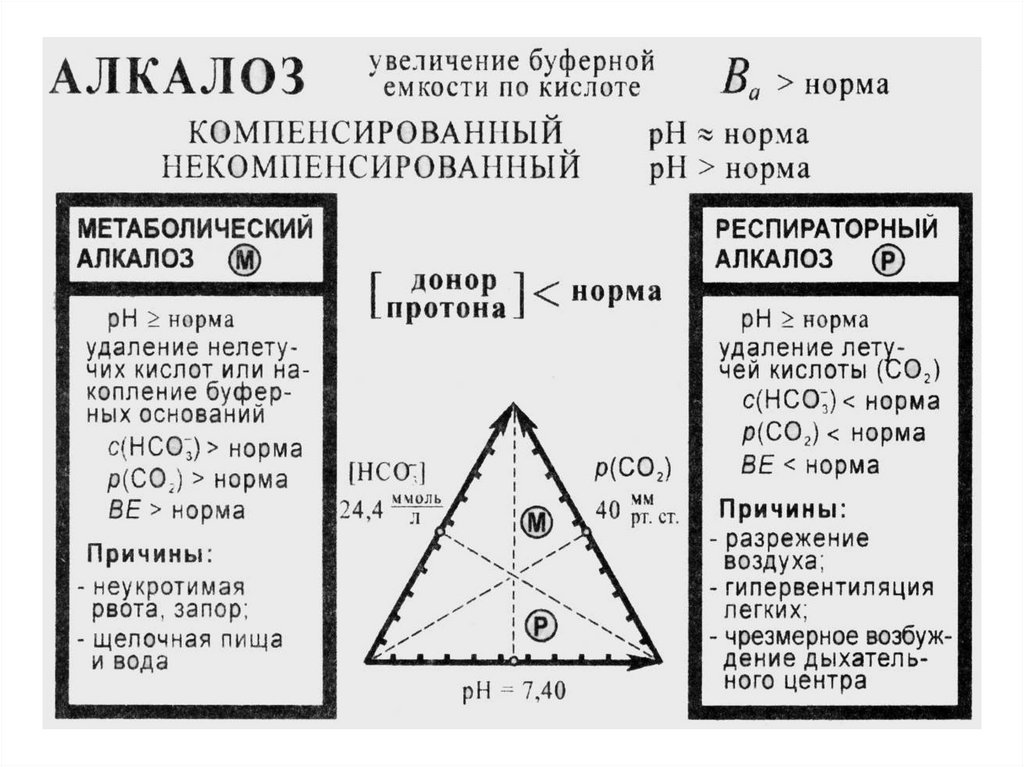
Алкалоз
– накопление в организме щелочных продуктов
увеличение рН крови в сравнении с нормой
(увеличение кислотной буферной емкости в
51
сравнении с нормой)
52.
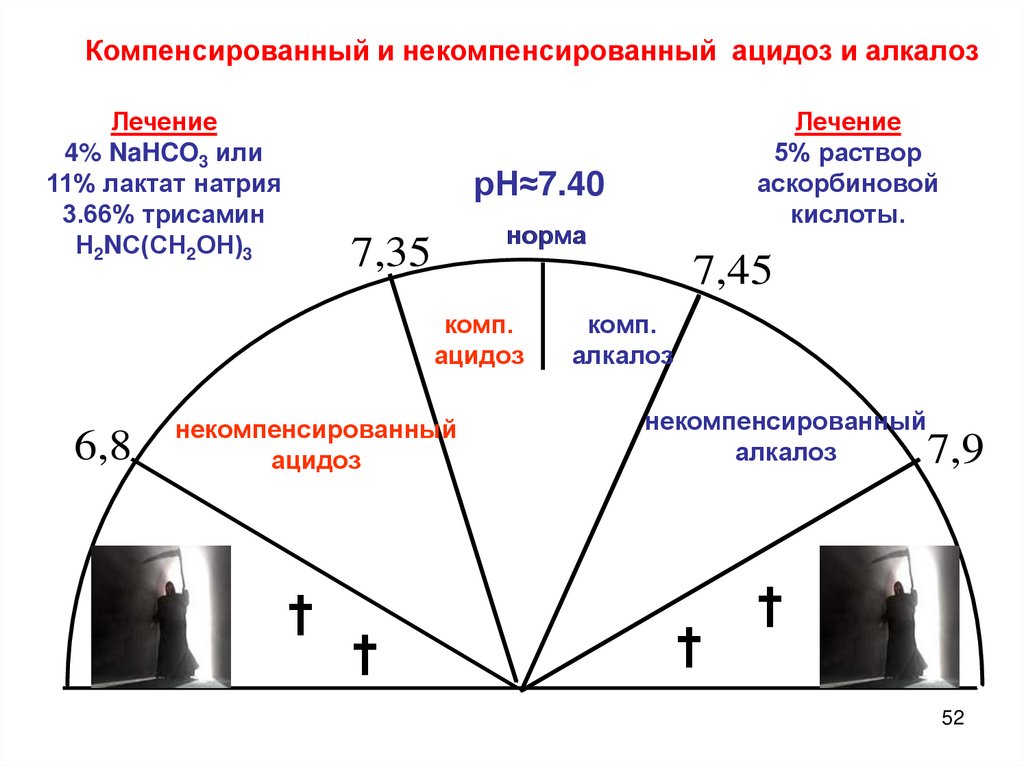
Компенсированный и некомпенсированный ацидоз и алкалозЛечение
4% NaHCO3 или
11% лактат натрия
3.66% трисамин
Н2NС(СН2ОН)3
рН≈7.40
норма
7,35
7,45
комп.
ацидоз
6,8
Лечение
5% раствор
аскорбиновой
кислоты.
комп.
алкалоз
некомпенсированный
ацидоз
некомпенсированный
алкалоз
†
†
†
†
7,9
52
53.
МЕТАБОЛИЧЕСКИЙ АЦИДОЗНедостаток НСО3- или избыток нелетучих кислот в
межклеточной жидкости
Причины:
введение или образование стойких кислот (молочная кислота
при шоке, кетокислоты при голодании и диабете);
неполное удаление кислот при почечной недостаточности;
потеря НСО3- при заболеваниях ЖКТ;
кислородное голодание тканей.
53
54.
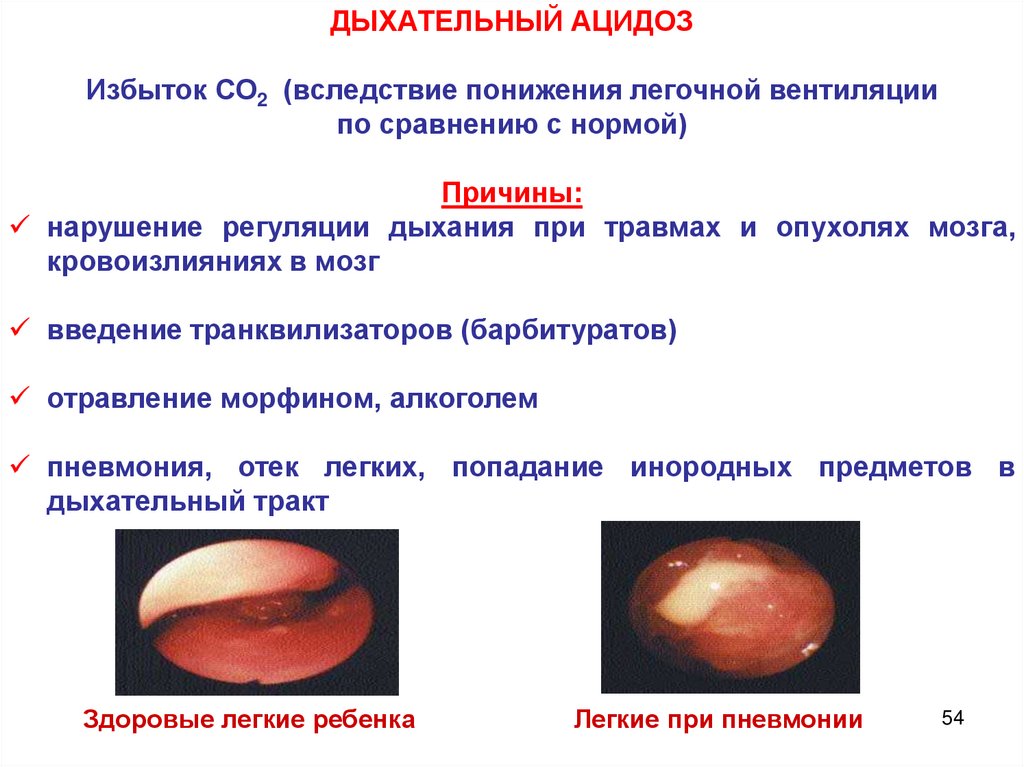
ДЫХАТЕЛЬНЫЙ АЦИДОЗИзбыток СО2 (вследствие понижения легочной вентиляции
по сравнению с нормой)
Причины:
нарушение регуляции дыхания при травмах и опухолях мозга,
кровоизлияниях в мозг
введение транквилизаторов (барбитуратов)
отравление морфином, алкоголем
пневмония, отек легких, попадание инородных предметов в
дыхательный тракт
Здоровые легкие ребенка
Легкие при пневмонии
54
55.
ДЫХАТЕЛЬНЫЙ АЛКАЛОЗНедостаток СО2 в связи с повышением легочной вентиляции,
в сравнении с нормой.
Причины:
вдыхание разреженного воздуха;
тепловая отдышка;
лихорадочное состояние, истерия.
55
56.
МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗУдаление кислот из организма или накопление НСО3Причины:
потеря Н+ при рвоте и кишечной непроходимости;
увеличение НСО3- при введении солей органических кислот
(лимонной, молочной, уксусной, яблочной);
длительный приём щелочной пищи или минеральной воды.
56
57.
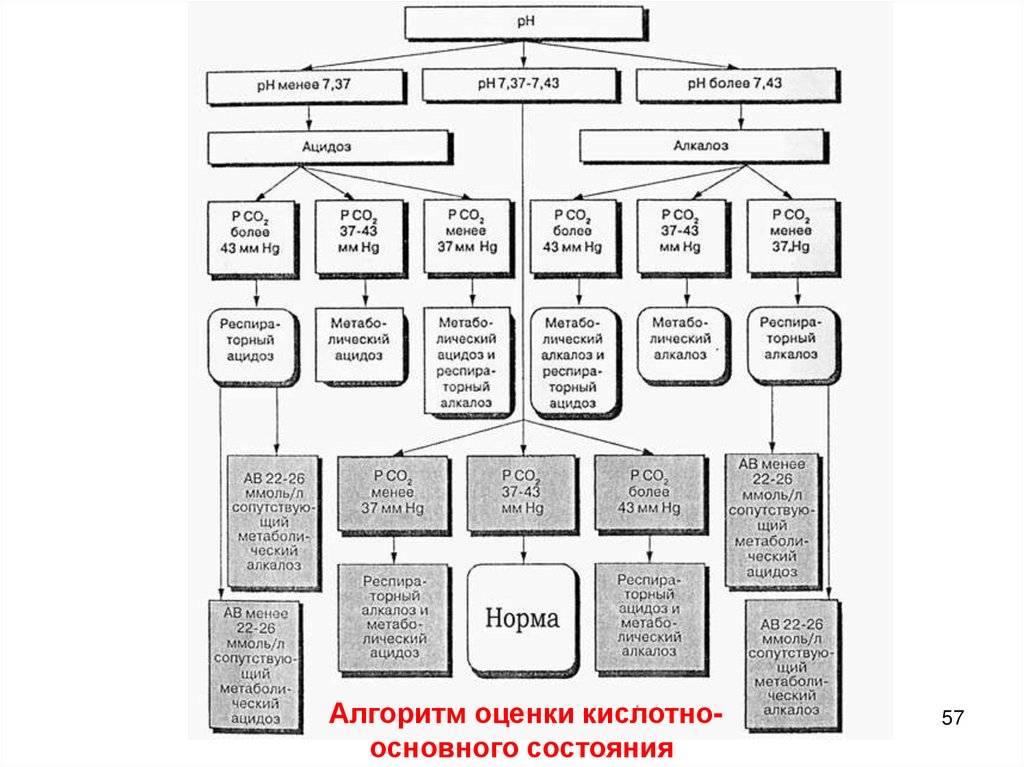
Алгоритм оценки кислотноосновного состояния57
58.
5859.
5960.
Щелочной резерв кровиЧисло мл СО2, содержащееся в 100 мл крови
(главным образом в виде гидрокарбонатов НСО3-)
Норма:
50-70 % (по объему)
или 25-30 ммоль/л
60
61.
Клинический анализ желудочного содержимого.Кислотность желудочного сока –
количество мл 0,1 н раствора щелочи, необходимого для
нейтрализации 100 мл профильтрованного желудочного
содержимого.
Норма
Пониженная кислотность
Повышенная кислотность
– 40-60 мл 0,1 н NaOH;
– 30 мл 0,1 н NaOH;
– 60 мл н NaOH.
61
62.
ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ62
63.
Гетерогенные равновесия – это равновесия, которыеустанавливаются в гетерогенных системах.
Термодинамическую систему, свойства которой от
точки к точке изменяются скачкообразно, называют
гетерогенной. Такая система состоит из нескольких
гомогенных частей. Гомогенную часть гетерогенной
системы называют фазой. Каждая фаза характеризуется
массой, геометрическими размерами, и, главное,
наличием границы раздела, отделяющей её от других
фаз.
63
64.
Порастворимости
в
растворителе
вещества
подразделяются на:
1) неограниченно растворимые – смешиваются с
растворителем в любых соотношениях, образуя
истинные растворы;
2) ограниченно растворимые, которые при разных
условиях могут образовывать как гомогенные, так и
гетерогенные системы.
64
65.
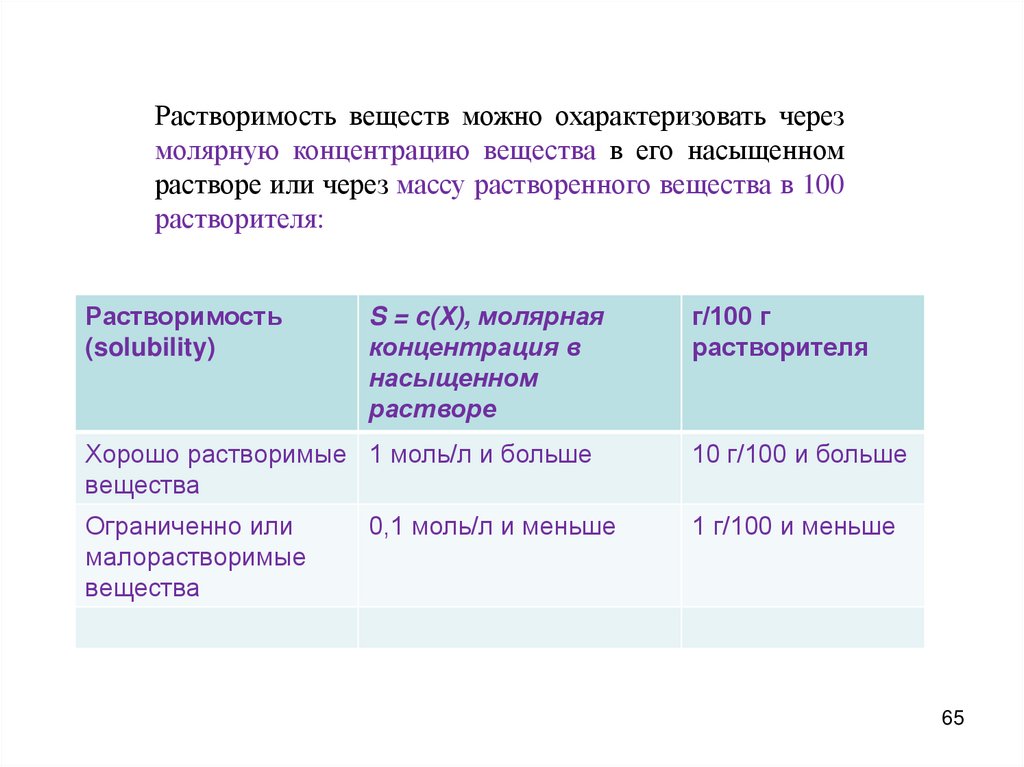
Растворимость веществ можно охарактеризовать черезмолярную концентрацию вещества в его насыщенном
растворе или через массу растворенного вещества в 100
растворителя:
Растворимость
(solubility)
S = c(X), молярная
концентрация в
насыщенном
растворе
г/100 г
растворителя
Хорошо растворимые 1 моль/л и больше
вещества
10 г/100 и больше
Ограниченно или
малорастворимые
вещества
1 г/100 и меньше
0,1 моль/л и меньше
65
66.
Для малорастворимых соединений молярнуюконцентрацию
насыщенного
раствора
называют растворимостью вещества Р.
66
67.
Растворение веществ с ограниченной растворимостью –это динамический процесс, когда параллельно идет
растворение и осаждение растворяемого вещества.
Когда скорость растворения становится равной
скорости осаждения (кристаллизации), наступает
динамическое равновесие.
67
68.
CaCO3 ⇄ Ca2+ + CO32осадок
насыщенный
раствор
При контакте осадка с водой в системе протекают процессы:
1) растворения – полярные молекулы воды переводят часть ионов
из кристаллической решетки CaCO3 в жидкую фазу;
2) осаждения – под влиянием электростатического поля
кристаллической решетки CaCO3 часть ионов Ca2+ и CO3 2переходят из жидкой фазы в твердую, достраивая
кристаллическую решетку соли.
68
69.
KtnAnm ⇄ nKtm+ + mAnnосадок
Kc
насыщенный
раствор
m
n
n
m
[Kt ] [An ]
69
70.
В насыщенном растворе малорастворимогосильного электролита при данной
температуре произведение молярных
концентраций его ионов, возведённых в
степени их стехиометрических
коэффициентов, есть величина постоянная и
называется произведением растворимости
(ПР, или Кs).
чем меньше Кs , тем менее растворимым
является малорастворимый электролит.
70
71.
К хорошо растворимым электролитам правилопроизведения растворимости неприменимо. Величину
ПР можно использовать только в отношении
электролитов, растворимость которых в воде не
превышает 0,01 моль/л.
KtnAnm
nKtm+ + mAnn ,
При растворимости вещества Р концентрация катионов составит nР,
а концентрация анионов mР.
ПРKt Anm [Kt m ] n [An n ] m ( nP )n ( mP )m nn mm P n m
n
PKtn Anm n m
ПРKtn Anm
nn mm
71
72.
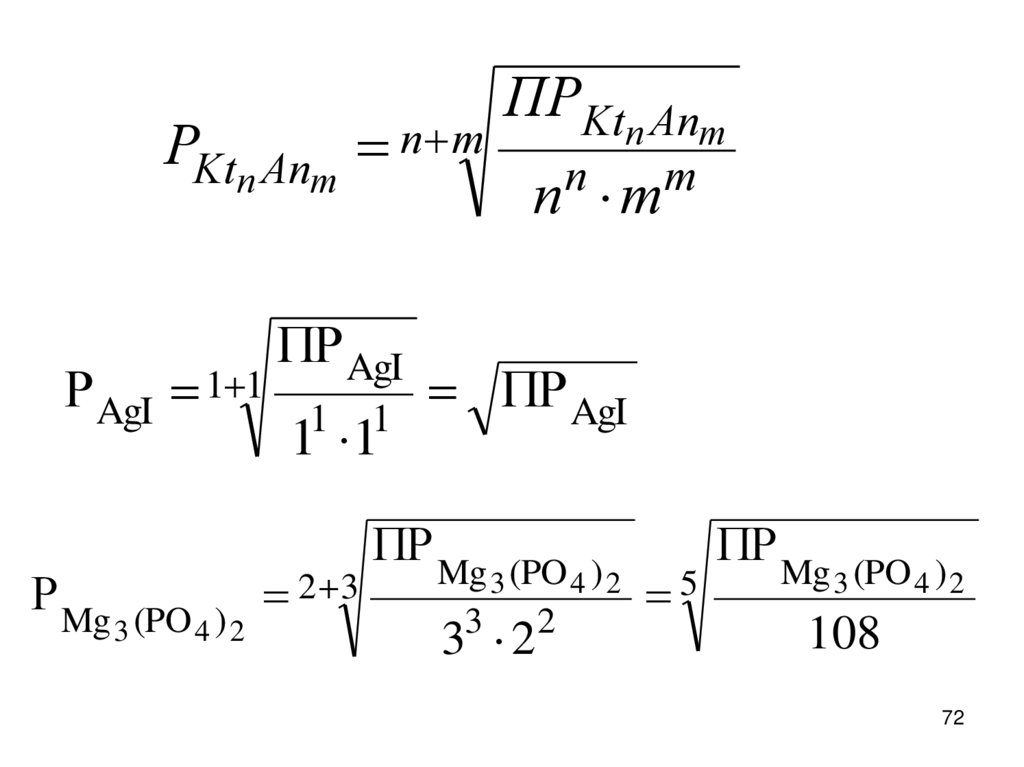
PKtn Anm n mР AgI 1 1
4 2
n
n m
m
ПР AgI
ПР
AgI
1 1
1 1
Р Mg (PO ) 2 3
3
ПРKtn Anm
ПР Mg (PO )
3
33 22
4 2
5
ПР Mg (PO )
3
4 2
108
72
73.
гмоль
г
Р[ ] Р[
] M[
]
л
л
моль
73
74.
В насыщенном растворе:ПРKtn Anm [Kt m ] n [An n ] m C n(Kt m ) C m(An n )
В ненасыщенном или пересыщенном растворе
.
величина
Cn (Kt m ) Cm (An n )
называется произведение концентраций ионов и обозначается
.
ПC i
74
75.
Условие выпадения осадка:Если произведение концентраций ионов,
возведённых
в
степени
их
стехиометрических
коэффициентов,
превышает произведение растворимости,
то происходит образование твёрдой фазы .
(осадка):
C n(Kt m ) C m(An n ) ПCi Kt An ПРKt An
n
m
n
m
75
76.
Условие растворения осадка:Если произведение концентраций ионов,
возведённых в степени стехиометрических
коэффициентов, не превышает произведение
растворимости, то осадок не образуется, а при
наличии в системе твёрдой фазы (осадка)
происходит её растворение:
C n (Kt m ) C m(An n ) ПCi Kt An ПРKt An
n
m
n
76
m
77.
Введение в насыщенный раствор вещества-электролита, несодержащего одноимённых ионов с осадком, напротив, повышает
растворимость соединения (солевой эффект). Причиной солевого
эффекта
является
усиление
межионных
взаимодействий,
способствующих переходу ионов вещества из кристаллической
решетки (твёрдой фазы) в раствор.
Так, растворимость сульфата бария в растворе хлорида натрия
сильного электролита, не образующего одноимённых ионов с осадком
выше, чем в чистой воде.
77
78.
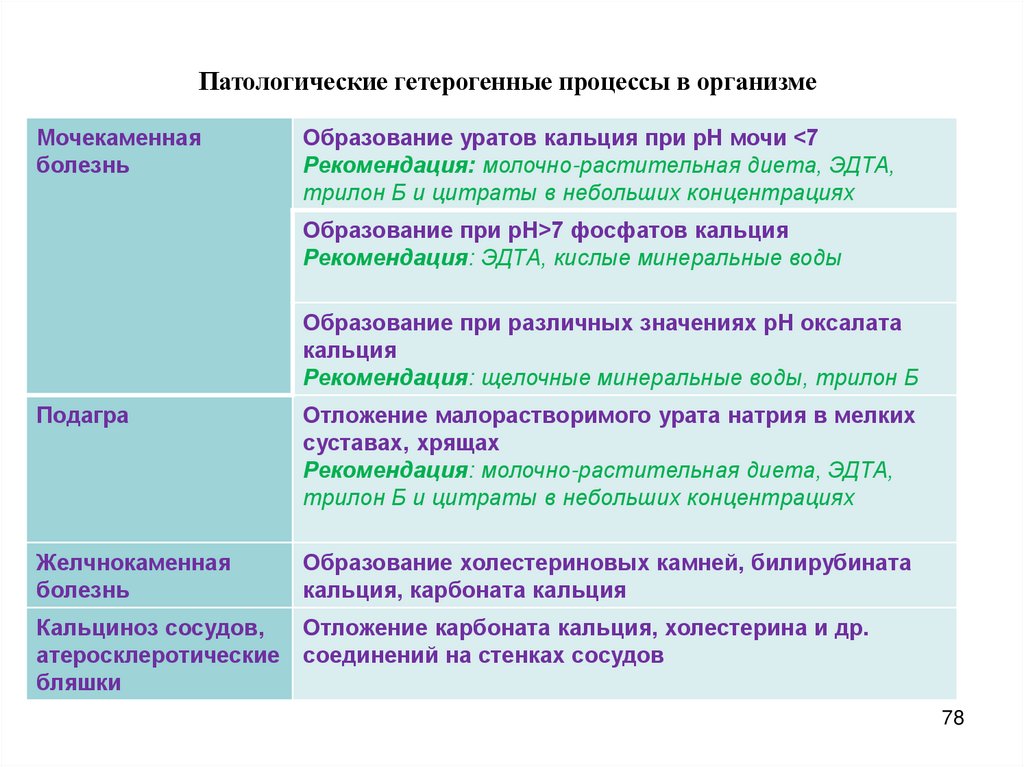
Патологические гетерогенные процессы в организмеМочекаменная
болезнь
Образование уратов кальция при рН мочи <7
Рекомендация: молочно-растительная диета, ЭДТА,
трилон Б и цитраты в небольших концентрациях
Образование при рН>7 фосфатов кальция
Рекомендация: ЭДТА, кислые минеральные воды
Образование при различных значениях рН оксалата
кальция
Рекомендация: щелочные минеральные воды, трилон Б
Подагра
Отложение малорастворимого урата натрия в мелких
суставах, хрящах
Рекомендация: молочно-растительная диета, ЭДТА,
трилон Б и цитраты в небольших концентрациях
Желчнокаменная
болезнь
Образование холестериновых камней, билирубината
кальция, карбоната кальция
Кальциноз сосудов,
атеросклеротические
бляшки
Отложение карбоната кальция, холестерина и др.
соединений на стенках сосудов
78














































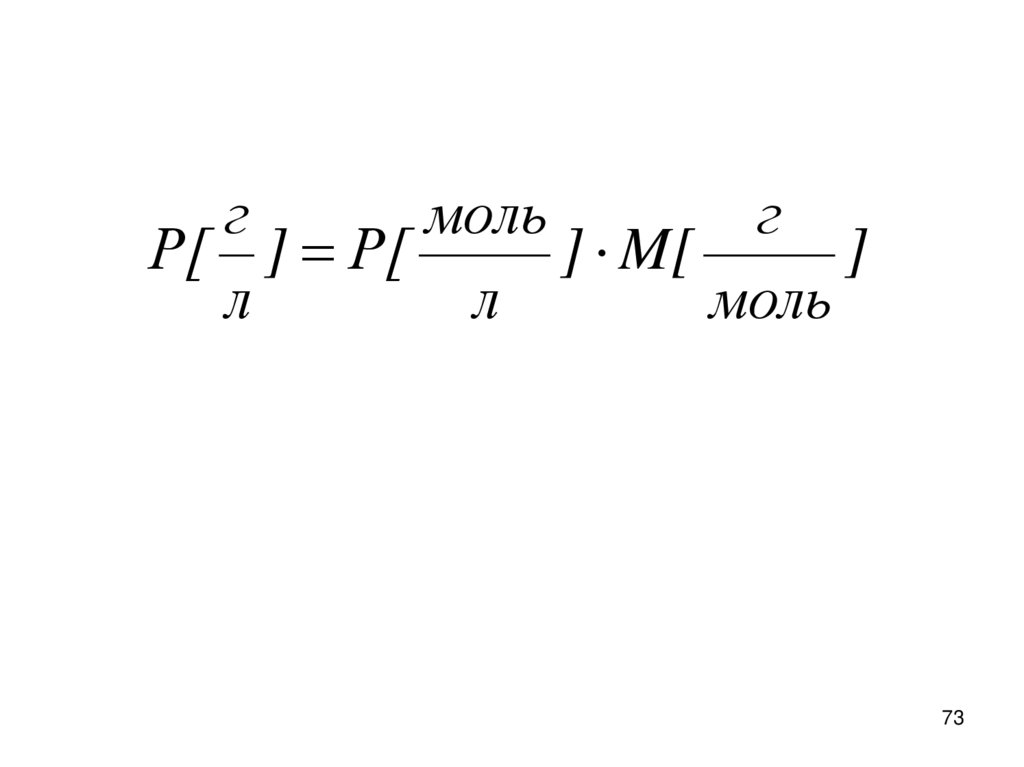





 Химия
Химия








