Похожие презентации:
37cb92b6e4144665a481cc0caf152068
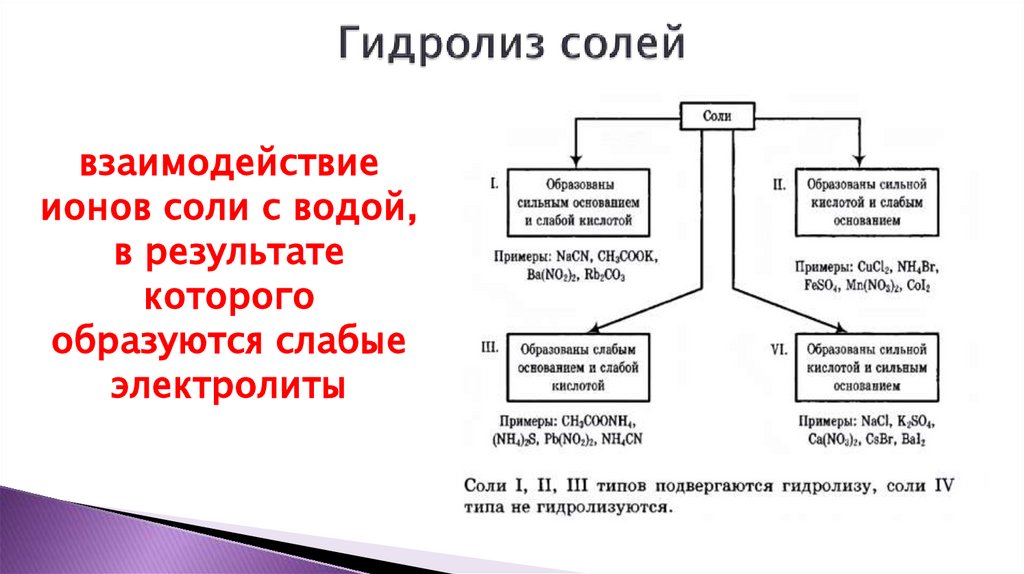
1. Электролитическая диссоциация. Понятие о водородном показателе (pH) раствора. Реакции ионного обмена. Гидролиз органических и
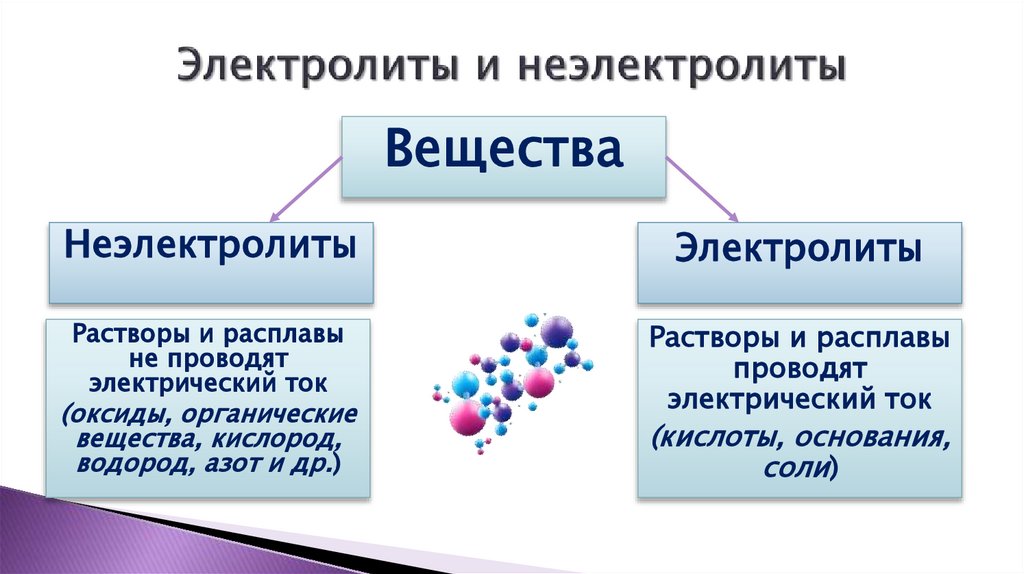
2. Электролиты и неэлектролиты
ВеществаНеэлектролиты
Электролиты
Растворы и расплавы
не проводят
электрический ток
Растворы и расплавы
проводят
электрический ток
(оксиды, органические
вещества, кислород,
водород, азот и др.)
(кислоты, основания,
соли)
3. Электролитическая диссоциация
Процесс распада электролитов на ионы приих растворении в воде или расплавлении.
KCl = K+ + ClHCl = H+ + ClNaOH = Na+ + OH-
Ионы
Катионы
Анионы
K+, H+
Cl-, OH-
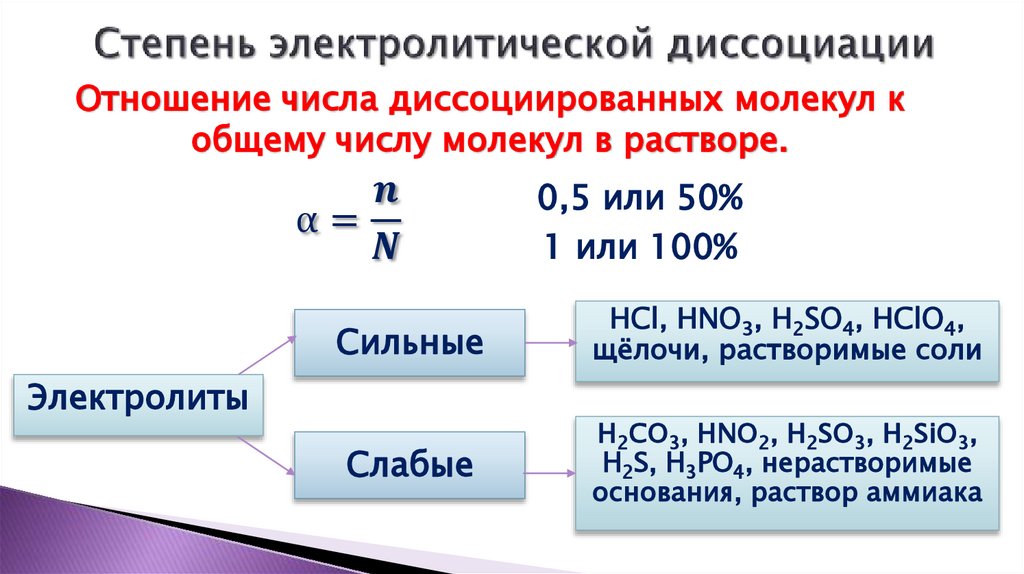
4. Степень электролитической диссоциации
Отношение числа диссоциированных молекул кобщему числу молекул в растворе.