Похожие презентации:
vodorod.svoystva_vodoroda
1. Тема урока: Водород. Нахождение в природе. Применение. Получение. Свойства
2. В 766 г. Английский ученый Генри Кавендиш получил «горючий воздух».Он хорошо горел. В 1787 г. А.Лавуазье, доказал, что этот
«воздух» входит всостав воды, и дал ему название «гидрогениум», т.е.
«рождающий воду».
O Я-самый легкий,
O Я-самый первый,
O Я-половина всей Вселенной!
O Жизнь даю звездам,
O Родится вода,
O Клич водорода «Готов Будь всегда»!
3. План урока:
O I.Водород-химический элемент ипростое вещество.
O II.Получение водорода.
O 1.Промышленный способ.
O 2.Лабораторный способ.
O III.Свойства водорода и его
применение.
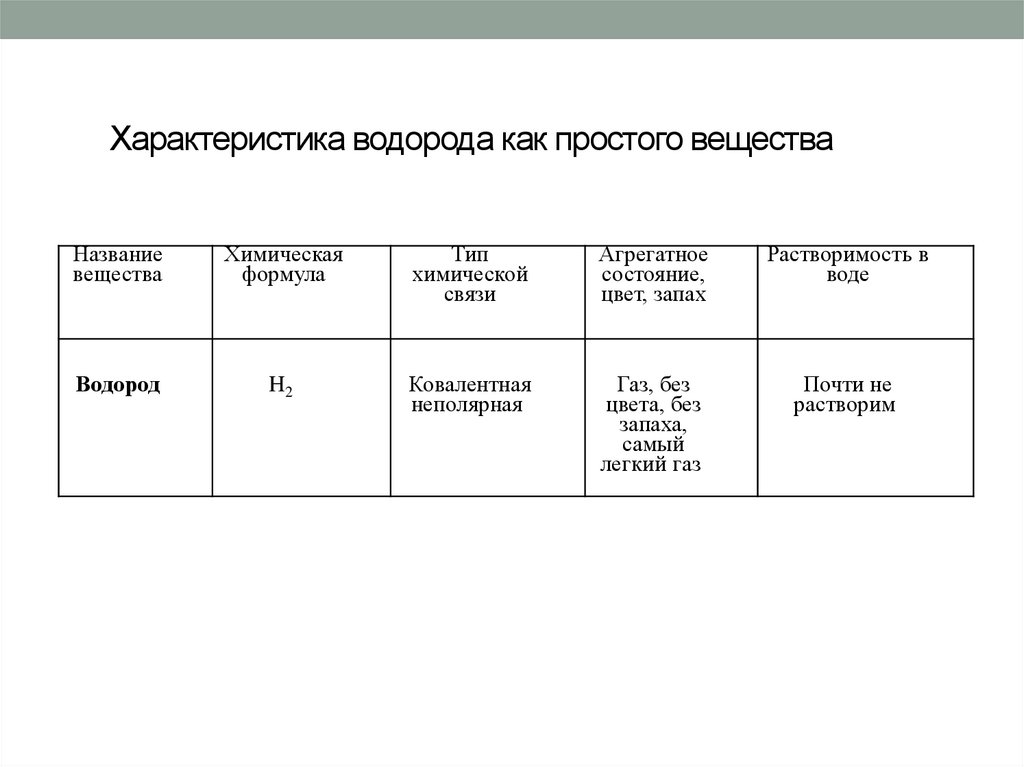
4. Характеристика водорода как простого вещества
Названиевещества
Химическая
формула
Тип
химической
связи
Агрегатное
состояние,
цвет, запах
Растворимость в
воде
Водород
H2
Ковалентная
неполярная
Газ, без
цвета, без
запаха,
самый
легкий газ
Почти не
растворим
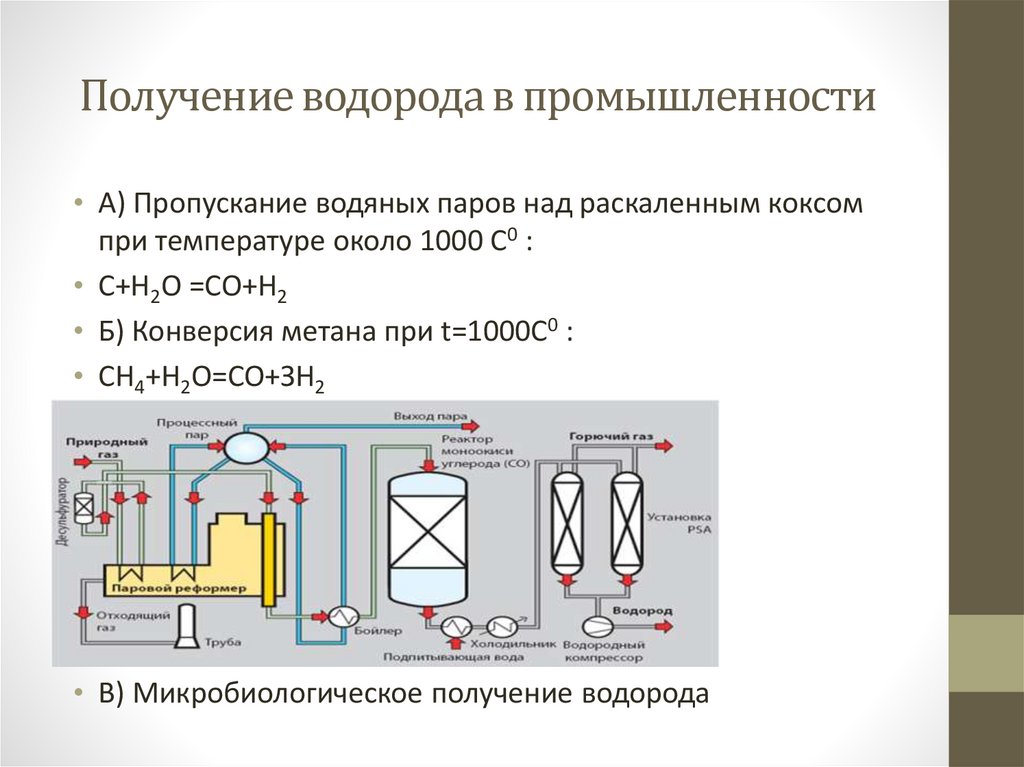
5. Получение водорода в промышленности
• А) Пропускание водяных паров над раскаленным коксомпри температуре около 1000 С0 :
• С+Н2О =СО+Н2
• Б) Конверсия метана при t=1000C0 :
• СН4+Н2О=СО+ЗН2
• В) Микробиологическое получение водорода
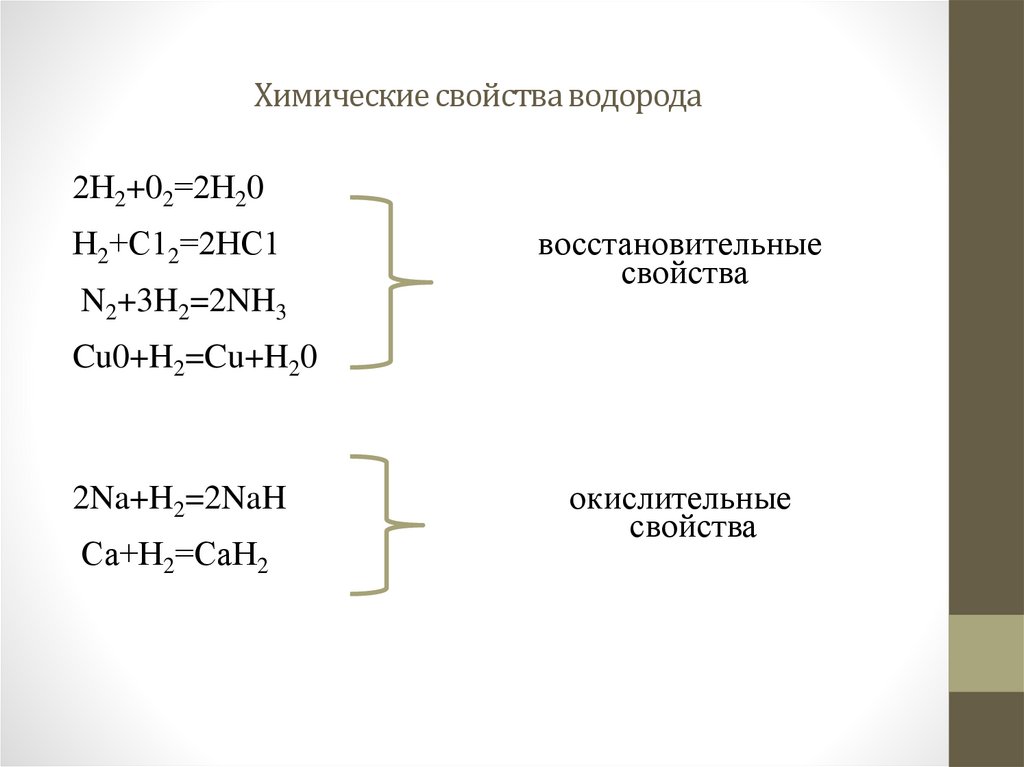
6. Химические свойства водорода
2Н2+02=2Н20Н2+С12=2НС1
N2+3H2=2NH3
восстановительные
свойства
Cu0+H2=Cu+H20
2Na+H2=2NaH
Са+Н2=СаН2
окислительные
свойства
7.
Уравнение химической реакцииН2+02=2Н20
Н2+С12=2НСl
Область применения
водорода
Ракетное топливо
Получение соляной
кислоты
N2+3H2=2NH3
Получение аммиака
Cu0+H2=Cu+H20
Получение металлов
8. Выполните тест задание
1. Группа, в которой находится водорода) 3
б) 2
в) 1
2. Порядковый номер водорода
а) 1
б) 2
в) 3
3. Относительная атомная масса водорода
а) 3
б) 2
в) 1
4. Формула простого вещества водорода
а) Н3
б) Н 2
в) Н
5. Молярная масса водорода
а) 2 г/моль
б) 2 г
в) 2 моль
Запишите уравнение реакций, с помощью которых можно
осуществить следующие превращения:
H2
H2S
SO2
SO3





 Химия
Химия








